Kresole
| Kresole | |||||
| Name | o-Kresol | m-Kresol | p-Kresol | ||
| Andere Namen | 2-Methylphenol 2-Hydroxytoluol |
3-Methylphenol 3-Hydroxytoluol |
4-Methylphenol 4-Hydroxytoluol | ||
| MIXED CRESOLS(INCI)[1] | |||||
| Strukturformel | 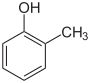
|

|
|||
| CAS-Nummer | 95-48-7 | 108-39-4 | 106-44-5 | ||
| 1319-77-3(Isomerengemisch)[2] | |||||
| PubChem | 335 | 342 | 2879 | ||
| FL-Nummer | 04.027 | 04.026 | 04.028 | ||
| Summenformel | C7H8O | ||||
| Molare Masse | 108,14 g·mol−1 | ||||
| Aggregatzustand | fest | flüssig | fest | ||
| Kurzbeschreibung | farblose bis gelbliche Kristalle bzw. Flüssigkeit mit stechendem, teerartigen Geruch[3][4][5] | ||||
| Schmelzpunkt | 31 °C[3] | 10,9 °C[4] | 34,8 °C[5] | ||
| Siedepunkt | 191 °C[3] | 203 °C[4] | 202 °C[5] | ||
| pKs-Wert[6] | 10,28 | 10,09 | 10,26 | ||
| Dichte | 1,05 g·cm−3[3] | 1,03 g·cm−3[4] | 1,03 g·cm−3[5] | ||
| Löslichkeit | 25,0 g·l−1(25 °C)[3] | 23,5 g·l−1(20 °C)[4] | 20,0 g·l−1(20 °C)[5] | ||
| GHS- Kennzeichnung |
| ||||
| H- und P-Sätze | 301‐311‐314 | ||||
| keine EUH-Sätze | |||||
| 201‐280‐301+310+330‐303+361+353‐304+340+310‐305+351+338[7] | |||||
| MAK | Schweiz: 5 ml·m−3bzw. 22 mg·m−3[8] | ||||
DieKresole(auchHydroxytoluolebzw.Methylphenole) bilden in der Chemie eine Stoffgruppe aromatischer Verbindungen, die sich sowohl vomPhenolals auch vomToluolableitet. Die Struktur besteht aus einem Benzolring mit angefügterHydroxy-(–OH) undMethylgruppe(–CH3) alsSubstituenten.Durch deren unterschiedliche Anordnung ergeben sich dreiKonstitutionsisomeremit der Summenformel C7H8O. In erster Linie sind sie als methylsubstituierte Phenole anzusehen. Ferner spricht man bei den halogeniertenDerivatenebenfalls von Kresolen.
Vorkommen
[Bearbeiten|Quelltext bearbeiten]Kresole und deren Derivate (z. B.Xylenole) sind in der Natur weit verbreitet. Man findet sie alsMetabolitenin verschiedenen Mikroorganismen sowie im Urin von Säugetieren, imSteinkohlen-undBuchenholzteer.

Alle drei Kresole kommen inTee,Arabica-Kaffee,Gemüsespargel,Besen-Beifuß,Japanischem Ligusterund derWeißen Maulbeerevor.[9][10][11]o-Kresol findet sich außerdem inEstragon,Spanischem Pfeffer,Ölpalmen,Echtem Süßholz,Tomaten,Polei-Minze,Pfefferminze,Indischem Patschuli,Sauerkirschen,demSandelholzbaum,Gelben SchlauchpflanzenundScutellaria baicalensis.[9]m-Kresol kommt natürlich auch inCommiphora myrrha,TabakundRheum palmatumvor.[10]p-Kresol kann zudem in derSüße Akazie,Estragon,Rooibos,Ylang-Ylang,Spanischem Pfeffer,Meerträubel(Ephedra sinica),Stech-Wacholder,Polei-Minze,Pfefferminze,Anis,Sauerkirschen,Rheum palmatum,Himbeeren,demSandelholzbaum,Baikal-Helmkraut,demTamarindenbaum,Amerikanischen Heidelbeeren,Heidelbeeren,GewürzvanilleundTahiti-Vanillenachgewiesen werden.[11]
Herstellung
[Bearbeiten|Quelltext bearbeiten]Ursprünglich wurden die nicht derivatisierten Kresole aus Steinkohlen- und Buchenholzteer isoliert. Man erhält ein flüssiges, gelbbraunes Isomerengemisch, das so genannteTrikresol.Einmalige Destillation führt zurrohen Carbolsäure.Die Reinherstellung der drei Kresole erfolgt auf Grundlage vonCarbolöldurch Extraktion mitNatronlauge.Alternativ wird dasPhenoraffin-Verfahrendurchgeführt, bei dem zur Extraktion eineNatriumphenolat-Lösung undDiisopropylethereingesetzt werden.
Synthetisch können Kresole durchVerkochungdes jeweiligenDiazoniumsalzesderToluidinedargestellt werden.
Großtechnisch wird Kresol, unter anderem durch die Reaktion vonChlortoluolmitNatronlaugeunter hohen Temperaturen (~250 °C) und Druck (~300 bar) in einem Rohrreaktor synthetisiert.
Eigenschaften
[Bearbeiten|Quelltext bearbeiten]Kresole sind stark licht- und luftempfindlich. Bei Temperaturen oberhalb von 80 °C bilden sich mit Luft explosionsfähige Gemische. Sie sind in Wasser wenig löslich und verbrennen unter starker Rußentwicklung. Kresole haben einen teerartigen Geruch. MitPropenreagiertm-Kresol zuThymol.
pKs-Wert
[Bearbeiten|Quelltext bearbeiten]Die Methylgruppe übt einen (schwachen)+I-Effektauf den Aromaten aus, wodurch die Elektronendichte im Ring erhöht wird. Dadurch wird u. a. dieAciditätdes phenolischen OH abgeschwächt. Die pKs-Werte sind daher etwas höher als die des Phenols (9,99[6]).
Reaktivität
[Bearbeiten|Quelltext bearbeiten]Neben dem (schwachen)+I-Effektder Methylgruppe ist jedoch der+M-Effektder Hydroxygruppe entscheidender für die chemischeReaktivität.Beide Effekte erhöhen deutlich dieElektronendichteim Ring. Der−I-Effektder Hydroxygruppe hat nur sehr wenig Einfluss auf die Eigenschaften der Kresole. Die Kresole gehen daher relativ leicht elektrophile aromatische Substitutionen ein.
Verwendung
[Bearbeiten|Quelltext bearbeiten]Kresole wirken alsBakterizid,InsektizidundFungizid.Sie sind deshalb vielfach Bestandteil vonDesinfektionsmitteln.m-Kresol findet als Fungizid in der Landwirtschaft Anwendung. 8 µl/g genügen, umGetreide60 Tage lang bei einer Lagertemperatur von 30 °C frei von Pilzbefall zu halten.m-Kresol ist alspharmazeutischer Hilfsstoffbeispielsweise Bestandteil vonInsulin glargin.Die typischen Konzentrationen liegen im Bereich von 1,5 bis 3 mg pro ml Injektionslösung.[12][13]
Kresole werden auch verwendet, um daraus Kunst- und Farbstoffe,Kunstharze(Kresolharze) und Arzneimittel herzustellen.
Toxikologie
[Bearbeiten|Quelltext bearbeiten]Kresol-Vergiftungen rufen recht unspezifische Symptome hervor. Anzeichen einer chronischen Vergiftung sind Kopfschmerzen, Husten- und Brechreiz, Appetitverlust sowie Mattheit und Schlaflosigkeit. Eine Aufnahme über die Haut durchResorptionerfolgt sehr schnell. Akute Vergiftungen mit Nierenschäden und Störungen desZentralnervensystemswie Krämpfen, Bewusstlosigkeit undAtemlähmungkönnen die Folge sein. Kresole gelten alskarzinogen.
Wie bei Phenolen allgemein kommt es bei oraler Einnahme zu (weißlichen) Verätzungen, welche schmerzlos sind, da Phenole anästhetisch wirken. Vergiftungserscheinungen treten beim Menschen ab etwa 3 g auf, ab etwa 10 g besteht die Möglichkeit eines tödlichen Schocks.
Darüber hinaus wirken Phenole und insbesondere Kresole starkdenaturierendaufProteine.Da sie stark ätzend sind, rufen sie bei Hautkontakt akute Hautschäden hervor, zerstören das Eiweiß der Hautzellen und überwinden den Schutzmechanismus der Haut, welche leicht sauer ist, beinahe sofort. Bei Kontamination offenerSchleimhäute(Mundhöhle, Nase, After) gelangen sie direkt ins Blut, wobei sie im Körper rasch verteilt werden und zu multiplen Eiweißschädigungen der inneren Organe führen. Ohne sofortige Einleitung von Gegenmaßnahmen können Kresole auch in geringer Menge lebensbedrohliche Wirkung haben.
Risikobewertung
[Bearbeiten|Quelltext bearbeiten]p-Kresol wurde 2012 von der EU gemäß derVerordnung (EG) Nr. 1907/2006(REACH) im Rahmen derStoffbewertungin den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen desStoffsauf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme vonp-Kresol waren die Besorgnisse bezüglichVerbraucherverwendung,hoher (aggregierter) Tonnage und weit verbreiteter Verwendung sowie der Gefahren ausgehend von einer möglichen Zuordnung zur Gruppe derCMR-Stoffeund als potentiellerendokriner Disruptor.Die Neubewertung fand ab 2015 statt und wurde vomVereinigten Königreichdurchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[14][15]
Nachweis
[Bearbeiten|Quelltext bearbeiten]Kresole können schon in Konzentrationen von wenigen Mikrogramm pro Kubikmeter Luft geruchlich wahrgenommen werden.
Zur Messung von o-, m- und p-Kresol-Expositionen amArbeitsplatznach den Kriterien desMesssystems Gefährdungsermittlung der Unfallversicherungsträger(MGU) wird mithilfe einer geeigneten Pumpe ein definiertes Luftvolumen durch ein Silicagelröhrchen gesaugt, sodass die in der Luft enthaltenen Kresole vom Silicagel adsorbiert werden. Zur analytischen Bestimmung wird das Silicagel mitDiethyletherextrahiert. Die qualitative und quantitative Bestimmung erfolgtgaschromatographischmit einemFlammenionisationsdetektor.DieBestimmungsgrenzebeträgt 0,5 mg/m³ bei 40 L Probeluftvolumen.[16]
Literatur
[Bearbeiten|Quelltext bearbeiten]- Klemm, Elias:Direktsynthese von Phenol und Kresol. Vom Katalysator zum Verfahren,Shaker VerlagGmbH 2002,ISBN 3-8265-9896-2.
- Autorenkollektiv:Organikum,22. Auflage, Wiley-VCH, Weinheim, 2004,ISBN 3-527-31148-3.
Weblinks
[Bearbeiten|Quelltext bearbeiten]- IR-Spektren der Kresole:o-Kresol;m-Kresol;p-Kresol
- Phenole und Kresole
Einzelnachweise
[Bearbeiten|Quelltext bearbeiten]- ↑Eintrag zuMIXED CRESOLSin derCosIng-Datenbankder EU-Kommission, abgerufen am 25. September 2021.
- ↑Eintrag zuKresol, Isomerein derGESTIS-StoffdatenbankdesIFA,abgerufen am 8. Mai 2017.(JavaScript erforderlich)
- ↑abcdefEintrag zuo-Kresolin derGESTIS-StoffdatenbankdesIFA,abgerufen am 2. September 2012.(JavaScript erforderlich)
- ↑abcdefEintrag zum-Kresolin derGESTIS-StoffdatenbankdesIFA,abgerufen am 2. September 2012.(JavaScript erforderlich)
- ↑abcdefEintrag zup-Kresolin derGESTIS-StoffdatenbankdesIFA,abgerufen am 2. September 2012.(JavaScript erforderlich)
- ↑abCRC Handbook of Tables for Organic Compound Identification,Third Edition, 1984,ISBN 0-8493-0303-6.
- ↑DatenblattCresol mixture of isomersbeiSigma-Aldrich,abgerufen am 8. Mai 2017 (PDF).
- ↑Schweizerische Unfallversicherungsanstalt(Suva):Grenzwerte – Aktuelle MAK- und BAT-Werte,abgerufen am 2. November 2015.
- ↑abO-CRESOL(engl.) In:Dr. Duke's Phytochemical and Ethnobotanical Database,Hrsg.U.S. Department of Agriculture,abgerufen am 24. Juli 2023.
- ↑abM-CRESOL(engl.) In:Dr. Duke's Phytochemical and Ethnobotanical Database,Hrsg.U.S. Department of Agriculture,abgerufen am 24. Juli 2023.
- ↑abP-CRESOL(engl.) In:Dr. Duke's Phytochemical and Ethnobotanical Database,Hrsg.U.S. Department of Agriculture,abgerufen am 24. Juli 2023.
- ↑Werner Waldhäusl:Diabetes in der Praxis.Springer-Verlag, 2013,ISBN 978-3-642-97435-9,S. 406 (eingeschränkte Vorschauin der Google-Buchsuche).
- ↑Peter Hürter:Diabetes bei Kindern und Jugendlichen.Springer-Verlag, 2013,ISBN 978-3-662-06575-4,S. 134 (eingeschränkte Vorschauin der Google-Buchsuche).
- ↑Europäische Chemikalienagentur(ECHA):Substance Evaluation Conclusion and Evaluation Report.
- ↑Community rolling action plan (CoRAP) derEuropäischen Chemikalienagentur(ECHA):p-cresol,abgerufen am 20. Mai 2019.
- ↑Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA):MEGA-Auswertungen zur Erstellung von REACH-Expositionsszenarien für Kresole.Abgerufen am 11. Juli 2023.


