Myosin

Myosin(vonaltgriechischμυόςmyos,Genitiv zuμῦςmys‚Muskel‘)[1]bezeichnet eine Familie vonMotorproteinenineukaryotischenZellen.Myosin ist als ein wesentlicher Bestandteil imMuskelauch an der Umwandlung von chemischer Energie in Kraft und Bewegung beteiligt. Des Weiteren ist es in Kooperation mit anderen Motorproteinen wieKinesinundDyneinwesentlich amintrazellulären Transportvon Biomakromolekülen,Vesikelnund Zellorganellen längs der Strukturen desCytoskelettsbeteiligt. Im Gegensatz zu Kinesin und Dynein bewegt sich dabei Myosin entlang vonAktinfilamenten.Weitere zelluläre Funktionen umfassen unter anderem Zellbewegungen und-adhäsion.
Myosin-Klassen
[Bearbeiten|Quelltext bearbeiten]Zunächst wurde Myosin alsMotorproteinvonMuskelfasernidentifiziert (Bestandteil desSarkomer,den kontraktionsfähigen Abschnitten derMyofibrillen(Muskelfibrillen)), wobei ein Bündel von Myofibrillen eine Muskelfaser bildet. Später sind weitere Mitglieder der Proteinfamilie in Erscheinung getreten, deren Funktion noch weitgehend unbekannt ist. Für einzelne dieser unkonventionellen Myosine konnten Funktionen beim intrazellulären Transport von Vesikeln und Organellen, bei Endozytose oder Zellwachstum identifiziert werden.
Nach phylogenetischen Studien (vgl.Homologie (Biologie)) unterteilt man die Familie der Myosine in Klassen und Subklassen. In Muskelfasern vorkommendes Myosin gehört mit einigen anderen Nicht-Muskel Myosinen zu Klasse II, welche auch als konventionelle Myosine bezeichnet werden. Alle anderen Klassen werden als unkonventionelle Myosine bezeichnet. Die zuerst entdeckten unkonventionellen Myosine wurden in Klasse I zusammengefasst. Neuere Klassen unkonventioneller Myosine werden fortlaufend nummeriert (III, IV, V…). Offiziell wurden 18 Klassen unkonventioneller Myosine benannt, wobei inzwischen mindestens sechs weitere, noch nicht benannte Klassen bekannt sind. Einige Abgrenzungen und Zuordnungen sind aber fraglich.
Proteinstruktur
[Bearbeiten|Quelltext bearbeiten]Funktionales Myosin besteht aus mehreren Aminosäureketten:
- einer schweren Kette (heavy chain) sowie
- einer unterschiedlichen Anzahl von leichten Ketten.
Das Myosin-II-Molekül liegt als so genanntes Dimer vor, das aus insgesamt 6 Untereinheiten besteht (Hexamer):
- 2 schweren Ketten
- 4 leichten Ketten
Schwere Kette (Heavy Chain)
[Bearbeiten|Quelltext bearbeiten]Den schweren Ketten aller Myosine gemeinsam ist einekonservierteKopfdomäne, die die katalytischenATPase-Eigenschaften vereinigt und deshalb auch Motordomäne genannt wird.
An diese schließt sich die Halsregion an, welche eine unterschiedliche Anzahl von Bindedomänen für leichte Ketten (Light Chain Binding Domain,LCBD) enthalten kann. Ein Beispiel dafür ist das oft vorkommendeIQ-Motiv(Konsensus-Sequenz: IQXXXRXXXXR), an welches das ProteinCalmodulinin der Funktion als Leichtkette binden kann. Je nach Klasse variiert die Anzahl der LCBD. Insofern auch coiled-coil Strukturen ausgebildet werden, besteht die Möglichkeit zur Dimerisierung, sodass doppelköpfige Myosine entstehen.
Ebenso ist die darauf folgende Schwanzregion klassenspezifisch ausgeprägt und weist die größten Unterschiede zwischen den unterschiedlichen Klassen auf. Diese Region enthält oftmals unterschiedliche Proteininteraktionsdomänen, an welche die zu transportierende Fracht andocken kann. Konventionelle Myosine sind außerdem dafür bekannt, dass die Schwanzregion dieser dimeren Moleküle zur Bildung von Filamenten tendiert. Auf diese Weise bilden sich Myosin-Fasern, die Bestandteil desSarkomerssind. Für Nicht-Muskel-Myosine wird angenommen, dass über die Domänen in der Schwanzregion die Spezifität des Transporters bestimmt wird.
Leichte Kette (Light Chain)
[Bearbeiten|Quelltext bearbeiten]Die leichten Ketten sind kleinere Aminosäureketten, welche an die deutlich größere schwere Kette binden. Die jeweilige Bindung erfolgt spezifisch an Bindedomänen für leichte Ketten (LCBD).
Es existieren verschiedene leichte Ketten, deren Funktion einerseits rein strukturell ist (essentielle leichte Kette), zum anderen die Aktivität der Motordomäne reguliert (regulatorische leichte Kette).
Hierbei sei insbesondere auf die Regulation der Muskelaktivität durch Ca2+-Ionen hingewiesen, welche über die regulatorische leichte Kette erfolgt.
Die Bewegung von Myosin im Querbrückenzyklus
[Bearbeiten|Quelltext bearbeiten]Das hier beschriebene Beispiel zeigt die Bewegung von Myosin anhand des konventionellen Myosin II im Muskel, bei welchem die Aktin- und Myosinfilamente ineinander geschoben werden. Der Ablauf bei den unkonventionellen Myosinen ist von Prinzip gleich, außer dass hier ein Myosin-Dimer mit seiner Fracht an einem Aktinfilament entlang „wandert “. Dabei bindet jeweils ein Myosinkopf abwechselnd, so dass quasi „ein Fuß nach dem anderen “vorgesetzt wird. Die Bewegung erfolgt gerichtet, da Myosin auf dem Aktinfilament nur in eine Richtung wandern kann. In der Regel läuft Myosin in Richtung des Plus-Endes eines Aktinfilaments. Eine Ausnahme bildet hier bislang Myosin VI, welches sich in die Gegenrichtung bewegt. Die unterschiedlichen unkonventionellen Myosin-Klassen übernehmen hier also die Bewegung in beide Richtungen am Aktin, im Gegensatz zu Kinesin und Dynein an denMikrotubuli.
Die Motoraktivität wird durch den sogenannten Querbrückenzyklus beschrieben. Gegenüber der Schwanzregion ist die Motordomäne abgewinkelt. In Abwesenheit vonATPbindet sie fest anAktin-Filamente. Bindung von ATP bewirkt ein Abdissoziieren vom Aktin-Filament. Anschließend verändert sich der Neigungswinkel der Motordomäne auf etwa 90° (Pre-Power-Stroke-Konformation). Nach der Hydrolyse vonATPzuADP+P bindet Myosin wieder an das Aktin-Filament. Nach Abgabe von P und ADP kommt es zum Kraftschlag (Power-Stroke), einem Zurückklappen des Neigungswinkels auf 50° (Post-Power-Stroke-Konformation). Da hierbei Myosin wieder fest an das Aktin-Filament gebunden ist, erfolgt eine gerichtete Bewegung. Im Muskel bewirkt das mehrmalige Durchlaufen des Querbrückenzyklus, dass sich die Myosin-Filamenteund die Aktin-Filamente ineinander schieben; es kommt zurMuskelkontraktion.
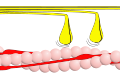
- Querbrückenzyklus
-
Phase 1– Myosin (gelb) bindet an Aktin (rosa). Dies wird durch Konformationsumwandlung des Tropomyosins möglich, das so die Bindestellen des Aktins für Myosin freigibt. Diese Konformationsumwandlung des Tropomyosins wird durch Bindung von Ca2+-Ionen an Troponin ausgelöst. Der angedeutete Winkel beträgt etwa 90°.
-
Phase 2– Myosinköpfchen (gelb) spalten ATP zu ADP und Phosphat und führen dabei ihren Kraftschlag aus. Das gebundene Aktin wird dabei in Richtung des Kraftschlags verschoben. Der angedeutete Winkel beträgt etwa 50°.
-
Phase 3– Myosinköpfchen (gelb) lösen sich unter Aufnahme von ATP vom Aktin (rosa).
-
Phase 4– Myosin (gelb) im Ruhezustand. Aktin (rosa).
Bereitstellung der Energie
[Bearbeiten|Quelltext bearbeiten]Der ATP-Vorrat im Muskel reicht gewöhnlich für fünf bis sechs Sekunden Dauerbelastung. Danach wird aufeinanderfolgendKreatinphosphat(genügt etwa zehn weitere Sekunden) und schließlichGlukose(Traubenzucker) von den Muskeln verstoffwechselt.
Literatur
[Bearbeiten|Quelltext bearbeiten]- Jeremy M. Berg, John L. Tymoczko,Lubert Stryer:Biochemie.6. Auflage, Spektrum Akademischer Verlag, Heidelberg 2007,ISBN 978-3-8274-1800-5.
- Donald Voet, Judith G. Voet:Biochemistry.4. Auflage, John Wiley & Sons, New York 2011,ISBN 978-1-11813992-9.
- Bruce Alberts,Alexander Johnson, Peter Walter, Julian Lewis, Martin Raff, Keith Roberts:Molecular Biology of the Cell,4. Auflage, Taylor & Francis 2002,ISBN 978-0-81533218-3.
Weblinks
[Bearbeiten|Quelltext bearbeiten]Einzelnachweise
[Bearbeiten|Quelltext bearbeiten]- ↑Renate Wahrig-Burfeind (Hrsg.):Wahrig. Illustriertes Wörterbuch der deutschen Sprache.ADAC-Verlag, München 2004,ISBN 3-577-10051-6,S.590.