Nitroverbindungen

Nitroverbindungensindorganische Verbindungen,bei denen eine oder mehrereNitrogruppen(–NO2) an jeweils ein Kohlenstoffatom eines organischen Restes gebunden sind. Man kann zwischenaliphatischenundaromatischenNitroverbindungen unterscheiden. Die aromatischen Nitroverbindungen sind in der Regel stabiler. Organische Verbindungen, in denen die Nitrogruppe an ein weiteres Stickstoffatom gebunden ist (sog.N-Nitroverbindungen), gehören einer eigenen Verbindungsklasse an und werdenNitraminegenannt.
Aromatische Nitroverbindungen
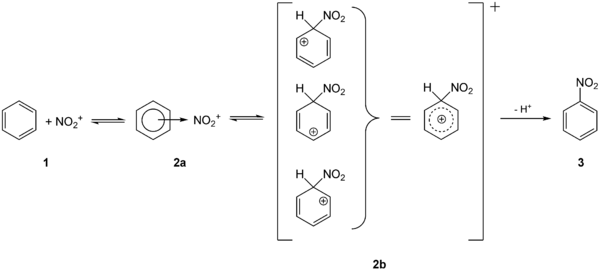
[Bearbeiten|Quelltext bearbeiten]Die aromatischen Nitroverbindungen (oft auchNitroaromaten) lassen sich durchelektrophile aromatische SubstitutionmitNitriersäuredirekt herstellen. Die Nitrierung vonBenzolliefert über die Zwischenstufen2aund2bden einfachsten Nitroaromat,Nitrobenzol3:
Zu den bekanntesten Vertretern gehören die SprengstoffeTrinitrotoluol,Pikrin-undStyphninsäure.Neben Sprengstoffen umfasst die Gruppe der Nitroaromaten auchFarbstoffe,Pharmazeutika,Herbizide,Ausgangsstoffe für die Kunststoffindustrie und synthetischeDuftstoffe,(z. B. Nitromoschus-Duftstoffe, mittlerweile in Verruf gekommen). In der chemischen Industrie sind Nitroaromaten bedeutende Zwischenprodukte, da sie zur Herstellung von aromatischen Aminen benötigt werden (z. B.Anilin,das aus Nitrobenzol synthetisiert wird) – siehe auchBASF.
Nitroaromaten als Umweltgifte
[Bearbeiten|Quelltext bearbeiten]Viele Nitroaromaten sindUmweltgifteund stellen als solche ein (Abfall-)Problem dar. So sind z. B. in Deutschland die Böden und das Grundwasser in der Umgebung ehemaliger Sprengstofffabriken noch heute mit Nitroaromaten kontaminiert.[1]
Aliphatische Nitroverbindungen
[Bearbeiten|Quelltext bearbeiten]Aliphatische Nitroverbindungen lassen sich u. a. durchnucleophile SubstitutionvonAlkylhalogenidenmit anorganischenNitriten,z. B.Silbernitrit,AgNO2oderNatriumnitrit,NaNO2herstellen.

- Synthese vonNitromethanausChloressigsäureund Natriumnitrit.
Sie sind präparativ vielseitig einsetzbar. So können sie beispielsweise in einerHenry-Reaktion(Nitro-Aldolreaktion) eingesetzt werden. Die so erhaltenen Nitroverbindungen können in weiteren Reaktionsschritten auch durchReduktionzu aliphatischenAminenoder in einerNef-ReaktionzuKetonenumgesetzt werden. Bedeutung besitzen sie als Zwischenprodukte in der chemischen Industrie, alsLösungsmitteloderTreibstoff.
Natürliche Nitroverbindungen
[Bearbeiten|Quelltext bearbeiten]InNaturstoffenkommen Nitrogruppen nur relativ selten vor. Einige der wenigen Beispiele für natürlich vorkommende Moleküle mit Nitrogruppe sindAristolochiasäuren,Chloramphenicol,2-Nitrophenolals Pheromon bei Zecken[2],3-Nitropropionsäure,Nitropentadecen ((1E)-1-Nitropentadec-1-en) und Nitrophenylethan.[3]
Unterscheidung von Nitro- und Nitritgruppen
[Bearbeiten|Quelltext bearbeiten]
Bei der Herstellung von Nitroverbindungen entsteht in einerNebenreaktionauch derEsterderSalpetrigen Säure(Nitrite) immer als Nebenprodukt. Der prozentuale Anteil ist jedoch vom Reaktionsweg abhängig. Der Unterschied besteht in der Wertigkeit des Stickstoffs. Die Nitrogruppe ist über dasStickstoffatom amKohlenstoffatom gebunden. In derisomerenNitritgruppe ist der Stickstoff dreiwertig und über einSauerstoffatom am Kohlenstoff gebunden.Nitroalkanesind temperaturstabiler als Nitritester.
Siehe auch
[Bearbeiten|Quelltext bearbeiten]Literatur
[Bearbeiten|Quelltext bearbeiten]- D. Olender, J. Żwawiak, L. Zaprutko:Multidirectional Efficacy of Biologically Active Nitro Compounds Included in Medicines.In:Pharmaceuticals.Band 11, Nummer 2, Mai 2018,doi:10.3390/ph11020054,PMID 29844300,PMC 6027522(freier Volltext) (Review). (Übersichtsartikel über biologisch aktive Nitroverbindungen, mit Anwendungen in der Medizin)
Einzelnachweise
[Bearbeiten|Quelltext bearbeiten]- ↑Bayerisches Landesamt für Umweltschutz:Rüstungsaltlasten - Fachinformation und Erfahrungsaustausch(PDF; 2,8 MB), Fachtagung vom 14. Oktober 2004.
- ↑Sara Fernandes Soares, Lígia Miranda Ferreira Borges:Electrophysiological responses of the olfactory receptors of the tick Amblyomma cajennense (Acari: Ixodidae) to host-related and tick pheromone-related synthetic compounds.In:Acta Tropica.Band124,Nr.3,Dezember 2012,S.192–198,doi:10.1016/j.actatropica.2012.08.007,PMID 22925715.
- ↑José Guilherme S. Maia, Eloísa Helena A. Andrade:Database of the Amazon aromatic plants and their essential oils.In:Química Nova.Band32,2009,S.595–622,doi:10.1590/S0100-40422009000300006.