Phenol
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Phenol | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C6H6O | |||||||||||||||||||||
| Kurzbeschreibung |
farblose, durch Verunreinigungen oft rötlich gefärbte,hygroskopische,nadelförmige Kristalle mit durchdringendem Geruch[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 94,11 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||||||||
| Dichte |
1,07 g·cm−3[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
182 °C[2] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| pKS-Wert |
9,99[4] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Brechungsindex |
1,5408 (41 °C)[6] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK | ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werdenSI-Einheitenverwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten beiStandardbedingungen(0 °C, 1000 hPa). Brechungsindex:Na-D-Linie,20 °C | ||||||||||||||||||||||
PhenoloderHydroxybenzol(veraltet auchKarbolsäure,älterCarbolsäure,oder kurzKarboloderCarbol) ist einearomatische,organischeVerbindung und besteht aus einerPhenylgruppe(–C6H5), an die eineHydroxygruppe(–OH) gebunden ist. Der farblose, kristalline Feststoff ist eine wichtigeIndustriechemikalieund dient als Zwischenprodukt besonders zur Herstellung diverserKunststoffe.Phenol ist der einfachste Vertreter derPhenole.MitBasenbildet PhenolSalze,diePhenolate.
Nomenklatur
[Bearbeiten|Quelltext bearbeiten]Der systematischeIUPAC-NamelautetBenzenol.Die heutzutage bevorzugteIUPAC-Bezeichnungist jedochPhenol.[12]
Geschichte
[Bearbeiten|Quelltext bearbeiten]Phenol wurde im Jahr 1834 vom ChemikerFriedlieb Ferdinand Rungebei der Destillation vonSteinkohlenteerentdeckt; er bezeichnete die Substanz als „Carbolsäure “.Auguste Laurententdeckte sie 1841 erneut und ermittelte die Summenformel als C6H6O.Charles Gerhardtnannte sie Phenol.[13]Der Name weist auf das Leuchtgas hin, welches neben Steinkohlenteer bei der Produktion von Koks entstand. Leuchtgas (Stadtgas) diente damals zur Beleuchtung der Städte (vgl. griechischphainomai„leuchten “).
Joseph Listersetzte es 1865 – in zwei- („Karbolwasser “)[14]oder fünfprozentiger Lösung – alsAntiseptikumbei der Wunddesinfektion ein; damals war die „Carbolsäure “nahezu das einzig verfügbare Mittel gegen Wundinfektionen.[3]Wegen seiner hautirritierenden Nebenwirkung wurde es aber bald durch andere Antiseptika ersetzt. Wegen seiner bakteriziden Wirkung wurde es alsDesinfektionsmitteleingesetzt. Zur Zeit derRussischen Grippeum 1890 wurden in England Gummiballons(Carbolic Smoke Balls)verkauft, die Karbolsäure enthielten, deren Dämpfe zum Schutz vor Infektionen mehrmals täglich eingeatmet werden sollten. Heute werden zur Desinfektion stattdessen Derivate des Phenols verwendet.[15]
In der Lebensmittelanalytik wurde Phenol zum Nachweis vonPeroxidasenim Fleisch verwendet. Bei der Karbolprobe wurde 2 ml Fleischfiltrat mit einer 5%igen Phenollösung und 3 Tropfen einer 3%igenWasserstoffperoxidlösungversetzt und die entstehende Farbe beurteilt.[16]
Phenol wird zusammen mit Formaldehyd zur Herstellung derPhenoplast-Kunstharzeverwendet: Unter dem WarenzeichenBakelitwurde Phenolharz zu Beginn des 20. Jahrhunderts als erster vollsynthetischer, industriell produzierterKunststoffhergestellt.
Während desHolocaustsermordetenSS-ÄrzteKZ-Häftlinge u. a. durchintrakardialePhenolinjektionen.[17][18][19]
Zu den neueren bekannten Phenolderivaten gehört das 1977 entwickelte NarkosemittelPropofol.[20]
Vorkommen
[Bearbeiten|Quelltext bearbeiten]
Phenol kommt in der Natur in vielen Pflanzen vor. Nachgewiesen wurde es unter anderem in[21]
- Kräutern und Gewürzen, wieMajoran,Rooibos,Gewürzvanille,Polei-Minze,Estragon,Tee,Zimt,Echtem Süßholz,Echtem Johanniskraut,Winter-Bohnenkraut,Sesam,Baikal-Helmkraut,Spanischem Pfeffer,Wiesenklee,Färberdisteln,Kalmus,Gewöhnlichem Froschlöffel,Besen-Beifußund derWeinraute.
- Gemüsen und Früchte, wie derGemeinen Schafgarbe,Heidelbeeren/Amerikanischen Heidelbeeren,Gemüsespargel,TomatenundWeißen Maulbeeren.
- Bäumen und Sträuchern, wieWaldkiefern,demSandelholzbaum,demTamarindenbaum,Zitrusfrüchten,Pinus elliottii,derVirginischen Zaubernuss,demJapanischen Liguster,Myrica cerifera,Virginischem TabakundIndischem Patschuli.
Gewinnung und Darstellung
[Bearbeiten|Quelltext bearbeiten]Phenole sind nicht durchelektrophile aromatische Substitutiondarzustellen, da ein entsprechendes Sauerstoff-Elektrophil nicht zugänglich ist.
Industrielle Herstellung
[Bearbeiten|Quelltext bearbeiten]Im industriellen Maßstab wird dieGrundchemikaliePhenol durch dasCumolhydroperoxid-Verfahren,auch alsPhenolsynthese nachHock(Hock-Verfahren) bekannt, hergestellt:

BenzolundPropenwerden zunächst durch eineFriedel-Crafts-Alkylierungim Sauren in Isopropylbenzol (Cumol) überführt. Cumol wird durch LuftsauerstoffzumHydroperoxidoxidiert, welches durch saure Aufarbeitung unterUmlagerungzu Phenol undAcetonzerfällt.[3]Das gleichzeitige Entstehen zweier leicht trennbarer, wertvoller Produkte macht dieses Verfahren besonders wirtschaftlich.
Herstellung aus nachwachsenden Rohstoffen
[Bearbeiten|Quelltext bearbeiten]Seit längerer Zeit wird an Möglichkeiten geforscht, Phenol ausnachwachsenden Rohstoffenund insbesondere ausLigninherzustellen.[22]Dazu eignen sich verschiedenePyrolysevariantenmit anschließender Produktaufbereitung.[23][24]Allerdings wird aktuell geschätzt, dass erst in den 2040er Jahren eine solche Phenolproduktion kommerzialisiert wird.[25]
Herstellung im Labor
[Bearbeiten|Quelltext bearbeiten]Im Labormaßstab werden Phenole auch durchVerkochenvonDiazoniumsalzen,welche durch dieDiazotierungvon aromatischenAminoverbindungen– hier vonAnilin– mitSalpetriger Säurein der Kälte entstehen, hergestellt:
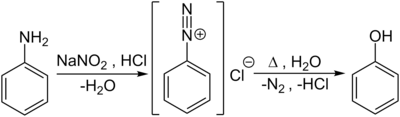
Eine weitere Darstellungsmöglichkeit besteht im Zusammenschmelzen des Natriumsalzes derBenzolsulfonsäuremitAlkalihydroxidin einernucleophilen aromatischen Substitutionnach Additions-Eliminierungs-Mechanismus (ipso-Substitution):

Im Sinne einerradikalischen Substitutionkann Benzol in derFenton-Reaktionzu Phenol umgesetzt werden. DieBaeyer-Villiger-OxidationvonAcetophenonliefertEssigsäurephenylester,welches nach Verseifung Phenol freisetzt.
Eigenschaften
[Bearbeiten|Quelltext bearbeiten]
Physikalische Eigenschaften
[Bearbeiten|Quelltext bearbeiten]Reines Phenol bildet bei Zimmertemperatur farblose Kristallnadeln, jedoch ist das kommerziell erhältliche Produkt i. d. R. durch geringe, aber intensiv gefärbte Verunreinigungen rosa bis rötlich-braun gefärbt.[26]Der Schmelzpunkt liegt bei 41 °C und der Siedepunkt bei 182 °C. Es besitzt einen charakteristischen, aromatischen Geruch. Wegen derhydrophilenOH-Gruppe ist Phenolhygroskopisch.In Phenol löst sich begrenzt viel Wasser. Bei etwa 6 % Wasser ist das Gemisch bei 20 °C flüssig.[3]Phenol löst sich nur mäßig in Wasser. Zwischen den Lösungen mit hohem und niedrigem Phenolanteil besteht eineMischungslücke.[27]Mit Wasser verflüssigtes Phenol wurde im medizinischen Bereich alsPhenolum liquefactumbezeichnet.[28]
Chemische Eigenschaften
[Bearbeiten|Quelltext bearbeiten]Die Hydroxygruppe des Phenols reagiert im Vergleich zuAlkoholenstärker sauer;daher ist Phenol eine schwacheorganische Säure.Die Ursache ist die Mesomeriestabilisierung der korrespondierenden Base des Phenolations. Die negative Ladung kann in den Ring delokalisiert werden.
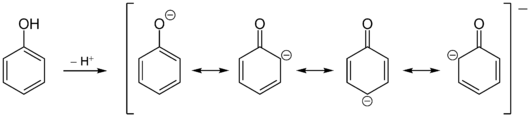
Im Gegensatz zu Alkoholen gehen Phenole nur bei hohen Temperaturen und Anwesenheit spezieller Katalysatoren nukleophile Substitutionsreaktionen unter Ersatz der Hydroxygruppe durch andereNukleophileein.[29]Die Hydroxy-Funktion zeigt, besonders im deprotonierten Zustand, einen ausgeprägten+M-Effekt.Daneben zeigt sie einen−I-Effekt.Da dieser aber deutlich kleiner ist als der +M-Effekt, wird Phenol sehr leicht elektrophil angegriffen. Der Angriff erfolgt bevorzugt inortho- undpara-Position zur Hydroxygruppe. Wegen des elektronenschiebenden Charakters der Hydroxygruppe ist Phenol etwa tausendmal reaktiver als Benzol. Die Bevorzugung desortho- bzw.para-Angriffs vonElektrophilenlässt sich einerseits durch Betrachtung der Grenzstrukturen des Phenolat-Anions verstehen. Die negative Ladung wird in den aromatischen Ring auf dieortho- undpara-Positionen delokalisiert. Da Elektrophile bevorzugt elektronenreiche Positionen angreifen, kommt es zu der beobachtetenRegioselektivität.Andererseits ist der bei der Substitution als Zwischenstufe entstehende σ-Komplex (Carbeniumion) inortho- undpara-Position mesomeriestabilisierter als inmeta-Position, da mehr energiearme Grenzstrukturen möglich sind und die Delokalisierung der Elektronen somit ausgeprägter ist. Die Substitution inpara-Position ist zusätzlich bevorzugt, da es dort nicht zusterischen Wechselwirkungendes angreifenden Elektrophils mit denfreien Elektronenpaarendes Sauerstoffs kommt.
DieKeto-Enol-Tautomerieliegt wegen der Ausbildung des thermodynamisch günstigen aromatischen Systems vollständig auf der Enol-Seite.
Eine technisch bedeutende nukleophile Substitutionsreaktion ist die Darstellung vonAnilinaus Phenol bei 250 °C und Anwesenheit eines Oxid-Katalysators (Aluminium-,Silicium-oderMagnesiumoxid,auchBorsäure) als „Halcon-Prozess“.[30]
Phenol setzt sich durchkatalytische HydrierungzuCyclohexanolum.
Verwendung
[Bearbeiten|Quelltext bearbeiten]
Phenol wird hauptsächlich als Ausgangsstoff zur Herstellung vonKunststoffenverwendet. Dabei spielt die Herstellung vonPhenoplastendie wichtigste Rolle. Phenol wird auch zuCaprolactamumgesetzt, einem Stoff zur Herstellung vonPolyamiden.Die Umsetzung zuBisphenol Aliefert einen wichtigen Ausgangsstoff zur Herstellung vonEpoxidharzen.
Aus Phenol wird das ArzneimittelAcetylsalicylsäurehergestellt. In der Mikroskopie wird Phenol zur Konservierung und zurGram-Färbungverwendet. Kosmetische Produkte dürfen in derEUund in Kanada kein Phenol mehr enthalten.[31][32][33][34]
Früher wurde eine Lösung von 22 Promille Phenol pro Liter Wasser alsDesinfektionsmitteleingesetzt, sogenanntes Karbolwasser oder Karbollösung. Wegen der Giftigkeit und auftretenden Hautirritationen wurde Karbolwasser (etwa als Carbolspray)[35]bald nach der Entdeckung anderer Desinfektionsmittel nicht mehr verwendet. Von dieser Verwendung leitet sich die Bezeichnung von (jungen) Krankenschwestern als Karbolmäuschen ab.
Darüber hinaus wurde Phenol zur Inaktivierung von Krankheitserregern für die Impfstoffherstellung genutzt (Phenolvakzine).[36]
Das billig herzustellende Phenol wird verschiedenen industriellen Produkten beigemischt, teilweise als Konservierungsmittel mit ähnlichen Eigenschaften wieFormaldehydund als Inhaltsstoff vonAbbeizmittelnzur Entfernung von Epoxy- und PU-Beschichtungen in der Luftfahrtindustrie.[37]
Sicherheitshinweise
[Bearbeiten|Quelltext bearbeiten]Phenol wirkt sowohl lokal als auch systemisch stark toxisch; bei dermaler Exposition besitzt es eine reizende bis ätzende Wirkung auf Schleimhäute, Haut und Augen. Die Augen können Schäden in Form einer Trübung derHornhaut,Schwellungen und Verwachsung der Lider bis zur Erblindung erleiden. Hautkontakt führt zuerst zu Hautrötung, später zu einer Weißverfärbung; längere Einwirkungszeit verursacht eine Dunkelfärbung bis zur Bildung vonNekrosen.[2]
Phenol wird vorwiegend über die Haut resorbiert, aber auch inhalative oder orale Aufnahme ist möglich. Im menschlichen Organismus schädigt die Substanz akut Nieren, Blut,Zentralnerven-und Herz-Kreislauf-System. Bei chronischer Exposition sind auch gastrointestinale und nervale Störungen, weiterhin Schädigung von Leber, Nieren und Hautveränderungen bekannt. Bei Inhalation wurden als Vergiftungssymptome Schwindel, Kopfschmerz und Störungen der Ohren, Erbrechen, Schlaflosigkeit und Nierenreizung beschrieben. Die Aufnahme hoher Mengen führte innerhalb weniger Stunden zu massiven Nierenfunktionsstörungen bis zu akutem Nierenversagen. Orale Aufnahme bewirkt Verätzungen im Mund, Rachen, Speiseröhre und Magen; weiterhin sind Schluckstörungen und Störungen im Magen-Darm-Trakt bekannt.[2]
Die Toxizität wird auf reaktiveMetabolitendes Phenol zurückgeführt, die an dieDNAund andereMakromolekülebinden und dabei Brüche in denChromosomenund mutagene Effekte auslösen können. Eine orale Dosis ab 1 g kann vereinzelt für einen Menschen tödlich sein; individuell wurden aber auch wesentlich höhere Dosen überlebt.[2]Der oraleLDLo-Wert für den Menschen liegt zwischen 140[11]und 1400 mg/kg Körpergewicht; bei Kindern beträgt die orale minimale letale Dosis 10 mg/kg Körpergewicht.[10][2]
Phenol wurde 2015 von der EU gemäß derVerordnung (EG) Nr. 1907/2006(REACH) im Rahmen derStoffbewertungin den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen desStoffsauf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Phenol waren die Besorgnisse bezüglichVerbraucherverwendung,Exposition vonArbeitnehmern,hoher (aggregierter) Tonnage, hohes Risikoverhältnis (Risk Characterisation Ratio,RCR) und anderer gefahrenbezogener Bedenken sowie der möglichen Gefahr durch mutagene Eigenschaften. Die Neubewertung fand ab 2015 statt und wurde vonDänemarkdurchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[38][39]
Historische Beschreibung
[Bearbeiten|Quelltext bearbeiten]„Karbolsäure (Steinkohlenteerkreosot, acidum phenylicum, acidum carbolicum). Eine Substanz, die für die Farbenindustrie und Medizin (alsDesinfektionsmittel) eine außerordentliche Bedeutung erlangt hat. Der Handelsname ist immer noch Karbolsäure, während der wissenschaftliche Name jetzt Phenol ist; diese Substanz besitzt zwar die Eigenschaften einer schwachenSäureund ist imstande, sich mit Basen zu verbinden, wird deshalb auch Phenylsäure oder Phensäure genannt, zugleich aber und in noch höherem Grade spielt sie die Rolle eines Alkohols, daher auch der Name Phenylalkohol, den man in Phenol gekürzt hat. Man gewinnt die Karbolsäure hauptsächlich aus demSteinkohlenteerund demBraunkohlenteer,imHolzteersind nur äußerst geringe Mengen davon enthalten, denn dasKreosotdes Holzteers besteht nicht, wie man eine Zeit lang glaubte, aus Phenol, sondern aus dem strukturell ähnlichenKresol,[40]sowie noch einigen anderen Stoffen. Um die Karbolsäure zu gewinnen, behandelt man den zwischen 150 und 200 °C übergehenden Teil des Teers mitNatronlauge,welche sich mit der Karbolsäure und dem Kresol, das auch im Steinkohlenteer enthalten ist, verbindet, trennt diese Lösung von den übrigen Teerbestandteilen und zersetzt sie mit einer Säure. Man destilliert dann das abgeschiedene ölige Produkt und fängt das, was über 190 °C übergeht, besonders auf; letzteres wird als rohes Kresol, das, was unter 190 °C übergeht, als rohe Karbolsäure verkauft. Beide Substanzen sind in diesem Zustande noch braune, sehr übel riechende, ölige Flüssigkeiten. Diese rohe Karbolsäure (acidum carbolicum crudum) wird teils weiter gereinigt, teils wird sie zur Konservierung von Holz und zum Desinfizieren vonAbtrittgrubenverwendet. “
Weblinks
[Bearbeiten|Quelltext bearbeiten]Einzelnachweise
[Bearbeiten|Quelltext bearbeiten]- ↑August Laurent:Ueber das Phenol (Phenyloxydhydrat, phenylige Säure).In:Journal für Praktische Chemie.52, 1851, S. 279–282.doi:10.1002/prac.18510520125.
- ↑abcdefghijklmnEintrag zuPhenolin derGESTIS-StoffdatenbankdesIFA,abgerufen am 3. Januar 2023.(JavaScript erforderlich)
- ↑abcdEintrag zuPhenol.In:Römpp Online.Georg Thieme Verlag, abgerufen am 9. Juni 2013.
- ↑CRC Handbook of Tables for Organic Compound Identification,Third Edition, 1984,ISBN 0-8493-0303-6.
- ↑Phenol.In:Gefahrstoffinformationsssystem Chemikalien.Berufsgenossenschaft Rohstoffe und chemische Industrie, Berufsgenossenschaft Holz und Metall, 29. April 2024,abgerufen am 7. Mai 2024(deutsch).
- ↑David R. Lide (Hrsg.):CRC Handbook of Chemistry and Physics.90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL,Physical Constants of Organic Compounds,S. 3-422.
- ↑Eintrag zuPhenolimClassification and Labelling InventoryderEuropäischen Chemikalienagentur(ECHA), abgerufen am 1. Februar 2016. Hersteller bzw.Inverkehrbringerkönnen die harmonisierte Einstufung und Kennzeichnungerweitern.
- ↑Schweizerische Unfallversicherungsanstalt(Suva):Grenzwerte – Aktuelle MAK- und BAT-Werte(Suche nach108-95-2bzw.Phenol), abgerufen am 2. November 2015.
- ↑Stoffliste (MAK-Werte und TRK-Werte),Verordnung des Bundesministers für Arbeit über Grenzwerte für Arbeitsstoffe sowie über krebserzeugende und fortpflanzungsgefährdende (reproduktionstoxische) Arbeitsstoffe (Grenzwerteverordnung 2021 – GKV), Österreich, abgerufen am 27. August 2021.
- ↑abcW. B. Deichmann:Toxicology of Drugs and Chemicals.New York 1969, Academic Press, S. 463.
- ↑abR. Lefaux, O. H. Cleveland:Practical Toxicology of Plastics.Chemical Rubber Co., 1968, S. 329.
- ↑Henri A Favre, Warren H Powell:Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013.Hrsg.: The Royal Society of Chemistry. Cambridge 2014,ISBN 978-0-85404-182-4,S.416, 668.
- ↑Max Bloch, in Günther Bugge,Das Buch der großen Chemiker,Band 2, Verlag Chemie, Berlin 1930, S. 92–114.
- ↑Wörterbuch der Veterinärmedizin,2. Auflage, S. 617
- ↑Heinz Lüllmann, Klaus Mohr, Lutz Hein,Pharmakologie und Toxikologie,Georg Thieme, Stuttgart, 2010, S. 541 (eingeschränkte Vorschauin der Google-Buchsuche).
- ↑Wörterbuch der Veterinärmedizin,2. Auflage, S. 617
- ↑Die SS-Ärzte.(vom 4. März 2016 imInternet Archive) Website der KZ-Gedenkstätte Mauthausen. Abgerufen am 9. Juli 2019.
- ↑Hans Halter:Die Mörder sind noch unter uns. NS-Ärzte - Von der Euthanasie.Bericht im Spiegel 25/1988, 20. Juni 1988, S. 112–122.
- ↑Karin Orth:Das System der nationalsozialistischen Konzentrationslager. Eine politische Organisationsgeschichte.Hamburg 1999.
- ↑Otto Mayrhofer:Gedanken zum 150. Geburtstag der Anästhesie.In:Der Anaesthesist.Band 45, 1996, S. 881–883, hier: S. 883.
- ↑abPHENOL(engl.) In:Dr. Duke's Phytochemical and Ethnobotanical Database,Hrsg.U.S. Department of Agriculture,abgerufen am 24. Juli 2023.
- ↑Joseph Zakzeski, Pieter C. A. Bruijnincx, Anna L. Jongerius & Bert M. Weckhuysen:The Catalytic Valorization of Lignin for the Production of Renewable Chemicals.In:Chemical Reviews.Band110,Nr.6,2010,S.3565–3567,doi:10.1021/cr900354u.
- ↑Joy Esohe Omoriyekomwan, Arash Tahmasebi & Jianglong Yu:Production of phenol-rich bio-oil during catalytic fixed-bed and microwave pyrolysis of palm kernel shell.In:Bioresource Technology.Band207,2016,S.188–196,doi:10.1016/j.biortech.2016.02.002.
- ↑Dengle Duan, Hanwu Lei,Yunpu Wang, Roger Ruan, Yuhuan Liu, Lijun Ding, Yayun Zhang & Lang Liu:Renewable phenol production from lignin with acid pretreatment and ex-situ catalytic pyrolysis.In:Journal of Cleaner Production.Band231,2019,S.331–340,doi:10.1016/j.jclepro.2019.05.206.
- ↑Vinoth Kumar Ponnusamy, Dinh Duc Nguyen, Jeyaprakash Dharmaraja, Sutha Shobana, Rajesh Banu, Rijuta Ganesh Saratale, Soon Woong Chang & Gopalakrishnan Kumar:A review on lignin structure, pretreatments, fermentation reactions and biorefinery potential.In:Bioresource Technology.Band271,2019,S.462–472,doi:10.1016/j.biortech.2018.09.070.
- ↑Karl-Heinz Lautenschläger, Werner Schröter, Joachim Teschner, Hildegard Bibrack,Taschenbuch der Chemie,18. Auflage, Harri Deutsch, Frankfurt (Main), 2001.
- ↑Hans-Dieter Jakubke, Ruth Karcher (Hrsg.):Lexikon der Chemie,Spektrum Akademischer Verlag, Heidelberg, 2001.
- ↑Arnold Willmes,Taschenbuch Chemische Substanzen,Harri Deutsch, Frankfurt (M.), 2007, S. 583.
- ↑S. A. Lawrence:Amines: synthesis, properties and applications,Cambridge University Press, 2004,ISBN 978-0-521-78284-5,S. 80.
- ↑Hans-Jürgen Arpe,Klaus Weissermel:Industrielle Organische Chemie: Bedeutende Vor- und Zwischenprodukte.6. Auflage, Wiley-VCH, 2007,ISBN 978-3-527-31540-6,S. 418.
- ↑Prohibited substances in cosmetic product (Annex II, #1175, Phenol) - European Commission.In:ec.europa.eu.Abgerufen am 6. Juli 2018(englisch).
- ↑CosIng - Cosmetics - GROWTH - European Commission.In:ec.europa.eu.Abgerufen am 6. Juli 2018(englisch).
- ↑Health Canada:Cosmetic Ingredient Hotlist - Canada.ca.In:canada.ca.18. Juni 2004,abgerufen am 6. Juli 2018(englisch).
- ↑Health Canada:Cosmetic Ingredient Hotlist: Prohibited and Restricted Ingredients - Canada.ca.In:canada.ca.18. Juni 2004,abgerufen am 6. Juli 2018(englisch).
- ↑Nicolai Guleke:Kriegschirurgie und Kriegschirurgen im Wandel der Zeiten. Vortrag gehalten am 19. Juni 1944 vor den Studierenden der Medizin an der Universität Jena.Gustav Fischer, Jena 1945, S. 14.
- ↑J. P. McGettigan:Experimental rabies vaccines for humans.In:Expert Rev Vaccines(2010), Band 9, Heft 10, S. 1177–1186.doi:10.1586/erv.10.105.PMID 20923268.PMC 3072237(freier Volltext).
- ↑CH207 Aircraft paintstripper, phenolic, acid.Callington, 14. Oktober 2009, archiviert vomam23. September 2015;abgerufen am 25. August 2015(englisch).
- ↑Europäische Chemikalienagentur(ECHA):Substance Evaluation Conclusion and Evaluation Report.
- ↑Community rolling action plan (CoRAP) derEuropäischen Chemikalienagentur(ECHA):Phenol,abgerufen am 6. März 2022.
- ↑Kresol ist Methylphenol.
- ↑Karbolsäure.In:Merck’s Warenlexikon.3. Aufl. 1884 ff., S. 250 f.
- CoRAP-Stoff
- ATC-C05
- ATC-D08
- ATC-N01
- ATC-R02
- Giftiger Stoff bei Verschlucken
- Giftiger Stoff bei Hautkontakt
- Giftiger Stoff bei Einatmen
- Ätzender Stoff
- Erbgutverändernder Stoff
- Gesundheitsschädlicher Stoff (Organschäden)
- Umweltgefährlicher Stoff (chronisch wassergefährdend)
- Phenol
- Arzneistoff
- Pharmazeutischer Hilfsstoff
- Aromastoff (EU)
- Futtermittelzusatzstoff (EU)




![{\displaystyle \mathrm {C_{6}H_{5}OH\ +\ NH_{3}\ {\xrightarrow[{Kat.}]{250^{\circ }C}}\ C_{6}H_{5}NH_{2}\ +\ H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/ee2fee96963f62879e3117c093e3eb5dca2a51fe)