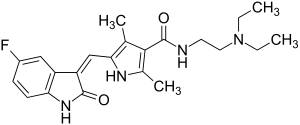
Sunitinib
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Sunitinib | |||||||||||||||
| Andere Namen |
N-[2-(Diethylamino)ethyl]-5-[(Z)-(5-fluor-1,2-dihydro-2-oxo-3H-indol-3-yliden)-methyl]-2,4-dimethyl-1H-pyrrol-3-carboxamid(IUPAC) | |||||||||||||||
| Summenformel | C22H27FN4O2 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code | ||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 398,48 g·mol−1 | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werdenSI-Einheitenverwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten beiStandardbedingungen(0 °C, 1000 hPa). | ||||||||||||||||
Sunitinib(Handelsname:Sutent,Hersteller:Pfizer) ist einRezeptor-Tyrosinkinase-Inhibitor,der alsArzneistoffzur Behandlung Erwachsener mit nicht resezierbaren und/oder metastasierten malignen gastrointestinalen Stromatumoren (GIST) zugelassen ist, wenn eine Behandlung mitImatinibwegen Resistenz oder Unverträglichkeit fehlgeschlagen ist. Des Weiteren ist das Medikament zur Behandlung Erwachsener mit fortgeschrittenem und/oder metastasiertemNierenzellkarzinom(RCC) und zur Behandlung nicht resezierbarer oder metastasierter, gut differenzierterpankreatischerneuroendokriner Tumoren(pNET) mit Krankheitsprogression bei Erwachsenen zugelassen.[2]ImOff-Label-Usewurde Sunitinib mit einigem Erfolg (verlängerte Überlebensdauer) bei Patienten mit fortgeschrittenemAderhautmelanomeingesetzt.[3]
Hintergrund
[Bearbeiten|Quelltext bearbeiten]Die Entwicklung des Wirkstoffs geht auf Grundlagenforschungen von Mitarbeitern des deutschenMax-Planck-Instituts für Biochemiein Zusammenarbeit mit Partner-Institutionen in den USA in den 1980er-Jahren zurück. Ein 1991 ausgegründetes Unternehmen führte die Ergebnisse einer kommerziellen Verwertung zu, wurde bald übernommen und landete schließlich 2003 bei Pfizer. Dem Konzern gelang es 2006, eine Zulassung für das Medikament zu erhalten.[4]
Pharmakologie
[Bearbeiten|Quelltext bearbeiten]Sunitinib hemmt verschiedeneRezeptor-Tyrosinkinasen.Dies sind unter anderemPDGFR,VEGFR,c-Kit,FLT, CSF undRET.Diese Rezeptoren werden mit dem Tumorwachstum, der pathologischenAngiogeneseund der Entwicklung vonMetastasenbei Krebserkrankungen in Verbindung gebracht.
Unter der Behandlung mit Sunitinib können als unerwünschte Wirkungen Müdigkeit, Durchfall,Hand-Fuß-Syndrom,Mundschleimhautentzündung undarterielle Hypertonieauftreten. Als Ursache für die Müdigkeit wird oft eineSchilddrüsenunterfunktiongefunden,[5][6]als deren Ursache eine verminderteIod-Aufnahme in dieSchilddrüsegilt[7]– vermutlich bedingt durch einenicht-kompetitive HemmungderThyreoperoxidase.[6]
Literatur
[Bearbeiten|Quelltext bearbeiten]- L. Sun, C. Liang, S. Shirazian, Y. Zhou, T. Miller, J. Cui, J. Y. Fukuda, J. Chu, A. Nematella, X. Wang, H. Chen:Discovery of 5-[5-fluoro-2-oxo-1,2- dihydroindol-(3Z)-ylidenemethyl]-2,4- dimethyl-1H-pyrrole-3-carboxylic acid (2-diethylaminoethyl)amide, a novel tyrosine kinase inhibitor targeting vascular endothelial and platelet-derived growth factor receptor tyrosine kinase.In:J. Med. Chem.Band 46, 2003, S. 1116–1119. (Synthese)
- NEJM: A. Méjean u. a.:Sunitinib Alone or after Nephrectomy in Metastatic Renal-Cell Carcinoma.In:The New England Journal of Medicine.3. Juni 2018,doi:10.1056/NEJMoa1803675.
- NEJM: R. Motzer u. a.:Cytoreductive Nephrectomy — Patient Selection Is Key.In:The New England Journal of Medicine.3. Juni 2018,doi:10.1056/NEJMe1806331.
Einzelnachweise
[Bearbeiten|Quelltext bearbeiten]- ↑abDatenblattSunitinib malatebeiSigma-Aldrich,abgerufen am 3. Januar 2023 (PDF).
- ↑European Medicines Agency:Produktinformation Sutent (EMEA/H/C/000687 -II/0038)(PDF; 452 kB).
- ↑M. E. Valsecci, M. Orloff, R. Sato, I. Chervoneva, C. Shields, J. Shields, M. Mastrangelo, T. Sato:Adjuvant Sunitinib in High-Risk Patients with Uveal Melanoma.In:Ophthalmology.2017, online publiziert am 18. September
- ↑Pressemeldung MPI, 8. Februar 2006
- ↑Brian I. Rini, Ila Tamaskar, Phillip Shaheen, Renee Salas, Jorge Garcia, Laura Wood, Sethu Reddy, Robert Dreicer, Ronald M. Bukowski:Hypothyroidism in Patients With Metastatic Renal Cell Carcinoma Treated With Sunitinib.In:Journal of the National Cancer Institute.Band 99, Nr. 1, 2007, S. 81–83;doi:10.1093/jnci/djk008.
- ↑abE. Wong, L. S. Rosen, M. Mulay, A. Vanvugt, M. Dinolfo, C. Tomoda, M. Sugawara, J. M. Hershman:Sunitinib induces hypothyroidism in advanced cancer patients and may inhibit thyroid peroxidase activity.In:Thyroid.Band 17, Nr. 4, Apr 2007, S. 351–355.PMID 17465866.
- ↑D. Mannavola, P. Coco, G. Vannucchi, R. Bertuelli, M. Carletto, P. G. Casali, P. Beck-Peccoz, L. Fugazzola:A novel tyrosine-kinase selective inhibitor, sunitinib, induces transient hypothyroidism by blocking iodine uptake.In:J Clin Endocrinol Metab.Band 92, Nr. 9, Sep 2007, S. 3531–3534. Epub 2007 Jun 26.PMID 17595247.