Terpene

Terpene[] sind eine große undheterogeneGruppechemischer Verbindungenmit einer Vielfalt anKohlenstoffgerüsten,deren gemeinsames Merkmal darin besteht, dass sich ihr Grundgerüst aufIsopren-Einheiten zurückführen lässt. Die Terpene im engen Sinn sind reineKohlenwasserstoffe,von denen viele natürlich in Organismen vorkommen,[1]oft alssekundäre Pflanzenstoffe.
Im weiteren Sinn werden auch die verwandtenTerpenoidedazu gezählt, deren Grundgerüst sich ebenfalls von Isopren-Einheiten ableiten lässt. Im Unterschied zu den Terpenen sind sie durch zusätzlichefunktionelle Gruppengekennzeichnet, können aber auch in ihrem Kohlenstoffgerüst Unterschiede aufweisen. Terpenoide kommen in der Natur vorwiegend als Vertreter derAlkohole,Ether,Aldehyde,Ketone,Carbonsäuren,CarbonsäureesterundGlycosidevor.Ätherische Öle,die aus Pflanzen gewonnen werden, bestehen zum Großteil aus Terpenen bzw. Terpenoiden. Sie spielen für die Pflanze eine wichtige Rolle bei der Modulation zellulärer Funktionen und in den Wechselwirkungen pflanzlicher und tierischer Arten eines Ökosystems, indem sie beispielsweise Fressfeinde abschrecken, Bestäuber anlocken odermutualistischeFormen des Zusammenlebens fördern. Die meisten der über 8000 Terpene und über 30.000 Terpenoide kommen alsNaturstoffevor.[2]
Die biologischen Funktionen von Terpenen sind bisher nur begrenzt erforscht worden. Eine bekannte Einsatzmöglichkeit ist z. B. die Wirkung der Teilgruppe derPheromoneals Lockmittel für Insektenfallen. Weiter wirken viele Terpeneantimikrobiell.Die Wirkung zur Behandlung von Viren ist noch Gegenstand der Forschung[3][4][5]Zahlreiche Terpene bzw. Terpenoide werden als Geruchs- oder Geschmacksstoffe inParfümsund kosmetischen Produkten eingesetzt,[6]daneben aber auch zurVergällung.[7]
Für die vielfältigen Strukturvarianten sind verschiedene Klassifikationen möglich. DieIUPACetwa zählt nurKohlenwasserstoffezu den Terpenen, wogegen alle sauerstoffhaltigen Isoprenabkömmlinge als Terpenoide gelten.[8]In der Praxis haben sichTrivialnamenfür die Kohlenstoffgerüste eingebürgert, die sich häufig am wissenschaftlichen Namen jenes Organismus orientieren, aus dem diese erstmals isoliert wurden.
Geschichte
[Bearbeiten|Quelltext bearbeiten]
Die Terpene wurden nach einem Vorschlag des französischen ChemikersMarcelin BerthelotvonAugust Kekulénach dem BaumharzTerpentinbenannt,[9]das nebenHarzsäurenauch Kohlenwasserstoffe enthält. Ursprünglich wurden nur diese als Terpene bezeichnet; der Begriff wurde später erweitert und genauer spezifiziert. Wichtigste Forscher auf dem Gebiet der Terpene waren neben anderen vor allemOtto Wallach[10]undLeopold Ružička.[11]Beide Wissenschaftler wurden für ihre Leistungen zur Erforschung der Terpene mit demNobelpreis für Chemie(O. Wallach 1910[12]und L. Ruzicka 1939[13]) gewürdigt.
Zu den Anfangszeiten der Naturstoffisolierungen, im 19. Jahrhundert, war die Aufklärung von chemischen Strukturen sehr aufwändig,[14]was dazu führte, dass viele chemisch identische Terpene verschiedene Namen erhielten, die sich weitgehend von ihrer biologischen Herkunft ableiteten. Erst Otto Wallach zeigte 1884, dass viele dieser Verbindungen tatsächlich identisch waren. Im Jahr 1892 konnte Wallach die ersten neun Terpene eindeutig beschreiben und hat im Jahr 1914 seine Erkenntnisse in dem BuchTerpene und Campherveröffentlicht.[15]Er erkannte, dass die Terpene auf Isopreneinheiten aufbauen. Ein weiterer Pionier auf dem Gebiet der Strukturaufklärung der Terpene warAdolf von Baeyer.[16]Trotz der Forschungsarbeit waren lange Zeit nur sehr wenige niedere Terpene eindeutig identifiziert. So konnte erst 1910 die erste korrekte Formel eines Sesquiterpens, desSantalens,durchFriedrich Wilhelm Semmlerermittelt werden.[17]
DieBiogenetische Isoprenregelwurde 1887 vonOtto Wallachaufgestellt und 1922 vonLeopold Ružičkaunter diesem Namen formuliert.[11]Die Biosynthese der Terpene wurde schließlich vonFeodor LynenundKonrad Blochim Jahr 1964 geklärt. Beide Wissenschaftler wurden mit demNobelpreis für Physiologie oder Medizingeehrt.[18][19]
Biosynthese
[Bearbeiten|Quelltext bearbeiten]Den Terpenen ist gemeinsam, dass sie sich auf ein Gerüst zurückführen lassen, dessen Grundeinheit einfach oder mehrfach der ungesättigte KohlenwasserstoffIsoprenist. Ein zentraler Baustein in der Biosynthese von Terpenen ist dasDimethylallylpyrophosphat(DMAPP) und sein DoppelbindungsisomerIsopentenylpyrophosphat(IPP). Beide Bausteine enthalten fünf Kohlenstoff-Atome und eine Doppelbindung und können alsaktiviertes Isoprenaufgefasst werden. Der von F. Lynen und K. Bloch vorgestellteBiosyntheseweg[18]geht vonAcetyl-CoAals ursprünglichen Baustein aus, welches zurMevalonsäureumgesetzt wird. Aus der Mevalonsäure werden dann die Bausteine DMAPP und IPP synthetisiert.[1]Ein erst in jüngerer Zeit gefundener alternativer Biosyntheseweg, der sogenannteMEP (2C-Methyl-D-erythritol-4P)-pathwaygeht von einem Zucker-Derivat als C-5-Baustein aus. Dieser Weg wurde jedoch bisher nur in einigen Mikroorganismen, in grünenAlgenund Pflanzen beobachtet. Beide Wege finden unabhängig voneinander statt.[20] Der Mevalonatbiosyntheseweg ist imCytosollokalisiert und der MEP-Biosyntheseweg in den Plastiden (Chloroplast, Leukoplast etc.). Der Austausch zwischen Substraten der beiden Stoffwechselwege ist minimal. Alle Mono- und Diterpene werden in den Plastiden synthetisiert und alle Sesquiterpene im Cytosol.
Die weitere Synthese beginnt mit DMAPP und IPP, den Endprodukten des Mevalonatwegs:
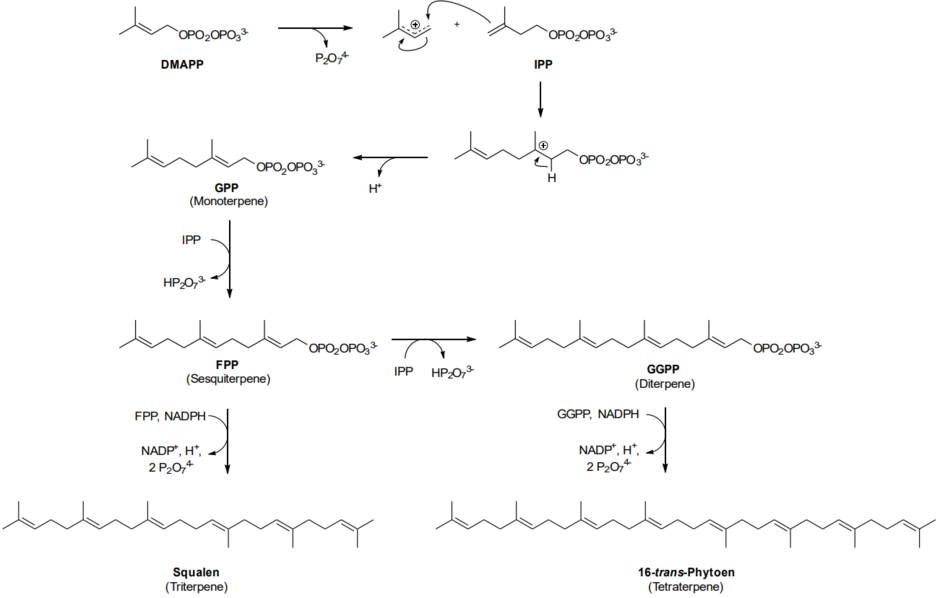
Die Farnesylpyrophosphatsynthase verknüpft ein Molekül DMAPP und zwei Moleküle IPP zumFarnesylpyrophosphat(FPP), das das Grundgerüst der cytosolischen Sesquiterpene ist. Aus zwei Einheiten Farnesylphosphat entsteht das Squalen (Squalensynthase), das Grundgerüst der Triterpene. Die plastidäre Geranylgeranylpyrophosphatsynthase verknüpft ein Molekül DMAPP mit drei Molekülen IPP zumGeranylgeranylpyrophosphat(GGPP), dem Grundgerüst der Diterpene. GGPP kann wiederum zum 16-trans-Phytoen reagieren, dem Grundgerüst der Tetraterpene. Jedes Terpen wird so über die Biosynthese dargestellt, indem dieSchlüsselenzymein der Terpenbiosynthese, dieTerpensynthasen,diese Grundgerüste in die jeweiligen Terpene umwandeln.[21]
Eigenschaften
[Bearbeiten|Quelltext bearbeiten]Die meisten Terpene sind in Wasser schwer löslich, lösen sich aber gut in unpolaren Lösungsmitteln wieChloroformoderDiethylether.Bei Bedarf können sie aber mitLösungsvermittlernoder in Form vonLiposomen[22][23]auch in wässrige Lösung gebracht werden.
Besonders Mono-, Sesqui- und begrenzt Diterpene sind wasserdampfflüchtig, was bei ihrer Gewinnung aus Pflanzen durchWasserdampfdestillationausgenutzt wird.
Terpene haben reizendes (Haut, Atemwege) und allergisierendes Potential.[24]
Analytik
[Bearbeiten|Quelltext bearbeiten]Für die Strukturaufklärung der Terpene finden alle spektroskopischen und spektrometrischen Methoden wieNMR-Spektroskopie(ein- und mehrdimensional) undMassenspektrometrieAnwendung. Es wurden schon Terpen-Strukturen mit Hilfe der Kristallstrukturanalyse aufgeklärt und korrigiert.[25]
Zur Analytik von bekannten Terpenen wird dieGaschromatographiegenutzt,[26]häufig in Kopplung mit einem Massenspektrometer. Hier können die Terpene zum einen über ihreRetentionszeitenund dem charakteristischen Fragmentierungsmuster im Massenspektrum im Vergleich mit einer bekannten Referenz identifiziert werden.
Gewinnung
[Bearbeiten|Quelltext bearbeiten]
Terpene, vor allem Mono-, Sesqui- und Diterpene, können ausPflanzen(teilen) oder ätherischen Ölen durch physikalische Methoden wieWasserdampfdestillation,[27]ExtraktionoderChromatographiegewonnen werden.[28]Dabei liefern die jugendlichen Pflanzen typischerweise die Terpen-Kohlenwasserstoffeund die älteren Pflanzen zunehmend diesauerstoffhaltigenDerivate,wieAlkohole,AldehydeundKetone.
Es gibt chemische Methoden zur großtechnischen Synthese von Terpenen, die meist sehr spezifisch sind.[29][30]
Klassifizierung
[Bearbeiten|Quelltext bearbeiten]
Die Terpene gehören in der Systematik der organischen Chemie zu denLipiden.Der gemeinsame Baustein aller Terpene ist dasIsopren.Daher lassen sich Terpene nach den sie aufbauenden Isopren-Einheiten unterteilen. Eine vollständige Isopren-Einheit umfasst jeweils 5 Kohlenstoffatome (C5-Regel). Generell wird zwischen acyclischen, mono-, bi-, tri-, tetra-, penta- bzw. polycyclischen Terpenen unterschieden, alsoMolekülenohne, mit einem, mit zwei, drei, vier, fünf bzw. vielen Ringen. Weiterhin unterscheiden sich die Terpene durch das Kohlenstoffgerüst, auf dem sie aufbauen. Außerdem werden sie über ihre sekundäre Stoffgruppenzugehörigkeit klassifiziert.
Terpene mit 5 Kohlenstoffatomen werden Hemiterpene genannt (C5), Terpene mit 10 Monoterpene (C10), mit 15 Sesquiterpene (C15), mit 20 Diterpene (C20), mit 25 Sesterterpene (C25), mit 30 Triterpene (C30), mit 40 Tetraterpene (C40). Terpene mit mehr als 8 Isopreneinheiten, also mit mehr als 40 Kohlenstoffatomen, werden auch Polyterpene genannt (größer als C40). Die Namen kommen von griechischen bzw. lateinischen Zahlwörtern her (hemi‚halb‘;mono‚eins‘;sesqui‚eineinhalb‘;di‚zwei‘), wobei je eine Isopreneinheit als ein halbes Terpen gezählt wird.[1]

Unterschiede bestehen zudem darin, ob die Isopreneinheiten jeweilsKopf-Schwanz,Kopf-KopfoderSchwanz-Schwanzverbunden sind. Bei dieser sogenannten „biogenetischen “Unterscheidung wird jenes Ende der Isopreneinheit, das dieIsopropylgruppeenthält,Kopfgenannt; das unsubstituierte Ende der Isopreneinheit wird alsSchwanzbezeichnet.[11]
Zu den Terpenen zählen die verwandten Terpenoide, die sich ebenfalls strukturell von verknüpften Isoprenen ableiten. Jedoch unterscheiden sie sich von den Terpenen im engen Sinn durch zusätzlichefunktionelle Gruppen.Auch Abwandlungen des Kohlenstoffgerüstes kommen vor, bei denen in späteren Schritten der Biosynthese Kohlenstoffatome umgruppiert oder abgetrennt wurden. Folglich ist deren Anzahl an C-Atomen nicht mehr immer durch 5 teilbar. Dass sie dennoch zu den Terpenen gezählt werden, liegt an Gemeinsamkeiten der Biosynthese, nicht an gemeinsamen Eigenschaften. Die zahlreichen natürlich vorkommenden Terpene und Terpenoide zählen zu densekundären Pflanzenstoffen.
Hemiterpene
[Bearbeiten|Quelltext bearbeiten]
Den Hemiterpenen liegt eine Isopreneinheit zugrunde. Es sind ungefähr zwei Dutzend Hemiterpene bekannt, die in der Natur in ungebundener Form äußerst selten vorkommen. Die wichtigsten Hemiterpene sind dasPrenolsowie dieCarbonsäurenTiglinsäure,Angelicasäure,SeneciosäureundIsovaleriansäure.Sie kommen jedoch häufig als Pyrophosphate als Biosyntheseintermediat der Terpene undglycosidischgebunden vor.[31]
Monoterpene
[Bearbeiten|Quelltext bearbeiten]

Den Monoterpenen liegen zwei Isopreneinheiten zugrunde, also ein Grundgerüst mit 10 C-Atomen. Es sind über 900 Monoterpene bekannt. Alle werden durchMonoterpensynthasenausGeranylpyrophosphatsynthetisiert; dies geschieht über eine Reihe von komplexen organisch-chemischen Reaktionen, die zu der großen strukturellen Vielfalt der Monoterpene führen.[1]Monoterpene haben für Kohlenwasserstoffe eine hoheBioverfügbarkeit.
Tricyclische Monoterpene sind selten, ein Beispiel istTricyclen.
Monoterpene sind zusammen mit Sesquiterpenen Hauptbestandteile von ätherischen Ölen, die von Pflanzen in großen Mengen produziert werden. So lässt sich zum Beispiel aus einem Quadratmeter mit Nadelstreu bedecktem Waldboden bis zu ein Liter an Monoterpenen gewinnen. In den Bestandteilen von über 2.000 Pflanzen aus 60 verschiedenen Familien finden sich Monoterpene.[1]
Acyclische Monoterpene
[Bearbeiten|Quelltext bearbeiten]
Wichtige acyclische Kohlenwasserstoff-Monoterpene sindMyrcen,OcimenundCosmen.Alle sind Bestandteile ätherischer Öle.Linaloolfindet sich imRosen- und bis zu 50 Prozent imLavendelöl.KorianderundPalmarosaölenthaltenGeraniolundNerol.Citronellolkann aus Citronellöl gewonnen werden,MyrcenolausThymianöl.AuchLavandulolfindet sich im Lavendelöl.Ipsdienolist Duftstoff in den Blüten vonOrchideenarten.Diese Verbindungen sind häufig vorkommende acyclische Monoterpen-Alkohole.
Die Terpen-AldehydeNeralundGeranialbilden das StereoisomerengemischCitral,das intensiv nach Zitronen riecht und daher in Aromen verwendet wird.Citronellalwird als Insektenabwehrmittel verwendet. Eine Monoterpencarbonsäure ist dieGeraniumsäure.
AlsFuranoideacyclische Monoterpene sind zum BeispielPerillenundRosenfuranzu nennen. Rosenfuran ist eine geruchsbestimmende Komponente des Rosenöls. Perillen kommt in ätherischen Ölen vor und ist ein Abwehrpheromon.
Monocyclische Monoterpene
[Bearbeiten|Quelltext bearbeiten]
Die meisten monocyclischen Monoterpene, die sich vom p-Menthanableiten lassen, weisen einCyclohexangerüstauf. DasThioterpineol,der Stoff mit dem kleinsten bekanntenGeruchsschwellenwert,lässt sich hier einordnen.[1]Doch gibt es auch solche mitCyclopentangerüst,wieJunionon,oder mitCyclobutangerüstwieGrandisol,einPheromondesBaumwollkapselkäfers,für das verschiedene Synthesewege bekannt sind,[32]auchphotochemische[33]Verfahren. Zu den einCyclopropan-Gerüst enthaltenden Monoterpenen gehörenChrysanthemolundChrysanthemumsäure,zu deren Estern einigePyrethrinezählen.
Die monocyclischen Monoterpene mit Cyclohexangerüst werden meist nach ihrer sekundären Stoffgruppenzugehörigkeit unterteilt. Die wichtigsten Kohlenwasserstoffe sind hierMenthan,Limonen,Phellandren,Terpinolen,Terpinenundp-Cymol.Menthan ist im Vergleich zu den anderen Monoterpen-Kohlenwasserstoffen in der Natur eher selten. Limonen tritt sehr häufig in den verschiedensten Pflanzen auf, Terpinolen und Terpinen sind Duftstoffe und Bestandteil ätherischer Öle, Terpinolen ist ein Alarmpheromon derTermiten.Phellandren findet sich imKümmel,FenchelundEukalyptusöl.p-Cymol findet sich imEinfachen Bohnenkraut.
Mentholist Hauptbestandteil desPfefferminzöls,es ist einAnalgetikumund wird für weitere medizinische Anwendungen verwendet. AuchPulegolfindet sich in Pfefferminzölen.Piperitolkommt in Eukalyptus- und Pfefferminzarten vor.Terpineolist ein Duftstoff.Carveolfindet sich in Zitrusölen.Thymolfindet sich in den ätherischen Ölen des Thymians und Oreganos.Dihydrocarveolkommt imKümmel,Pfeffer,SellerieundMinzevor.Anetholfindet sich imAnisundFenchel.
MenthonundPulegon,sowie deren Isomere, kommen wie das Menthol in Pfefferminzölen vor.Phellandralfindet sich im Wasserfenchelöl.CarvonundCarvenonfinden sich im Kümmel und Dill,Piperitonin Eukalyptusölen.Rosenoxidist ein heterocyclisches Monoterpen mitPyranringund Duftstoff des Rosenöls.
Bicyclische Monoterpene
[Bearbeiten|Quelltext bearbeiten]
1,4-Cineolund1,8-Cineol(Eucalyptol) enthalten eine Etherbrücke, sind bicyclisch und gehören zu denEpoxy-Monoterpenen. 1,8-Cineol wirktbakterizidund findet sich hauptsächlich in Eukalyptus undLorbeersowie zusammen mit dem 1,4-Cineol in Wacholder.Ascaridolist einPeroxid,das sich inGänsefußartenfindet.
Zu den bicyclischen Monoterpenen mit Cyclopentanring gehörenIridoidemit Cyclopentanpyrangerüst, die einen Sechs- und einen Fünfring enthaltenden. Entdeckt wurden solche Verbindungen zum ersten Mal in einerAmeisenart(Iridomyrmex) und sind somit einige der wenigen Terpene nichtpflanzlicher Herkunft. Durch Ausschleusung von Kohlenstoffmolekülen aus dem Grundgerüst entstehen Terpenoide, die nicht mehr zu den Terpenen zählen.[34]Zu den Iridoiden gehören zum BeispielAucubinundCatalpolausSpitzwegerich(Plantago lanceolata) sowieLoganinaus Bitterklee. Auch inBaldrian(Valeriana officinalis) undTeufelskralle(Harpagophytum procumbens) sind Iridoide und Iridoidglycoside enthalten.

Die ebenfalls einen Sechsring enthaltenden Bicyclen von Caran, Thujan,Pinan,Bornan (veraltet auch:Camphan) und Fenchan, weiter gefasst auchIsobornylanundIsocamphan,sind die wichtige Stammverbindungen weiterer bicyclischer Monoterpene.
3-Carenfindet sich inTerpentinölen(in russischem Terpentinöl, ausPinus sylvestris,als zweithäufigste Komponente),[35]dem Öl des Schwarzen Pfeffers und kommt außerdem in Citrusölen, Tannen und Wacholder-Arten vor.Thujen[36]kommt imKorianderundDillund außerdem nebenSabinenin Ölen vor.Thujonkommt imWermutkrautvor, das zum Beispiel zuAbsinthundWermutverarbeitet wird.Thujanolkommt imLebensbaum-,Wacholder- undArtemisia-Arten vor. Carbonsäuren mit Caran- beziehungsweise Carengrundgerüst, wie dieChaminsäure,kommen zum Beispiel inScheinzypressenvor.
2-Pinen(α-Pinen) ist die Hauptkomponente der Terpentinöle, häufig findet sich auch 2(10)-Pinen (β-Pinen).Verbenolist Bestandteil desTerpentins,es ist, zusammen mit dem in den Ölen des Rosmarins vorkommendenVerbenonein SexualpheromondesBorkenkäfers.Pinocarvonkommt in Eukalyptusölen vor und ist Sexualpheromonen desKiefernspanners(Bupalus piniariaL.).
Campherist durchblutungsfördernd, schleimlösend und hat viele weitere medizinisch-interessante Eigenschaften. Es kann aus dem Kampferbaum isoliert werden, ebenso wieBorneol.Isoborneolkommt in vielenKorbblütlernvor.
DieFenchane,besondersFenchonundFencholund deren Derivate, treten in mehreren ätherischen Ölen auf.Fenchenund seine Derivate sind selten in ätherischen Ölen.
Anethofuranist ein bicyclisches Monoterpen mitFurankörper.
Sesquiterpene
[Bearbeiten|Quelltext bearbeiten]Den Sesquiterpenen liegen drei Isopreneinheiten zugrunde, also ein Grundgerüst mit 15 C-Atomen (und damit anderthalb – lateinischsesqui– mal soviele wie die aus zwei Isopreneinheiten aufgebauten Monoterpene). Es gibt mehr als 3.000 Sesquiterpene, die damit die größte Untergruppe der Terpene darstellen. Sie leiten sich vomFarnesylpyrophosphatab. Rund zwanzig der zahlreichen Sesquiterpene sind als Riech- und Aromastoffe von wirtschaftlicher Bedeutung.
Acyclische
[Bearbeiten|Quelltext bearbeiten]Farnesylpyrophosphat,die Stammverbindung der Sesquiterpene, kommt zum Beispiel inÖlschiefervor,Farnesolim Rosen- und Jasminöl.Nerolidolfindet sich in Orangenblüten,Sinensalim Orangenöl.Furanoideacyclische Sesquiterpene sindDendrolasin,SesquirosenfuranundLongifolin.Dendrolasin ist nicht nur pflanzlicher Herkunft, es kommt auch in Ameisen vor (der Name stammt von der AmeisengattungDendrolasius). DieAbscisinsäurereguliert das Wachstum von Pflanzen; sie wird nicht direkt von Farnesylpyrophosphat aus synthetisiert, sondern über den Umweg desCarotinoid-Stoffwechsels(siehe Tetraterpene).
Monocyclische
[Bearbeiten|Quelltext bearbeiten]
Die monocyclischen Sesquiterpene werden hauptsächlich in die Stammverbindungen Bisabolane,Germacrane,ElemaneundHumulaneunterteilt.
Über 100 Bisabolane kommen natürlich in Pflanzen vor.Zingiberenkommt im Ingweröl vor.β-Bisabolenfindet sich in Scheinzypressen und Kiefernarten, das entzündungshemmendeBisabololim Öl der Kamille.Sesquisabinenkommt im Schwarzen Pfeffer,Sesquithujenim Ingwer vor. Die vom Germacran abgeleitetenPeriplanonesind Sexualpheromone.BicycloelemenundElemolleiten sich vom Eleman ab, Elemol findet sich im Citronellöl, Bicycloelemen im Pfefferminzöl. Viele vom Humulan abgeleitete Terpene finden sich im Öl desHopfens.
Polycyclische
[Bearbeiten|Quelltext bearbeiten]
Die meisten der Sesquiterpene sind polycyclisch. Unter den knapp 30Caryophyllanenist das wichtigste dasCaryophyllen,es findet sich im Kümmel, Pfeffer und Gewürznelken. Von denEudesmanenundFuranoeudesmanensind ungefähr 450 bekannt.Selinenfindet sich im Sellerie und Cannabis,Eudesmolin Eukalyptusarten,Costolin Costuswurzelnöl. DieSantoninewirkenantihelmintisch.Ein wichtiges Furanoeudesman ist dasTubipofuran.Die etwa 150 bekanntenEremophilaneundValeranefinden sich vor allem in höheren Pflanzen.Nootkatonsowie11-Eremophilen-2,9-dionsind Geschmackstoffe im Grapefruitöl. Von denCadinanensind ungefähr 150 bekannt,Cadinadienfindet sich im Hopfenöl,Muuroladienin Terpentinsorten,CadinenimKubebenpfefferundWacholder.DieArtemisiasäurewirkt antibakteriell.GuajaneundCycloguajanegibt es über 400.Guajadienfindet sich imTolubalsam.Eine Reihe von Pseudoguajanen, wie dieAmbrosiasäurefindet sich inAmbrosiaarten.Viele derHimachalanefinden sich imZedernöl.MehrereDaucanefinden sich in derWilden Möhre(Daucus carota), nachdem diese benannt sind. Das vonMarasmanabgeleiteteIsovelleralwirkt antibiotisch, das vomIsolactaranabgeleiteteMerulidialist ein Metabolit desGallertfleischigen Fältlings(Phlebia tremellosa), eines Pilzes, der auf Totholz zu finden ist. DieAcorane,die 50Chamigraneund die kleine Gruppe derAxananesindSpiroverbindungen,die Chamigrane finden sich in Algen. Das vomCedranabgeleiteteCedrolist Geruchsstoff des Zedernöls.Hirsutanesind häufig Metaboliten von Pilzen, ein Beispiel ist dieHirsutumsäure.Das tricyclischeSpathulenolfindet sich imBeifuß(Artemisia vulgaris),Estragon(Artemisia dracunculus), derEchten Kamilleund anderenArtemisiien,[37]inBaumwolle-Arten (Gossypium),[38]Hypericum perforatum[39]sowie in verschiedenenNepeta-Arten.[40]
Es gibt einige Gruppen polycyclischer Sesquiterpene, die nicht vom Farnesan abstammen.
Diterpene
[Bearbeiten|Quelltext bearbeiten]
Den Diterpenen liegen vier Isopreneinheiten zugrunde, also ein Grundgerüst mit 20 C-Atomen Es gibt rund 5000 bekannte Diterpene, alle Diterpene leiten sich von der Ausgangsverbindung (E,E,E)-Geranylgeranylpyrophosphatab.
Acyclische
[Bearbeiten|Quelltext bearbeiten]Phytan findet sich zum Beispiel zusammen mit derPhytansäureimÖlschieferoder auch in der menschlichenLeber.Chlorophyllist ein Ester desPhytols.
Cyclophytane bis Tetracyclophytane
[Bearbeiten|Quelltext bearbeiten]
Die meisten Cyclophytane leiten sich vom 10,15-Cyclophytan ab, 1,6-Cyclophytane sind seltener.[41]
Retinal,Retinol,AxerophthenundTretinoinsind Vertreter derVitamin-A-Reihe, Retinal ist mit demOpsinin derNetzhautdes Auges zumRhodopsingebunden und dort für den Sehvorgang wichtig. Die aus Retinal gebildetenRetinsäurenüben Einfluss auf Wachstum und die Zelldifferenzierung aus.Agelasin EundAgelasidin Bwirken krampflösend und antibakteriell.

Die etwa 400 Bicyclophytane leiten sich vomLabdanab, seltener vom 1,6-Cyclophytan abgeleitetenHalimanoderClerodan.PumiloxidundAbienolfinden sich in Fichten.LabdanolsäureundOxocativinsäurefinden sich inKieferngewächsen,Sclareolin Salbeiarten, diePinifolsäurein den Nadeln von Kieferngewächsen.
Wichtige Stammverbindungen der Tricyclophytane sind diePrimarane,Cassane,CleistanthaneundAbietan.Die Primarane, wiePodocarpinol,PodocarpinsäureundNimbiol,finden sich hauptsächlich in europäischen Kiefern. Von den Cassanen, hauptsächlich von derCassainsäure,leiten sich Ester-Alkaloideab. Cleistanthane sind zum BeispielAuricularsäureundCleistanol.Abietane finden sich hauptsächlich in Nadelbäumen, wie die HarzsäureAbietinsäure,AbietenoloderPalustrinsäure.


Das vom tricyclische DiterpenoidBaccatin IIIabgeleitete Terpen-AlkaloidPaclitaxelaus derPazifischen Eibewird auf Grund seinerMitosehemmenden Wirkung alsZytostatikumin derKrebstherapieeingesetzt. Das ebenfalls tricyclischeForskolinwird in derBiochemieals Aktivator derAdenylylcyclaseeingesetzt.
Die Tetracyclophytane werden in mehrere Stammgruppen unterteilt. EinKauran,1,7,14-Trihydroxy-16-kauren-15-on, wirkt tumorhemmend. DieAtisane,wie dasAtisen,lassen sich in bestimmteAlkaloideumwandeln. Von denGibberellanenabgeleitete Terpenoide wieGibberellinsäurebeeinflussen alsPhytohormonedas Pflanzenwachstum. DieGrayanotoxane,wie dasLeucothol Csind häufig toxisch und finden sich in vielen Blättern.
Sesterterpene
[Bearbeiten|Quelltext bearbeiten]
Den Sesterterpenen liegen fünf Isopreneinheiten zugrunde, also ein Grundgerüst mit 25 C-Atomen. Sesterterpene wurden erstmals 1965 aus Insektenwachs und niederen Pilzen isoliert. Es gibt ungefähr 150 bekannte Sesterterpene, davon haben 30 einenFuran-Körper, sie leiten sich von 3,7,11,15,19-Pentamethylicosan ab. Sesterterpene sind in der Natur eher selten, sie finden sich hauptsächlich in niederen Pflanzen, Pilzen oder in den Blättern der Kartoffel. Sesterterpene mit Furankörper können ausSchwämmen,wie der ArtIrcinia campana,isoliert werden.
Die wichtigsten acyclischen Sesterterpene sind das 3,7,11,15,19-Pentamethyl-2,6-icosadien-1-ol,Ircinin Iund 8,9-Dehydroircinin I. Das Ircin I hat eine antibakterielle Wirkung und findet sich zum Beispiel in dem SchwammIrcinia oros,das 8,9-Dehydroircinin I inCacospongia scalaris.Die monocyclischen Sesterterpene finden sich in Schwämmen und Wachsen von Insekten vonCeroplastes ceriferus.Zu nennen ist dasCyclohexan-Sesterterpen,Neomanoalid,welches antibakteriell wirkt,CericeranundCerifeol 1.Bicyclische Sesterpene sind zum BeispielDysideapalaunsäure,SalvisyriacolidundSalvisyriacolidmethylester.Das tricyclische SesterterpenCheilanthatriolfindet sich in Farnen. Die tetracyclischen Sesterterpene finden sich in Schwämmen und bauen hauptsächlich auf demScalaranauf.
Triterpene
[Bearbeiten|Quelltext bearbeiten]
Den Triterpenen liegen sechs Isopreneinheiten zugrunde, also ein Grundgerüst mit 30 C-Atomen. Es gibt ungefähr 1700 Triterpene; sie leiten sich hauptsächlich vomSqualanab, welches aus zwei Schwanz-Schwanz verknüpftenSesquiterpen-Einheiten besteht, sowie dem davon abgeleitetenSqualen.D-VitamineundGallensäurensind oxidierte abgeleitete Triterpene, der Tetracyclus desGonansfindet sich abgeleitet bei denSteroiden.Acyclische Triterpene sind in der Natur relativ selten, vor allem tetracyclische und pentacyclische Triterpene sind in der Natur verbreitet.
Tetracyclische
[Bearbeiten|Quelltext bearbeiten] |
 |
Die tetracyclischen Triterpene besitzen dasGonangerüstals chemisches Grundgerüst, das auch in denSteroidenzu finden ist, Stammverbindungen sind dieProtostaneundFusidane,Dammarane,Apotirucallane,TirucallaneundEuphane,Lanostane,CycloartaneundCucurbitane.Einige von den Fusidanen abgeleiteten Terpenoide, wie dieFusidinsäuregreifen selektiv in den bakteriellen Stoffwechsel ein und werden daher alsAntibiotikaeingesetzt. Ein wichtiges Apotirucallan ist dasMelianin A.Es gibt ungefähr 200 Lanostane, ein Beispiel ist dasLanosterol.Von den Cycloartanen gibt es rund 120, dieAnanassäurefindet sich inAnanasholz.Von den Cucurbitanen gibt es nur circa 40 natürliche, dieCucurbitacineF und B werden alsChemotherapeutikumin derKrebstherapieerprobt.
Pentacyclische
[Bearbeiten|Quelltext bearbeiten]

Eine der Grundstrukturen der pentacyclischen Triterpene ist dasHopan(sieheHopanoide). Die Fernáne,AdiananeundFilicanefinden sich in Farnen, wie einige Gammacerane. Zu den Adiananen und Filicanen gehört dasSimiarenolundFilicenal,das imFrauenhaarfarnvorkommt, ein Gammaceran ist dasKetohakonanol.Es existieren mehrere auf andere Art entstandene pentacyclische Triterpene wie dieStictane,SerrataneundIridale.Stictane finden sich in der Baumrinde vieler Bäume, das Serratan 14-Serraten findet sich in europäischen Waldfarnen. Ein Iridal ist dasAmbreinaus derAmbradesPottwals.Die meisten Iridale finden sich jedoch hauptsächlich inSchwertlilien.BetulinundBetulinsäure(dieHIVhemmt) finden sich in der Rinde vonBirken.
Tetraterpene
[Bearbeiten|Quelltext bearbeiten]Den Tetraterpenen liegen acht Isopreneinheiten zugrunde, also ein Grundgerüst mit 40 C-Atomen. Zu den natürlich vorkommenden Tetraterpenen gehören die meisten der als fettlöslichePigmente(Lipochrome) inArchaeen,Bakterien, Pflanzen und Tieren weit verbreitetenCarotinoide.Hierzu zählen die verschiedenenCarotine,reine Kohlenwasserstoffe wie dasLycopinmit der Summenformel C40H56,und auch deren sauerstoffhaltigen Derivate, dieXanthophylle.Einige davon abgewandelte Verbindungen mit verlängertem oder verkürztem Kohlenstoffgerüst, etwaApocarotinoideoderDiapocarotinoidewie dasCrocetin,werden ebenfalls alsCarotinoidebezeichnet, stellen jedoch keine Tetraterpenoide dar.
Polyterpene
[Bearbeiten|Quelltext bearbeiten]
Polyterpene bestehen aus mehr als acht Isopreneinheiten;Leopold Ružičkanannte diesePolyisoprenePolyprene.
cis-Polyisopren liegt imNaturkautschukvor, der kommerziell aus demLatexdesKautschukbaumsund aus dem derGuayule-Pflanze gewonnen wird. Es ist daneben im Latex vieler anderer Pflanzenarten enthalten,[42]z. B. imRussischen Löwenzahnund imGummibaum.[43][44]
trans-Polyisopren ist Hauptbestandteil des gummigen Anteils vonGuttaperchaundBalatasowie des „Gummis “derGummiulmeund kommerziell weniger bedeutend.Chicle,aus demBreiapfelbaumgewonnen, enthält ein 1:1 bis 4:1-Gemisch vontrans- undcis-Polyisopren.[45]
Zu den Polyterpenen werden auch aus Isopren-Untereinheiten aufgebaute langkettige Polymere mit endständigerHydroxygruppegezählt,Polyprenolegenannt. Im Unterschied zubakteriellenPolyprenolen sind dieeukaryotischenwie die vonArchaeenan dem die funktionelle OH-Gruppe tragenden Isoprenoidα-ungesättigt. Hierzu gehören beispielsweise pflanzlicheBetulaprenoleund beim MenschenDolichol,das u. a. als Lipidkomponente imNeuromelaninderSubstantia nigravorkommt.[46]
Prenylchinonesind Terpenoide mit bis zu zehn Isopreneinheiten, unter ihnen finden sichVitamin K1und K2,Vitamin E,Plastochinonsowie dieUbichinone.
Literatur
[Bearbeiten|Quelltext bearbeiten]- Eberhard Breitmaier:Terpene.Teubner Verlag, Januar 1999,ISBN 3-519-03548-0.
- Lutz Roth:Terpene, Terpentinöl.Ecomed Verlag, Landsberg, Juni 2001,ISBN 3-609-69140-9.
- Gerhard Habermehl,Peter E. Hammann, Hans C. Krebs,Naturstoffchemie.2. Auflage, Springer Verlag, 2002,ISBN 3-540-43952-8.
- Peter Nuhn:Naturstoffchemie. Mikrobielle, pflanzliche und tierische Naturstoffe.2. Auflage, S. Hirzel Wissenschaftliche Verlagsgesellschaft Stuttgart, 1990,ISBN 3-7776-0473-9.
- J. D. Conolly, R. A. Hill:Dictionary of Terpenoids.Chapman & Hall, London, New York, Tokyo, Melbourne, Madras 1991.
Siehe auch
[Bearbeiten|Quelltext bearbeiten]Weblinks
[Bearbeiten|Quelltext bearbeiten]Einzelnachweise
[Bearbeiten|Quelltext bearbeiten]- ↑abcdefE. Breitmaier:Terpene – Aromen, Düfte, Pharmaka, Pheromone,1. Auflage, B. G. Teubner, Stuttgart, Leipzig 1999,ISBN 3-519-03548-0.
- ↑Peter Nuhn:Naturstoffchemie: Mikrobielle, pflanzliche und tierische Naturstoffe,4., neu bearb. Auflage, Hirzel S. Verlag, Stuttgart,ISBN 3-7776-1363-0.
- ↑Georg Sticker:Heilwirkungen der terpenhaltigen Öle und Harze.Wien und Leipzig 1917.
- ↑Paul Schnitzler:Essential Oils for the Treatment of Herpes Simplex Virus Infections.In:Chemotherapy.Band64,Nr.1,2019,S.1–7,doi:10.1159/000501062(karger[abgerufen am 12. Juli 2021]).
- ↑C. Koch, J. Reichling, J. Schneele, P. Schnitzler:Inhibitory effect of essential oils against herpes simplex virus type 2.In:Phytomedicine.Band15,Nr.1-2,Januar 2008,S.71–78,doi:10.1016/j.phymed.2007.09.003(elsevier[abgerufen am 12. Juli 2021]).
- ↑Hagers Handbuch der Pharmazeutischen Praxis – 4. Auflage.
- ↑Cathleen Terhune Alty, BA, RDH:Do you want that mouthwash straight up or on the rocks?12. Mai 2014,abgerufen am 12. Juli 2021.
- ↑IUPAC-Definition für Terpene und Terpenoide.
- ↑A. Kekulé (1863) Lehrbuch der organischen Chemie. Verlag von Ferdinand Enke, Erlangen.
- ↑O. Wallach:Zur Kenntniss der Terpene und der ätherischen Oele.In:Justus Liebigs Annalen der Chemie.Band227,Nr.3,1885,S.277–302,doi:10.1002/jlac.18852270306.
- ↑abcL. Růžička:Perspektiven der Biogenese und der Chemie der Terpene.In:Pure and Applied Chemistry.Band6,Nr.4,1963,S.493–524,doi:10.1351/pac196306040493.
- ↑O. Wallach Nobelpreisvortrag (PDF, engl.; 82 kB).
- ↑L. Ruzicka Nobelpreisvortrag (PDF,engl.; 537 kB).
- ↑Dissertation zur Strukturaufklärung von Cedren, G. W. Kusserow ETH Zürich 1948
- ↑O. Wallach: Terpene und Campher: Zusammenfassung eigener Untersuchungen auf d. Gebiet d. alicyclischen Kohlenstoffverbindungen Terpene und Campher: Zusammenfassung eigener Untersuchungen auf d. Gebiet d. alicyclischen Kohlenstoffverbindungen, Veit Leipzig 1914.DNB361835116.
- ↑A. de Meijere: Adolf von Baeyer – Nobelpreisträger für Chemie 1905,Angew. Chem.,2008,117,S. 8046–8050;doi:10.1002/ange.200503351.
- ↑F. W. Semmler:Zur Kenntnis der Bestandteile ätherischer Öle. (Konstitution der α-Santalol- und α-Santalen-Reihe: Die Konstitution der Sesquiterpenalkohole und Sesquiterpene.).In:Berichte der deutschen chemischen Gesellschaft.43, 1910, S. 1893,doi:10.1002/cber.191004302121.
- ↑abNobelpreisvortrag von F. Lynen(PDF; 536 kB).
- ↑Nobelpreisvortrag von K. Bloch(PDF; 191 kB).
- ↑M. Rohmer:The discovery of a mevalonate-independent pathway for isoprenoid biosynthesis in bacteria, algae and higher plants,in:Nat Prod Rep.,1999,16,S. 565–574;doi:10.1039/A709175C.
- ↑H. Kleinig:The Role of Plastids in Isoprenoid Biosynthesis.In:Annual Review of Plant Physiology and Plant Molecular Biology.Band40,Juni 1989,S.39–59,doi:10.1146/annurev.pp.40.060189.000351(PDF).
- ↑PatentEP0776202:Liposomal verkapseltes Taxol, seine Herstellung und seine Verwendung.Angemeldet am18. August 1995,veröffentlicht am17. Mai 2000,Anmelder: Max-Delbrück-Centrum für Molekulare Medizin, Erfinder: Martin Brandl, Iduna Fichtner, Regine Reszka, Gernot Warnke.
- ↑PatentEP1471886:Verfahren zur Erhöhung der Wasserlöslichkeit lipophiler Wirkstoffe; Herstellung von hochkonzentrierten wässrigen Zusammensetzungen dieser Wirkstoffe; derartige Produkte und ihre Verwendung.Angemeldet am15. Januar 2003,veröffentlicht am15. August 2007,Anmelder: KliniPharm GmbH, Erfinder: Eva Bogdanovic, Katja Grzimek, Wolfgang Schatton.
- ↑Umweltbundesamt:Es liegt was in der Luft - über Duftstoffe im öffentlichen und privaten Bereich,abgerufen am 3. Januar 2020.
- ↑M. Dobler, J: D. Dunitz, B. Gubler, H. P. Weber, G. Büchi, J. Padilla O.:The Structure of Patchouli Alcohol.In:Proceedings of the Chemical Society.Nr.12,1963,S.383,doi:10.1039/PS9630000357.
- ↑E. von Rudloff:Gas-Liquid Chromatography of Terpens.In:Canadian Journal of Chemistry.30, 1961, S. 1200–1206,doi:10.1139/v61-152.
- ↑Beschreibung eines Schulversuchs.
- ↑E. Stahl, W. Schild:Isolierung und Charakterisierung von Naturstoffen.Gustav Fischer Verlag, Stuttgart 1986,ISBN 3-437-30511-5.
- ↑Patent zur großtechnischen Synthese von Menthol:
PatentEP1162186:Verfahren zur Herstellung von d,l-Menthol.Angemeldet am30. April 2001,veröffentlicht am12. Dezember 2001,Anmelder: Bayer AG, Erfinder: Claus Dreisbach, Michael Friederich, Hans-Jürgen Gross, Jörg-Dietrich Jentsch, Gerald John, Reinhard Langer, Thomas Prinz, Andreas Schlemenat, Andreas Schulze-Tilling. - ↑Patent zur großtechnischen Synthese von Campher:
PatentEP0539990:Verfahren zur Herstellung von Camphen durch Umlagerung von Alpha -Pinen.Angemeldet am29. Oktober 1992,veröffentlicht am8. Januar 1997,Anmelder: Hoechst Aktiengesellschaft, Erfinder: Eberhard Ritter, Thomas Wisser, Alfred Riedel, Manfred Gscheidmeier, Joachim Maginot. - ↑Beispiel für die Isolierung von Hemiterpenen als Glycoside:
Søren Damtoft, Søren Rosendal Jensen:Hemialboside, a hemiterpene glucoside from Lamium album.In:Phytochemistry.Band39,Nr.4,Juli 1995,S.923–924,doi:10.1016/0031-9422(95)00085-L. - ↑T. Graham, E. Gray, J. Burgess, B. Goess:An Efficient Synthesis of (±)-Grandisol Featuring 1,5-Enyne Metathesis.In:Journal of Organic Chemistry.Band 75, Nr. 1, 2010, S. 226–228;doi:10.1021/jo9020375,PMC 2798917(freier Volltext).
- ↑K. Langer, J. Mattay, A. Heidbreder, M. Möller:A New Stereoselective Synthesis of Grandisol.In:European Journal of Organic Chemistry.März 1992, S. 257–260,doi:10.1002/jlac.199219920144.
- ↑kliniken.de:Iridoide.(vom 2. August 2012 im Webarchivarchive.today)
- ↑Eintrag zuTerpentinöl.In:Römpp Online.Georg Thieme Verlag, abgerufen am 25. Mai 2014.
- ↑L. Tschugaeff:Ueber das Thujen, ein neues bicyclisches Terpen.In:Berichte der deutschen chemischen Gesellschaft,1900,33,S. 3118–3126;doi:10.1002/cber.19000330363.
- ↑Ziaei, A. et al.:Identification of spathulenol in Salvia mirzayanii and the immunomodulatory effects,in:Phytother Res,2011,25(4), S. 557–562;doi:10.1002/ptr.3289;PMID 20857430.
- ↑G. W. Elzen, H. J. Williams, S. B. Vinson:Isolation and identification of cotton synomones mediating searching behavior by parasitoid Campoletis sonorensis.In:Journal of Chemical Ecology.Band10,Nr.8,August 1984,S.1251–1264,doi:10.1007/BF00988552.
- ↑K. H. C. Baser, T. Ozek, H. R. Nuriddinov, A. B. Demirci:Essential Oils of Two Hypericum Species from Uzbekistan.In:Chemistry of Natural Compounds.Band38,Nr.1,Januar 2002,S.54–57,doi:10.1023/A:1015781715535.
- ↑K. H. C. Baser, N. Kirimer, M. Kurkcuoglu, B. Demirci:Essential Oils of Nepeta Species Growing in Turkey.In:Chemistry of Natural Compounds.Band36,Nr.4,Juli 2000,S.356–359,doi:10.1023/A:1002832628159.
- ↑Eberhard Breitmaier: Terpene: Aromen, Düfte, Pharmaka, Pheromone. 2. Auflage, WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim, 2005, S. 52,doi:10.1002/9783527623693.
- ↑Shinzo Kohjiya, Yuko Ikeda:Chemistry, Manufacture and Applications of Natural Rubber.Woodhead, 2014,ISBN 978-0-85709-683-8,S. 30–34. (eingeschränkte Vorschauin der Google-Buchsuche)
- ↑Charles E. Carraher Jr., L. H. Sperling:Polymer Applications of Renewable-Resource Materials.Plenum Press, 1983,ISBN 978-1-4613-3505-4(Reprint) S. 9.
- ↑A. Behr, Th. Seidensticker:Einführung in die Chemie nachwachsender Rohstoffe.Springer, 2018,ISBN 978-3-662-55254-4,S. 234. (eingeschränkte Vorschauin der Google-Buchsuche)
- ↑A. Steinbüchel, T. Koyama:Biopolymers.Band 2:Polyisoprenoids,Wiley, 2001,ISBN 978-3-527-30221-5,S. 11.
- ↑H. Fedorow, R. Pickford, J. Hook, K. Double, G. Halliday, M. Gerlach, P. Riederer, B. Garner:Dolichol is the major lipid component of human substantia nigra neuromelanin.In:Journal of Neurochemistry.92. Jahrgang,Nr.4,Februar 2005,S.990–995,doi:10.1111/j.1471-4159.2004.02975.x(englisch).