Vascular Endothelial Growth Factor

Dievaskulären endothelialen Wachstumsfaktoren(die englische AbkürzungVEGFfürVascular Endothelial Growth Factorist auch im Deutschen üblich) sind eine Gruppe wichtigerSignalmoleküle,die hauptsächlich sowohl in derVaskulogenese(de novo-Bildung des embryonalenBlutgefäßsystemsundLymphgefäßsystems) als auch in derAngiogeneseund derLymphangiogenese(dem Wachstum neuer Blut- bzw. Lymphgefäße ausgehend von existierenden Gefäßen) seine Wirkung entfaltet. Wie der Name bereits impliziert, stimuliert dieser Faktor hauptsächlich die direkt an das Blut angrenzende Zellschicht (das vaskuläreEndothel), hat aber auch Effekte auf andere Zellen (z. B. Stimulation der Migration vonMonozytenundMakrophagen).In vitrostimuliert VEGF dieTeilungundMigrationvon Endothelzellen. In Säugetieren sind fünf verschiedene VEGFs bekannt (A-D sowie PlGF), von denen jedes einzelne in verschiedenen Formen auftreten kann, die durchalternatives Spleißenundposttranslationale Modifikationenerzeugt werden.[1]
Der BegriffVEGFbeschreibt eine Familie vonProteinen,welche unterschiedliche Eigenschaften haben. Zuerst entdeckt wurde VEGF-A, danach wurden die Faktoren VEGF-B und PlGF(Placental Growth Factor)sowieVEGF-Cund VEGF-D (beide wichtig für die Bildung derLymphgefäße) entdeckt. Daneben existieren noch die verwandten viralen Homologen (VEGF-E) und die imSchlangengiftvorhandenen VEGF-F.
VEGF-A
[Bearbeiten|Quelltext bearbeiten]VEGF-A wird in allen vaskularisierten Geweben gefunden, und es wird vermutet, dass es für die vaskuläreHomöostasenotwendig ist. DasGen,das für VEGF-A kodiert, kann durchalternatives Splicingverschiedene Varianten des Proteins von unterschiedlicher Länge hervorbringen. So wurden bisher in Menschen die Varianten VEGF-A121,VEGF-A138,VEGF-A145,VEGF-A162,VEGF-A165,VEGF-A165b,VEGF-A189und VEGF-A206 beschrieben (die Zahlen entsprechen der Anzahl derAminosäurenim jeweiligen Protein).
Diese Proteine unterscheiden sich jeweils nur durch kurze Domänen am C-Terminus, was jedoch einen großen Einfluss auf ihre biologische Funktion hat und ihre Interaktion mitHeparan-Sulfatenund dem Ko-Rezeptor Neuropilin steuert.[2]
Funktion
[Bearbeiten|Quelltext bearbeiten]Alle Mitglieder der VEGF-Familie bewirken eine zelluläre Antwort, indem sie an eineTyrosinkinase,den VEGF-Rezeptor (VEGFR), binden und so das extrazelluläre Signal ins Zellinnere weiterleiten. Es existieren drei Rezeptoren (VEGFR 1–3), wobei unterschiedlicheAffinitätenzu beobachten sind. So bindet VEGF-A nur an den Rezeptor Typ 1 und 2, während PlGF und VEGF-B nur an den Rezeptor Typ 1 binden und VEGF-C und VEGF-D nur an die Rezeptoren Typ 2 und 3. VEGF-E und F binden beide an die Rezeptoren Typ 2. Die Rezeptoren dimerisieren, nachdem sie VEGF gebunden haben, undphosphorylierensich dann gegenseitig. Damit werden sie aktiv und leiten dasSignalweiter.
Die Produktion von VEGF wird angeregt, wenn Zellennicht genug Sauerstofferhalten. In diesem Fall produzieren Zellenhypoxie-induzierte Faktoren,welche zur Ausschüttung von VEGF und schließlich zurAngiogeneseführen. Dies wurde an Zelllinien aufgeklärt.[3][4]
In der Gefäßwand fördert VEGF die Produktion vonStickstoffmonoxid(NO), dies wiederum führt zurGefäßerweiterung (Vasodilatation)und zum Absinken desBlutdrucks.[5]
Medizinische Bedeutung
[Bearbeiten|Quelltext bearbeiten]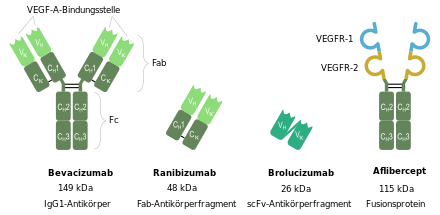
Eine erhöhteExpressionvon VEGF-A wird bei einer Reihe vonTumorengefunden, bei denen er die Durchlässigkeit der Blutgefäße erhöht und damit dieBlut-Tumor-Schrankeöffnet. Zudem spielt die Interaktion zwischen VEGF und dem VEGF-Rezeptor in derNiereeine wichtige Rolle bei der Entwicklung des Organs und in der Aufrechterhaltung derFiltrationsbarriere.[6]
Dermonoklonale AntikörperBevacizumabbindet an VEGF-A und hemmt so dieGefäßneubildung(Angiogenese). Bevacizumab wurde inPhase-III-Studienerfolgreich gegenDarmkrebs,LungenkrebsundBrustkrebseingesetzt. In Phase-II-Studien wurde Bevacizumab eingesetzt bei der Behandlung vonBauchspeicheldrüsenkrebs,NierenkrebsundProstatakrebs.Nebenwirkungen sindBlutungen,GeschwüreimMagen-Darm-Traktsowie Nierenschäden mitBluthochdruckundProteinurie(Eiweiß im Urin).[7]In derOphthalmologie(Augenheilkunde) wird Bevacizumaboff labelanstelle des teureren Ranibizumab verwendet.
Ranibizumabist ein Fragment des Bevacizumab. Es wird zur Behandlung derfeuchten Makuladegeneration,einer häufig zur Erblindung führenden Augenkrankheit, die vielfach mit Gefäßneubildung einhergeht, eingesetzt. Außerdem ist es – wie die anderen VEGF-Hemmer – das Mittel der Wahl zur Behandlung des zystoidenMakulaödemsals Folge eines Venenastverschlusses (VAV) oderZentralvenenverschlusses(ZVV) in der Retina.
DieTyrosinkinase-InhibitorenSunitinib,SorafenibundVatalanibhemmen ebenfalls die Signaltransduktion von VEGF-Rezeptor. Sunatinib und Sorafenib werden bei der Behandlung von fortgeschrittenem Nierenkrebs eingesetzt, Vatalanib unter anderem bei der Behandlung von Darmkrebs,Ramucirumabist ein monoklonaler Antikörper gegen den VEGF2 Rezeptor und wird verwendet bei derTherapievonMagenkrebs.
Aflibercept(VEGF Trap) ist einrekombinantesFusionsprotein,in dem diebindende Domänedes löslichen VEGF-Rezeptors mit demFc-FragmentvonImmunglobulin Gkombiniert ist. Aflibercept bindet alleIsoformenvon VEGF-A.[8][9]Aflibercept ist in der EU zugelassen zur Behandlung der altersbedingten feuchten Makuladegeneration und des diabetischen Makulaödems (2012) sowie deskolorektalen Karzinoms(2013).
Pegaptanibist einAptamer,das spezifisch an VEGF-A bindet. Es ist zur Behandlung der Feuchten Makuladegeneration zugelassen.
ImNierenkörperchenist VEGF für die Aufrechterhaltung der Integrität derfenestrierten kapillären Endothelzellenverantwortlich. In derSchwangerschaftkann VEGF durch den löslichen VEGF-Rezeptor (sFlt1) gehemmt werden. Dieser wird in derPlazentagebildet und gelangt mit dem Blut in die Niere. Folge der verminderten VEGF-Aktivität sind Schwellungen der Endothelzellen im Nierenkörperchen, die letztlich zum Krankheitsbild derPräeklampsieführen.[10] Bei Krebspatienten kann eine anti-VEGF-Behandlung zuProteinurie[11] undthrombotischer Mikroangiopathie[12] führen.
Weblinks
[Bearbeiten|Quelltext bearbeiten]Einzelnachweise
[Bearbeiten|Quelltext bearbeiten]- ↑S Yla-Herttuala, TT Rissanen, I Vajanto, J Hartikainen:Vascular endothelial growth factors: biology and current status of clinical applications in cardiovascular medicine.In:J Am Coll Cardiol.,2007 Mar 13, 49(10), S. 1015–1026,PMID 17349880.
- ↑S. Cebe Suarez, M. Pieren u. a.:A VEGF-A splice variant defective for heparan sulfate and neuropilin-1 binding shows attenuated signaling through VEGFR-2.In:Cellular and Molecular Life Sciences.63, 2006, S. 2067–2077,doi:10.1007/s00018-006-6254-9.
- ↑K. M. Mohamed, A. Le u. a.:Correlation between VEGF and HIF-1 Alpha expression in human oral squamous cell carcinoma.In:Experimental and molecular pathology,Band 76, Nummer 2, April 2004, S. 143–152,doi:10.1016/j.yexmp.2003.10.005,PMID 15010293.
- ↑D. Shweiki, A. Itin u. a.:Vascular endothelial growth factor induced by hypoxia may mediate hypoxia-initiated angiogenesis.In:NatureBand 359, Nummer 6398, Oktober 1992, S. 843–845,doi:10.1038/359843a0,PMID 1279431.
- ↑Timothy D. Henry et al.:The VIVA Trial: Vascular Endothelial Growth Factor in Ischemia for Vascular Angiogenesis.In:Circulation.Nr.107,2003,S.1359–1365(ahajournals.org).
- ↑Hassane Izzedine et al.:Angiogenesis Inhibitor Therapies: Focus on Kidney Toxicity and Hypertension.In:American Journal of Kidney Diseases.Nr.50,2007,S.203–218(ajkd.org).
- ↑Xiaolei Zhu et al.:Risks of Proteinuria and Hypertension With Bevacizumab, an Antibody Against Vascular Endothelial Growth Factor: Systematic Review and Meta-Analysis.In:American Journal of Kidney Diseases.Nr.49,2007,S.186–193(ajkd.org).
- ↑J. Holash, S. Davis u. a.:VEGF-Trap: a VEGF blocker with potent antitumor effects.In:Proceedings of the National Academy of Sciences of the United States of AmericaBand 99, Nummer 17, August 2002, S. 11393–11398,doi:10.1073/pnas.172398299,PMID 12177445,PMC 123267(freier Volltext).
- ↑A. Dowlati:Hunting and trapping the vascular endothelial growth factor.In:Journal of clinical oncology:official journal of the American Society of Clinical Oncology,Band 28, Nummer 2, Januar 2010, S. 185–187,doi:10.1200/JCO.2009.25.4359,PMID 19949005.
- ↑Isaac E. Stillman, S. Ananth Karumanchi:The Glomerular Injury of Preeclampsia.In:J Am Soc Nephrol.Nr.18,2007,S.2281–2284,PMID 17634433.
- ↑Roncone D et al.:Proteinuria in a patient receiving anti-VEGF therapy for metastatic renal cell carcinoma.In:Nat Clin Pract Nephrol.Nr.3(5),2007,S.287–293,PMID 17457362.
- ↑Izzedine H et al.:Thrombotic microangiopathy and anti-VEGF agents.In:Nephrol Dial Transplant.Nr.22,2007,S.1481–1482(oxfordjournals.org).