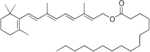
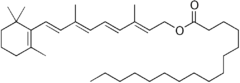
Vitamin A

UnterVitamin Awerden alle fettlöslichenchemischen Verbindungen(Vitamere) zusammengefasst, die die biologische Aktivität desRetinolsentfalten und sich von denCarotinoidenableiten.[1]Zu Vitamin A zählen neben Retinol selbst (Vitamin A1), seineEster(wieRetinylacetat,-palmitat,-propionat oder -stearat) sowie Provitamin A-Carotinoide (α-Carotin,β-Carotin undβ-Cryptoxanthin).[1]Chemisch handelt es sich umRetinoide,dies schließt auch synthetische Derivate des Retinols ein.
In allen Fällen werden diese Verbindungen inRetinalundRetinsäuremetabolisiert und entfalten dann ihre spezifische Vitamin-A-Wirkung. Sie können durchenzymatischkatalysierteReaktionen ineinander überführt werden, mit der einzigen Ausnahme, dass Retinsäuren nicht mehr recycliert werden können.
Vitamin A ist für alleWirbeltiereessentiellund für denSehvorgang,dieFortpflanzungundEmbryonalentwicklung,die Zell- und Gewebedifferenzierung undImmunfunktionenvon Bedeutung.
Geschichte
[Bearbeiten|Quelltext bearbeiten]
Bereits um 1500 v. Chr. verwendeten die Chinesen Leber und Honig zur Heilung vonNachtblindheit.[2]Im 16. Jahrhundert n. Chr. beschrieb Guilleaume diese Heilung.
Ende des 19. und Anfang des 20. Jahrhunderts untersuchte man den Einfluss unterschiedlicherDiätenauf das Wachstum von Säugetieren wie Ratten und Mäusen. So hatNikolai Iwanowitsch Lunin1881[3]beobachtet, dass Mäuse bei einer Diät aus gereinigten Milchbestandteilen (Casein,Fett,Milchzucker,Mineralstoffeund Wasser) nicht überleben können; beiVollmilchpulverselbst konnten sie dagegen normal wachsen.[4][5]Er folgerte daraus, dass „in der Milch ausser dem Casein, Fett, Milchzucker und den Salzen noch andere Stoffe vorhanden sein müssen, welche für die Ernährung unentbehrlich sind “.[3]Seine Ergebnisse zogen noch wenig Interesse nach sich, Lunin verfolgte sie auch nicht weiter. 1891 führte der damalige Student Carl A. Socin[6]aus dem LaborGustav von BungeFütterungsstudien bei Mäusen durch und fand heraus, dass inEigelbeine damals unbekannte fettähnliche und essentielle Substanz enthalten ist.[7]Cornelius Adrianus Pekelharingbestätigte 1905 Lunins Beobachtung: InMilchist eine Substanz enthalten, die selbst in geringen Mengen für die Ernährung nötig ist.[7]1909 konntePaul Knapp[8]bei Ratten zeigen, dass die zusätzliche Gabe von Milch bei einer definierten Diät an Proteinen, Kohlenhydraten, Fetten und Mineralstoffen vor Augenkrankheiten wieBindehautentzündungundHornhautulcusschützte und auch die Todesfälle verhinderte.[7]Er erwähnte auch die Arbeiten Lunins und Socins. Wenn umgekehrt die Fette in Milch mittelsEthanolundEtherextrahiert werden (wobei damit auch Vitamin A entfernt wird), können Mäuse nicht mehr überleben, wasWilhelm Stepp1911[9]publizierte.[7]
Frederick Gowland Hopkinskam allgemein zu dem Schluss, dass in der Nahrung bestimmte essentielle Faktoren für Wachstum und Überleben enthalten sein müssen.[7]In einer Veröffentlichung von 1912[10]zeigte er, dass ein Mangel jener Faktoren, die er als akzessorische Ernährungsfaktoren bezeichnete („accessory food factors “), bei jungen Ratten zu erheblichen Wachstumsstörungen führte. Er vermutete einen Zusammenhang zwischen der Unterversorgung mit diesen Stoffen und ähnlichen Gesundheitsproblemen auch beim Menschen, untersuchte dies aber nicht weiter. Jene akzessorische Faktoren wurden später als Vitamine bezeichnet, für die „Entdeckung der wachstumsfördernden Vitamine “wurde er 1929 gemeinsam mitChristiaan Eijkmanmit demNobelpreis für Physiologie oder Medizinausgezeichnet.

Elmer McCollumbegann 1907 an derUniversity of Wisconsin–Madisonmit systematischen Fütterungsexperimenten an Kühen mit verschiedenen Getreiden bei ähnlicher Zusammensetzung an Proteinen, Kohlenhydraten, Fetten und Mineralstoffen. Hierbei zeigte sich, dass Kühe unter Weizen erblindeten, bei Mais aber nicht.[5]McCollum wechselte bei den Versuchstieren auf Ratten, da dies erheblich schnellere Experimente erlaubte. Zusammen mitMarguerite Davis(* 1887; † 1967) führte er weitere Fütterungsstudien durch und zeigte 1913[11],dass typische Vitamin A-Mangelerscheinungen durch Gabe vonButteroder Eigelb, insbesondereEtherextrakteausLuzernen,LeberoderNieren,behoben werden konnten. Sie schlussfolgerten, dass einfettlöslicherWachstumsfaktor existieren muss; dieser ließ sich z. B. aus Butter extrahieren und in andere Fette übertragen.[5]Jener Faktor war jedoch nicht in anderen Fetten wieOlivenöloderSchmalzenthalten.[7]
Unabhängig gelangten auch inYaleLafayette B. MendelmitThomas B. Osborne1913 zu diesem Schluss:[12]bei Ratten konnten Mangelerscheinungen einer speziellen Diät aus isolierten Proteinen, Stärke, Schmalz und „proteinfreier “Milch durch die Zugabe von Butter vermieden werden.[7]Die Entdeckung von Vitamin A schreibt man aber McCollum zu, da die Ergebnisse von ihm (und Davis) drei Wochen vor denen Mendels und Osborns im selben Journal (Journal of Biological Chemistry) eingereicht wurden.[4]1916[13]schlug McCollum die Bezeichnung „fat-soluble A “vor – so grenzte er den damals anderen Faktor („water-soluble B “) aus denBeriberi-Studien (Thiamin) ab. Später wurde der Name dann kurz zu „Faktor A “,[5]1920 nach Vorschlag vom BiochemikerJack Drummondschließlich zu „Vitamin A “unter Anlehnung des vonCasimir Funkgeprägten Begriffes („Vital-Amine “).[7]
1931[14]gelangPaul KarrerdieStrukturaufklärungvon Vitamin A sowie Provitamin A,[7]sechs Jahre später kristallisierten Harry N. Holmes und Ruth E. Corbet amOberlin CollegeVitamin A[15].DieDarstellungTretinoins(Vitamin-A-Säure) undRetinals(Vitamin-A-Aldehyd) gelang 1946 David Adriaan van Dorp und Jozef Ferdinand Arens[16][17],währendOtto Isler1947[18]ein Verfahren für die großtechnische Synthese von Vitamin A vorstellte.[7]
Vorkommen
[Bearbeiten|Quelltext bearbeiten]| tierischen Ursprungs | µg RE / 100 g | pflanzlichen Ursprungs | µg RE / 100 g |
|---|---|---|---|
| Schweineleber | 36000 | Karotte | 1500 |
| Leberwurst | 8300 | Grünkohl | 860 |
| Eigelb | 886 | Spinat | 795 |
| Butter | 653 | Zitrone | 567 |
| Sahne,30 % Fett | 339 | Kopfsalat | 187 |
| Makrele | 100 | Mais | 185 |
| Lachs | 41 | Brokkoli | 146 |
| Jogurt,3,5 % Fett | 32 | Spargel | 87 |
| Hühnerfleisch | 32 | Gurke | 62 |
| Kuhmilch, 3,5 % Fett | 31 | Banane | 9 |
| Rindfleisch | 20 | Weintrauben | 6 |
| Schweinefleisch | 6 | Apfel | 6 |
| Kuhmilch, 0,3 % Fett | 3 | Weizen (Vollkorn) | 3 |
In tierischen Nahrungsmitteln steht Vitamin A hauptsächlich als Retinylpalmitat zur Verfügung, in pflanzlichen alsCarotine.Die Umrechnungen der biologischen Aktivität der zahlreichen verschiedenen Vitamere kann durch zwei Kenngrößen erleichtert werden:
- Zum einen wird das sogenannte Retinoläquivalent (RE bzw. RÄ) angegeben. Hierbei entsprechen 1 RE 1 µgall-trans-Retinol, 6 µg β-Carotin oder 12 µg andere als Provitamin A fungierende Carotinoide.[1][19]Vereinzelt wird hierbei noch vom Gebrauch derInternationalen Einheiten(IE) für isolierte Substanzen mit Vitamin-A-Charakter gemacht, wobei 1 IE Vitamin A 0,3 µgall-trans-Retinol bzw. 0,6 µg β-Carotin entsprechen. Die Angabe in IE berücksichtigt nicht die geringe Absorption von Carotinoiden aus vielen Nahrungsmitteln.
- Zum anderen nutzt man das sogenannte Retinolaktivitätsäquivalent (RAE bzw. RAÄ), was die unterschiedlichen Grade an Bioverfügbarkeit und Biokonversion in Rechnung trägt.[1]Nach neueren Untersuchungen ist die Bioverfügbarkeit nur in öligen Suspensionen unter optimalen Bedingungen hoch. Gerade Provitamin-A-Carotinoide können mit anderen Nahrungsinhaltsstoffen interagieren, was deren Umwandlung in Retinol beeinflusst.[20]1 RAE entsprechen 1 µgall-trans-Retinol, 2 µg β-Carotin (in Öl), 12 µg β-Carotin in Lebensmittel oder 24 µg andere als Provitamin A fungierende Carotinoide.
Der Körper kann überschüssiges Vitamin A kaum abbauen, weshalb es sich leicht im Körper anreichert, insbesondere in der Leber. Daher enthält die Leber von Tieren so viel Vitamin A, dass häufiger Verzehr von Leber wiederum zu einer Anreicherung im Körper des Konsumenten führt. Dies kann zuHypervitaminoseführen. Schweineleber enthält beispielsweise bis zu 42 mg Vitamin A (140.000 IE) pro 100 g. Die Leber desEisbären(Ursus maritimus) ist aufgrund ihres sehr hohen Vitamin-A-Gehaltes toxisch und wird deshalb von denEskimosnicht gegessen. Dies trifft in geringerem Maße auch für andere Tiere derArktiszu, insbesondere verschiedeneRobben.[21]
Synthetische Herstellung
[Bearbeiten|Quelltext bearbeiten]Vitamin A wird auch in erheblichem Umfang als Retinaolacetat synthetisch hergestellt,[22]das Verfahren geht vonCitralaus, das zumβ-Jononumgesetzt wird, aus dem durch Addition vonEthinein Baustein mit 15 C-Atomen hergestellt und zu einemPhosphor-Ylid(Wittigsalz) umgesetzt wird. Dieses reagiert in einerWittig-Reaktionmit β-Formylcrotylacetat zum Retinolacetat.[23]
Physiologie
[Bearbeiten|Quelltext bearbeiten]Etwa die Hälfte des aus der Nahrung stammenden Vitamin A wird aufgenommen.[24]Es liegt bei Nahrungsmittel tierischen Ursprungs in Form von Retinol und Retinylester („präformiertes Vitamin A “)[20],bei denen aus Pflanzen in Form von Provitamin-A-Carotenoiden vor. Während präformiertes Vitamin A mit 70–90 % effizient absorbiert wird, gibt es bei β-Carotin dagegen erhebliche Schwankungen von 5–65 %.[24]Dies liegt u. a. an Nahrungs- und Ernährungsfaktoren oder am allgemeinen Gesundheitsstatus.
Bei Vitamin A handelt es sich umlipophileVerbindungen. Daher begünstigen Fette und Gallensäuren die Resorption im Darmlumen, dieses wird mizellar fast vollständig aufgenommen. Bei Retinol geschieht dies mittels passiver oder mittels Carrier-vermittelter Diffusion direkt in die Zellen der Darmschleimhaut.[19][1][24]
Retinylester dagegen müssen erst zu Retinol hydrolysiert werden. Dies erfolgt mithilfe nichtspezifischer Pankreaslipasen (z. B. einerPankreaslipaseund einer Cholesterolester-Lipase), oder an den Zelloberflächen der Dünndarmschleimhaut mittels einer intestinaler Retinylester-Hydrolase:
Bei Vorliegen physiologischer Mengen wird das Retinol im Cytoplasma derEnterozytenanRetinol-bindende Proteine(CRBP), insbesondere CRBP II gebunden.[24]CRBP II liegt dort in hohen Konzentrationen vor. Danach folgt eine Veresterung des gebundenen Retinols durch eine membrangebundeneLecithin-Retinol-Acyltransferase(LRAT), es werden bevorzugt langkettigen Fettsäuren wiePalmitinsäure[19]umgesetzt, wodurch Retinylpalmitat gebildet wird. Sollten sehr hohe Dosen an Vitamin A aufgenommen werden, kann diese Rückverestertung auch direkt erfolgen. Teilweise erfolgt die Veresterung auch durch eineDiacylglycerol-O-Acyltransferase 1(DGAT1):[24]
Die gebildeten Retinylester, aber auch aufgenommene Carotinoide werden zusammen mitTriglyceridenundCholesterininChylomikroneninkorporiert, wofür dasmikrosomale Triglycerid-Transferproteinnötig ist. Etwa 66 % des aufgenommenen Retinols wird in veresteter Form im Blut transportiert, ein Drittel gelangt direkt ins Blut.[24]Die Chylomikronen gelangen über die intestinaleLymphbahnin den Blutkreislauf und schließlich zur Leber. Dort werden sie in Form von Chylomikronenresten in Leberzellen aufgenommen, was rezeptorvermittelt erfolgt. Nach Aufnahme werden die Retinylester hydrolysiert und zur Kurzspeicherung erfolgt eine Bindung an CRBP in den Parenchymzellen. Retinol kann auch längerfristig gespeichert werden, dies geschieht nach Transport in die perisinusoidalen Stellatumzellen der Leber und anschließender Veresterung. Die Veresterung erfolgt hier mit einer hepatären LRAT, die strukturell höchstwahrscheinlich der LRAT in den Enterozyten gleicht.[24]Im Gegensatz dazu wird die Expression der hepatären LRAT durch den Vitamin-A-Status des Körpers beeinflusst.
Vitamin A wird zu 95 % überwiegend in Form von Retinylpalmitat oder -stearat in der Leber gespeichert (100–300 µg/g), 80 % davon in den perisinusoidalen Stellatumzellen.[1]Der Körper kann für ein bis zwei Jahre Vitamin A speichern, falls die Versorgung ausreichend ist; die Halbwertszeit beläuft sich auf 50–100 Tage.
Umwandlung der Carotine
[Bearbeiten|Quelltext bearbeiten]Nebenβ-Carotinnehmen Tier und Mensch pflanzlichesα-Carotinundβ-Cryptoxanthinmit der Nahrung auf. Provitamin A-Carotinoide werden mittels desHDL-Rezeptors(SR-B1) in die Enterozyten transportiert.[24]
Das Enzymβ-Carotin-15,15′-Dioxygenase(BCO1, ehemals bekannt auch als β-Carotin-15,15′-Monooxygenase BCMO1) ist dort in der Lage, diese Carotine zu Retinal umzusetzen.[25]Während bei β-Carotin diese Umsetzung zu zwei Molekülenall-trans-Retinal vollständig geschieht, werden anderen Stoffe asymmetrisch gespalten, wodurch nur jeweils ein Molekül Retinal entsteht.
BCO1 wird in vielen Gewebetypen exprimiert, am meisten Aktivität herrscht aufgrund der Substratverfügbarkeit jedoch im Darm.[26]
Auch das Retinal aus dieser Reaktion bindet schnell an CRBP II im Zellinnern der Enterozyten. Ist der Vitamin-A-Bedarf gestillt, wird dieBCO1-Genexpressionzurückgefahren. Überschüssiges β-Carotin lokalisiert in lipophilen Zonen des Körpers, so auch in der Haut, was im Extremfall als harmlose Gelbfärbung wahrnehmbar ist (Aurantiasis cutis,Carotinämie).[27]
Retinal wird anschließend zu Retinol reduziert, wahrscheinlich von einem Enzym, das in der Membran des ER (dem Zytosol zugewandt) lokalisiert ist, der Retinal-Reduktase RalR1.[26]
Wie viel des aufgenommenen β-Carotins ein Mensch wirklich in Vitamin A umwandeln kann, hängt von seiner genetischen Situation ab. Große Teile der Bevölkerung tragen auf mindestens einem der beidenBCO1-Gene Variationen, die die Umwandlung – ohnehin schon wenig effektiv (nur 3 % oder weniger der aufgenommenen Carotinoide werden absorbiert, die Umwandlung beträgt dann bei manchen Pflanzen nur einen Faktor von 28:1 Betacarotin zu Retinol) – herabsetzt.[25]Die katalytische Aktivität von BCO1 um bis zu 70 % vermindert sein.[28]Für manche Menschen ist es somit erheblich erschwert, den Vitamin-A-Bedarf durch rein pflanzliche Ernährung zu decken.
Funktion
[Bearbeiten|Quelltext bearbeiten]Vitamin A ist wichtig für das Wachstum, Funktion und Aufbau vonHautundSchleimhäuten,Blutkörperchen,Stoffwechselsowie für denSehvorgang.Die Verwertung dieses Vitamins im Körper kann durch Leberschäden und die Einnahme von Östrogenpräparaten gestört werden. Neueste Untersuchungen zeigten, dass entgegen der Vermutung selbst durch geringste Mengen Fett in Nahrungsmitteln das Vitamin A vom Körper aufgenommen und verwendet werden kann.
Sehvorgang
[Bearbeiten|Quelltext bearbeiten]
Beim Sehvorgang vermittelt 11-cis-Retinal (beiSüßwasserfischenund manchenAmphibien11-cis-3,4-Dehydroretinal) als lichtempfindliches Chromophor die Phototransduktion. Es kommt in den Sehpigmenten bei den Lichtrezeptoren in derRetinavor. Unter den vielen Vitamin A-Funktionen ist die fürs Sehen am besten untersucht.[1]
All-trans-Retinsäure wird zudem für die Differenzierung verschiedener Membranen (Binde-undHornhaut) sowie Zellen (Stäbchen- undZapfenzellen) benötigt.[24]Beim ersteren trägt Vitamin A dadurch zur strukturellen Integrität des Auges bei. Tränenflüssigkeit enthält an RBP gebundenes Retinol, bei einem Vitamin A-Mangel wird die Hornhaut zunehmend trocken (Xerophthalmie), zusätzlich bilden sich sogenannte Bitôt-Flecken.[1]
Nervensystem
[Bearbeiten|Quelltext bearbeiten]Retinol erhält gesundeNervenzellenin denperipheren Nervenbahnen,imGehirnund imRückenmark.
Blutkörperchen
[Bearbeiten|Quelltext bearbeiten]Retinol fördert entscheidend die Bildung neuerErythrozytenund erleichtert den Einbau desEisens.
Eiweiß-Stoffwechsel
[Bearbeiten|Quelltext bearbeiten]Es ist an derProteinsyntheseund beim Fettstoffwechsel in der Leber beteiligt, so dass eine proteinreiche Nahrung zu einem Vitamin-A-Mangel führen kann. Auch bei erhöhtem Stress erhöht sich der Vitamin-A-Bedarf, da Stress den Proteinbedarf erhöht. Somit steigt der Retinol-Bedarf auch bei schweren Krankheiten wieArthritis,AidsoderKrebs.
Haut und Schleimhäute
[Bearbeiten|Quelltext bearbeiten]Vitamin A spielt eine zentrale Rolle für die Struktur und Gesundheit dieser Gewebe, da es ein normales Zellwachstum nicht nur der Haut, sondern auch der Wände derAtem-,Verdauungs-undHarnwegegewährleistet. Des Weiteren beugt esDNA-Schädenin Hautzellen vor, trägt zu deren Reparatur bei und normalisiert die Hautfunktionen, beispielsweise gesunde Zellteilung derKeratinozyten(sieheEpidermis).
Knochengerüst
[Bearbeiten|Quelltext bearbeiten]Vitamin A ist an derOssifikation,der Knochenbildung undKnochenheilungbeteiligt. Besonders bei Kindern ist daher eine ausreichende Vitamin-A-Versorgung wichtig.
Embryonales Wachstum
[Bearbeiten|Quelltext bearbeiten]DieVitamin-A-Säure(All-trans-Retinsäure) bzw. ihr Salz, dasRetinat,ist ein wichtiger Wachstumsfaktor für Nervenzellen während der Embryonalentwicklung. Es wird von Zellen desPrimitivknotensausgeschüttet und ist beteiligt an der Ausbildung der Längsachse (Vorn-hinten-Orientierung) des Embryos.Nervenzellenwandernentlang des Konzentrationsgradienten der Retinsäure.
Reproduktion
[Bearbeiten|Quelltext bearbeiten]Retinol ist an der Synthese vonTestosteronundÖstrogensowie an der Spermato- und Oogenese beteiligt, außerdem an der Synthese von Retinal, einem Bestandteil von Rhodopsin, dem für die Lichtwahrnehmung in den Fotorezeptoren der Augen zuständigen Protein. Des Weiteren sind die Menge und die Form der Spermien von einer optimalen Versorgung mit Vitamin A abhängig. Über die Wirkungen auf die menschlichen Schleimhäute ist Vitamin A auch für die Aufrechterhaltung der Struktur und Funktion der Samen- und Eileiter (beide mit Schleimhaut ausgekleidet) wichtig. Bei der Frau werden Unfruchtbarkeit und Fehlgeburten mit Retinolmangel in Zusammenhang gebracht.
Immunsystem
[Bearbeiten|Quelltext bearbeiten]Vitamin A moduliert dasImmunsystem.So stimuliert Retinsäure das Wachstum vonT-Lymphozyten,inhibiert dieses beiB-Lymphozytensowie deren Vorläuferzellen und beeinflusst das Gleichgewicht anT-Helferzellen.[24]Die durchMakrophageninduzierte Entzündungsreaktionen werden mittels Vitamin A verstärkt, indem es die Produktion vonIL-12undIFN-γanregt. Das Vitamin reguliert die Antigenpräsentation und Entwicklung nicht ausgereifterdendritischer Zellenund blockiert die Fähigkeit von Makrophagen, Bakterien aufzunehmen und zu zerstören.
Zudem wird die Synthese vonGlykoproteinenmittels Vitamin A reguliert. Nach vielen Infektionen ist der Vitamin-A-Bedarf gesteigert.[1]
Bedarf
[Bearbeiten|Quelltext bearbeiten]| Altersgruppe | D-A-CH(2020)
µg RAE / Tag |
EFSA(2015)
µg RE / Tag |
|---|---|---|
| Kleinkinder (4–7 Jahre) | 350 | 300 |
| Kinder (7–10 Jahre) | 450 | 400 |
| Kinder mit 10 Jahren | 600 | 400 |
| Jugendliche (11–13 Jahre) | 600 | 600 |
| Jugendliche (13–15 Jahre) | 700 (♀); 800 (♂) | 600 |
| Adoleszente (15–19 Jahre) | 800 (♀); 950 (♂) | 650 (♀); 750 (♂) |
| Erwachsene (< 65 Jahre) | 700 (♀); 850 (♂) | 650 (♀); 750 (♂)
(15–17 J.) |
| Senioren (≥ 65 Jahre) | 700 (♀); 800 (♂) | 650 (♀); 750 (♂) |
| Schwangere | 800 | 700 |
| Stillende | 1300 | 1300 |
Vitamin A wird teilweise direkt mit der Nahrung aufgenommen, darin enthaltenes Retinol und Retinylester werden hierbei alspräformiertes Vitamin Abezeichnet.[20]Alternativ geschieht dies durch Aufnahme vonCarotinen(Provitamin A),die in fast allen Wirbeltieren zu Vitamin A umgesetzt werden können (Ausnahme sind beispielsweiseHauskatzen[30]). Der tatsächliche Tagesbedarf beim Menschen ist abhängig von Alter, Geschlecht und Lebensumständen. Angegeben werden dieZufuhrreferenzwerte(RDA) in mg oder µg Retinolaktivitätsäquivalente (RAE). Frauen bis 65 Jahren sollten im Durchschnitt 700 µg RAE, Männer bis 850 µg RAE täglich aufnehmen.[29]Bei Adoleszenten ist der Bedarf etwas erhöht: Junge Frauen von 15 bis 19 Jahren sollten 800 µg RAE, gleichaltrig junge Männer bis 950 µg RAE pro Tag konsumieren. Bei Schwangeren wird eine Tagesdosis von 1300 µg RAE empfohlen. Die 2015 von derEFSAfestgelegten Referenzwerte unterscheiden sich geringfügig von denen derD-A-CH-Gesellschaften,außerdem hat die EFSA diese in Form von µg Retinoläquivalente (RE) abgeleitet.
Längeres Kochen,Sauerstoffund Licht schaden Vitamin A. Deshalb sollte man Lebensmittel, die Vitamin A enthalten, immer ungeschält oder verpackt und dunkel – am besten im Kühlschrank – lagern. Die Kochverluste liegen zwischen 10 und 30 Prozent.
Wegen der im Vergleich zu den empfohlenen Mengen niedrigentolerierbaren oberen Einnahmemenge(UL) rät dasBundesinstitut für Risikobewertung(BfR) auf eine Anreicherung von präformierten Vitamin A inNahrungsergänzungsmittel(NEM) zu verzichten.[29]Alternativ gibt das BfR eine Höchstmenge von 200 µg pro Tagesverzehrempfehlung eines NEM an, wenn Vitamin A bis zu einer Tageshöchstmenge von 400 µg konsumiert wird. Diese Höchstmenge erlaubt einen signifikanten Beitrag zur Vitamin-A-Versorgung für Personen, bei denen diese schlecht ist. Jedoch würde ein Teil der 14- bis 18-Jährigen und erwachsene Männer ab 25 Jahren gerade bei Mehrfachverwendung von Vitamin-A-haltigen NEMs der UL für Vitamin A überschritten werden. Das BfR rät außerdem dazu, dass Vitamin-A-haltige NEMs für Schwangere mit einem Hinweis versehen werden, Vitamin A nur nach ärztlicher Rücksprache einzunehmen.[29]
Auf die Anreicherung mittels präformierten Vitamin A sollte bei Lebensmittel verzichtet werden. Als Ausnahme geltenMargarineoderMischfetterzeugnisse.Diese werden als Butterersatz in Deutschland seit vielen Jahren verpflichtend mit Vitamin A angereichert (1 mg Vitamin A pro 100 Gramm).[29]
Mangel (Hypovitaminose)
[Bearbeiten|Quelltext bearbeiten]
Bei Mangel an Vitamin A (Vitamin-A-Mangel) kommt es zu erhöhter Infektionsanfälligkeit, Trockenheit der Haut, Haare, Nägel und Augen („Augendarre “,Xerophthalmie), Haarausfall,Nachtblindheit,verringerter Sehschärfe, erhöhter Lichtempfindlichkeit,Keratomalazie,Eisenmangel, erhöhter Gefahr einer arteriosklerotischen Herzerkrankung, erhöhtem Krebsrisiko in Organen mit Schleimhäuten, erhöhtem Risiko für Nierensteine aufgrund erhöhter Calciumausscheidung, Fruchtbarkeitsstörungen, beeinträchtigtem Geruchssinn, Tastsinn und Appetit, Müdigkeit und Wachstumsstörungen wie z. B. Störungen des Knochenwachstums im Kindesalter.
Risikogruppen:[31]
- Unzureichende Verdauung (Maldigestion) und Aufnahme (Malabsorption) infolge gastrointestinalen Erkrankungen, z. B. beiMorbus Crohn,Zöliakie,bei einem jejunoilealer Bypass, bei Leber- und Bauchspeicheldrüsenerkrankungen, bei einem Gallengangsverschluss
- Patienten mit erhöhter Blendempfindlichkeit, Nachtblindheit und verschiedenen Vitamin A-Mangel bedingten Formen einer krankhaft trockenen Horn- und Bindehaut des Auges, Bitot-Flecken oder z. B. Xerophthalmien
- Patienten mit speziellen Hals-Nasen-Ohren-Erkrankungen wieArzneimittel-Rhinitis,(Epi)pharyngitissicca oderOzaena– in allen Fällen liegt eineVerkümmerungder Schleimhaut vor
- Patienten mit erhöhter Infektanfälligkeit
- Schwangere und Stillende
Risikofaktoren[31]
- chronische Mangelernährung
- einseitige Ernährung oder Fehlernährung
- parenterale Ernährung
- Alkoholismus
- Komedikation, die die Resorption vermindern (z. B.Colestyramin,Colestipol oderNeomycin)
Die Unterversorgung mit Vitamin A (Vitamin-A-Defizienz,kurz VAD, auchA-Avitaminose) ist ein weit verbreitetes Problem inEntwicklungsländern.Etwa 250 Millionen Vorschulkinder leiden an VAD und jedes Jahr sterben daran etwa eine Million Kinder. Zwischen 250.000 und 500.000 Kinder erblinden zudem durch VAD und die Hälfte stirbt im darauf folgenden Jahr.[32]Auch führt Vitamin-A-Mangel zu einer stark erhöhten Komplikationsrate bei Infektionskrankheiten wieMasern.[33]Bei an Masern erkrankten Kindern empfiehlt dieWHOeine zweimalige Gabe an Vitamin A, diese kann eine masernbedingteErblindungoder Augenschäden verhindern, außerdem dieMortalitätsenken.[34]Vitamin-A-Gaben eignen sich dagegen nicht zurPräventionder Masern.[35]
Gegenmaßnahmen
Zur Vermeidung der Vitamin-A-Unterversorgung, wie sie vor allem als Armutsphänomen in Entwicklungsländern vorkommt, existieren mehrere Strategien:[36]
- Verteilung von Vitamintabletten: Hierbei werden typischerweise alle 6 Monate Retinoltabletten verabreicht. Das Retinol wird in der Leber gespeichert und von dort über einen Zeitraum von vier bis sechs Monaten abgegeben. Diese Strategie ist kosteneffektiv, es kann jedoch Schwierigkeiten geben, große Anteile der bedürftigen Kinder zu erreichen.
- Anreicherung von Lebensmitteln:Hierbei werden Lebensmittel während der Herstellung oder Verpackung mit Mikronährstoffen angereichert. In Lateinamerika konnte beispielsweise die Anreicherung von Zucker erheblich zur Bekämpfung der VAD beitragen. Allerdings ist die Anreicherung nur eine Option, wenn die Bedürftigen industriell verarbeitete Produkte konsumieren. In Afrika ist dies z. B. oft nicht der Fall.
- Diversifizierung der Ernährung: Maßnahmen wie Aufklärung unter Betroffenen sollen helfen, dass mehr Vitamin-A-reiche Lebensmittel konsumiert werden, etwa aus dem eigenen Garten. Der Nachteil ist, dass die Verfügbarkeit von Vitamin-A-reichen Nahrungsmitteln häufig saisonal bedingt stark schwankt.
- Biofortifikation:Hierbei wird mithilfe der Pflanzenzüchtung der Mikronährstoffgehalt von Nutzpflanzen erhöht. So wurde der Gehalt von Provitamin A, Zink oder Eisen in Grundnahrungsmitteln wie Maniok, Mais, Reis und Süßkartoffel erhöht, auch mithilfe der Gentechnik (Goldener Reis). Schätzungen zufolge ist die Kosteneffizienz der Biofortifikation in Entwicklungsländern relativ hoch.
Überversorgung (Hypervitaminose)
[Bearbeiten|Quelltext bearbeiten]| Altersgruppe | UL [mg Retinol und Retinylester (ohne Vitamin A-aktive Carotinoide) / Tag] |
|---|---|
| Kleinkinder (4–7 Jahre) | 1,1 |
| Kinder (7–10 Jahre) | 1,5 |
| Jugendliche (11–13 Jahre) | 2,0 |
| Jugendliche (13–15 Jahre) | 2,6 |
| Adoleszente (15–19 Jahre) | 3,0 |
| Erwachsene | 3,0 |
| Schwangere | 3,0 |
| Stillende | 3,0 |
Akute Überdosierung
[Bearbeiten|Quelltext bearbeiten]Relativ selten kann eine akute Intoxikation durch Vitamin A auftreten, dies passiert in der Regel durch eine exzessive Einnahme von Vitamin A-enthaltenenNahrungsergänzungsmitteln(NEM).[1]In der Literatur sind aber auch Vergiftungen nach Verzehr großer Mengen von Eisbär-, Robben- und Haifischleber dokumentiert.[19]Bei Einnahme hoher Mengen an Vitamin A (300.000 IE bzw. > 50.000 IE/Tag) erschöpft sich die Speicherkapazität der Leber, im Blut jene des Retinol-bindenden Proteins; dies führt dazu, dass Retinylester sowie freies Retinol biologische Membranen angreift. Akute Symptome sind altersabhängig. Bei Erwachsenen hat sich die Einnahme von 500 mg (1.500.000 IE), bei Kindern von 100 mg (300.000 IE) und bei Kleinkindern von 30 mg (100.000 IE) wie folgt geäußert:Übelkeit,Erbrechen,starkeKopfschmerzen,Benommenheit,Schwindel,Sehstörungen(Papillenödem)[19],unkoordinierte Bewegungen,Schläfrigkeit,Jucken,einem Abschälen der Haut sowie einer Vorwölbung derFontanelle(bei Säuglingen).[1]Diese Anzeichen sind etwa 36 Stunden nach Absetzen der Vitamin A-Quelle reversibel.[19]
In der Labordiagnostik manifestiert sich eine Vitamin A-Überdosis durch eine erhöhteFibrinolysezeit,einem erniedrigtenQuick-Wert,erhöhteAST- undALT-Werte und eine mäßig beschleunigteBlutsenkungsreaktion.[19]
Chronische Überdosierung
[Bearbeiten|Quelltext bearbeiten]Häufiger als eine akute Vergiftung mit Vitamin A ist eine längereÜberversorgung mit Vitamin A(Hypervitaminose A) durch orale Aufnahme oder mittels Resorption durch die Haut. Diese kann sich bei Kindern bei einer täglichen Einnahmen von 18.000 IE ausbilden, bei Erwachsenen bei 100 000 IE pro Tag.[1]In der Literatur werden chronische Überdosierungen auch bei einer Einnahme von 30–60 mg pro Tag über 2 Jahre beobachtet.[19]Auch die dosis- und derivatabhängige Einnahme retinsäurehaltiger Medikamente kann hierbei eine Rolle spielen. Als frühe Symptome einer Hypervitaminose A geltenRhagaden,trockene und schuppende Haut, Jucken,Haarausfall,Müdigkeit, Knochen-,Gelenk- undMuskelschmerzenundHämorrhagien.Längerfristig wurden auch weitere Symptome beobachtet:Hepatosplen Omega lie,eineHypertrophiefettspeichernderLeberzellen,Leberzirrhose(teilweise mit Todesfolge[37]), Kopfschmerzen infolge gesteigerten Liquordrucks sowie im Serum eine Erhöhung derAP- und derCalciumwerte.[1]Bei massiver Überdosierung kann es zu meist symmetrischenZapfenepiphysenamOberschenkelknochenkommen.
Eine Überversorgung mit Vitamin während derSchwangerschaftist bereits bei einer täglichen Aufnahme von Vitamin A 10.000 IU bzw. 3 mg pro Tag anzunehmen, was zukindlichen FehlbildungenwiekraniofacialenAbnormitätenoderHerzklappenfehlernund spontanenFehlgeburtenführen kann.[38]
Eine einzelne Studie, dieteratogeneEigenschaften bei der Aufnahme von 30.000 IE Vitamin A zeigte, konnte nicht bestätigt werden. Die Sicherheit einer Dosis von 10.000 IE wurde mehrfach gezeigt. Die Empfehlung einer täglichen Dosis von 2.500 IE (0,75 mg) scheint damit gerechtfertigt.[39][40]
Die frühesten Hinweise auf Hypervitaminose A wurden in Afrika an dem rund 1,7 Millionen Jahre alten, weiblichen SkelettKNM-ER 1808einesHomo erectusentdeckt, das die für Hypervitaminose A typischen Formen von Knochenmissbildungen aufwies, verursacht vermutlich durch den Verzehr extrem großer Mengen von Leber.[41]
Das Überangebot anCarotinenführt beim Menschen nicht zu einer Überversorgung mit Vitamin A (Hypervitaminose A), weil der Körper die Umwandlung der Carotine zu Vitamin A entsprechend herunterregelt. Ein Zuviel an Carotinen macht sich optisch als Gelbfärbung der Haut bemerkbar (Carotinämie,„Karottenikterus “), ist aber nicht behandlungsbedürftig, da keine Hypervitaminose vorliegt.
Diagnostik
[Bearbeiten|Quelltext bearbeiten]Der Serumspiegel ist zur Diagnose einer Hypervitaminose ungeeignet. Ein sicherer Indikator ist hingegen die Relation von Vitamin A zu RBP (Retinol-bindendes Protein). Übersteigt der Serumspiegel die Bindungskapazität durch RBPs, so liegt freies Vitamin A vor, das toxische Wirkung entfaltet.
Weitere Vertreter
[Bearbeiten|Quelltext bearbeiten]
In der Literatur wird 11-cis-3,4-Didehydroretinal als Vitamin A2bezeichnet, ein lichtempfindliches Chromophor bei Photorezeptoren inWirbeltieren.Es ähnelt 11-cis-Retinal, hat aber noch eine zusätzliche Doppelbindung im β-Jononring.[42]Vitamin A3(3-Dehydroretinal) nutzen dagegenGliederfüßer,während bei manchenKrebstierendas als Vitamin A4bezeichnete 4-Hydroxyretinal gefunden wurde.[43]
Literatur
[Bearbeiten|Quelltext bearbeiten]- Klaus Pietrzik, Ines Golly, Dieter Loew:Handbuch Vitamine: Für Prophylaxe, Therapie und Beratung.1. Auflage. Urban&Fischer, Elsevier, München 2008,ISBN 978-3-437-55361-5,S.190–226.
- Richard D. Semba:On the 'discovery' of vitamin A.In:Annals of Nutrition & Metabolism.Band61,Nr.3,2012,S.192–198,doi:10.1159/000343124,PMID 23183288(englisch).
- Richard D. Semba:The vitamin A story - lifting the shadow of death.In:World Review of Nutrition and Dietetics.Band104,2012,doi:10.1159/isbn.978-3-318-02189-9,PMID 23006926(englisch).
Weblinks
[Bearbeiten|Quelltext bearbeiten]- Helmut Heseker, Anna Stahl:Vitamin A: Physiologie, Funktionen, Vorkommen, Referenzwerte und Versorgung in Deutschland(PDF; 555 kB), Ernährungs-Umschau, 13. September 2010
- Höchstmengenvorschläge für Vitamin A in Lebensmitteln inklusive Nahrungsergänzungsmitteln(PDF; 454 kB),Bundesinstitut für Risikobewertung,2021
- Scientific Opinion on Dietary Reference Values for vitamin A(PDF),Europäische Behörde für Lebensmittelsicherheit,2015
- Vitamin A-Produkte – was ist sinnvoll?,Klartext Nahrungsergänzung (Verbraucherzentrale), 20. Dezember 2021
Einzelnachweise
[Bearbeiten|Quelltext bearbeiten]- ↑abcdefghijklmnHelmut Heseker, Anna Stahl:Vitamin A: Physiologie, Funktionen, Vorkommen, Referenzwerte und Versorgung in Deutschland.(PDF) In:Ernährungs-Umschau.13. September 2010,abgerufen am 29. Januar 2022.
- ↑Hans Konrad Biesalskiet al.:Ernährungsmedizin.3., erweiterte Auflage. Thieme Verlag, 2004,ISBN 978-3-13-100293-8,S.111,doi:10.1055/b-0033-116.
- ↑abNikolai Iwanowitsch Lunin:Ueber die Bedeutung der anorganischen Salze für die Ernährung des Thieres.In:Zeitschrift für physiologische Chemie.Band5,Nr.1,1. Januar 1881,S.31–39,doi:10.1515/bchm1.1881.5.1.31.
- ↑abLouis Rosenfeld:Vitamine - vitamin. The early years of discovery.In:Clinical Chemistry.Band43,Nr.4,April 1997,S.680–685,doi:10.1093/clinchem/43.4.680,PMID 9105273(englisch).
- ↑abcdGeorg Wolf:A history of vitamin A and retinoids.In:FASEB journal: official publication of the Federation of American Societies for Experimental Biology.Band10,Nr.9,Juli 1996,S.1102–1107,doi:10.1096/fasebj.10.9.8801174,PMID 8801174(englisch).
- ↑C. A. Socin:In welcher Form wird das Eisen resorbirt?Band15,Nr.2,1. Januar 1891,S.93–139,doi:10.1515/bchm1.1891.15.2.93.
- ↑abcdefghijRichard D. Semba:On the 'discovery' of vitamin A.In:Annals of Nutrition & Metabolism.Band61,Nr.3,2012,S.192–198,doi:10.1159/000343124,PMID 23183288(englisch).
- ↑Paul Knapp:Experimenteller Beitrag zur Ernährung von Ratten mit künstlicher Nahrung und zum Zusammenhang von Ernährungsstörungen mit Erkrankungen der Conjunctiva.In:Zeitschrift für experimentelle Pathologie und Therapie.Band5,Nr.1,1. Mai 1908,S.147–169,doi:10.1007/BF02622432.
- ↑Wilhelm Stepp:Experimentelle Untersuchungen über die Bedeutung der Lipoide für die Ernährung.In:Zeitschrift für Biologie.Band57,1911,S.135–170.
- ↑Frederick G. Hopkins:Feeding experiments illustrating the importance of accessory factors in normal dietaries.In:The Journal of Physiology.Band44,Nr.5-6,15. Juli 1912,S.425–460,doi:10.1113/jphysiol.1912.sp001524,PMID 16993143,PMC 1512834(freier Volltext) – (englisch).
- ↑Elmer McCollum,Marguerite Davis:The necessity of certain lipins in the diet during growth.In:The Journal of Biological Chemistry.Band15,Nr.1,1. Juli 1913,S.167–175,doi:10.1016/S0021-9258(18)88553-2,PMID 4586894(englisch).
- ↑Thomas B. Osborne,Lafayette B. Mendel:The relation of growth to the chemical constituents of the diet.In:Journal of Biological Chemistry.Band15,Nr.2,1. August 1913,S.311–326,doi:10.1016/S0021-9258(18)88530-1(englisch).
- ↑Elmar V. McCollum,Cornelia Kennedy:The dietary factors operating in the production of polyneuritis.In:Journal of Biological Chemistry.Band24,Nr.4,1. April 1916,S.491–502,doi:10.1016/S0021-9258(18)87532-9(englisch).
- ↑Paul Karreret al.:Zur Kenntnis des Vitamins-A aus Fischtranen.In:Helvetica Chimica Acta.Band14,Nr.5,1. Oktober 1931,S.1036–1040,doi:10.1002/hlca.19310140511.
- ↑Harry N. Holmes, Ruth E. Corbet:The Isolation of Crystalline Vitamin A.In:Journal of the American Chemical Society.Band59,Nr.10,Oktober 1937,S.2042–2047,doi:10.1021/ja01289a075(englisch).
- ↑Jozef F. Arens, David A. van Dorp:Synthesis of some compounds possessing vitamin A activity.In:Nature.Band157,16. Februar 1946,S.190,doi:10.1038/157190a0,PMID 21015124(englisch).
- ↑David A. van Dorp, Jozef F. Arens:Synthesis of vitamin A aldehyde.In:Nature.Band159,Nr.4058,9. August 1947,S.189,doi:10.1038/160189a0,PMID 20256189(englisch).
- ↑Otto Isleret al.:Synthese des Vitamin A.In:Helvetica Chimica Acta.Band30,Nr.6,15. Oktober 1947,S.1911–1927,doi:10.1002/hlca.19470300666,PMID 20272080.
- ↑abcdefghKlaus Pietrzik, Ines Golly, Dieter Loew:Handbuch Vitamine: Für Prophylaxe, Therapie und Beratung.1. Auflage. Urban&Fischer, Elsevier, München 2008,ISBN 978-3-437-55361-5,S.190–226.
- ↑abcUlrike Weber-Fina:Neue Vitamin-A-Referenzwerte.In:Deutsche Apotheker Zeitung.24. November 2020,abgerufen am 31. Januar 2022.
- ↑Dietrich Mebs:Gifttiere – Ein Handbuch für Biologen, Toxikologen, Ärzte und Apotheker.Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart 1992; Seite 128,ISBN 3-8047-1219-3.
- ↑BASF erweitert Vitamin-A-Anlage in LudwigshafenChemie.de vom 18. September 2018, abgerufen am 5. Februar 2020
- ↑Werner Reif, Hans Grassner:Die technische Vitamin‐A‐Synthese der BASF.In:Chemie Ingenieur Technik.Band45,Nr.10,1973,S.646–652b,doi:10.1002/cite.330450920.
- ↑abcdefghijScientific Opinion on Dietary Reference Values for vitamin A.(PDF) In:EFSA.5. März 2015,abgerufen am 4. Februar 2022(englisch).
- ↑abMasako Suzuki, Meika Tomita:Genetic Variations of Vitamin A-Absorption and Storage-Related Genes, and Their Potential Contribution to Vitamin A Deficiency Risks Among Different Ethnic Groups.In:Frontiers in Nutrition.Band9,2022,S.861619,doi:10.3389/fnut.2022.861619,PMID 35571879,PMC 9096837(freier Volltext) – (englisch).
- ↑abYvette Fierce et al.:In vitro and in vivo characterization of retinoid synthesis from beta-carotene.In:Archives of Biochemistry and Biophysics.Band472,Nr.2,15. April 2008,S.126–138,doi:10.1016/j.abb.2008.02.010,PMID 18295589,PMC 2587144(freier Volltext).
- ↑Peter Altmeyer, M. Bacharach-Buhles, N. Buhles, Neal H. Brockmeyer, M. Herde, M. Stucker:Springer Enzyklopädie Dermatologie, Allergologie, Umweltmedizin.Springer,ISBN 3-540-41361-8,S.165–166.
- ↑Guangwen Tang:Bioconversion of dietary provitamin A carotenoids to vitamin A in humans.In:The American Journal of Clinical Nutrition.Band91,Nr.5,Mai 2010,S.1468S–1473S,doi:10.3945/ajcn.2010.28674G,PMID 20200262,PMC 2854912(freier Volltext) – (englisch).
- ↑abcdefHöchstmengenvorschläge für Vitamin A in Lebensmitteln inklusive Nahrungsergänzungsmitteln.(PDF) BfR,abgerufen am 29. Januar 2022.
- ↑Florian J. Schweigert et al.:Cats absorb beta-carotene, but it is not converted to vitamin A.In:The Journal of Nutrition.Band132,6 Suppl 2, Juni 2002,S.1610S–2S,doi:10.1093/jn/132.6.1610s,PMID 12042471.
- ↑abKlaus Pietrzik, Ines Golly, Dieter Loew:Handbuch Vitamine: Für Prophylaxe, Therapie und Beratung.1. Auflage. Urban & Fischer, München 2007,ISBN 978-3-437-59162-4,S.210.
- ↑Micronutrient deficiencies, WHO, 2011.
- ↑Lamine Traoré et al.:[Strategies to control vitamin A deficiency].In:Sante (Montrouge, France).Band8,Nr.2,März 1998,S.158–162,PMID 9642744.
- ↑Measles.Weltgesundheitsorganisation,5. Dezember 2019,abgerufen am 5. Februar 2020(englisch).
- ↑Rene F. Najera:Vitamin A and Measles.In:History of Vaccines.The College of Physicians of Philadelphia, 12. März 2019,abgerufen am 4. November 2023(englisch).
- ↑Hugo De Groote et al.:Estimating consumer willingness to pay for food quality with experimental auctions: the case of yellow versus fortified maize meal in Kenya.In:Agricultural Economics.Band42,Nr.1,2011,S.1–16,doi:10.1111/j.1574-0862.2010.00466.x.
- ↑André. P. Geubel et al.:Liver damage caused by therapeutic vitamin A administration: estimate of dose-related toxicity in 41 cases.In:Gastroenterology.Band100,Nr.6,Juni 1991,S.1701–1709,doi:10.1016/0016-5085(91)90672-8,PMID 2019375.
- ↑Sabina Bastos Maia et al.:Vitamin A and Pregnancy: A Narrative Review.In:Nutrients.Band11,Nr.3,22. März 2019,doi:10.3390/nu11030681,PMID 30909386,PMC 6470929(freier Volltext).
- ↑Stefan Hartmann et al.:Exposure to retinyl esters, retinol, and retinoic acids in non-pregnant women following increasing single and repeated oral doses of vitamin A.In:Annals of Nutrition & Metabolism.Band49,Nr.3,Mai 2005,S.155–164,doi:10.1159/000086879,PMID 16006784.
- ↑Richard K. Miller et al.:Periconceptional vitamin A use: how much is teratogenic?In:Reproductive Toxicology (Elmsford, N.Y.).Band12,Nr.1,Januar 1998,S.75–88,doi:10.1016/s0890-6238(97)00102-0,PMID 9431575.
- ↑A. Walker et al.:A possible case of hypervitaminosis A in Homo erectus.In:Nature.Band296,Nr.5854,18. März 1982,S.248–250,doi:10.1038/296248a0,PMID 7038513.
- ↑Joseph C. Corbo:Vitamin A1/A2chromophore exchange: Its role in spectral tuning and visual plasticity.In:Developmental Biology.Band475,Juli 2021,S.145–155,doi:10.1016/j.ydbio.2021.03.002,PMID 33684435,PMC 8900494(freier Volltext) – (englisch).
- ↑Darwin Babino et al.:The Biochemical Basis of Vitamin A3 Production in Arthropod Vision.In:ACS chemical biology.Band11,Nr.4,15. April 2016,S.1049–1057,doi:10.1021/acschembio.5b00967,PMID 26811964,PMC 4841470(freier Volltext) – (englisch).