Γερμάνιο
| Γερμάνιο | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ιστορία | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ταυτότητα του στοιχείου | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Όνομα, σύμβολο | Γερμάνιο (Ge) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ατομικός αριθμός (Ζ) | 32 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κατηγορία | ημιμέταλλα | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ομάδα, περίοδος, τομέας |
14,4, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σχετική ατομική μάζα (Ar) |
72,63(1) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ηλεκτρονική διαμόρφωση |
[Ar]3d104s24p2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Αριθμός EINECS | 231-164-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Αριθμός CAS | 7440-56-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ατομικές ιδιότητες | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ατομική ακτίνα | 122 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ομοιοπολική ακτίνα | 122 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ακτίνα van der Waals | 211 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ηλεκτραρνητικότητα | 2,01 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κυριότεροι αριθμοί οξείδωσης |
+4, +2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ενέργειες ιονισμού | 1η:762,2 ΚJ/mol 2η:1537 ΚJ/mol 3η:3302 ΚJ/mol 4η:4411 ΚJ/mol[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Φυσικά χαρακτηριστικά | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κρυσταλλικό σύστημα | κυβικό | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κρυσταλλικό πλέγμα | ολοεδρικά κεντρωμένο | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σημείο τήξης | 938,25 °C (1720,85 °F) (1211,40 K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σημείο βρασμού | 2833 °C (5131 °F) (3106 K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Πυκνότητα | 5,323 g/cm³ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ενθαλπίατήξης | 36,9 ΚJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ενθαλπίαεξάτμισης | 334 ΚJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ειδικήθερμοχωρητικότητα | 23,222 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Μαγνητική συμπεριφορά | διαμαγνητικό[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ειδικήηλεκτρική αντίσταση |
0,6 Ω·m[3][Σημ. 1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ειδικήηλεκτρική αγωγιμότητα | 1,67 S/m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ειδικήθερμική αγωγιμότητα |
60,2 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σκληρότητα Mohs | 6,0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Μέτρο ελαστικότητας (Young's modulus) |
(27 °C) 103 GPa[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Μέτρο διάτμησης (Shear modulus) |
(27 °C) 41 GPa[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Μέτρο ελαστικότητας όγκου (Bulk modulus) |
(27 °C) 75 GPa[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Λόγος Poison | (27 °C) 0,26[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ταχύτητα του ήχου | 2420 m/s (εγκάρσια κύματα σε στερεό) 4580 m/s (διαμήκη κύματα σε στερεό)[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Επικινδυνότητα | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Φράσεις κινδύνου | 20, 22, 36, 37, 38 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Φράσεις ασφαλείας | 37, 39 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κίνδυνοι κατά NFPA 704 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Η κατάσταση αναφοράς είναι η πρότυπη κατάσταση (25°C, 1 Atm) εκτός αν σημειώνεται διαφορετικά | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Τογερμάνιο(λατινικάgermanium) είναι τοχημικό στοιχείομε σύμβολοGe,ατομικό αριθμό32καισχετική ατομική μάζα72,63(1).[6]Ανήκει στηνομάδα14(πρώην IVA) τουπεριοδικού πίνακα,στην 4ηπερίοδο και στον τομέα p. Έχειθερμοκρασία τήξης938,25°Cκαιθερμοκρασία βρασμού2833 °C. Στις «κανονικές συνθήκες περιβάλλοντος», δηλαδήθερμοκρασία25 °C και υπό πίεση 1atm,το (χημικά καθαρό) γερμάνιο είναι σπάνιο, σκληρό, λαμπερό, γκριζόλευκομεταλλοειδές,[Σημ. 2]χημικά παρόμοιο με τα στοιχείαπυρίτιοκαικασσίτερο,τα οποία είναι τα «γειτονικά» του στην ομάδα 14. Το γερμάνιο στη φύση αντιδρά και σχηματίζεισύμπλοκες ενώσειςμε τοοξυγόνο,γενικά όμως είναι πολύ δραστικό για να βρεθεί στη φύση σε ελεύθερη (στοιχειακή) κατάσταση. Το γερμάνιο είναι διεσπαρμένο στηλιθόσφαιρα,με περιεκτικότητα που κυμαίνεται μεταξύ 1,0ppmκαι 1,7 ppm, λίγο αφθονότερο από τομολυβδαίνιοκαι τοβολφράμιοκαι κάπως λιγότερο άφθονο από τοβηρύλλιοκαι τονκασσίτερο.Υπάρχει επίσης σε σπάνια ορυκτά όπως ογερμανίτης,οαργυροδίτης,ορενιερίτηςκ.ά..
Επειδή πολύ λίγαορυκτάστη Γη περιέχουν υψηλήσυγκέντρωσηγερμάνιου, το γερμάνιο ανακαλύφθηκε σχετικά αργά. Το1869οΝτμίτρι Μεντελέγιεφ(Dmitri Mendeleev) προέβλεψε την ύπαρξη και κάποιες από τις ιδιότητές του, με βάση τη θέση του στον Περιοδικό του Πίνακα, και το ονόμασε «υποπυρίτιο» (ekasilicon). Περίπου δυο δεκαετίες αργότερα, το1886,οΚλέμενς Γουίνκλερ(Clemens Winkler) ανακάλυψε το νέο στοιχείο στο ορυκτόαργυροδίτηςμαζί μεάργυροκαιθείο.Παρόλο που το στοιχείο θύμιζε κάπως τοαρσενικόκαι τοαντιμόνιο,από την αναλογία σύνθεσης των ενώσεών του, ο Γουίνκλερ συμφώνησε με το Μεντελέγιεφ ότι είναι συγγενικό με το πυρίτιο και το ονόμασε «γερμάνιο», σύμφωνα με το λατινικό όνομα της Γερμανίας, της πατρίδας του. Στις μέρες μας, το γερμάνιοεξορύσσεταικυρίως από τα κατάλοιπα τουσφαλερίτη,μετά την εξαγωγή τουψευδαργύρου,αλλά επίσης ανακτάται και από μεταλλεύματααργύρου,μολύβδουκαιχαλκού,καθώς και από την ιπτάμενη τέφρα. Περίπου το 1/3 του γερμανίου που χρησιμοποιείται παγκοσμίως προέρχεται απόανακύκλωση.Οι κυριότερες χώρες παραγωγής γερμανίου είναι οιΗΠΑ,ηΚίνα,τοΒέλγιο,οΚαναδάς,ηΙαπωνία,ηΓερμανία,ηΡωσία,ηΟυκρανία,ηΝαμίμπιακαι τοΚονγκό.
Χημικά, το στοιχειακό γερμάνιο είναι σταθερό στον αέρα έως και τους 400 °C, πάνω από τους οποίους αρχίζει ναοξειδώνεται.Δεν προσβάλλεται αισθητά από ανόργαναοξέα,όπως τουδροχλωρικό(HCl) ή τουδροφθορικό οξύ(HF), εκτός και αν είναι παρόν και κάποιος οξειδωτικός παράγων. Διαβρώνεται με αργό ρυθμό από το θερμό πυκνόθειικό οξύ(H2SO4) και ταχύτερα από τονιτρικό οξύ(HNO3) και από τοβασιλικό νερό.Διαλύεται εύκολα στο λιωμένονάτριο(Na) και στουδροξείδιο του καλίου(KOH), δίνοντας γερμανικά άλατα (γερμανικό νάτριο και γερμανικό κάλιο, αντίστοιχα) αλλά (διαλύεται επίσης) και σε λιωμένα νιτρικά και ανθρακικά άλατα. Σχηματίζει ενώσεις στις οποίες έχει αριθμό οξείδωσης κυρίως +4 όπως π.χ. GeO2,GeCl4,κ.ά..
Το γερμάνιο είναι το δεύτερο σε τεχνολογικό και εμπορικό ενδιαφέρον, μετά τοπυρίτιο,ημιαγώγιμουλικό. Το χημικά καθαρό στοιχείο άρχισε να αξιοποιείται ως ημιαγωγός πριν από 50 περίπου χρόνια, στα πρώταραντάρκαιτρανζίστορ,αλλά εκτοπίστηκε σταδιακά από το κατά πολύ φθηνότερο πυρίτιο. Σήμερα, ενώσεις του, όπως το GeO2,χρησιμοποιούνται ως συστατικά του γυαλιού, στις τηλεπικοινωνιακέςοπτικές ίνες,σε συσκευές υπερύθρων νυκτερινής όρασης, ωςκαταλύτεςπολυμερισμούγια το πλαστικότερεφθαλικό πολυαιθυλένιο(PET), καθώς και σεφωτοβολταϊκά.Μικρές ποσότητες γερμανίου χρησιμοποιούνται στη βιομηχανία φωσφορούχων υλικών, στημεταλλουργίακαι στηχημειοθεραπεία.
Το γερμάνιο σχηματίζει, επίσης, μεγάλο αριθμόοργανογερμανικές ενώσεις,όπως τοτετρααιθυλογερμανάνιο[(CH3CH2)4Ge], που είναι χρήσιμο στην οργανομεταλλική χημεία.
Το γερμάνιο δεν θεωρείται απαραίτητο χημικό στοιχείο για κανέναζωντανό οργανισμό.Κάποιες σύνθετες οργανογερμανικές ενώσεις ερευνούνται για πιθανή χρήση σεφαρμακευτικάπροϊόντα, αλλά τα σχετικά πειράματα ακόμη δεν έχουν αποδειχθεί επιτυχή. Όμοια με το πυρίτιο και τοαλουμίνιο(Al), οι φυσικές γερμανιούχες ενώσεις τείνουν να είναι αδιάλυτες στο νερό και έτσι έχουν πολύ μικρήτοξικότητααπό κατάπωση. Ωστόσο, συνθετικά διαλυτά γερμανιούχα άλατα είναινεφροτοξικά,και συνθετικές χημικά δραστικές γερμανιούχες ενώσεις με αλογόνα και υδρογόνο όπως τοτετραχλωρογερμάνιο(GeCl4), τογερμανάνιο(GeH4), αλλά και τοδιοξείδιο του γερμανίου(GeO2) είναι ερεθιστικές και τοξικές.
Στη φύση βρίσκεται με μορφή πέντε σταθερώνισοτόπων:70Ge,72Ge,73Ge,74Ge και76Ge. Απ' αυτά, το76Ge είναι τόσο πολύ μακρόβιο, έχειημιζωή1,78·1021χρόνια, που θεωρείται σταθερό.
Ιστορία
[Επεξεργασία|επεξεργασία κώδικα]
Το1864,οΆγγλοςχημικόςΤζων Νιούλαντς(John Alexander Reina Newlands,1837-1898) προέβλεψε την ύπαρξη του νέου (για τότε) στοιχείου στον «πίνακα των τριάδων», που είχε προτείνει[7].Σε μια επιστολή του προς τον εκδότη τωνΧημικών Νέωνστις30 Ιουλίου1864[8],ο Νιούλαντς πρότεινε ότι όπως υπήρχαν οι οριζόντιες τριάδες των χημικών στοιχείωνφωσφόρος(P) -αρσενικό(As) -αντιμόνιο(Sb) ήθείο(S) -σελήνιο(Se) -τελλούριο(Te) κ.τ.λ.. όπου το μεσαίο στοιχείο έχειατομικό βάρος(όπως ήταν γνωστό τότε) περίπου τομέσο όροτων ατομικών βαρών των δύο άλλων στοιχείων, έτσι και μεταξύ του πυριτίου (Si, με ατομικό βάρος περίπου 28) και του κασσιτέρου (Sn, με ατομικό βάρος περίπου 118), στην τριάδα (ΙΙΙ), έπρεπε να υπάρχει ένα στοιχείο με ατομικό βάρος περίπου το μέσο όρο, δηλαδή περίπου (118+28)/2 = 73. Η πρόβλεψη του Νιούλαντς, όμως, ξεχάστηκε, αλλά επτά (7) χρόνια αργότερα, το1871,οΡώσοςχημικόςΝτμίτρι Μεντελέγιεφ,στην προσπάθειά του να ολοκληρώσει τονΠεριοδικό Πίνακατων χημικών στοιχείων που είχε δημιουργήσει, προέβλεψε, μεταξύ άλλων άγνωστωνχημικών στοιχείων,και αυτό που θα κάλυπτε το κενό μεταξύ του πυριτίου και του κασσιτέρου στην ομάδα του άνθρακα.[9]Λόγω της θέσης του στον Περιοδικό Πίνακα, ο Μεντελέγιεφ ονόμασε το άγνωστο στοιχείοεκαπυρίτιο,με σύμβολοEs,και προέβλεψε ότι το ατομικό του βάρος θα ήταν περίπου 72.
Το Σεπτέμβριο του1885,ένα εργάτης τουορυχείουαργύρου στο Χίμμελσφουρστ, κοντά στο Φράιμπεργκ τηςΣαξωνίας,βρήκε, σε βάθος 460μέτρων,ένα ασυνήθιστο (νέο για τότε)ορυκτό,πλούσιο σε ασήμι, και το παρέδωσε στο διευθυντή του ορυχείου.[10]Εκείνος, το έστειλε στο φημισμένο ορυκτολόγο καικρυσταλλογράφοκαθηγητήΆλμπιν Βάισμπαχ(Albin Julius Weisbach,1833–1901) στοΠανεπιστήμιοΟρυκτολογίαςκαιΤεχνολογίαςτου Φράιμπεργκ, ο οποίος αναγνώρισε ότι επρόκειτο για νέο ορυκτό είδος και το ονόμασεαργυροδίτη.Στη συνέχεια, το έδωσε στο χημικόΙερώνυμο Ρίχτερ(Hieronymus Theodor Richter,1824–1898), που είχε ανακαλύψει μαζί με τον Ράιχ το1863το στοιχείοίνδιο(In), για μια προκαταρκτικήχημική ανάλυση.[11][12]Ο Ρίχτερ βρήκε ως κύρια συστατικά του ορυκτού το θειάφι (S) και το ασήμι (Ag), αλλά δήλωσε επίσης και την παρουσία μιας μικρής ποσότηταςυδραργύρου,γεγονός πολύ παράξενο, αφού αυτό το μέταλλο δεν είχε εντοπιστεί στα κοιτάσματα της περιοχής.[11]Ο Βάισμπαχ ζήτησε από τον Γερμανό συνάδελφό του Κλέμενς Βίνκλερ (Clemens Alexander Winkler,1838 – 1904), που εργαζόταν τότε στο Πανεπιστήμιο, να επιβεβαιώσει τα ευρήματα επαναλαμβάνοντας τη χημική ανάλυση του αργυροδίτη. Αυτός διαπίστωσε ότι περιείχε 73 έως 75 % άργυρο, 17 με 18 % θείο, πολύ μικρές ποσότητεςσιδήρου(Fe), ίχνηαρσενικού(As), ενώ έμενε απροσδιόριστο περίπου το 6 - 7 % του βάρους του δείγματος. Μετά από αρκετές εβδομάδες επίπονης αναζήτησης, ο Βίνκλερ πείστηκε ότι ο αργυροδίτης, του οποίου τον τύπο βρήκε ότι είναι Ag8GeS6,περιείχε ένα νέο στοιχείο, παρόμοιο με τοαντιμόνιο(Sb), στο οποίο έδωσε το όνομα «γερμάνιο». Ανακοίνωσε την ανακάλυψή του στις6 Φεβρουαρίου1886.[12]Πριν τη δημοσίευση, όμως, των αποτελεσμάτων του, ο Βίνκλερ είχε αποφασίσει να ονομάσει το νέο στοιχείο «ποσειδώνιο», επειδή το1846είχε προβλεφθεί, με μαθηματικό (θεωρητικό) τρόπο, η ύπαρξη του πλανήτηΠοσειδώνα,όπως είχε προβλεφθεί και η ύπαρξη του νέου χημικού στοιχείου πριν αυτό ανακαλυφθεί. Όμως, το όνομα «ποσειδώνιο» είχε ήδη δοθεί το1877,από το Γερμανό ορυκτολόγο Χέρμαν, σε ένα (νέο για τότε, αλλά δήθεν) χημικό στοιχείο,[13]που είχε βρει στο ορυκτόκολουμπίτη,και που τελικά αποδείχθηκε ότι ήταν (απλά)κράματανταλίου(Ta) -νιοβίου(Nb).[14]Έτσι, ο Βίνκλερ ονόμασε το στοιχείο «γερμάνιο» (από τη λατινική λέξηGermaniaγια τηΓερμανία), προς τιμή της πατρίδας του.[11]
Επειδή το νέο στοιχείο έδειξε κάποιες ομοιότητες με τα χημικά στοιχεία αντιμόνιο και αρσενικό, η σωστή θέση του στον περιοδικό πίνακα ήταν υπό περίσκεψη, δηλαδή μήπως έπρεπε να τοποθετηθεί ανάμεσα στο αντιμόνιο και στοβισμούθιο(Bi). Αλλά, ταυτόχρονα, οι ομοιότητές με την πρόβλεψη του Μεντελέγιεφ έδειχναν ότι το γερμάνιο είναι το προβλεπόμενοεκαπυρίτιο,δηλαδή ότι έπρεπε να τοποθετηθεί μεταξύ πυριτίου και κασσιτέρου.[15][16]Ο επιστημονικός κόσμος αμέσως άρχισε να ενδιαφέρεται για το νέο στοιχείο. Στις26 Φεβρουαρίου1886ο Μεντελέγιεφ ανακοίνωσε στο περιοδικόBerichte der deutschen Chemischen Gesellschaftμια λίστα με τις ιδιότητες που θα έπρεπε να έχει το νέο στοιχείο ώστε να ταιριάζει στη θέση ανάμεσα στο αντιμόνιο και το βισμούθιο. Αναλογιζόμενος, όμως, τις χημικές ιδιότητες των ενώσεων του νέου στοιχείου, σκέφτηκε ότι ήταν πιθανότερο το γερμάνιο να ήταν τοεκακάδμιο, δηλαδήένα στοιχείο μεταξύκαδμίουκαι υδραργύρου. Ταυτόχρονα, ο Γερμανός χημικόςΒίκτορ φον Ρίχτερ(Victor von Richter,1841–1891) από τοΜπρεσλάου,έγραψε στο Βίνκλερ ότι πίστευε πως το γερμάνιο ήταν τοεκαπυρίτιο,και μ' αυτή την άποψη συμφώνησε δυο μέρες αργότερα και ο Γερμανός χημικόςΤζούλιους Λόταρ Μέγιερ(Julius Lothar Meyer,1830 - 1895).[17]Στο μεταξύ, εξορύχτηκε νέα (μεγαλύτερη) ποσότητα, συγκεκριμένα 500kg,αργυροδίτη από τα ορυχεία της Σαξονίας, που βοήθησε την έρευνα των χημικών ιδιοτήτων του γερμανίου. Έτσι, το 1887, ο Βίνκλερ επιβεβαίωσε ότι οι ιδιότητες αντιστοιχούν στο εκαπυρίτιο του Μεντελέγιεφ.[18][15][19]Επίσης, προσδιόρισε το ατομικό βάρος του γερμανίου σε 72,32 amu, αναλύοντας καθαρότετραχλωρογερμάνιο(GeCl4), ενώ οΓάλλοςχημικόςΠωλ Εμίλ Λεκόκ ντε Μπουαμποντράν(Paul Émile Lecoq de Boisbaudran,1838–1912), που ανακάλυψε το στοιχείογάλλιο(Ga), προσδιόρισε το ατομικό βάρος του γερμανίου σε 72,3, με σύγκριση τωνφασματικών του γραμμώντου στοιχείου.[20]
Ο Βίνκλερ ήταν ικανός να παρασκευάσει αρκετές νέες (για τότε) ενώσεις του γερμανίου, που περιλάμβαναν τα φθορίδια, τα χλωρίδια και τα σουλφίδια του γερμανίου, το διοξείδιο του γερμανίου (GeO2) και τοτετραιθυλογερμανάνιο[Ge(C2H5)4], την πρώτη οργανογερμανική ένωση.[18]Οι φυσικές ιδιότητες αυτών των ενώσεων, που ανταποκρίνονταν στις προβλέψεις του Μεντελέγιεφ για τις αντίστοιχες ενώσεις του εκαπυριτίου, αποτέλεσαν μια σημαντική επιβεβαίωση της ιδέας του Μεντελέγιεφ για την περιοδικότητα των χημικών στοιχείων. Ιδού η σύγκριση μεταξύ των προβλέψεων, των πειραματικών δεδομένων του Βίνκλερ και τις αντίστοιχες σημερινές ιδιότητες του γερμανίου:[18]
| Ιδιότητα | Εκα-πυρίτιο (Μεντελέγιεφ, 1871) |
Γερμάνιο (Βίνκλερ, 1886) |
Γερμάνιο (Σήμερα) |
|---|---|---|---|
| Σχ. ατομική μάζα | 72 | 72,32 | 72,63 |
| Χρώμα | σκούρο γκρίζο | γκριζόλευκο | γκριζόλευκο |
| Πυκνότητα (g/cm³) | 5,5 | 5,47 | 5,323 |
| Ατομικός όγκος (cm³) | 13 | 13,22 | 13,57 |
| Ειδική θερμότητα (J/g.K) | 0,306 | 0,318 | 0,310 |
| Αριθμός οξείδωσης | 4 | 4 | ±4, +2 |
| Τύπος οξειδίου | EsO2 | GeO2 | GeO2 |
| Πυκν. οξειδ. (g/cm³) | 4,7 | 4,703 | 4,228 |
| Ιδιότητες | Κυρίως όξινες | Κυρίως όξινες | Κυρίως όξινες |
| Τύπος χλωριδίου | EsCl4 | GeCl4 | GeCl4 |
| Πυκν. χλωρ. (g/cm³) | 1,9 | 1,887 | 1,8443 |
| Σ.β. χλωρ.(°C) | 60-100 | 86 | 83,1 |
| Ένωση με C2H5- | Es(C2H5)4 | Ge(C2H5)4 | Ge(C2H5)4 |
| Πυκν. (g/cm³) | 0,96 | 0,99 | 0,991 |
| Σ.β.(°C) | 160 | 163 | 162,5 |
Για πάνω από 40 χρόνια μετά την ανακάλυψή του το γερμάνιο δεν είχε βρει καμιά σημαντική επιστημονική ή τεχνολογική εφαρμογή. Μάλιστα μέχρι τα τέλη της δεκαετίας του 1930, υπήρχε η πεποίθηση ότι ήταν μέταλλο με μικρήαγωγιμότητα,παρεξήγηση που διατηρείται ως ένα σημείο μέχρι σήμερα.[21]
Το 1923 ο Βρετανός φυσικοχημικόςΦράνσις Ουίλιαμ Άστον(Francis William Aston,1877 – 1945, Nobel Φυσικής 1922) ανακάλυψε τα τρία από τα πέντε σταθερά ισότοπα70Ge,72Ge,74Ge.
Το 1930 μηχανικοί της Αμερικάνικης εταιρείας Eagle-Picher διαχώρισαν για πρώτη φορά αναγκαστικά το γερμάνιο από την παραγωγή ψευδαργύρου και μολύβδου καθώς η παρουσία του εμπόδιζε την ηλεκτρόλυση του Zn στις μεταλλουργικές μεθόδους, ιδιαίτερα στην αναδυόμενη τότε αυτοκινητοβιομηχανία. Η ίδια εταιρεία μαζί με τη ΓερμανικήOtavi Minenξεκίνησαν στις αρχές της δεκαετίας του 1930 την πρώτη εμπορική παραγωγή γερμανίου αλλά η ζήτηση ήταν πολύ μικρή περιοριζόμενη στα πανεπιστήμια και στα κυβερνητικά εργαστήρια.[22]
ΟB' Παγκόσμιος Πόλεμοςυπήρξε η αφορμή για την ανάπτυξη της φυσικής των ημιαγωγών. Η αρχή έγινε το 1942 όταν οΚαρλ Λαρκ-Χόροβιτς(Karl Lark-Horovitz,1892 - 1958), πρόεδρος στο Τμήμα Φυσικής του Πανεπιστημίου Purdue, αποφάσισε να χρησιμοποιήσει στα ηλεκτρονικά εξαρτήματα των ραντάρ το γερμάνιο αναδεικνύοντας έτσι τα προτερήματα του νέου υλικού.[21][Σημ. 3]Το πρόβλημα όμως ήταν ότι οι δύο γνωστότερες πηγές Ge βρίσκονταν τότε στην εχθρική Γερμανία. Τελικά οι δυσκολίες ξεπεράστηκαν με την αξιοποίηση των αποβλήτων της κατεργασίας ψευδαργύρου στην Οκλαχόμα και την εξαγωγή απ' αυτά όλης της απαιτούμενης ποσότητας Ge.[10]

Πριν το1945παραγόταν σε χυτήρια μόνο μερικές εκατοντάδες κιλά γερμανίου κάθε χρόνο. Με την εφεύρεση του πρώτου transistor επαφής από πολυκρυσταλλικό γερμάνιο και την επίσημη παρουσίασή του από τους Αμερικανούς φυσικούςΤζον Μπαρντίν(John Bardeen,1908 – 1991, Nobel Φυσικής 1956, 1972),Ουόλτερ Μπρατέιν(Walter Houser Brattain,1902 – 1987, Nobel Φυσικής 1956) και Ουίλιαμ Σόκλι (William Bradford Shockley Jr.,1910 – 1989) στις 23 Δεκεμβρίου 1947, ξεκίνησε η "ηλεκτρονική επανάσταση" του γερμανίου που κράτησε δέκα περίπου χρόνια ενώ η ετήσια παγκόσμια παραγωγή έφθασε στους 40 τόνους. Ήδη όμως οι τεχνολογικές δυσκολίες αξιοποίησης του πυριτίου είχαν αρχίσει να ξεπερνιούνται. Το τέλος της εποχής του transistor γερμανίου επήλθε στις 12 Σεπτεμβρίου 1958 όταν ο Αμερικανός φυσικόςΤζακ Κλαιρ Κίλμπυ(Jack St. Clair Kilby,1923 – 2005, Nobel Φυσικής 2000) της εταιρείας Texas Instruments παρουσίασε τοολοκληρωμένο κύκλωμα(IC) γερμανίου ενώ δυο χρόνια αργότερα έκανε την εμφάνισή του το πρώτο transistor πυριτίου και ο ΑμερικανόςΡόμπερτ Νόις(Robert Norton Noyce,1927 – 1990) μαζί με τον ΕλβετόΖαν Αμεντέ Ορνί(Jean Amédée Hoerni,1924 - 1997) της εταιρείαςFairchild Semiconductorsπαρουσίασαν το πρώτο ολοκληρωμένο κύκλωμα από πυρίτιο.[21]
Το γερμάνιο δεν μπορούσε φυσικά να ανταγωνιστεί σε κόστος και διαθεσιμότητα το πυρίτιο και έτσι
άρχισε να αντικαθίσταται μαζικά απ' αυτό στα ηλεκτρονικά. Ξεκίνησε όμως η αξιοποίησή του σε άλλες εφαρμογές:[7]
- Το 1965 άρχισε η εκτενής χρήση του γερμανίου σε καταλύτες πολυμερισμού στην Ιαπωνία καθώς και οι κρύσταλλοι γερμανίου-γαλλίου σε ανιχνευτές ακτινοβολίας.
- Το 1972 κατοχυρώνεται η πρώτη πατέντα καταλύτη αναμόρφωσης πετρελαίου με γερμάνιο-λευκόχρυσο.
- Το 1975 ξεκινά η χρήση γερμανίου σε διόδους LED.
- Το 1978 άρχισε η χρήση του γερμανίου στις οπτικές ίνες.
Σήμερα, το γερμάνιο θεωρείται "μέταλλο στρατηγικής σημασίας" για πολλές χώρες προηγμένες τεχνολογικά ενώ έχουν κατασκευαστεί και εξελιγμένα διπολικά τρανζίστορ ετεροεπαφής πυριτίου-γερμανίου (SiGe) καθώς και νανοσωματίδια γερμανίου.[21]
Εμφανίσεις
[Επεξεργασία|επεξεργασία κώδικα]Το γερμάνιο δε βρίσκεται ελεύθερο στη φύση. Είναι σπάνιο χημικό στοιχείο, πολύ διασπαρμένο και το 55οαφθονότερο στηλιθόσφαιρα.Αναφέρονται διάφορες περιεκτικότητες του στοιχείου στο στερεό φλοιό της Γης: 1,4 ppm,[23]1,5 ppm,[24]1,6 ppm,[25]1,7ppm[26]και 1,8 ppm.[1]
Πυριγενή και μεταμορφωμένα πετρώματα.Στα περισσότερα πυριγενή και μεταμορφωμέναπετρώματακαθώς και σταορυκτάπου περιέχονται σ' αυτά, η πιο συνηθισμένη περιεκτικότητα γερμανίου είναι 1,5 ppm. Υπάρχει σχετικά μικρή διαφορά μεταξύ φεμικών, υπερμαφικών, ενδιάμεσων καιγρανιτικών πετρωμάτωντα οποία όλα περιέχουν Ge μεταξύ 0,9 ppm και 1,5 ppm.
Οι σχηματισμοίgreisen,σφαλερίτηκαιπηγματίτηπολλές φορές είναι πλούσιοι σε γερμάνιο. Ο σφαλερίτης μπορεί να περιέχει μέχρι και 1000 ppm.[27]Σε θειούχες αποθέσεις που σχηματίστηκαν από δραστηριότητα μικρή έως μέτρια θειούχων διαλυμάτων, το γερμάνιο συγκεντρώνεται στο σφαλερίτη σε ποσότητες μέχρι 3000 ppm, ενώ αν οι αποθέσεις δημιουργήθηκαν από διαλύματα με έντονη θειούχα δραστηριότητα, το Ge φτιάχνει τα δικά του σουλφίδια.[28]
Κάποια ορυκτά περιέχουν έως και αρκετές εκατοντάδες ppm γερμανίου: ο λευκόςμαρμαρυγίας63 ppm, ογρανάτης180 ppm και κυρίως τοτοπάζι,που αποτελεί και το βασικό ορυκτό που φιλοξενεί Ge στον πηγματίτη, 700 ppm.[29]
Ιζηματογενή πετρώματα.Τα επίπεδα γερμανίου σε κλαστικάιζηματογενή πετρώματαείναι συνήθως της τάξης του 1 έως 2 ppm. Τα ανθρακικά πετρώματα περιέχουν κατά μέσο όρο 0,2 ppm γερμάνιο ενώ αργιλικά πετρώματα καιάργιλοι2 ppm. Ο εβαπορίτης και ο καθαρόςασβεστόλιθοςωστόσο, έχουν πολύ χαμηλό περιεχόμενο σε Ge, συνήθως < 0,1 ppm[27].Ιζήματα πλούσια σε οργανική ύλη, όπως ο μαύροςσχιστόλιθος,συνήθως περιέχουν έως 3,3 ppm Ge.[29]
Κοιτάσματα και τέφρα άνθρακα.Η συσσώρευση γερμανίου σε κοιτάσματα άνθρακα, χούμου,τύρφηςακόμη καιπετρελαίου.[27]Τα κοιτάσματα άνθρακα περιέχουν κατά μέσο όρο 5 ppm Ge ενώ η περιεκτικότητά του σ' αυτά κυμαίνεται από 0,5 ppm έως 50 ppm.[27]Η μεγαλύτερη περιεκτικότητα σε γερμάνιο στην Ευρώπη, υπάρχει στον Ιταλικόλιγνίτη,6600 ppm.[29]Η τέφρα άνθρακα περιέχει κατά μέσο όρο 500 ppm Ge με εύρος διακύμανσης περιεκτικότητα 50 - 500 ppm[27]όμως πρόσφατες έρευνες έδειξαν ότι το γερμάνιο βρίσκεται στην τέφρα μονάδων παραγωγής φωταερίου (μίγμα CO, H2,CO2και H2O) με διάφορες μορφές διαλυτών σουλφιδίων και οξειδίων και η περιεκτικότητα σε Ge εξαρτιόταν από την προέλευση της στάχτης κυμαινόμενη πάντως μεταξύ 190 ppm και 320 ppm.[30]Η υψηλότερη συγκέντρωση που βρέθηκε ποτέ σε τέφρα ήταν 16000 ppm κοντά στην περιοχήHartleyτης βορειοανατολικής Αγγλίας. Τα κοιτάσματα άνθρακα κοντά στοXilinhaote,της Εσωτερικής Μογγολίας, περιέχουν περίπου 1600 τόνους γερμανίου.[31]
Άλλα περιβάλλοντα.Το γερμάνιο εμφανίζεται και σε οξειδωμένες ζώνες θειούχων κοιτασμάτων όπου συγκεντρώνεται σεοξείδια,υδροξείδιακαι υδροξυ-θειικά άλατα, σχηματίζοντας μερικές φορές τα δικά του ορυκτά. Επίσης ορισμένα οξείδια και υδροξείδια του σιδήρου και του μαγγανίου είναι ιδιαίτερα εμπλουτισμένα σε γερμάνιο, συμπεριλαμβανομένου τουγκαιτίτη(έως 3000 ppm) και τουαιματίτη(έως 5300 ppm). Επίσης σε κοιτάσματα οξειδίων του σιδήρου μπορεί να υποκαταστήσει το Fe στομαγνητίτησε διάφορα γεωλογικά περιβάλλοντα.[28]
Σε υπόγεια ύδατα, η μέση περιεκτικότητα του γερμανίου είναι περίπου 300 ppt, στα νερά ποταμών 50 ppt και στο θαλασσινό νερό 60 ppt.[7]
Η περιεκτικότητα των ανθρακούχων μετεωριτών σε γερμάνιο είναι περίπου 21 ppm.[32]
Ορυκτά του γερμανίου
[Επεξεργασία|επεξεργασία κώδικα]Παρόλο που έχουν περιγραφεί περίπου 30 σπάνια ορυκτά που περιέχουν γερμάνιο[33]από τα οποία τουλάχιστον στα δεκαέξι το γερμάνιο είναι το κύριο συστατικό[7],από κανένα δε εξάγεται γερμάνιο. Πολλά ορυκτά προέρχονται αποκλειστικά από δύο κοιτάσματα χαλκού στηνΑφρική· τοTsumebστηΝαμίμπιακαι τοKipushiστοΖαΐρ.Δύο μάλιστα από τα ορυκτά αυτά, ογερμανίτηςκαι ορενιερίτης,έχουν χαρακτηρισθεί ως διακριτά μεταλλεύματα γερμανίου και βρέθηκε ότι περιέχουν 5–10 % Ge στοTsumebκαι 6,3–7,7 % στοKipushi.[34]Το νεότερο ορυκτό με γερμάνιο που περιγράφηκε το 2006 ήταν οκαλβερτίτης,Cu5Ge0,5S4.[33]Τα ενδιαφέροντα ορυκτά για τη βιομηχανία είναι οαργυροδίτης(με τυπική περιεκτικότητα σε Ge 6-7 %), ο γερμανίτης (8,7 % Ge), ο ρενιερίτης (7,8 % Ge) και οκανφιελντίτης(1,8 % Ge).[35]
Οαργυροδίτης(Ag8GeS6) ήταν το πρώτο ορυκτό του γερμανίου που περιγράφηκε το 1886 από το Βάισμπαχ και σ' αυτό ο Βίνκλερ ανακάλυψε το γερμάνιο. Πήρε το όνομά του από την ελληνική λέξη "αργυρώδης" που σημαίνει "αυτός που περιέχει άργυρο" και συνήθως περιέχει προσμίξεις Fe, Sb, Sn.
Ογερμανίτης,Cu26Fe4Ge4S32,ήταν το επόμενο ορυκτό που περιγράφηκε για πρώτη φορά το 1922 και περιέχει ως προσμίξεις Ga, Zn, Mo, As, V.[36]
Ορενιερίτης,(Cu,Zn)11(Ge,As)2Fe4S16), ανακαλύφθηκε το 1948 πήρε το όνομά του από τον Armand Renier, Βέλγο γεωλόγο και Διευθυντή της Βελγικής Γεωλογικής Εταιρείας.[36]
Οκανφιελντίτηςείναι ένα σπάνιοσουλφίδιομε τύπο Ag8SnS6που ανακαλύφθηκε το 1893 και περιέχει συνήθως ποικίλες ποσότητες γερμανίου ως υποκατάστατο τουκασσιτέρουκαιτελλουρίουως υποκατάστατο τουθείου.Ανταποκρίνεται δηλ. στο γενικότερο τύπο Ag8(Sn,Ge)(S,Te)6.[36]
Εξαγωγή από τα μεταλλεύματα - Μεταλλουργία
[Επεξεργασία|επεξεργασία κώδικα]Το γερμάνιο δεν εξάγεται από κάποιο συγκεκριμένο ορυκτό. Το μεγαλύτερο μέρος του παράγεται ως παραπροϊόν της μεταλλουργίας κυρίως του ψευδαργύρου αλλά και του χαλκού και του μολύβδου, ενώ ένα σχετικά μικρό αλλά όχι αμελητέο τμήμα της παραγωγής προέρχεται από την τέφρα του άνθρακα (ιπτάμενες τέφρες,fly ashes) και τα κατάλοιπα βιομηχανιών φωταερίου. Η ανάκτηση του Ge στη βιομηχανία βασίζεται κυρίως σε υδρομεταλλουργικές διεργασίες οι οποίες αρκετές φορές έχουν υψηλό οικονομικό και περιβαλλοντικό κόστος. Πολλές από αυτές τις τεχνολογικές διαδικασίες περιλαμβάνουν την ανάκτηση του Ge με τη δημιουργία ενός διαλύματος που περιέχει το ημιμέταλλο από την έκπλυση με οξύ των πρώτων υλών η οποία στη συνέχεια ακολουθείται από την παραγωγή των τελικών προϊόντων γερμανίου.[34]Έχουν αναπτυχθεί επίσης πολλές συμβατικές τεχνικές για το διαχωρισμό του στοιχείου από άλλα χημικά στοιχεία που περιέχονται στα εκπλύματα. Μεταξύ των τεχνικών αυτών περιλαμβάνεται η καταβύθιση με ταννίνη, η απόσταξη του GeCl4,η επίπλευση, η προσρόφηση σε ενεργό άνθρακα, η καθίζηση, η εκχύλιση με διαλύτη και η ρόφηση σε ιοντοανταλλακτικές ρητίνες.[37]
Το καθαρό γερμάνιο που παράγεται από οποιαδήποτε πρώτη ύλη, καθαρίζεται μέχρι βαθμού 6Ν (99,9999 %) με πολλαπλές τήξεις ζώνης. Οι συνολικές προσμίξεις είναι συνήθως λιγότερες από 100 ppb, ενώ οι ηλεκτρικά ενεργές προσμίξεις δεν ξεπερνούν το 0,5 ppb. Για εξαιρετικά απαιτητικές χρήσεις, το γερμάνιο μπορεί να παραχθεί και με συνολικές προσμίξεις λιγότερες από 0,0003 ppb.[7]
Οι ράβδοι καθαρού Ge επενδύονται εξωτερικά με πολυαιθυλένιο, τοποθετούνται σε κουτιά για προστασία από εισαγωγή ανεπιθύμητης πρόσμιξης (επιμόλυνση) και θραύση κατά τη μεταφορά διότι το καθαρό γερμάνιο είναι εύθραυστο σαν το γυαλί. Το γερμάνιο για οπτικές εφαρμογές μορφοποιείται σε μεγάλους κόκκους, πολυκρυσταλλικές πλάκες ή "καλλιεργείται" σε πολυ- ή μονο-κρυστάλλους με τη μέθοδοCzochralski.Η διεργασία αυτή είναι μέθοδος ανάπτυξης μονο-κρυστάλλων ημιαγώγιμων στοιχείων (π.χ. Si, Ge, GaAs κ.ά.), ευγενών μετάλλων (π.χ. Pd, Pt, Ag, Au κ.ά.), αλάτων και συνθετικών πολύτιμων λίθων κατά την οποία ένας προσανατολισμένος κρύσταλλος- "σπόρος" βυθίζεται στο υγρό τήγμα του υλικού οπότε στη διεπαφή στερεού-υγρού αρχίζει να αναπτύσσεται ένας ενιαίος κρύσταλλος.[38]
Ανάκτηση από μεταλλεύματα ψευδαργύρου.Μετά την εξόρυξη, τη σύνθλιψη, το διαχωρισμό και τη συμπύκνωση του μεταλλεύματος ψευδάργυρου, το υλικό αποστέλλεται σε μία κάμινο με σκοπό να ανακτηθεί κυρίως ο ψευδάργυρος και το γερμάνιο να παραμείνει ως παραπροϊόν με τυπική περιεκτικότητα < 1 %.[22]Μετά τον εμπλουτισμό τα συμπυκνώματα είναι κυρίως σουλφίδια τα οποία μετατρέπονται στην κάμινο σε οξείδια παρουσία αέρα με αντιδράσεις στερεού-αερίου σε υψηλή θερμοκρασία, διαδικασία που είναι γνωστή ωςψήσιμο:
- GeS2+ 3O2→ GeO2+ 2SO2
Μέρος του γερμανίου καταλήγει στη σκόνη που παράγεται κατά τη διάρκεια αυτής της διαδικασίας, ενώ το υπόλοιπο μετατρέπεται σε γερμανικά ιόντα (GeO44-) που εκπλύνονται από κοινού με τον Zn με θειικό οξύ. Μετά την εξουδετέρωση, μόνο ο Zn παραμένει στο διάλυμα και το ίζημα περιέχει το γερμάνιο, διάφορα άλλα μέταλλα αλλά και κατάλοιπα Zn. Τα τελευταία ανάγονται με τη μέθοδο Waelz και το οξείδιο του Zn εκπλύνεται για δεύτερη φορά. Το GeO2τελικά παραλαμβάνεται ως ίζημα και μετατρέπεται με αέριο Cl2ή HCl σε GeCl4,το οποίο έχει χαμηλό σημείο βρασμού (83 °C) και μπορεί να απομακρυνθεί με απόσταξη:[39]
- GeO2+ 4HCl → GeCl4+ 2H2O
- GeO2+ 2Cl2→ GeCl4+ O2
Το GeCl4είτε υδρολύεται με απιονισμένο νερό προς οξείδιο ή καθαρίζεται με κλασματική απόσταξη σε δοχεία από γυαλί ή λιωμένο χαλαζία και στη συνέχεια υδρολύεται:[39]
- GeCl4+ 2H2Ο → GeO2+ 4HCl
Το GeO2που προκύπτει έχει τη μορφή λευκής κοκκώδους σκόνης και χρησιμοποιείται και για άμεση χρήση αλλά και ως ενδιάμεσο της παραγωγής καθαρού γερμανίου. Αν πρόκειται να διατεθεί άμεσα στο εμπόριο, συσκευάζεται σε φιάλες πολυαιθυλενίου.[7]
Καθαρό γερμάνιο κατάλληλο για διάφορες βιομηχανικές εφαρμογές, παράγεται με αναγωγή του οξειδίου με άνθρακα:[40]
- GeO2+ C → Ge + CO2
Αν πρόκειται όμως το Ge να χρησιμοποιηθεί σε οπτικές ή ημιαγώγιμες εφαρμογές, τότε το οξείδιο ανάγεται με Η2στους 760 °C:
- GeO2+ 2H2→ Ge + 2H2O
Ανάκτηση από την ιπτάμενη τέφρα.Τα τελευταία χρόνια έχουν αναπτυχθεί πολλές μέθοδοι εξαγωγής Ge από την ιπτάμενη τέφρα στην οποία, υπό κατάλληλες συνθήκες, το στοιχείο μπορεί να βρίσκεται σε περιεκτικότητα μέχρι και 10 φορές υψηλότερη από αυτήν στα κοιτάσματα άνθρακα. Οι διεργασίες ανάκτησης του Ge από την τέφρα των λιθανθράκων είναι παρόμοιες μ' αυτές που χρησιμοποιούνται για την ανάκτηση από τα μεταλλεύματα Zn: υδρομεταλλουργική διαδικασία βασισμένη σε έκπλυση με H2SO4 και NaOH και στη συνέχεια ανάκτηση του Ge από τα διαλύματα με επίπλευση ιόντων, απευθείας ανάκτηση με έκπλυση με οξύ από το λιγνίτη την ανάκαμψη της GE από την έκπλυση οξύ απευθείας από το λιγνίτη και επακόλουθη απόσταξη του GeCl4χωρίς διήθηση των εκχυλισμάτων, καταβύθιση με ταννίνη, ιοντοανταλλαγή κλπ..[34]Η πιο δημοφιλής μέθοδος εξαγωγής του γερμανίου από την τέφρα του άνθρακα είναι η χλωρίωση σε υψηλή θερμοκρασία κατά την οποία σχηματίζεται πτητικό GeCl4από θέρμανση στους 400 °C για 90 λεπτά μίγματος τέφρας και NΗ4Cl. Το χλωρίδιο απορροφάται στη συνέχεια από πυκνό HCl και μετά υδρολύεται προς GeO2με απόδοση πάνω από 80 %.[30]Στη συνέχεια από το GeO2ανακτάται το Ge όπως περιγράφηκε παραπάνω.
Παραγωγή - Οικονομικά στοιχεία
[Επεξεργασία|επεξεργασία κώδικα]Το 2009 και το πρώτο εννεάμηνο του 2010, η συνολική παγκόσμια παραγωγή γερμανίου ήταν ελαφρά μειωμένη σε σχέση με το 2008 και εκτιμήθηκε μεταξύ 100 και 120 τόνων συμπεριλαμβανομένου αυτού που ανακτήθηκε από συμπυκνώματα ψευδαργύρου, από ιπτάμενη τέφρα και από ανακυκλώσιμα υλικά[38].Οι κυριότερες χώρες παραγωγής ραφιναρισμένου γερμανίου για το 2010 ήταν κατά σειρά η Κίνα (περίπου 80 τόνοι), η Ρωσία (περίπου 5 τόνοι), οι Η.Π.Α. (περίπου 4,6 τόνοι), ενώ όλες οι άλλες χώρες παραγωγής δηλ. το Βέλγιο, ο Καναδάς, η Ιαπωνία, η Γερμανία, η Ουκρανία, η Ναμίμπια και το Κονγκό συνεισέφεραν περίπου 30 τόνους.[41]
Επειδή το γερμάνιο συνήθως ανακτάται ως παραπροϊόν, η τιμή και η διαθεσιμότητά του μακροπρόθεσμα αποτελούν αντικείμενο προσφοράς και ζήτησης και εξαρτώνται, εκτός από το ίδιο το γερμάνιο, και από το βασικό μέταλλο όπως είναι π.χ. ο ψευδάργυρος. Αυτό δεν συμβαίνει όμως βραχυπρόθεσμα διότι οι παραγωγοί και οι τελικοί χρήστες συχνά έχουν διαφορετικά αποθέματα του προϊόντος οπότε οι βραχυπρόθεσμες τιμές ελέγχονται κυρίως από τη ζήτηση.[22]
Η μέση τιμή του γερμανίου καθαρότητας 99,99 % (4Ν) τον Αύγουστο του 2011 στη Ευρωπαϊκή Ένωση ήταν περίπου 1630 δολάρια/Kg.[42]
Από το τέλος του Β' Παγκοσμίου Πολέμου μέχρι το 1979, οι τιμή του γερμανίου στις Η.Π.Α. δεν ξεπέρασε καμιά χρονιά τα 400 δολάρια/Kg. Από το 1981 μέχρι το 1994, η αυξημένη ζήτηση και η περιορισμένη προσφορά προκάλεσε μεγάλες αυξήσεις τόσο στην αγορά των Η.Π.Α. όσο στην παγκόσμια, οπότε υπήρξε μια κατακόρυφη άνοδος της τιμής το Ge που έφθασε κατά μέσο όρο στις Η.Π.Α. τα 1060 δολάρια/Kg. Η άνοδος της τιμής συνεχίστηκε και την περίοδο 1995 - 2000 με μέση τιμή 1535 δολάρια/Kg λόγω αξιοποίησης του στοιχείου σε εφαρμογές οπτικών ινών και υπέρυθρης ακτινοβολίας. Η τιμή σταθεροποιήθηκε την περίοδο 2001 - 2009 σε μέσο όρο περίπου 865 δολάρια/Kg[43]
Δευτερογενής παραγωγή - Ανακύκλωση.Σε παγκόσμιο επίπεδο, μεταξύ 25 % και 35 % του συνολικού γερμανίου που χρησιμοποιείται προέρχεται από ανακυκλωμένααπορρίμματα.[7]Το δευτερογενές γερμάνιο ανακτάται σε ποσοστό έως και 60 % από τα υπολείμματα της βιομηχανίας ηλεκτρονικών. Το γερμάνιο επίσης ανακτάται απόανακύκλωσηάχρηστων ηλεκτρονικών συσκευών αλλά αυτή η πηγή συνεισφέρει σε μικρό ποσοστό στη δευτερογενή παραγωγή λόγω των μικρών ποσοτήτων γερμανίου που ανακτώνται. Εντούτοις, το ανακυκλωμένο γερμάνιο από οπτικά συστήματα στρατιωτικών οχημάτων που αποσύρθηκαν ή από καλώδιαοπτικών ινών,έχει αυξηθεί κατά τη διάρκεια της τελευταίας δεκαετίας.[38]Η εισαγωγή νέων οδηγιών τηςΕυρωπαϊκής Ένωσηςσχετικά με τα απόβλητα ηλεκτρικού και ηλεκτρονικού εξοπλισμού αναμένεται να οδηγήσει σε μεγαλύτερες ανακτώμενες ποσότητες γερμανίου από τα υπολείμματα (θραύσματα) της κατεργασίας του υλικού από τις βιομηχανίες.[44]
Φυσικά χαρακτηριστικά
[Επεξεργασία|επεξεργασία κώδικα]
Το γερμάνιο είναι λαμπερό, γκριζόλευκο, σκληρό (6,0 στησκληρομετρική κλίμακα Mohs), εύθραυστο μεταλλοειδές. Έχει πυκνότητα 5,3234 g/cm³ στη στερεά κατάσταση και 5,500 g/cm³ σε υγρή και είναι διαμαγνητικό στοιχείο με μαγνητική επιδεκτικότητα χm= -11,6×10-6cm³/mol.[2]
Υπάρχουν τέσσερις αλλοτροπικές μορφές γερμανίου, η α-, η β-, η γ- και η δ-μορφή. Τα άτομα στον κρύσταλλο α-Ge, που είναι η μορφή σε κανονική θερμοκρασία και πίεση, σχηματίζουν ομοιοπολικούς δεσμούς (υβριδισμός sp3) και κρυσταλλώνονται στη δομή του αδάμαντος που αποτελείται από ένα ενδοκεντρωμένο κυβικό πλέγμα (fcc) με βάση αποτελούμενη από δύο ίδια άτομα. Στη δομή αυτή κάθε άτομο του πλέγματος περιβάλλεται από τέσσερις πρώτους γείτονες που σχηματίζουν ένα κανονικό τετράεδρο[45]με παράμετρο κυψελίδας α = 0,56579060 nm στους 25 °C.[5]Το β-Ge, που κρυσταλλώνεται στο τετραγωνικό σύστημα, και το δ-Ge, που κρυσταλλώνεται στο κυβικό, είναι σταθερά σε πιέσεις μεγαλύτερες από 12 GPa (118431 atm). Η τετραγωνική γ-μορφή αποσυμπιέζεται προς β-Ge.[5]
Είναιενδογενής ημιαγωγόςέχει δηλ. ημιαγώγιμες ιδιότητες και σε καθαρή κατάσταση, χωρίς προσμίξεις. Μπορεί όμως να μετατραπεί σεημιαγωγό τύπου nαν στο κρυσταλλικό του πλέγμα προστεθεί κάποιο πεντασθενές στοιχείο[3]όπως As, Sb κ.ά. ή σεημιαγωγό τύπου pαν εισαχθεί τρισθενές στοιχείο όπως Ga, B κ.ά..
Έχει υψηλότερη ηλεκτρική αγωγιμότητα και κατά συνέπεια μικρότερη ηλεκτρική αντίσταση από το πυρίτιο σε θερμοκρασία δωματίου, αλλά σημαντικά μικρότερο ενεργειακό χάσµα ζώνης (band gap) απ' αυτό, Εg= 0,663 eV στους 27 °C ενώ το Si έχει Εg= 1,12 eV (και το GaAs Εg= 1,43 eV). Έχει επίσης μικρότερα σημεία τήξης και βρασμού από το Si, ενώ παρατηρείται η ασυνήθιστη ιδιότητα να αυξάνεται ο όγκος του με την ψύξη, όπως το νερό. Τέσσερα άλλα στοιχεία έχουν αυτή την ιδιότητα: το πυρίτιο, το βισμούθιο, το αντιμόνιο και το γάλλιο.[46]
Το γερμάνιο είναι διαφανές στην εγγύς υπέρυθρη ακτινοβολία σε περιοχή μηκών κύματος από 1.800 έως 23.000 nm. Έχει υψηλό δείκτη διάθλασης για το IR, 4,0026 στα 11.000 nm, σε συνδυασμό με χαμηλή χρωματική διασπορά δηλ. διακύμανση του δείκτη διάθλασης με το μήκος κύματος. Το γυαλί από GeO2έχει επίσης ένα υψηλό δείκτη διάθλασης και χαμηλή διασπορά.[7]
Το γερμάνιο ως ημιαγωγός
[Επεξεργασία|επεξεργασία κώδικα]Σύμφωνα με τις κλασσικές απόψεις, οι ημιαγωγοί (semiconductors) αποτελούν μια κατηγορία στερεών σωμάτων που χαρακτηρίζονται από μικρό αριθμό ελεύθερων ηλεκτρονίων σε αντίθεση µε τα μέταλλα που παρουσιάζουν μεγάλο πλήθος ελεύθερων ηλεκτρονίων και τους μονωτές (insulators) που διαθέτουν ελάχιστα ελεύθερα ηλεκτρόνια. Στην κατηγορία των ημιαγωγών ανήκει γενικά κάθε υλικό που επιτρέπει να περνά το ηλεκτρικό φορτίο από μέσα του με κάποιες προϋποθέσεις, όπως είναι αύξηση της θερμοκρασίας ή η πρόσπτωση φωτός.

Οι ημιαγωγοί έχουν τιμές ειδικής αντίστασης, μεταξύ ενός αγωγού και ενός μονωτή. Η αγωγιμότητά τους κυμαίνεται από 10-6έως 104Ω-1·m-1και είναι μικρότερη της αγωγιμότητας των μετάλλων και μεγαλύτερη των μονωτών.[47]Το εξαιρετικά καθαρό γερμάνιο, απαλλαγμένο από όλες τις προσμίξεις, έχει ειδική ηλεκτρική αγωγιμότητα 0,02 Ω-1·cm-1.[46]
Σήμερα, οι ιδιότητες των ημιαγωγών ερμηνεύονται με βάση την κβαντομηχανική και για τη διάκριση μεταξύ μετάλλων, ημιαγωγών και μονωτών χρησιμοποιείται ακριβέστερο κριτήριο, η τιμή του ενεργειακού χάσματος. Κάθε ομάδα χωριστών ενεργειακών σταθμών των ελεύθερων ηλεκτρονίων στη μάζα ενός υλικού ονομάζεται ενεργειακή ζώνη. Οι ζώνες διαχωρίζονται μεταξύ τους από ενεργειακά χάσματα, δηλαδή απαγορευμένες τιμές ενέργειες στις οποίες δεν μπορούν να υπάρξουν ελεύθερα ηλεκτρόνια. Ως ενέργεια χάσματος, Εg(energyήband gap) ορίζεται η ενεργειακή απόσταση, μετρημένη συνήθως σε eV, των γεμάτων από τις άδειες επιτρεπτές ηλεκτρονιακές στάθμες. Η ταινία με τις γεμάτες στάθμες, που είναι κατειλημμένη από τα ηλεκτρόνια σθένους, ονομάζεταιζώνη σθένους(valence band) ενώ η κενή ταινία με τις επιτρεπτές ηλεκτρονικές στάθμες ονομάζεταιζώνη αγωγιμότητας(conduction band).[45]
Το μηδέν στην κλίμακα των ενεργειών ορίζεται συνήθως στην κορυφή της ταινίας σθένους, όπως φαίνεται στο σχήμα των ενεργειακών ζωνών.
| T (°C) | Εg(eV) |
|---|---|
| –73 | 0,700 |
| 25 | 0,664 |
| 27 | 0,663 |
| 50 | 0,654 |
| 100 | 0,634 |
| 300 | 0,550 |
Στους αγωγούς, με σχεδόν μηδενικό ενεργειακό χάσμα, είναι εύκολη η μεταπήδηση των ηλεκτρονίων από τη ζώνη σθένους στη ζώνη αγωγιμότητας λόγω της επίδρασης εξωτερικού ηλεκτρικού πεδίου ενώ στους μονωτές είναι σχεδόν αδύνατη η μεταπήδηση αυτή λόγω υψηλών τιμών του Eg,περίπου 5 eV.[48]Αν και η διάκριση μεταξύ ημιαγωγών και μονωτών δεν είναι αυστηρή, μπορούμε να πούμε ότι οι ημιαγωγοί έχουν Eg≤ 2eV.[45]Το ενεργειακό χάσμα στους ημιαγωγούς εξαρτάται από τη θερμοκρασία. Όταν αυτή αυξάνεται το χάσμα μικραίνει. Στο διπλανό πίνακα φαίνονται οι Egτου γερμανίου σε ορισμένες θερμοκρασίες που προέκυψαν από τη σχέση Eg= 0,742 - 4,8·10-4·T2/(T+235) όπου Τ η θερμοκρασία σε βαθμούς Κ του ενεργειακού χάσματος[4].
Υπάρχουν διαφόρων ειδών ημιαγωγοί ανάλογα με τη σύστασή τους: Στοιχειακοί (Si, Ge), δυαδικές ενώσεις (π.χ. GaAs, InP, AlAs κλπ.), τριαδικά κράματα (π.χ. AlxGa1-xAs, GaxIn1-xP κλπ.), τετραδικά κράματα (π.χ. GaxIn1-xAsyP1-yκλπ.) και ημιαγωγοί ευρέως χάσματος (π.χ. ZnSe, GaN, InN κλπ.).[45]Επίσης, ανάλογα με την ύπαρξη ή μη προσμίξεων, οι ημιαγωγοί ταξινομούνται σε ενδογενείς (intrinsic semiconductors) όπως το Ge και σε ημιαγωγούς προσμίξεων ή εξωγενείς (extrinsic semiconductors). Οι τελευταίοι διακρίνονται σε αγωγούς τύπου p και τύπου n και μπορούν να προκύψουν από τους ενδογενείς με προγραμματισμένη προσθήκη προσμίξεων που ονομάζεται εμπλουτισμός ή ντοπάρισμα (doping). Αν ενωθεί ένας ημιαγωγός n-τύπου με έναν p-τύπου, η διαχωριστική τους επιφάνεια ονομάζεταιεπαφή p-n.Ταtransistorsείναι επαφές n-p-n ή p-n-p.
Ενδογενείς ημιαγωγοί.Σε έναν κρύσταλλο από καθαρό γερμανίου το κάθε άτομο, έχει τέσσερα εξωτερικά ηλεκτρόνια ( 4s24p2) που το καθένα συμμετέχει σε ομοιοπολικό δεσμό µε ένα άλλο ηλεκτρόνιο κάποιου γειτονικού ατόµου με αποτέλεσμα την ανυπαρξία αγωγιμότητας στον κρύσταλλο. Μπορεί όμως εξαιτίας κάποιου εξωτερικού ερεθίσματος (θέρμανση, ακτινοβόληση κλπ.) να προσπέσει ενέργεια σε κάποιο από τα δεσμευμένα τα ηλεκτρόνια με αποτέλεσμα να διασπαστεί ο αντίστοιχος δεσμός, να ελευθερωθεί το ηλεκτρόνιο και ν' αρχίσει να κινείται άτακτα μέσα στη μάζα του κρυστάλλου. Η κενή θέση που δημιουργήθηκε µε αυτό τον τρόπο ονομάζεται οπή (hole) και συμβολίζεται μεp.[48]Η οπή είναι στην πραγματικότητα μια θετική ανωμαλία στην ουδέτερη δομή του πλέγματος και συμπεριφέρεται σαν θετικό φορτίο. Η οπή βέβαια μπορεί να συμπληρωθεί εύκολα από ένα γειτονικό ηλεκτρόνιο γιατί τα ηλεκτρόνια ταλαντεύονται γύρω από τη θέση ισορροπίας τους κι ένα από αυτά μπορεί να εγκατασταθεί στη θέση της οπής συμπληρώνοντας τον ατελή δεσμό. Τότε βέβαια μια άλλη οπή θα εμφανισθεί στη προηγούμενη θέση και είναι σαν να μετακινήθηκε η αρχική οπή. Όπως είναι φανερό λοιπόν μέσα στον κρύσταλλο ενός ενδογενούς ημιαγωγού θα συνυπάρχουν δυο ειδών ισάριθμα σωματίδια με αντίθετο φορτίο: τα ελεύθερα ηλεκτρόνια και οι οπές. Αυτά μπορούν να μετακινηθούν µε την επίδραση οποιουδήποτε εξωτερικού ηλεκτρικού πεδίου, συµβάλλοντας έτσι και τα δυο στην ηλεκτρική αγωγιμότητα του κρυστάλλου. Επειδή στον ημιαγωγό αυτό, οι φορείς δημιουργήθηκαν από µόνοι τους μέσα στον ίδιο κρύσταλλο τον ονομάζουμεενδογενή ημιαγωγό.Η συγκέντρωση οπών ή ηλεκτρονίων στον ενδογενή ημιαγωγό ονομάζεταιενδογενής συγκέντρωση(intrinsic carrier concentration), ni,και για το γερμάνιο στους 27 °C είναι[5]2,33×1013οπές(ή ηλεκτρόνια)/cm³ ενώ για το πυρίτιο είναι 1,02×1010οπές(ή ηλεκτρόνια)/cm³.
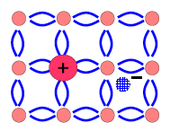
Ημιαγωγοί τύπου n.Αν σε κρύσταλλο καθαρού γερμανίου προστεθεί μικρή ποσότητα ενός πεντασθενούς στοιχείου όπως π.χ. αρσενικό[47](με δομή εξωτερικής στιβάδας 4s24p3), αντιμόνιο (5s25p3) κ.ά., τότε από τα πέντε ηλεκτρόνια σθένους του ατόμου πρόσμιξης τα μεν τέσσερα θα συμμετέχουν σε δεσμούς µε γειτονικά άτομα γερμανίου, ενώ το πέμπτο ηλεκτρόνιο θα παραμείνει αδέσμευτο. Αυτό το ηλεκτρόνιο, µε ελάχιστη ενέργεια μπορεί να αποσπασθεί αυξάνοντας έτσι τον αριθμό των ελεύθερων ηλεκτρονίων που μπορούν να δημιουργηθούν µε την ενδογενή διαδικασία και καθιστώντας τα περισσότερα από τις οπές[48].Τέτοιος ημιαγωγός ονομάζεταιημιαγωγός n-τύπουδιότι τα αρνητικά (negative) φορτία είναι περισσότερα από τα θετικά (οπές). Το στοιχείο πρόσμιξης που δίνει στον κρύσταλλο ελεύθερα ηλεκτρόνια λέγεταιδότης.Τα ελεύθερα ηλεκτρόνια που είναι περισσότερα χαρακτηρίζονται ωςφορείς πλειονότητας,ενώ οι λιγότερες οπέςφορείς μειονότητας.
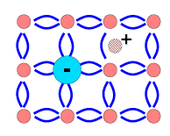
Ημιαγωγοί τύπου p.Αν στον κρύσταλλο γερμανίου εισαχθεί τρισθενές στοιχείο όπως π.χ. γάλλιο[47](με δομή στιβάδας σθένους 4s24p1) ή βόριο (2s22p1), τότε τα τρία εξωτερικά ηλεκτρόνια των ατόµων πρόσμιξης συμμετέχουν σε δεσμούς μαζί µε ηλεκτρόνια από γειτονικά άτομα ενώ ταυτόχρονα η έλλειψη τέταρτου ηλεκτρονίου δημιουργεί μια οπή στη θέση αυτή[48].Με τον τρόπο αυτό δημιουργούνται τόσες οπές, όσα και τα άτομα πρόσμιξης. Το στοιχείο πρόσμιξης σ' αυτή την περίπτωση λέγεταιαποδέκτης.Η αγωγιμότητα των ημιαγωγών αυτών οφείλεται κυρίως στις οπές οι οποίες συμπεριφέρονται σα να φέρουν θετικό (positive) φορτίο. Έτσι, ο ημιαγωγός χαρακτηρίζεταιημιαγωγός p-τύπου.Επειδή εδώ οι οπές είναι πολύ περισσότερες χαρακτηρίζονται ωςφορείς πλειονότηταςκαι τα ελεύθερα ηλεκτρόνιαφορείς μειονότητας.
Χημικά χαρακτηριστικά
[Επεξεργασία|επεξεργασία κώδικα]Ηλεκτρονιακή δόμηση
[Επεξεργασία|επεξεργασία κώδικα]| Ζ | Χημικό στοιχείο | Ηλεκτρόνια ανά στιβάδα |
|---|---|---|
| 6 | Άνθρακας | 2, 4 |
| 14 | Πυρίτιο | 2, 8, 4 |
| 32 | Γερμάνιο | 2, 8, 18, 4 |
| 50 | Κασσίτερος | 2, 8, 18, 18, 4 |
| 82 | Μόλυβδος | 2, 8, 18, 32, 18, 4 |
| 114 | Φλερόβιο | 2, 8, 18, 32, 32, 18, 4 |

Το γερμάνιο ανήκει στην 14η ομάδα (παλιότερος συμβολισμός IVΑ) του περιοδικού πίνακα και στον τομέα p, δηλαδή τα εξωτερικά του ηλεκτρόνια ανήκουν σε p-τροχιακό. Τα στοιχεία του τομέα p παρουσιάζουν μεταξύ τους μεγάλες διαφορές στις φυσικοχημικές ιδιότητες, διότι είναι ο μόνος τομέας που περιέχει μέταλλα, αμέταλλα και ευγενή αέρια. Ανήκει επίσης και στα λεγόμενα πτωχά μέταλλα (poor metals), χημικός όρος που δεν είναι αναγνωρισμένος από την IUPAC. Αυτά είναι 14 στοιχεία του τομέα-p που δημιουργούν ένα τρίγωνο δεξιά των στοιχείων μετάπτωσης στον περιοδικό πίνακα και είναι τοαργίλιο,τοίνδιο,τογάλλιο,τοθάλλιο,το γερμάνιο, οκασσίτερος,ομόλυβδος,τοαντιμόνιο,τοβισμούθιο,τοπολώνιοκαι τα στοιχεία 113,φλερόβιο,115 καιλιβερμόριο.Είναι ηλεκτραρνητικότερα των μεταβατικών μετάλλων, πιο μαλακά απ' αυτά και έχουν θερμοκρασίες τήξης και βρασμού γενικά χαμηλότερες.[49]
Τοφαινόμενο αδρανούς ζεύγους,όρος που προτάθηκε για πρώτη φορά το 1927 από τον Άγγλο θεωρητικό χημικό Νέβιλ Σίντγκουικ (Nevil Vincent Sidgwick,1873 - 1952), αν και υπάρχει, δεν είναι τόσο έντονο στο γερμάνιο όσο στο μόλυβδο που βρίσκεται δυο θέσεις πιο κάτω στην ίδια ομάδα του περιοδικού πίνακα. Στο Ge, τα 2 ηλεκτρόνια του τροχιακού 4s δε δημιουργούν τόσο έντονη σχετικιστική συστολή οπότε τα 2 ηλεκτρόνια του τροχιακού 4p να μην είναι τόσο προστατευμένα με αποτέλεσμα να ιονίζονται σχετικά εύκολα μαζί με τα 4s ηλεκτρόνια. Αυτό έχει ως συνέπεια ο κύριος αριθμός οξείδωσης του Ge να είναι ο +4 και οι ενώσεις του Ge(II) να μην είναι τόσο σταθερές όσο του Ge(IV).[50]
Χημικές αντιδράσεις
[Επεξεργασία|επεξεργασία κώδικα]Οι χημικές ιδιότητες του γερμανίου βρίσκονται μεταξύ των αμετάλλων C και Si και των μετάλλων Sn και Pb[51].Οι ενέργειες ιονισμού (σε KJ/mol) των σταδιακών μετατροπών του γερμανίου σε ιόντα από Ge+έως Ge10+[52]καθώς και ταδυναμικάημιαντιδράσεων αναγωγής διαφόρων ενώσεων και ιόντων του Ge[53],βρίσκονται στους "κρυμμένους" πίνακες που ακολουθούν:
| Ενέργειες ιονισμού και ημιαντιδράσεις αναγωγής ενώσεων του γερμανίου | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Αντιδράσεις με Ο2και Η2Ο.Το γερμάνιο είναι αρκετά σταθερό στον αέρα μέχρι τους 400 °C οπότε και αρχίζει αργά η οξείδωσή του με θέρμανση σε κόκκινη φλόγα από το ατμοσφαιρικό Ο2η οποία γίνεται πιο αισθητή πάνω από τους 600 °C[52].Ταυτόχρονα εκλύεται και λευκός καπνός:
- Ge + O2→ GeO2(s)
Ανάλογα με τη θερμοκρασία, τη στοιχειομετρία της αντίδρασης και άλλες συνθήκες, μπορεί το προϊόν να είναι GeO[54]:
- 2Ge + O2→ 2GeO(s)
| Μήκη δεσμών (pm) και | ||||||||||||
| Δεσμός | Μήκος δεσμού | Ενέργεια | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ge—Η | 153 | 288 | ||||||||||
| Ge—C | 195 | 237 | ||||||||||
| Ge—N | 257 | |||||||||||
| Ge—O | 363 | |||||||||||
| Ge—F | 168 | 464 | ||||||||||
| Ge—Cl | 210 | 340 | ||||||||||
| Ge—Ge | 241 | 163 | ||||||||||
| Ge—Br | 230 | 276 | ||||||||||
| Ge—I | 212 | |||||||||||
Το ερυθροπυρωμένο γερμάνιο αποσυνθέτει τους υδρατμούς:[56]
- Ge + H2Ο → GeO2+ H2
Αντιδράσεις με οξέα και βάσεις.Σε κανονικές συνθήκες, το γερμάνιο δεν επηρεάζεται από πυκνά διαλύματα υδροχλωρικού (HCl) καιυδροφθορικού οξέος(HF) ούτε και υδροξειδίου του νατρίου (NaOΗ) περιεκτικότητας 50 %[57]ακόμα και στη θερμοκρασία βρασμού τους εκτός κι αν είναι παρών κάποιος οξειδωτικός παράγων π.χ. υπεροξείδιο του υδρογόνου (Η2Ο2) το οποίο σε περιεκτικότητα 3 % διαλύει το γερμάνιο[57]ή υποχλωριώδες νάτριο (NaOCl).[58]Υπό ειδικές συνθήκες (θέρμανση στους 225 °C για 16 ώρες υπό πίεση) το Ge αντιδρά με το HF και παράγεται GeF2:[59]
- Ge + 2HF → GeF2+ H2
Όταν άνυδρο HCl διαβιβαστεί πάνω από αργά θερμαινόμενη σκόνη γερμανίου στους 480-500 °C προκύπτει μίγμα τριμεθυλογερμάνιου, HGeCl3,σε ποσοστό 30 % και GeCl4σε ποσοστό 70 %.[60]
Το Ge αντιδρά με το νιτρικό οξύ (HNO3) σε όλες τις θερμοκρασίες οπότε προκύπτει GeO2ενώ εκλύεται αέριο ΝΟ:[51]
- 3Ge + 4HNO3→ 3GeO2+ 4NO + H2Ο
Αντιδρά αργά με το θερμό H2SO4οπότε εκλύεται διοξείδιο του θείου:
- Ge + H2SO4→ GeO2+ SO2+ H2
όχι όμως με το ψυχρό θειικό οξύ. Αντιδρά άμεσα με μίγμα HNO3+HF. Επίσης, αντιδρά με λιωμένα υδροξείδια των αλκαλίων οπότε και ελευθερώνεται αέριο Η2ενώ αντιδρά αργά με βασιλικό νερό.[22]Υπό την επίδραση H2S παράγεται GeS2:
- Ge + 2H2S → GeS2+ 2H2
Άλλες αντιδράσεις.Το γερμάνιο αντιδρά με GeCl4στους 350-430 °C υπό χαμηλή πίεση και με GeF4στους 150 °C δίνοντας GeCl2και GeF2αντίστοιχα:[59]
- Ge + GeCl4→ 2GeCl2
- Ge + GeF4→ 2GeF2
Η αντίδραση S και Ge δίνει, ανάλογα με τις συνθήκες, GeS2ή GeS:[54]
- Ge + 2S → GeS2
- Ge + S → GeS
Το γερμάνιο εκτοπίζει τον άργυρο από τα διαλύματα του όχι όμως το χαλκό, τον υδράργυρο, τον κασσίτερο, το αντιμόνιο και το βισμούθιο.[57] Το τριμεθυλοσιλάνιο αντιδρά με άτομα Ge:[60]
- Ge + 4Me3SiH → Me6Si2+ H2+ (Me3Si)2GeH2
Ανίχνευση γερμανίου με φασματοσκοπικές μεθόδους
[Επεξεργασία|επεξεργασία κώδικα]Κατά την ανίχνευση του γερμανίου με φλογοφασματοσκοπία εκπομπής (flame emission spectroscopy, FES) ή με φασματοσκοπία ατομικής εκπομπής (atomic absorption spectroscopy, AAS), η πιο ικανοποιητική γραμμή είναι στα 265,12 nm. Και για τις δύο μεθόδους χρησιμοποιείται φλόγα υποξειδίου του αζώτου (N2O)-ακετυλενίου (C2H2) ελαφρώς πλούσια σε καύσιμο με καυστήρα μακράς διαδρομής, για να διαχωρίσει ένα σταθερό GeO. Πολλά κατιόντα ελαττώνουν την απορρόφηση του Ge χωρίς όμως η ελάττωση αυτή να υπερβαίνει το 10 % της συνιστώμενης φλόγας.[53]Στη φασματοσκοπία ατομικής εκπομπής (atomic absorption spectroscopy, AAS), το όριο ανίχνευσης[Σημ. 4]του γερμανίου σε υδατικό διάλυμα είναι 300 μg/L.[61]
Ισότοπα
[Επεξεργασία|επεξεργασία κώδικα]Έχουν αναφερθεί συνολικά 32ισότοπατου γερμανίου[62]από τα οποία πέντε είναι φυσικά:70Ge,72Ge,73Ge,74Ge και76Ge. Απ' αυτά το76Ge χαρακτηρίζεται ως εξόχως μακρόβιοραδιοϊσότοπο,διασπώμενο με διπλήβ—-διάσπασηκαι έχειχρόνο ημιζωής1,582×1021χρόνια.[23]Το74Ge είναι το πιο κοινό ισότοπο με ποσοστό συμμετοχής στο φυσικό γερμάνιο 36,72 %. Το73Ge είναι το λιγότερο κοινό ποσοστό περίπου 7,76 %.[62]Όταν το ισότοπο72Ge βομβαρδιστεί μεσωματίδια απαράγει σταθερό77Se, απελευθερώνοντας ταυτόχροναηλεκτρόνιαυψηλής ενέργειας.[63]Εξαιτίας αυτού του γεγονότος, χρησιμοποιείται σε συνδυασμό με τοραδόνιοστις πυρηνικέςμπαταρίες.[63]
Άλλα 27ραδιοϊσότοπαέχουν συντεθεί μεσχετικές ατομικές μάζεςκυμαινόμενες από 58 έως 89. Το πλέον σταθερό απ' αυτά είναι το68Ge με ημιζωή 270,95 ημέρες, το οποίο διασπάται με αρπαγή ηλεκτρονίου προς68Ga. Το λιγότερο σταθερό είναι το60Ge με χρόνο ημιζωής 30 ms. Ενώ τα περισσότερα ραδιοϊσότοπα του γερμανίου διασπώνται με β--διάσπαση, το61Ge και το64Ge διασπώνται με β+καθυστερούμενη εκπομπήπρωτονίουπρος τελικά προϊόντα60Ni και64Ni αντίστοιχα.[23]
Ενώσεις του γερμανίου
[Επεξεργασία|επεξεργασία κώδικα]| Ακέραιοι α.ο. του Ge σε ορισμένες ενώσεις του | |
|---|---|
| –4 | Ca2Ge |
| –2 | CaGe |
| –1 | [Ge4]4- |
| +1 | GeH4 |
| +2 | GeS |
| +3 | Ge2Cl4 |
| +4 | GeO2 |
Είναι γνωστοί πολλοίαριθμοί οξείδωσηςτου γερμανίου και θετικοί και αρνητικοί, όμως επειδή αυτό έχει δομή εξωτερικής στιβάδας 4s24p2,εμφανίζεται στις ενώσεις του κυρίως μεαριθμό οξείδωσης(α.ο.) +4 εφόσον μπορεί να απολέσει και τα 4 ηλεκτρόνια της 4ης στιβάδας. Ο δεύτερος σε συχνότητα εμφάνισης α.ο. είναι ο +2 γεγονός που οφείλεται στο "φαινόμενο αδρανούς ζεύγους" διότι το Ge μπορεί να απολέσει και μόνο τα 2 ηλεκτρόνια τουτροχιακού4p. Ενώσεις στις οποίες το γερμάνιο έχει α.ο. +3 είναι σπάνιες όπως π.χ. στο Ge2Cl6,ενώ α.ο. +1, +2 και +3 παρατηρήθηκαν σε επιφάνειεςοξειδίων.[64]Στο υδρίδιο GeH4αλλά και σε άλλες ενώσεις π.χ. Ca2Ge, το γερμάνιο έχει αριθμό οξείδωσης -4 ενώ στην ένωση CaGe το Ge εμφανίζει α.ο. -2[46]και σεδιαμαγνητικάανιόντα Zintl όπως το [Ge9]4−ή το [Ge9]2−το γερμάνιο έχει κλασματικούς α.ο. ενώ στο [Ge4]4-έχει α.ο. = -1[1].
Επειδή ηενέργεια ιονισμούπου απαιτείται για να απομακρυνθούν 4 ηλεκτρόνια είναι τεράστια, γι' αυτό οι δεσμοί στις στερεές ενώσεις του γερμανίου είναι κυρίωςομοιοπολικοί[49].Τα άτομα γερμανίου στις ενώσεις τους δε σχηματίζουν σταθερούς τριπλούς δεσμούς με άλλα άτομα γερμανίου ή αζώτου όπως κάνουν τα άτομα άνθρακα[65]ενώ κβαντομηχανικές μελέτες με τη μέθοδο των μοριακών τροχιακών δείχνουν ότι διπλός δεσμός Ge=Ge υπάρχει σε παράγωγα τουδιγερμενίουτης μορφής R2Ge=GeR2και στα σχετικάδιγερμύνιαAr'Ge=GeAr' όπου Ar' = C6H3-2,6-Trip2με Trip = C6H2-2,4,6-iPr3και iPr = ισοπροπύλιο = (CH3)2CH-.[66]
Υδρίδια
[Επεξεργασία|επεξεργασία κώδικα]Οι ενώσεις του γερμανίου με το υδρογόνο λέγονταιγερμάνιακαι έχουν γενικό τύπο GenH2n+2με n = 1 - 9. Δεν αντιδρούν με το νερό και είναι ενώσεις ανάλογης κατασκευής με τα αλκάνια (CnH2n+2) και τα σιλάνια (SinH2n+2) και ονομάζονται με παραπλήσιο τρόπο: μονογερμάνιο GeH4,διγερμάνιο, Ge2H6,τριγερμάνιο Ge3H8κλπ..[46]

Το GeH4παρασκευάζεται καθαρό με απόδοση πάνω από 30 % με την αντίδραση GeCl4και μικτού υδριδίου λιθίου-αργιλίου (LiAlH4) σε αιθερικό διάλυμα.[67]Μπορεί να παρασκευαστεί επίσης εύκολα από την αντίδραση υδροβρωμίου (HBr) με γερμανίδιο του μαγνησίου (Mg2Ge) σε υγρή αμμωνία στους -40 °C. Σ' αυτήν την περίπτωση, μαζί παράγονται και μικρές ποσότητες δι, τρι τετρα και πενταγερμάνιου. Το GeH4είναι αέριο στη θερμοκρασία δωματίου και σταθερό μέχρι τους 285 °C. Σε διάλυμα αμμωνίας συμπεριφέρεται ως οξύ κατά Brönsted-Lowry αποδίδοντας πρωτόνιο στην ΝΗ3.Όταν αντιδρά με αλκαλιμέταλλα σχηματίζονται τα άχρωμαγερμύλια των αλκαλιμετάλλωνμε τύπο MGeH3,όπου Μ = Na, K, Rb, Cs ενώ ελευθερώνεται και αέριο Η2.[46]
Ανώτερα γερμάνια με n = 6, 7, 8 παράγονται με διοχέτευση ηλεκτρικών εκκενώσεων σε GeH4υπό πίεση 50 KPa. Τα γερμάνια με n = 2, 3, 4, 5 είναι άχρωμα ελαιώδη υγρά.[46]
Έχουν παρασκευαστεί και μικτά υδρίδια Si-Ge της μορφής H3Si-GeH3,H3Si-GeH2-SiH3και GeH3-SiH2-GeH3όπως και αλογονο-γερμάνια του τύπου GeH4-nXnπ.χ. GeH3Cl, GeH2Cl2,GeHCl3.[46]
Οξείδια - Υδροξείδια - Οξέα
[Επεξεργασία|επεξεργασία κώδικα]Τοδιοξείδιο του γερμανίου(GeO2) παρασκευάζεται συνήθως από τηνυδρόλυσητουτετραχλωριούχου γερμανίου(GeCl4) αλλά και από την ανάφλεξη του δισουλφιδίου GeS2.Έχειεπαμφοτερίζονταχαρακτήρα[65]δηλ. αντιδρά και με οξέα (GeO2+ 4HCl → GeCl4+ 2H2O) και με βάσεις (GeO2+ 4NaOH → Na4GeO4+ 2H2O.[50]Υπάρχει σε τρεις μορφές:[22]

- Διαλυτή μορφή στο νερό, σταοξέαHCl,HFκαι στοNaOH.Έχει εξαγωνική δομή και είναι η πιο κοινή μορφή οξειδίου του γερμανίου. Παρασκευάζεται από το GeCl4.Έχειπυκνότητα4,228 g/cm³,σημείο τήξης1116 °C καιδιαλυτότηταστο νερό 4,53 g/L (25 °C) και 13 g/L (100 °C).
- Αδιάλυτη μορφή (μεKsp= 1,0×10-57[53]) με τετραγωνική δομή που παρασκευάζεται με θέρμανση της διαλυτής στους 300-900 °C παρουσία 0,5 % w/w αλογονιδίου αλκαλιμετάλου (π.χ.NaCl). Έχει πυκνότητα 6,239 g/cm³ και σημείο τήξης 1086 °C.
- Η υαλώδης μορφή προκύπτει από τηντήξητων άλλων μορφών και την ψύξη του τήγματος. Έχει πυκνότητα 3,637 g/cm³ και είναι διαλυτή και στο νερό και στα HCl, HF, NaΟH.
Το σκούρο καφέ κρυσταλλικόμονοξείδιο του γερμανίου(GeO) μπορεί να παρασκευαστεί σε καθαρή μορφή με θέρμανση μίγματος Ge και GeO2απουσία Ο2ή με αφυδάτωση του Ge(OH)2αν και αυτή η ένωση δεν έχει χαρακτηριστεί[68]ή με αντίδραση GeCl2με υδατικό διάλυμα NH3[1].Το GeO έχει τη δομή του ρουτιλίου και η ένυδρη μορφή του, GeO·nH2O, καταβυθίζεται ως ίζημα όταν προστεθεί Ge(OH)2σε διάλυμα με Ge2+.[67]Το GeO είναι ισχυρό αναγωγικό μέσο[65]και σταθερό σε θερμοκρασία δωματίου αλλά σε θερμοκρασία 697 °C αυτοοξειδώνεται προς GeO2και Ge.[1]Είναι επαμφοτερίζον οξείδιο δηλ. αντιδρά και με οξέα (GeO + 2HCl → GeCl2+ H2O) και με βάσεις (GeO + 2NaOH → Na2GeO2+ H2O).[50]
Τουδροξείδιο του γερμανίου (IV),Ge(OH)4,προκύπτει από τη διάλυση της διαλυτής μορφής του GeO2και έχει σαφώς όξινη συμπεριφορά. Μπορεί να γραφεί και ωςγερμανικό οξύ,H4GeO4,που είναι διπρωτικό με με pK1= 9,03 και pK2= 12,33.[46]
Τουδροξείδιο του γερμανίου (ΙΙ),Ge(OH)2,υπάρχει μόνο σε διάλυμα, είναι επαμφοτερίζον και διαλύεται τόσο σε οξέα δίνοντας άλατα Ge(II): Ge(OH)2+ 2HClO4→ Ge(ClO4)2+ 2H2Ο όσο και σε βάσεις: Ge(OH)2+ OH—→ Ge(OH)3—.Αφυδατώνεται στους 650 °C προς GeO. Μπορεί να γραφεί και ωςγερμανώδες οξύ,H2GeO2.[46]
Αλογονούχες ενώσεις
[Επεξεργασία|επεξεργασία κώδικα]Όλα τα τετραλογονίδια του Ge είναι γνωστά και όλα με υδρόλυση απελευθερώνουν HX.[1]Το άχρωμο αέριοτετραφθοριούχο γερμάνιο,GeF4,μπορεί να παρασκευαστεί με πολλούς τρόπους. Συνήθως όμως παρασκευάζεται από τη θερμική αποσύνθεση του φθορογερμανικού βαρίου, BaGeF6.[65]GeF4υψηλής καθαρότητας παράγεται με απευθείας αντίδραση F2και στοιχειακού Ge. Έχει οσμή σκόρδου και βγάζει αναθυμιάσεις στον αέρα. Χρησιμοποιείται για εμφύτευση ιόντων σε ημιαγωγούς.[22]

Τοτετραχλωριούχο γερμάνιο,GeCl4,είναι άχρωμο υγρό διαλυτό στην ακετόνη, στο οινόπνευμα, στο βενζόλιο κ.ά. αλλά αδιάλυτο στο θειικό οξύ με το οποίο και δεν αντιδρά.[22]Μπορεί να παρασκευαστεί με θέρμανση Cl2και Ge. Η υδρόλυσή του είναι αμφίδρομη αντίδραση και οδηγεί στο σχηματισμό του υδροξειδίου Ge(OH)4.[65]
Το λευκό κρυσταλλικό στερεότετραβρωμιούχο γερμάνιο,GeBr4(πυκνότητα 3,1 g/cm³, σημείο βρασμού 186 °C, σημείο τήξης 26 °C) και το πορτοκαλί-κόκκινο στερεότετραϊωδιούχο γερμάνιο,GeI4(πυκνότητα 4,4 g/cm³, σημείο βρασμού 377 °C, σημείο τήξης 144 °C),[32]παρασκευάζονται εύκολα με απευθείας αντίδραση Br2και I2με Ge ή του GeO2με HBr και HI αντίστοιχα.
Τα διαλογονίδια του γερμανίου, GeX2με X = F, Cl, Br, I, είναι επίσης γνωστά και σταθερά σε αντίθεση με τα διαλογονίδια του πυριτίου που είναι ασταθή[1].Μπορούν να παραχθούν με αναγωγή των αντίστοιχων GeX4όταν θερμαίνονται με Ge. Επειδή όμως ο α.ο. +2 του Ge δεν είναι τόσο σταθερός όσο ο +4, αυτοοξειδώνονται σε υψηλή θερμοκρασία μετατρεπόμενα πάλι προς GeX4και Ge. Είναι περισσότερο πτητικά από τα GeX4,έχουν αναγωγικές ιδιότητες και η οξείδωσή τους οδηγεί σε GeO2.[65]
Τοδιφθοριούχο γερμάνιο(πυκνότητα 3,64 g/cm³, σημείο βρασμού 130 °C, σημείο τήξης 110 °C[32]) είναι άχρωμο κρυσταλλικό πολυμερισμένο στερεό, που ανταποκρίνεται στον τύπο [GeF2]nκαι σε υψηλή θερμοκρασία αυτοοξειδώνεται προς αέριο GeF4,στερεό Ge και αέριο GeF που είναι ασταθές, συμπυκνώνεται και αυτοοξειδώνεται. Είναι διαλυτό σε υδατικό διάλυμα HF και οινόπνευμα. Απορροφά υγρασία από τον αέρα και μετατρέπεται σε Ge(OH)2.Έχει χρησιμοποιηθεί στην εναπόθεση άμορφου φιλμ από ατμό στις τεχνολογίες πλάσματος.[22]
Τοδιχλωριούχο γερμάνιοείναι ανοιχτό κίτρινο έως λευκό κρυσταλλικό στερεό και τοδιιωδιούχο γερμάνιοείναι πορτοκαλί - κίτρινο κρυσταλλικό στερεό (πυκνότητα 5,4 g/cm³, αποσύνθεση στους 550 °C).[32]
Τοφθορογερμανικό οξύ,H2GeF6,μπορεί να παρασκευαστεί από την αντίδραση GeO2και HF ή από την υδρόλυση του GeF4.Η προσθήκη KF ή BaF2στο οξύ οδηγεί στο σχηματισμό K2GeF6ή BaGeF6που είναι σταθερά σε θερμοκρασίες μέχρι 500 °C όπου το δεύτερο αρχίζει να αποσυντίθεται προς GeF4και BaF2[22].
Υπάρχουν πολλές ενώσεις της μορφής MGeCl3όπου το Μ+είναι αλκαλιμέταλλο, κατιόν αμμώνιο ή φωσφόνιο π.χ. RbGeCl3,CsGeCl3,[NH4][GeCl3], [Ph4P][GeCl3] κ.ά. Παρασκευάζονται με διάφορους τρόπους, πολλές φορές σε μη υδατικά διαλύματα, και έχουν διάφορες κρυσταλλικές δομές. Η ένωση CsGeCl3ανήκει σε ομάδα ημιαγώγιμων ενώσεων της μορφής CsEX3όπου Ε = Ge, Sn, Pb και Χ = Cl, Br, I.[1]
Έχουν μελετηθεί επίσης και αλογονούχες ενώσεις όπως που περιέχουν διπλό δεσμό Ο=Ge ή S=Ge όπως O=GeF2,S=GeF2,S=GeCl2.[46]
Φάσεις και ιόντα Τσιντλ
[Επεξεργασία|επεξεργασία κώδικα]Ο όροςφάσεις Τσιντλ(Zintl) υποδηλώνει μια κατηγορία διμεταλλικώνιοντικών ενώσεωνκάθε μια από τις οποίες αποτελείται από τη συνένωση ενόςκατιόντοςαλκαλιμετάλλου,μετάλλουαλκαλικών γαιώνή μετάλλου τωνλανθανιδώνμεανιόνπου προέρχεται από στοιχείο των ομάδων 13, 14, 15 ή 16. Οι φάσειςZintl,που ονομάστηκαν έτσι από τον Γερμανό χημικόΈντουαρντ Τσιντλ(Eduard Zintl,1898 – 1941) που τις ανακάλυψε τη δεκαετία του 1930, δεν έχουν τις ιδιότητες τωναλάτωναλλά των μετάλλων δηλ. υψηλό σημείο τήξης, είναι ελατές και όλκιμες, είναιηλεκτρικά αγώγιμεςκαι χρησιμοποιούνται ωςημιαγωγοί.Το γερμάνιο δε σχηματίζει σε στερεά κατάσταση δυαδικές ενώσεις μεμέταλλα.Αντίθετα, είναι πολύ γνωστοί οι σχηματισμοί ιόντων και φάσεων Zintl στις οποίες ταξινομούνται ταμεταλλικά γερμανίδιατου τύπου MmGenόπου Μ = μέταλλο των ομάδων 1 και 2 του περιοδικού πίνακα. Οι φάσεις αυτές μπορεί να περιέχουν ανιόντα με ποικιλία στερεοδομών όπως απλά Ge4-(π.χ. Mg2Ge, Ca2Ge κ.ά.), διμερή Ge26-(π.χ. BaMg2Ge κ.ά), τετράεδρα Ge94-(π.χ. NaGe, KGe, RbGe, BaGe2κ.ά.) κ.ά..[46]Πρόσφατες συνθετικές μέθοδοι φάσεων Zintl με γερμάνιο, περιλαμβάνουν αναγωγή του στοιχείου σε διάλυμανατρίουήκαλίουσε υγρήαμμωνία(NH3). Η μέθοδος αναπτύχθηκε με την προσθήκη της κρυπτικής ένωσης 4,7,13,16,21,24-εξιοξα-1,10-διαζαδικυκλο[8.8.8]εξα-εικοσάνιο (2,2,2-cryptandσυντομογραφίαcrypt-222) που έχει τύπο N(CH2CH2OCH2CH2OCH2CH2)3N και είναι από τους σημαντικότερους εκπροσώπους της οικογένειας των κρυπτικών ενώσεων οι οποίες είναι δικυκλικοί πολυαιθέρες με μια επιπλέον γέφυρα που επιτρέπει πληρέστερη και επιλεκτικότερη παγίδευση συγκεκριμένων κατιόντων αλκαλίων και αλκαλικών γαιών προς σχηματισμό ενώσεων προσθήκης γνωστών ως cryptates.[69]Έτσι, παγιδεύονται επιλεκτικά ιόντα Na+ή Κ+και απομονώνονται άλατα της μορφής [Na(crypt-222)]4[Ge9].[1]
Άλλες ανόργανες ενώσεις
[Επεξεργασία|επεξεργασία κώδικα]Το κρυσταλλικό στερεόαζωτούχο γερμάνιο (IV),Ge3N4,λιώνει στους 900 °C[32]και παρασκευάζεται από την αντίδραση σκόνης Ge και αμμωνίας στους 700-850 °C. Δεν αντιδρά με τα περισσότερα οξέα και υδροξείδια των αλκαλίων αλλά ούτε και με το βασιλικό νερό ακόμα κι αν αυτό είναι θερμό[22].Το σκούρο καφέαζωτούχο γερμάνιο (ΙΙ),Ge3N2,είναι σκόνη που παρασκευάζεται με θέρμανση του ιμιδίου [GeNH]nστους 250-300 °C.[46]Στους 600 °C αντιδρά με Η2δίνοντας Ge και ΝΗ3(Ge3N2+ 3H2→ 3Ge + 2NH3).[60]
Η λευκή σκόνηθειούχο γερμάνιο (IV),GeS2,έχει πυκνότητα 3 g/cm³ και εξαχνώνεται στους 597 °C[1].Είναι ασυνήθιστη ένωση γιατί είναι αδιάλυτη στα ισχυρά και πυκνά ανόργανα οξέα όπως π.χ. HCl 6Μ και H2SO46M. Αυτή η ιδιότητα επιτρέπει την ανάκτηση του γερμανίου από όξινα διαλύματα με αεριοποίηση με H2S.[22]
Τοθειούχο γερμάνιο (IΙ),GeS, έχει πυκνότητα 4,1 g/cm³ και λιώνει στους 615 °C[32].Παρασκευάζεται με αναγωγή του GeS2με Η2ή με Ge και σχηματίζει γκρι-μαύρες νιφάδες με μεταλλική γυαλάδα.[46]
Το πορτοκαλοκίτρινο κρυσταλλικόσεληνιούχο γερμάνιο (IV),GeSe2,λιώνει στους 707 °C και έχει πυκνότητα 4,56 g/cm³, ενώ το γκρίζοσεληνιούχο γερμάνιο (ΙΙ),GeSe, λιώνει στους 667 °C, έχει πυκνότητα 5,56 g/cm3[32]και καταβυθίζεται ως ίζημα όταν διοχετευθεί H2Se σε υδατικό διάλυμα GeCl2.[46]
Το κρυσταλλικό στερεότελλουριούχο γερμάνιο (II),GeTe, έχει θερμοκρασία τήξης 725 °C και πυκνότητα 6,16 g/cm³.[32]Παρασκευάζεται με απευθείας αντίδραση Ge και Te.[46]
Οργανικές ενώσεις
[Επεξεργασία|επεξεργασία κώδικα]
Έχουν παρασκευαστεί πολλές οργανογερμανικές ενώσεις στις οποίες το Ge έχει αριθμό οξείδωσης +4 όπως άκυκλες ενώσεις, σπιρογερμάνια, γερματράνια, πορφυρίνες γερμανίου, παράγωγα γερμανοκενίου κ.ά..[70]Οι περισσότερες απ' αυτές τις ενώσεις χρησιμοποιούνται ως αντικαρκινικά φάρμακα.
Οι οργανικές ενώσεις όπου το Ge έχει α.ο. +2 είναι τις περισσότερες φορές δραστικά ενδιάμεσα οργανικών αντιδράσεων ή ελεύθερες ρίζες.
Γερμάνιο (ΙV).Η πρώτη οργανογερμανική ένωση, τοτετρααιθυλογερμάνιο,(CH3CH2)4Ge, συντέθηκε από το Βίνκλερ το 1887 με αντίδραση του GeCl4με τον διαιθυλοψευδάργυρο, (CH3CH2)2Zn.[70]

Μεταξύ των πρώτων οργανογερμανικών ενώσεων που παρασκευάστηκαν και χρησιμοποιήθηκαν παλιότερα ως συμπληρώματα διατροφής ήταν και το 3-[(2-καρβοξυλαιθυλο-οξογερμυλ)οξυ-οξογερμυλ]προπανικό οξύ πιο γνωστό με πολλά άλλα ονόματα όπως δις(2-καρβοξυαιθυλογερμάνιο)τριοξείδιο, τριοξείδιο του γερμανίου, Ge-132, SK 818, προπαγερμάνιο, προξυγερμάνιο, ρεπαγερμάνιο κ.ά. Συντέθηκε για πρώτη φορά το 1966 από τουςV. F. Mironov, E. M. BerlinerκαιT. K. Garκαι έχει τύπο((HOOCCH2CH2Ge)2O3))nπρόκειται δηλ. για πολυμερές.[70]
Ορισμένα σύμπλοκα έχουν ως δότεςligandsάτομα Ο, Ν ή P π.χ. [GeF4(NMe3)2].[58]
Γερμάνιο (ΙΙ).Ταγερμύλια(ή γερμυλένια), R2Ge, εμφανίζονται κατά κανόνα ως δραστικά ενδιάμεσα που μετατρέπονται ταχύτατα σε πολυμερή της μορφής (GeR2)n.Ορισμένα γερμύλια με ογκώδεις υποκαταστάτες και υπό ειδικές συνθήκες, μπορούν να απομονωθούν όπως π.χ. το δις(διπυριτο}γερμύλιο Ge[CH(SiMe3)2]2που είναι κίτρινο κρυσταλλικό στερεό με σημείο τήξης 180 °C και βρίσκεται στη στερεά φάση ως διμερές (διγερμένιο) [CH(SiMe3)2]2Ge=Ge[CH(SiMe3)2]2.[71]
Τογερμανοκένιο,Ge(C5H5)2,ανήκει στα γερμύλια, ονομάζεται δις(κυκλοπενταδιενυλο)γερμύλιο, και ανακαλύφθηκε το 1986. Έχει χρησιμοποιηθεί στην κατασκευή νανοσυρμάτων γερμανίου υψηλής απόδοσης με τη μέθοδο της χημικής εναπόθεσης ατμών.[71]
Οργανικά σύμπλοκα με δεσμό Ge-Ge.Σήμερα είναι γνωστές πολλές ετεροκυκλικές οργανικές ενώσεις με τριμελείς, τετραμελείς, πενταμελείς και εξαμελείς δακτυλίους οποίες συμμετέχουν άτομα Ge ενωμένα μεταξύ τους ή με άλλα άτομα με απλό ή διπλό δεσμό.[71]Τα σύμπλοκα που έχουν τρία ή περισσότερα άτομα του κεντρικού στοιχείου ενωμένα όλα μεταξύ τους είναι γνωστά ως σύμπλοκαclusterή βοτρυοειδή σύμπλοκα. Το γερμάνιο φτιάχνει σύμπλοκαclusterτης μορφής GenRm(n ≥ m) όπου R είναι μεγάλη ποικιλία οργανικών ομάδων κυκλικών ή άκυκλων με ή χωρίς ετεροάτομα. Έτσι έχουν παρασκευαστεί σύμπλοκα με n = m = 2, 3, 4, 6, 8, 10, όπωςδιμερήμε διπλό δεσμό Ge=Ge,τριμερήμε τριγωνική διάταξη των ατόμων Ge,τετραμερή(τετραγερματετραεδράνια) με τα άτομα Ge στις κορυφές τετραέδρου,εξαμερήμε πρώτη ένωση που παρασκευάστηκε το εξαγερμαπρισμάνιο Ge6{CH(SiMe3)2}6όπου Me = μεθύλιο = CH3-,οκταμερήκαιδεκαμερή.Υπό ειδικές συνθήκες μπορούν να συντεθούν πολύ λίγα σύμπλοκα και με n > 10.[66]
Κράματα γερμανίου
[Επεξεργασία|επεξεργασία κώδικα]Ήδη από τη δεκαετία του 1960 έχουν περιγραφεί πολλά κράματα με γερμάνιο, τα περισσότερα από τα οποία παρασκευάζονται με τήξη του Ge με κάποιο άλλο μέταλλο ακόμα και με ευγενή μέταλλα.[7]Ένα ενδιαφέρον κράμα, το Argentium Sterling, που είναι κατοχυρωμένο με δίπλωμα ευρεσιτεχνίας, αποτελείται από 92,5 % άργυρο και 7,5 % χαλκό. Αν αντικατασταθεί μέρος του χαλκού από 1,2 % γερμάνιο,[72]το κράμα αποκτά αυξημένη ολκιμότητα, υψηλή αντίσταση στην αμαύρωση, αυξημένη θερμική και ηλεκτρική αντίσταση και άλλες ενδιαφέρουσες μηχανικές ιδιότητες.
Το ημιαγώγιμο κράμα Si1-xGexαποτελείται από κάθε γραμμομοριακή αναλογία Si και Ge.
Τοξικότητα - Προφυλάξεις
[Επεξεργασία|επεξεργασία κώδικα]Κατά τη δεκαετία του 1970, ιδιαίτερα στηνΙαπωνίαμετά τη δημοσίευση το 1980 ενός βιβλίου με τίτλο "Miracle Cure: Organic Germanium"[10]αλλά και αργότερα σε άλλες χώρες, ήταν δημοφιλή συμπληρώματα διατροφής που περιείχαν ενώσεις γερμανίου καθώς και ελιξίρια για ορισμένες ασθένειες (π.χ.καρκίνοςκαιAIDS). Το Ge δεν αποτελεί ουσιώδες στοιχείο για τη διατροφή και γενικά η οξεία τοξικότητά του είναι χαμηλή. Ωστόσο, αναφέρθηκαν τουλάχιστον 31 σοβαρά επεισόδια, ακόμα και θάνατοι, που συνδέονταν με παρατεταμένη πρόσληψη ενώσεων γερμανίου. Στους ασθενείς παρατηρήθηκαν σημάδια δυσλειτουργίας τουήπατοςκαι των νεφρών,αναιμίακαι μυϊκή αδυναμία. Η επαναλειτουργία των νεφρών ήταν αργή και ατελής ακόμα και πολύ μετά από τη διακοπή της πρόσληψης του ουσιών. Τελικά το 1989 το Υπουργείο Υγείας της Μεγάλης Βρετανίας εξέδωσε ανακοίνωση σχετικά με τους κινδύνους που υπήρχαν από την πρόσληψη των συμπληρωμάτων αυτών.[73]

Τοστοιχειακό γερμάνιοδεν θεωρείται ότι είναι ουσιαστικής σημασίας για την υγεία των φυτών ή ζώων, παρόλο που οι τοξικολογικές επιπτώσεις του στοιχείου δεν έχουν πλήρως διερευνηθεί. Γενικά ούτε το στοιχείο ούτε οι ενώσεις του θεωρούνται ότι προκαλούν μεταλλάξεις, αν και υπάρχουν υποψίες για το GeCl4.[74]Για λόγους πρόληψης όμως, το γερμάνιο, θα πρέπει να θεωρηθεί ερεθιστικό για ταμάτιακαι επιβλαβές σε περίπτωσηεισπνοήςήκατάποσης.Η προτεινόμενη TLV[Σημ. 5]είναι 10 mg/m³.[75]Προβλήματα υγείας μπορεί να δημιουργηθούν από την αιωρούμενη σκόνη, όχι τόσο του γερμανίου όσο τουδιοξειδίου του πυριτίου(SiO2) το οποίο συνυπάρχει κατά την επεξεργασία του στοιχείου καθώς και κατά την τήξη σκόνης για παραγωγή πλινθωμάτων γερμανίου. Η κατεργασία και λείανση κρυστάλλων γερμανίου μπορεί να προκαλέσει σκόνη και έχει μετρηθεί συγκέντρωση Ge έως και 5 mg/m³ αέρα κατά τη διάρκεια ξηρής κατεργασίας.[76]
Η παραγωγή μονοκρυστάλλων Ge στις βιομηχανίες ημιαγωγών προκαλεί στο περιβάλλον εργασίας αυξημένη θερμοκρασία αέρα (έως 45 °C),ηλεκτρομαγνητική ακτινοβολίακαι μόλυνση του αέρα με τουδρίδιο GeH4.Το τελευταίο είναι η πιο επιβλαβής ένωση του Ge, μαζί με το GeCl4.Το υδρίδιο μπορεί να προκαλέσει οξεία δηλητηρίαση και έχει αποδειχθεί σε πειραματόζωα ότι είναι ένα πολυ-συστημικό δηλητήριο που προκαλεί σοβαρές βλάβες στο νευρικό και κυκλοφορικό σύστημα.[76]Τα όρια έκθεσης για τον άνθρωπο που καθόρισαν οι Η.Π.Α. για το GeΗ4είναι:[77]NIOSHREL:[Σημ. 6]TWA[Σημ. 7]0,6 mg/m³.
Τοτετραχλωριούχο γερμάνιο,GeCl4,είναι ισχυρά ερεθιστική ένωση για τοαναπνευστικό σύστημα,τα μάτια και τοδέρμαμε ελάχιστη ερεθιστική ποσότητα 13 mg/m³ αέρα πάνω από την οποία καταστρέφει τακύτταρατωνπνευμόνωντων πειραματόζωων. Σε μεγαλύτερες ποσότητες προκαλεί βρογχίτιδα καιπνευμονία.Το GeCl4αποδείχθηκε επίσης τοξικό για τοσυκώτικαι τα νεφρά των πειραματόζωων.[76]Η τοξική δράση του χλωριδίου είναι πιθανό να οφείλεται στη συνδυαστική δράση με προϊόντα υδρόλυσης όπως το GeO2,HCl, Ge2Cl6του.
Τοδιοξείδιο του γερμανίου,GeO2,δεν είναι ερεθιστικό για το δέρμα αλλά όταν έρθει σε επαφή με υγρασία δημιουργείγερμανικό οξύτο οποίο μπορεί να προκαλέσει ερεθισμούς.[76]Επίσης σε πειραματόζωα έχει προκαλέσει και καρδιακά προβλήματα.[74]
Επικίνδυνα πρέπει να θεωρούνται επίσης και τακράματα γερμανίου με αρσενικόδιότι κατά την κατεργασία τους παράγεταιαρσίνη(AsH3) η οποία, εκτός του ότι είναι η ίδια τοξική, ενώνεται και με άλλα χημικά στοιχεία δημιουργώντας τοξικά υδρίδια.[76]
Για την προστασία από το γερμάνιο και τις ενώσεις του στους χώρους εργασίας, πρέπει αυτοί να αερίζονται πολύ καλά και να αποφεύγεται παραμονή του προσωπικού σε μέρη όπου συσσωρεύεται σκόνη ή καπνοί από την κατεργασία των υλικών. Οι εργαζόμενοι πρέπει να φορούν κατάλληλα ρούχα και γάντια και να υποβάλλονται συχνά σε ιατρικές εξετάσεις.
Χρήσεις και εφαρμογές
[Επεξεργασία|επεξεργασία κώδικα]| Ποσοστά ζήτησης Ge ανά εφαρμογή το 2011[41] | ||
|---|---|---|
| οπτικές ίνες | 30 % | |
| οπτικά υπερύθρων | 25 % | |
| Καταλύτης PET | 25 % | |
| Ηλεκτρονικά και ηλιακές εφαρμογές |
15 % | |
| Άλλες εφαρμογές | 5 % | |
Κατά τη διάρκεια του 2010 σε παγκόσμιο επίπεδο, το γερμάνιο, είτε ως στοιχειακό είτε ως οξείδιο ή τετραχλωρίδιο, χρησιμοποιήθηκε κατά 30 % στην κατασκευή του πυρήνα των οπτικών ινών, κατά 25 % στους φακούς υπέρυθρων φωτογραφικών μηχανών, κατά 25 % ως καταλύτης πολυμερισμού για την παραγωγή τερεφθαλικού πολυαιθυλενίου, κατά 15 % σε ηλεκτρονικές συσκευές και φωτοβολταϊκά και κατά 5 % σε άλλες εφαρμογές στη μεταλλουργία, σε φωσφορίζοντα υλικά και σε αντικαρκινικά φάρμακα.[Σημ. 8]Σε μια έκθεση που δημοσίευσε η Ευρωπαϊκή Ένωση αναφέρεται ότι το γερμάνιο είναι μεταξύ των δεκατεσσάρων κρίσιμων πρώτων υλών για τις χώρες μέλη της. Η διαπίστωση αυτή βασίστηκε στο επίπεδο παραγωγής, υποκατάστασης και ανακύκλωσης καθώς και στους κινδύνους που συνδέονται με τη θέση των πηγών εφοδιασμού κάθε υλικού.[41]
Οπτικά υλικά
[Επεξεργασία|επεξεργασία κώδικα]
Το οξείδιο του γερμανίου(IV), GeO2,είναι ιδιαίτερα χρήσιμο σε ευρυγώνιους φακούς, μικροσκόπια και για το βασικό πυρήνα των οπτικών ινών, εξαιτίας του υψηλού δείκτη διάθλασης του και της χαμηλής οπτικής διασποράς του. Αντικαθιστά επίσης το οξείδιο του τιτανίου, ως πρόσμιξη για την παραγωγή ινών πυριτίου, εξαλείφοντας την ανάγκη για περαιτέρω θερμική επεξεργασία, η οποία έκανε τις ίνες εύθραυστες.
Επειδή το γερμάνιο είναι διαφανές στην υπέρυθρη ακτινοβολία, αποτελεί ένα πολύ σημαντικό οπτικό υλικό, που μπορεί εύκολα να κοπεί, να λειανθεί και να χρησιμοποιηθεί τελικά σε φακούς φωτογραφικών μηχανών. Ιδιαίτερα χρησιμοποιείται ως το μπροστινό μέρος οπτικών εξαρτημάτων σε κάμερες θερμικής απεικόνισης που δουλεύουν σε μήκος κύματος 8 - 14 μm, σε ανιχνευτές στρατιωτικών εφαρμογών, στην υπέρυθρη φασματοσκοπία, σε συστήματα νυχτερινής όρασης σε αυτοκίνητα, σε εφαρμογές πυρόσβεσης.[40]Το γερμάνιο έχει πολύ υψηλό δείκτη διάθλασης (4,0) και επομένως είναι απαραίτητη μια αντι-ανακλαστική επίστρωση. Για το σκοπό αυτό χρησιμοποιείται μια πολύ σκληρή ειδική επίστρωση από αδαμαντοειδή άνθρακα (diamond-like carbon, DLC), με δείκτη διάθλασης από 1,7 έως 2,4 στα 632,8 nm, η οποία προσφέρει επίσης και αντοχή στη σκληρή μεταχείριση και στη διάβρωση.[78]
Υποκατάστατα γερμανίου
[Επεξεργασία|επεξεργασία κώδικα]Το φθηνότεροπυρίτιομπορεί να υποκαταστήσει το Ge σε ορισμένες ηλεκτρονικές εφαρμογές απ' αυτές στις οποίες ακόμα χρησιμοποιείται. Ορισμένες μεταλλικές ενώσεις μπορούν επίσης να το αντικαταστήσουν σε υψηλήςσυχνότηταςηλεκτρονικές εφαρμογές και σε ορισμένες εφαρμογές LED. Υποκατάστατα του στοιχειακού γερμανίου σε συστήματαυπερύθρωνείναι επίσης οσεληνιούχος ψευδαργύρος(ZnSe) αλλά και τογυαλίγερμανίου συχνά όμως σε βάρος της απόδοσης της συσκευής. Επίσης, τοτιτάνιοέχει τη δυνατότητα να υποκαταστήσει το γερμάνιο ωςκαταλύτηςπολυμερισμού.[41]
Επιλεγμένη βιβλιογραφία
[Επεξεργασία|επεξεργασία κώδικα]- Ebbing D.D, Gammon S.D. (2008).General Chemistry(9η έκδοση). Cengage Learning.ISBN0618857486.
- Emsley J (2003).Nature's building blocks: an A-Z guide to the elements.Oxford University Press.ISBN0198503407.
- Greenwood N. N.· Earnshaw, A. (1997).Chemistry of the Elements.Oxford.ISBN0750633654.
- Housecroft C.E., Sharpe A. G. (2005).Inorganic chemistry(3η έκδοση). Pearson Education Limited.ISBN9780131755536.
- Per Enghag (2004).Encyclopedia of the elements: technical data, history, processing, applications.John Wiley and Sons.ISBN3527306668.
- Pauling L. (2003).General Chemistry(3η έκδοση). Dover Publications Inc.ISBN9780486656229.
- Schwartz Μ. (2002).Encyclopedia of materials, parts, and finishes.CRC Press.ISBN1566766613.
- Weeks M.E. (1933).Discovery of the elements.Journal of Chemical Education.ISBN0766138720.
- Wiberg E.· Nils Wiberg N.· Holleman A.F. (2001).Inorganic chemistry.Academic Press.ISBN0123526515.
- Sadao Adachi (2004).Handbook on physical properties of semiconductors.Birkhäuser.ISBN1402078188.
- Cor L. Claeys, Eddy Simoen (2007).Germanium-based technologies: from materials to devices.Elsevier.ISBN0080449530.
- Cor L. Claeys, Eddy Simoen (2009).Extended defects in germanium: fundamental and technological aspects.Springer.ISBN3540856110.
Δείτε επίσης
[Επεξεργασία|επεξεργασία κώδικα]Σημειώσεις
[Επεξεργασία|επεξεργασία κώδικα]- ↑Το καθαρό Ge έχει ηλεκτρική αντίσταση 0,6 Ω·m και αγωγιμότητα 1,67 S/m περίπου. Η ηλεκτρική αντίσταση και κατ' επέκταση η αγωγιμότητα των ημιαγώγιμων υλικών δεν είναι σταθερές και εξαρτώνται από πολλούς παράγοντες όπως η θερμοκρασία, οι προσμίξεις κλπ.Resistivity of Germanium
- ↑Η IUPAC προτείνει τον όρο «ημιμέταλλο» (semimetal) αντί του όρου «μεταλλοειδές» (metalloid) όπως αναφέρεται στο βιβλίο "Inorganic chemistry" (2η έκδοση, 2005) των C. E. Housecroft και A. G. Sharpe σελ. 338 και όπως αναφέρει και η πλειονότητα της ελληνικής (και όχι μόνο) βιβλιογραφίας
- ↑Είναι ενδιαφέρον το γεγονός ότι η διδακτορική διατριβή του Βίνκλερ, που ανακάλυψε το γερμάνιο είχε θέμα τον "ανταγωνιστικό" ημιαγωγό, το πυρίτιο και τις ενώσεις του!Germanium-based technologies: from materials to devicesσελ. 1
- ↑Η ευαισθησία στην AAS, σχετίζεται με την κλίση της καμπύλης αναφοράς, και ορίζεται ως η συγκέντρωση του ελεγχόμενου στοιχείου σε υδατικό διάλυμα που παράγει απορρόφηση 1 %. Συνήθως εκφράζεται σε μg/mL ή μg/g ανά 1 % απορρόφηση
- ↑Η TLV (Threshold Limit Value) είναι η μέγιστη επιτρεπτή συγκέντρωση στον αέρα μιας ουσίας για κάποια συγκεκριμένη χρονική περίοδο (συνήθως 8 ώρες, αλλά μερικές φορές και 40 ώρες/εβδομάδα). Η TLV μιας ουσίας μπορεί να διαφέρει από χώρα σε χώρα
- ↑National Institute for Occupational Safety and Health (NIOSH). Είναι το Εθνικό Ινστιτούτο Επαγγελματικής Ασφάλειας και Υγείας των Ηνωμένων Πολιτειών. Το NIOSH είναι υπεύθυνο για την έρευνα και την ανάπτυξη, προτείνει πρότυπα υγείας και ασφάλειας αλλά δε νομοθετεί. ΤοREL(Recommented Exposure Limit) είναι το μέγιστο όριο έκθεσης στο ρυπαντή.
- ↑Time Weighted Average (TWA). Είναι η χρονικά σταθμισμένη μέση τιμή που αποτελεί όριο έκθεσης βασισμένο στην εργασία 8 ωρών/ημέρα και 40 ωρών/εβδομάδα.
- ↑Άλλη πηγή[1]αναφέρει ότι το γερμάνιο και τα παράγωγά του χρησιμοποιήθηκαν παγκοσμίως κατά 30 % στα υπέρυθρα οπτικά, κατά 20 % στις οπτικές ίνες, κατά 20 % ως καταλύτης PET, κατά 15 % σε ηλεκτρονικές και ηλιακές εφαρμογές και κατά 15 % σε άλλες χρήσεις
Παραπομπές
[Επεξεργασία|επεξεργασία κώδικα]- ↑1,001,011,021,031,041,051,061,071,081,09Catherine E. Housecroft, Alan G. Sharpe (2005). A. G. Sharpe, επιμ.Inorganic chemistry(2η, εικονογραφημένη έκδοση). Pearson Education.ISBN0130399132.
- ↑2,02,1«Magnetic susceptibility of the elements and inorganic compounds».Handbook of Chemistry and Physics(PDF)(81η έκδοση). CRC press. Αρχειοθετήθηκεαπό το πρωτότυπο(PDF)στις 12 Ιανουαρίου 2012.
- ↑3,03,1«Semiconductor Materials, Junctions, and Devices from RCA Transistor Manuel».Αρχειοθετήθηκεαπό το πρωτότυποστις 27 Αυγούστου 2011.Ανακτήθηκε στις 14 Αυγούστου 2011.
- ↑4,04,14,24,34,4Ioffe Physical-Technical Institute of the Russian Academy of Sciences
- ↑5,05,15,25,3Hans Warlimont (2005). W. Martienssen, Hans Warlimont, επιμ.Springer handbook of condensed matter and materials data, Τόμος 1(εικονογραφημένη έκδοση). Springer.ISBN3540443762.
- ↑Michael E. Wieser and Tyler B. Coplen (December 2010).«Atomic weights of the elements 2009 (IUPAC Technical Report)»(PDF).Pure Appl. Chem.83(2): 371.http://www.iupac.org/publications/pac/pdf/2011/pdf/8302x0359.pdf.Ανακτήθηκε στις 11/8/2011.
- ↑7,07,17,27,37,47,57,67,77,8W.C. Butterman, John D. Jorgenson (Μαΐου 2005).Mineral Commodity Profiles. Germanium(PDF).U.S. Geological Survey, Reston, Virginia. σελίδες 1–19.Ανακτήθηκε στις 12 Αυγούστου 2011.
- ↑John A. R. Newlands (July 30, 1864)).«Relations between Equivalents».Chemical News10:59-60.http://web.lemoyne.edu/~giunta/EA/NEWLANDSann.HTML.Ανακτήθηκε στις 2011-08-12.
- ↑Kaji, Masanori (2002).«D. I. Mendeleev's concept of chemical elements andThe Principles of Chemistry»(pdf).Bulletin for the History of Chemistry27(1): 4–16. Αρχειοθετήθηκε απότο πρωτότυποστις 2008-12-17.https://web.archive.org/web/20081217080509/http://www.scs.uiuc.edu/~mainzv/HIST/awards/OPA%20Papers/2005-Kaji.pdf.Ανακτήθηκε στις 2008-08-20.
- ↑10,010,110,2John Emsley (2003).Nature's building blocks: an A-Z guide to the elements(εικονογραφημένη, επανεκτύπωση έκδοση). Oxford University Press.ISBN0198503407.
- ↑11,011,111,2Clemens Winkler (1886).«Germanium, Ge, a New Nonmetallic Element (μετάφραση από τα γερμανικά)».Berichte der Deutschen Chemischen Gesellschaft19:210-211.http://www.chemteam.info/Chem-History/Disc-of-Germanium.html.Ανακτήθηκε στις 2011-08-12.
- ↑12,012,1Clemens Winkler (1886).«Germanium, Ge, ein neues, nichtmetallisches Element».Berichte der Deutschen Chemischen Gesellschaft19:210-211.http://gallica.bnf.fr/ark:/12148/bpt6k90705g/f212.
- ↑Editor's Scientific Record (June 1877).«Editor's Scientific Record»(PDF).Harper's New Monthly Magazine (1850-1899)55(325): 152-153.http://digital.library.cornell.edu/cgi/t/text/pageviewer-idx?c=harp;cc=harp;idno=harp0055-1;node=harp0055-1%3A20;view=pdf;seq=162;page=root;size=50.Ανακτήθηκε στις 2011-08-12.
- ↑Elementymology & Elements Multidict. Niobium
- ↑15,015,1Winkler, Clemens (1887). "Germanium, Ge, a New Nonmetal Element".Berichte der deutschen chemischen Gesellschaft(in German)19(1): 210–211. doi:10.1002/cber.18860190156. English translation at the Wayback Machine (archived December 7, 2008)
- ↑"Germanium, a New Non-Metallic Element".The Manufacturer and Builder:181. 1887. Retrieved 2008-08-20.
- ↑Mary Elvira Weeks (2003) [1934].Discovery of the Elements(3η έκδοση). Kessinger Publishing.ISBN0766138720.[νεκρός σύνδεσμος]
- ↑18,018,118,2Winkler, Clemens (1887). "Mittheilungen über des Germanium. Zweite Abhandlung".J. Prak. Chemie(in German)36(1): 177–209.
- ↑Brunck, O. (1886). "Obituary: Clemens Winkler".Berichte der deutschen chemischen Gesellschaft(in German)39(4): 4491–4548. doi:10.1002/cber.190603904164.
- ↑de Boisbaudran, M. Lecoq (1886).«Sur le poids atomique du germanium».Comptes rendus103:452.http://gallica.bnf.fr/ark:/12148/bpt6k3059r/f454.table.Ανακτήθηκε στις 2011-08-12.
- ↑21,021,121,221,3E.E. Haller.«Germanium: From Its Discovery to SiGe Devices»(PDF).Department of Materials Science and Engineering, University of California, Berkeley and Materials Sciences Division, Lawrence Berkeley National Laboratory, Berkeley, CA.http://www.osti.gov/bridge/servlets/purl/922705-bthJo6/922705.PDF.Ανακτήθηκε στις 2011-08-12.
- ↑22,0022,0122,0222,0322,0422,0522,0622,0722,0822,0922,10Kirk-Othmer (2005). «Germanium and germanium compounds». Στο: Arza Seidel.Kirk-Othmer Encyclopedia of Chemical Technology (vol. 12)(5η έκδοση). Wiley-Interscience. σελίδες 548–564.ISBN047148511X.Αρχειοθετήθηκεαπό το πρωτότυποστις 17 Μαρτίου 2013.
- ↑23,023,123,2The photographic periodic table
- ↑Chemical Society (Great Britain) (1982).Specialist periodical report. Environmental chemistry (volume 2).Royal Society of Chemistry.ISBN0851867650.
- ↑University of Split, Faculty of Chemistry and Technology, Croatia
- ↑J.D Burton, F Culkin and J.P Riley (May 1959).«The abundances of gallium and germanium in terrestrial materials».Geochimica et Cosmochimica Acta16(1-3): 151-180.http://www.sciencedirect.com/science/article/pii/0016703759900523.Ανακτήθηκε στις 2011-08-14.
- ↑27,027,127,227,327,4Barbara Sherwood Lollar (2005). Barbara Sherwood Lollar, επιμ.Environmental Geochemistry: Treatise on Geochemistry, Volume 9(εικονογραφημένη έκδοση). Elsevier.ISBN0080446434.
- ↑28,028,1Lawrence R. Bernstein (Νοέμβριος 1985).«Germanium geochemistry and mineralogy».Geochimica et Cosmochimica Acta(Elsevier Ltd.)49(11): 2409-2422.http://www.sciencedirect.com/science/article/pii/0016703785902418.Ανακτήθηκε στις 2011-08-14.
- ↑29,029,129,2R. Salminen (chief-editor) (επιμ.).Geochemical Atlas of Europe(PDF).σελίδες 181–182.ISBN951-690-913-2.Ανακτήθηκε στις 14 Αυγούστου 2011.[νεκρός σύνδεσμος]
- ↑30,030,1Michael Cox· Henk Nugteren· Mária Janssen-Jurkovičová, επιμ. (2008).Combustion residues: current, novel and renewable applications(εικονογραφημένη έκδοση). John Wiley and Sons.ISBN0470094427.
- ↑R. Höll, M. Kling, E. Schroll (March 2007).«Metallogenesis of germanium—A review».Ore Geology Reviews(Elsevier B.V)30 =3-4:145-180.http://www.sciencedirect.com/science/article/pii/S0169136806000345.
- ↑32,032,132,232,332,432,532,632,7WebElements. Germanium
- ↑33,033,1Mineral Species containing Germanium (Ge)
- ↑34,034,134,2Fátima Arroyo, Oriol Font, Constantino Fernández-Pereira, Xavier Querol, Roberto Juan, Carmen Ruiz, Pilar Coca (Aug 2009). «Germanium recovery from gasification fly ash: Evaluation of end-products obtained by precipitation methods».J Hazard Mater.167(1-3): 582-588.
- ↑Cor L. Claeys, Eddy Simoen (2007). Cor L. Claeys, Eddy Simoen, επιμ.Germanium-based technologies: from materials to devices(εικονογραφημένη έκδοση). Elsevier.ISBN0080449530.
- ↑36,036,136,2mindat.org - the mineral and locality database.Alphabetical Index of Minerals, Varieties, Synonyms and other names
- ↑World of Coal Ash (WOCA) Conference - May 9-12, 2011 in Denver, CO, USA: Fátima Arroyo, Constantino Fernández-Pereira, Pilar Bermeyo Oroz, Joaquín Olivares del Valle "Industrial Equipment Design for the Recovery of Germanium from Coal Fly Ash Leachates by Solvent Extraction"PDFΑρχειοθετήθηκε2012-03-06 στοWayback Machine.
- ↑38,038,138,2David E. Guberman (Μάρτιος 2011).2009 Minerals Yearbook. GERMANIUM (ADVANCE RELEASE)(PDF).U.S. GEOLOGICAL SURVEY.Ανακτήθηκε στις 15 Αυγούστου 2011.
- ↑39,039,1Naumov, A. V. (2007). «World market of germanium and its prospects».Russian Journal of Non-Ferrous Metals48(4): 265–272.doi:.
- ↑40,040,1Moskalyk, R. R. (2004). «Review of germanium processing worldwide».Minerals Engineering17(3): 393–402.doi:.
- ↑41,041,141,241,3(PDF)MINERAL COMMODITY SUMMARIES 2012.U.S. Geological Survey. January 2012, σελ. 64-65.ISBN978–1–4113–3349–9.http://minerals.usgs.gov/minerals/pubs/mcs/2012/mcs2012.pdf.Ανακτήθηκε στις 23/7/2012.
- ↑«Metal Prices» Germanium Metal».Αρχειοθετήθηκεαπό το πρωτότυποστις 16 Αυγούστου 2011.Ανακτήθηκε στις 28 Αυγούστου 2011.
- ↑T.D. Kelly· M.W. George· S.M. Jasinski· P.N. Gabby· D.E. Guberman.«Germanium Statistics»(PDF).U.S.Geological Survey.Αρχειοθετήθηκεαπό το πρωτότυπο(PDF)στις 26 Νοεμβρίου 2011.
- ↑Minor Metals Trade Association (MMTA). Germanium By a Special Contributor (PDF)[νεκρός σύνδεσμος]
- ↑45,045,145,245,3Ελένη Κ. Παλούρα (2008).Σημειώσεις για το μάθημα “Φυσική Στερεάς Κατάστασης”: Στοιχεία Θεωρίας Ημιαγωγών(PDF).Θεσσαλονίκη: Τμήμα Φυσικής, Αριστοτέλειο Πανεπιστήμιο Θεσσαλονίκης.Ανακτήθηκε στις 30 Αυγούστου 2011.
- ↑46,0046,0146,0246,0346,0446,0546,0646,0746,0846,0946,1046,1146,1246,1346,14Egon Wiberg· Nils Wiberg· Arnold Frederick Holleman (2001).Inorganic chemistry(εικονογραφημένη έκδοση). Academic Press.ISBN0123526515.
- ↑47,047,147,2ΠΑΠΑΣΑΒΒΑ ΠΑΝΑΓΙΩΤΑ-ΜΑΡΙΑ (Σεπτέμβριος 2010) (PDF).ΣΥΓΧΡΟΝΕΣ ΗΛΕΚΤΡΟΝΙΚΕΣ ΔΙΑΤΑΞΕΙΣ ΜΕ ΟΡΓΑΝΙΚΑ ΗΜΙΑΓΩΓΙΜΑ ΥΛΙΚΑ (Πτυχιακή Εργασία).ΤΕΧΝΟΛΟΓΙΚΟ ΕΚΠΑΙΔΕΥΤΙΚΟ ΙΔΡΥΜΑ ΚΡΗΤΗΣ. ΣΧΟΛΗ ΤΕΧΝΟΛΟΓΙΚΩΝ ΕΦΑΡΜΟΓΩΝ,ΤΜΗΜΑ ΗΛΕΚΤΡΟΛΟΓΙΑΣ. Αρχειοθετήθηκε απότο πρωτότυποστις 2012-04-25.https://web.archive.org/web/20120425053915/http://nefeli.lib.teicrete.gr/browse/stef/hle/2010/PapasavvaPanagiotaMaria/attached-document-1286353402-148590-29228/Papasava2010.pdf.Ανακτήθηκε στις 2011-08-29.
- ↑48,048,148,248,3Γ. Μήτσου.Στοιχεία Θεωρίας Ημιαγωγών(PDF).A.T.E.I. Αθηνών. Γενικό Τμήμα Φυσικής Χημείας & Τεχνολογίας Υλικών. Εργαστήριο Οπτοηλεκτρονικής και Laser. Αρχειοθετήθηκεαπό το πρωτότυπο(PDF)στις 12 Ιανουαρίου 2012.Ανακτήθηκε στις 29 Αυγούστου 2011.
- ↑49,049,1Γιάννης Αριστ. Μπαζάκης=.Γενική Χημεία.Αθήνα.
- ↑50,050,150,2Understanding Chemistry. PERIODIC TABLE GROUP 4 MENU
- ↑51,051,1Γ.Ε. Μανουσάκης (1983).Γενική και Ανόργανη Χημεία (Τόμος 2).Θεσσαλονίκη: Αφοί Κυριακίδη.
- ↑52,052,152,2Freshney periodic table on line
- ↑53,053,153,2Pradyot Patnaik, John A. Dean (2004).Dean's analytical chemistry handbook(2η έκδοση). New York: McGraw-Hill.ISBN0071410600.
- ↑54,054,1J. J. Zuckerman, A. P. Hagen (1991).Inorganic Reactions and Methods, the Formation of Bonds to Group Vib (O, S, Se, Te, Po) Elements, Μέρος 1.0471186589.ISBN0471186589.
- ↑«chem.tamu.edu»(PDF).Αρχειοθετήθηκεαπό το πρωτότυπο(PDF)στις 28 Ιανουαρίου 2018.
- ↑G. Singh (2007).Chemistry of d-block elements.Discovery Publishing House.ISBN8183562426.
- ↑57,057,157,2JACOB A. MARINSKY (Ιουλίου 1961).The Radiochemistry of Germanium(PDF).Subcommittee on Radiochemistry-National Academy of Sciences—National Research Council.Ανακτήθηκε στις 25 Αυγούστου 2011.
- ↑58,058,1M. Satake & S.A. Iqbal, M. Satake (2003).Chemistry Of P-Block Elements.Discovery Publishing House.ISBN8171412688.
- ↑59,059,1J. J. Zuckerman, A. P. Hagen (1989).Inorganic Reactions and Methods, the Formation of Bonds to Halogens.John Wiley and Sons.ISBN0471186562.
- ↑60,060,160,2J. J. Zuckerman (1987). J. J. Zuckerman, επιμ.norganic reactions and methods: The formation of the bond to hydrogen (part 2).John Wiley and Sons.ISBN0471186554.
- ↑American Chemical Society. Committee on Analytical Reagents (2006).Reagent chemicals: specifications and procedures(10η, εικονογραφημένη, επισημειωμένη έκδοση). Oxford University Press.ISBN0841239452.
- ↑62,062,1U.S. Department of Commerce. National Institute of Standards and Technology (NIST)
- ↑63,063,1«Alpha Fusion Electrical Energy Valve»(PDF).Nu Energy Research Institute. Αρχειοθετήθηκεαπό το πρωτότυπο(pdf)στις 1 Οκτωβρίου 2008.Ανακτήθηκε στις 10 Σεπτεμβρίου 2008.
- ↑D. Schmeisser, R.D. Schnell, A. Bogen, F.J. Himpsel, D. Rieger, G. Landgren, and J.F. Morar (1 July 1986).«Surface oxidation states of germanium».Surface Science(Elsevier B.V.)172(2): 455-465.http://www.sciencedirect.com/science/article/pii/0039602886907673.Ανακτήθηκε στις 21/8/2011.
- ↑65,065,165,265,365,465,5Sulekh Chandra (2005).Comprehensive Inorganic Chemistry.New Age International.ISBN8122415121.
- ↑66,066,1Matthias Driess, Heinrich Nöth (2004). Matthias Driess, Heinrich Nöth, επιμ.Molecular clusters of the main group elements(εικονογραφημένη έκδοση). Wiley-VCH.ISBN3527306544.
- ↑67,067,1W. Henderson (2000).Main group chemistry(εικονογραφημένη έκδοση). Royal Society of Chemistry.ISBN0854046178.
- ↑Wai-Kee Li· Gong-du Zhou· Thomas C. W. Mak (2008).Advanced structural inorganic chemistry(εικονογραφημένη έκδοση). Oxford University Press.ISBN0199216940.
- ↑Από "Αγγλο-ελληνικό/Ελληνο-αγγλικό λεξικό Χημείας Πανεπιστημίου Αθηνών": cryp-222[νεκρός σύνδεσμος]
- ↑70,070,170,2Marcel Gielen, Edward R. T. Tiekink (2005). Marcel Gielen, Edward R. T. Tiekink, επιμ.Metallotherapeutic drugs and metal-based diagnostic agents: the use of metals in medicine(εικονογραφημένη έκδοση). John Wiley and Sons.ISBN0470864036.
- ↑71,071,171,2Ian J S Fairlamb (2008). Ian J S Fairlamb, Jason M Lynam, επιμ.Organometallic Chemistry.Royal Society of Chemistry.ISBN0854043535.
- ↑Argentium Sterling MSDS
- ↑Shyy-Hwa Tao and P. Michael Bolger (Ιούνιος 1997).«Hazard Assessment of Germanium Supplements».Regulatory Toxicology and Pharmacology(Academic Press)25(3): 211-219.http://www.sciencedirect.com/science/article/pii/S0273230097910989.Ανακτήθηκε στις 2011-08-15.
- ↑74,074,1Gunnar Nordberg (2007). Gunnar Nordberg, επιμ.Handbook on the toxicology of metals(3η, εικονογραφημένη έκδοση). Academic Press.ISBN0123694132.
- ↑The Physical and Theoretical Chemistry Laboratory Oxford University. MSDS Germanium[νεκρός σύνδεσμος]
- ↑76,076,176,276,376,4Jeanne Mager Stellman (1998). Jeanne Mager Stellman, επιμ.Encyclopaedia of Occupational Health and Safety: Chemical, industries and occupations(4, εικονογραφημένη έκδοση). International Labour Organization.ISBN9221098168.
- ↑National Institute for Occupational Safety and Health (U.S.), Centers for Disease Control and Prevention (U.S.) (2005). Government Printing Office, επιμ.NIOSH Pocket Guide to Chemical Hazards, September 2005, August 2006 (Book)(αναθεωρημένη έκδοση). σελ. 151.ISBN0160727510.Ανακτήθηκε στις 15 Αυγούστου 2011.
- ↑A. Grill (1999).«Electrical and optical properties of diamond-like carbon»(PDF).Thin Solid Films(Elsevier Science S.A.)355-356:189-193. Αρχειοθετήθηκε απότο πρωτότυποστις 2012-09-07.https://web.archive.org/web/20120907213535/http://carbon.utsi.edu/downloads/AGrill_electrical_optical_dlc.pdf.Ανακτήθηκε στις 11/9/2011.
Εξωτερικοί σύνδεσμοι
[Επεξεργασία|επεξεργασία κώδικα]- Theodore Gray: Elements Display
- Mineral Species containing Germanium
- Library of Inorganic Structures: Ge
- Pictures of Germanium, its minerals and applications
- Pure Germanium crystals ~99,9999% picture in the element collection from Heinrich PniokΑρχειοθετήθηκε2016-03-05 στοWayback Machine.
- The Clemens Winkler Medal(Γερμανικά)
| Περιοδικός πίνακας | ||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| ||||||||||||||||||||||||||||||||||||||||||







