User:Hysocc/SMKLMKimia10/Unsursenyawadanpersamaanreaksi
Tata nama secara kimia secara umum
Ikatan ionik
[edit]Formatnya adalah "ion positif + ion negatif". Pada senyawa ionik biner, yaitu yang terdiri dari dua unsur saja, namanya adalah "unsur1 + unsur2+ida". Contoh Na (natrium) dan Cl (klor) menjadi NaCl (natrium klorida). Na dan Br (brom) menjadi NaBr (natrium bromida). Mg dan S menjadi MgS (magnesium sulfida). Untuk yang berikatan dengan oksigen, nama kedua menjadi oksida.
Untuk ionik yang menggunakan logam transisi (misal Fe, Ni, Cu, Co) di depannya, penamaan harus diikuti dengan tingkat oksidasinya yang ditulis dengan angka romawi dalam tanda kurung. Contoh besi (III) oksida adalah bentuk dari Fe2O3,sedangkan besi (II) oksida adalah FeO. Perbedaan keduanya ada pada tingkat oksidasi yang dialami besi dan disesuaikan dengan tingkat oksidasi dari oksigen, yaitu -2.
Pada besi (III), Fe mengalami tingkat oksidasi sebesar +3 (memberikan 3 elektron), sehingga ketika bertemu O2-(membutuhkan 2 elektron) akan menjadi Fe2O3.Sehingga kedua atom Fe akan memberikan enam elektron dan ketiga atom O pun akan menerima enam elektron.
Sedangkan pada besi (II) oksida, Fe mengalami tingkat oksidasi sebesar +2 dan O mengalami tingkat oksidasi -2, sehingga cukup satu Fe dan satu O menjadi FeO.
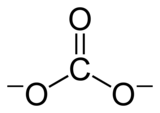
Pada ion poliatomik (ion dengan lebih dari satu unsur), penamaannya adalah sebagai berikut:
 |
 |
 |
 |
 |
|
 |
 |
 |
- amonium (NH4+)
- nitrit (NO2−)
- nitrat (NO3−)
- sulfit (SO32−)
- sulfat (SO42−)
- bisulfat (HSO4−)
- hidroksida (OH−)
- sianid (CN−)
- fosfat (PO43−)
- hidrogen fosfat (HPO42−)
- dihidrogen fosfat (H2PO4−)
- karbonat (CO32−)
- bikarbonat (HCO3−)
- hipoklorit (ClO−)
- klorit (ClO2−)
- klorat (ClO3−)
- perklorat (ClO4−)
- asetat (C2H3O2−)
- permanganat (MnO4−)
- dikromat (Cr2O72−)
- kromat (CrO42−)
- peroksida (O22−)
Senyawa yang diawali dengan hidrogen diberi awalan asam. Misal asam klorida (HCl).
Contoh soal
[edit]- 1. Unsur X dari golongan logam alkali tanah bereaksi dengan ion karbonat (CO32−) membentuk senyawa. Maka senyawa yang terbentuk akan memiliki rumus kimiaXCO3.Karena unsur dari golongan logam alkali tanah (golongan dua) dapat memberikan dua elektron kepada ion karbonat yang membutuhkan dua elektron. Sehingga satu atom X dapat tepat berpasangan dengan satu ion karbonat.
- 2. Unsur Y dari golongan logam alkali bereaksi dengan oksigen membentuk suatu senyawa, maka senyawa yang terbentuk akan memiliki rumus kimiaY2O.Karena unsur dari golongan logam alkali (golongan satu) hanya bisa memberikan satu elektron, sedangkan oksigen membutuhkan dua elektron agar kulit elektron terakhirnya penuh. Maka dibutuhkan dua atom Y untuk mengisi kebutuhkan elektron oksigen.
- 3. Unsur Z dari golongan logam alkali tanah bereaksi dengan unsur A dari golongan halogen, maka senyawa yang terbentuk akan memiliki rumus kimiaZA2.Karena unsur halogen membutuhkan satu elektron agar kulit elektron terluarnya penuh. Sedangkan atom Z dapat memberikan dua elektron. Sehingga butuh dua atom A agar seluruh elektron dari atom Z dapat terserap.

