Fero
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| kemia elemento•metalo | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| kuracilo• elementa minerala klaso • primary metabolite | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ĝeneralaj informoj | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nomo(latine),simbolo,numero | fero (ferrum), Fe, 26 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-numero | 7439-89-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Loko enperioda tabelo | 8 (VIII.B)-agrupo,4-aperiodo,blokod | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Karakteriza grupo | Transiraj metaloj | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| abundeco en terkrusto | 4,7 - 6,2 % | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombro de naturaj izotopoj | 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomaj ecoj | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Relativa atompezo | 55,845(2)amu | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenta radiuso | 125pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrona konfiguracio | [18Ar]3d64s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronojen ĉiuenergia ŝelo | 2, 8, 14, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oksidiĝa nombro | -II,II,III,IV, VI | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fizikaj ecoj | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Materia stato | solida | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristala strukturo | Space centrigita kuba kradeto (0-1179 K; 1674-1811 K), aree centrigita kuba kradeto (1179-1674 K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Denseco | (dum degelpunkto 6,98 g/cm³) 7,86 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Malmoleco | 4,0 (Mohs-skalo) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magneta konduto | Feromagneta(ĝis temperaturo 1043 K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Degelpunkto | 1538°C(1811K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bolpunkto | 2861°C(3134K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molvolumeno | 7,09 · 10−6m3/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boliga varmo | 340kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Premo de satura vaporo | 7,05Pa(je 1808 K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rapido de sono | je 293,15 K: (laŭlonge) 5900 m/s, (diagonale) 3200 m/s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Specifa varmokapacito | 0,1077 kJ/mol aŭ 452 J/(kg · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektra konduktivo | je20°C:10,4·106S/m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektra rezistivo | je20°C:96,1·10-9Ω· m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termika konduktivo | 80,2W/(m · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diversaj | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Redoksa potencialo | (Fe2++ 2e−→ Fe)−0,447 V (Fe3++ 3e−→ Fe) −0,037 V (FeO42-+ 8 H++ 3e−→Fe3++4 H2) 2,2V | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativeco | 1.83 (Pauling-skalo) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Joniga energio | Fe→Fe++e-:762,5 kJ/mol Fe+→Fe2++e-:1561,9 kJ/mol Fe2+→Fe3++e-:2957 kJ/mol Fe3+→Fe4++e-:5290 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jona radiuso | Fe2+:0,61 Å aŭ 0,78 Å(malaltspina kaj altspina aranĝo) Fe3+:0,55 Å aŭ 0,64 Å(malaltspina kaj altspina aranĝo) Fe4+:0,58 Å (0,52*10-10m) Fe6+:0,25 Å (0,25*10-10m)Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Se ne estas indikite alie, estas uzitaj unuoj deSIkajSVP. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

Fero(latineFerrum) estaskemia elementode laperioda tabelokun lasimboloFekajatomnumero26. Ĝi estasmetalo,faktetransirmetalo,de la 4-aperiodokaj de la 8-agrupoen laperioda tabelo.Ĝi estas laŭ maso la plej komuna elemento en laTero,formante multon de la ekstera kaj de la interna kernoj de la Tero. Ĝi estas la kvara plej abunda elemento en laTerkrusto.
En sia metala stato, fero estas rara en laTerkrusto,limigita al la kompono demeteoritoj.Ferercoj,kontraste, estas inter la plej abundaj de la Terkrusto, kvankam elpreni uzeblan metalon el ili postulasfornojnkapablajn atingi1500°Caŭ pli alte, ĉirkaŭ500°Cpli alte ol tio kio estas sufiĉa por fandikupron.Homoj ekregis tiun procezon enEŭrazionur antaŭ ĉirkaŭ 2000 jarojn a.K., kaj la uzado de ferajilojkajarmilojekmalutiligi kuprajnalojojn,en kelkaj regionoj, nur ĉirkaŭ 1200 a.K. Tiu okazaĵo estis konsiderata transiro el laBronzepokoal laFerepoko.En lamoderna mondo,feroalojoj, kielŝtalo,rustorezista ŝtalo,gisferokaj specialaj ŝtaloj estas pro multo la plej komunaj industriaj metaloj, pro siaj altaj mekanikaj propraĵoj kaj malalta kosto.
Praecaj kaj mildaj puraj fersurfacoj estas spegulecaj arĝent-grizaj. Tamen, fero reagas prete kunoksigenokajakvopor havigi brunajn al nigrajnhidratajnferoksidojn, komune konatajn kielrusto.Malkiel la oksidoj de kelkaj aliaj metaloj, kiuj formas pasivajn tavolojn, fera rusto okupas pli da volumeno ol tiuj de la metalo kaj tiel ŝveliĝas, eksponante freŝajn surfacojn al korodo.
La korpo de plenkreska homo enhavas ĉirkaŭ 4 gramojn (0.005% el la korpopezo) da fero, ĉefe enhemoglobinokajmioglobino.Tiuj duproteinojludas esencajn rolojn en lametabolodevertebruloj,respektive por la transporto de oksigeno fare de lasangokaj por la stokado de oksigeno enmuskoloj.Por pluteni la necesajn nivelojn, la homa fermetabolo postulas minimumon da fero en la dieto. Fero estas ankaŭ la metalo aktiva en multaj gravajredoksajenzimojkiuj temas kun la ĉela spirado kaj kun la oksidigo kaj reduktado en plantoj kaj animaloj.[1]
Kemie, la plej oftaj oksidostatoj de fero estas fero-2 kaj fero-3. Fero kunhavas multajn proprecojn de aliajtransirmetaloj,inklude la aliajnelementojn de grupo 8,nomeruteniokajosmio.Fero formas komponaĵojn en ampleksa gamo de oksidiĝaj statoj, nome −2 to +7. Fero ankaŭ formas multajn kunordigajn komponaĵojn; kelkaj el ili, kiel feroceno,ferokzalato,kajPrusia bluo,havas substancajn industriajn, medicinajn aŭ esplorajn aplikadojn.
Gravaj proprecoj[redakti|redakti fonton]
La averaĝa fero-atomohavas 56-oblanmasonde unuhidrogen-atomo. Fero estas la deke plej ofta elemento en launiverso.La metalo estas produktita elfererco,kiu enhavasferan oksidon.La fererco estas reduktata al kruda fero; procedo forigas la malpuraĵojn (ŝlako).
Fero gravasteknikepor la produktado deŝtalo.La ŝtaloj estasalojoj,kiuj enhavas krom fero aliajn metalojn kaj nemetalojn (precipekarbonon).
Laatomkernode fer-izotopo56Fe havas la plej fortan ligenergion jenukleonoel inter ĉiujatomkernoj.Lafuziode la elementoj en lastelojfiniĝas je fero. La pli pezaj elementoj aperas ĉe la eksplodo desupernovao,kiu respondecas ankaŭ pri la disĵeto de la kunkerniĝintaj materioj. Ekzistas hipotezoj, laŭ kiuj en forega estonto (101500jaroj) aperosferaj steloj,konsistantaj el izotopo56Fe, per kiuj finiĝos stela evoluo de la Universo[2].
En spactemperaturo laalotropajmodifoj de la pura fero estas laferitoaŭ α-fero. Tiu-ĉi modifo montraskube spacocentritankristalan kradon,kio estas sub911°C.Sube de laCurie-punktoĉe768°C,la ferito estas feromagneta. La modifo inter768°Ckaj911°Cnomiĝas β-fero. Ĉar ĝi de la α-fero ne diferenciĝas de la ferito en la magnetaj proprecoj, ĝi estas nomata ankaŭ kutime kiel α-fero. Ĝis1392°Cekzistas faco-centrita modifo aŭ aŭsterito. Ĉe pli altiĝanta temperaturo ŝanĝiĝas la fero al δ-ferito, kiu denove montras kube spacocentritan kradon. La fandopunkto estas1539°C.
Fero kiel mineralo[redakti|redakti fonton]

Tre malofte aperas la feropure.Lamineralokristaliĝas tiam en kubakristala kradokaj havas durecon de 4,5 kaj koloron de ŝtalgrizo al nigro. Ankaŭ la kraspa koloro estas griza.
Pro la reakcioj kunakvokajoksigeno,la pura fero ne estas stabila. Ĝi aperas enalojokunnikelonur enferometeoritojkaj enbazaltoj,en kiuj ĝireduktiĝasel la feroentenaj mineraloj.
Terfero,nomita ankaŭercpura fero,estas fero kiu originiĝis sur laTero,kaj estis trovita en metala formo pli ol kielerco.Tera fero estas tre rara, kun nur unu ĉefa konata kuŝejo en la mondo, situanta enGronlando.Terfero similas almeteora fero,en tio ke ĝi enhavas gravajn kvantojn kaj denikelokaj destrukturoj Widmanstatten.Tamen, terfero tipe enhavas nur ĉirkaŭ 3% da nikelo, kio estas tro malmulto ĉe meteoritoj. Estas du tipoj de terfero. Kaj la tipo 1a kaj la tipo 2a enhavas kompareblajn kvantojn de nikelo kaj de aliaj malpuraĵoj. La ĉefa diferenco inter ambaŭ estas la enhavo dekarbono.
Meteora fero,fojemeteordevena fero,[3]estasercpura metalotrovita enmeteoritojkaj farita el elementoj fero kajnikeloĉefe en la formo demineralajfazojkamacitokajtaenito.Meteora fero formas la kernon de laferometeoritojsed ĝi estas trovata ankaŭ en aliaj meteoritoj. Krom minoraj kvantoj deterfero,meteora fero estas la nura nature ekzistanta ercpura metalo de elementa fero ekzistanta sur la surfaco de laTero.
Laferometeoritojestas metalajmeteoritoj,konsistigata elmeteora fero,nomealojode fero kajnikelo,kun varia kvanto da aliaj metaloj:iridio,kromo,galio... Tiuj meteoritoj estis unu el plej praaj feraj fontoj por laferindustrio.Ĉirkaŭ 6% el la meteoritoj estas metalaj, sed ili estas multe pli oftaj en la kolektadoj da meteoritoj ĉar:
- Ili estas pli rekoneblaj disde laŝtonaj meteoritoj,kiuj similas terajn ŝtonojn;
- Ili pli rezistas al laefloresko;
- Ili pli bone rezistas al la eniro enatmosferonkaj restas sub formo de dikaj blokoj.
Rezultas, ke 90% (en maso) de la konataj meteoritoj estas ferometeoritoj. Plej konata estas laHoba Meteorito(enNamibio).
Kelkaj ferenhavaj mineraloj estashematito,magnetito,limonito,siderito,pirotino,epidotoktp.
Metala fero[redakti|redakti fonton]

Metala aŭterkrusta feroestas rare trovita sur la surfaco de la Tero ĉar ĝi tendencas oksidiĝi. Tamen, kaj la ekstera kaj la interna kernoj de laTero,kio estas ĉirkaŭ 35% el la maso de la tuta Tero, ŝajne konsistas el alojoj da fero, eble kunnikelo.Elektraj kurentoj en la likva ekstera kerno ŝajne estas la origino de lamagneta kampode la Tero. La aliajterecplanedoj(nomeMerkuro,Venuso,kajMarso) kaj laLunoŝajne havas metalan kernon konsistanta ĉefe el fero. Ŝajne ankaŭ laasteroidojde tipo M estas parte aŭ ĉefe el alojoj de metala fero.
La rarajfermeteoritojestas la ĉefa formo de natura metala fero en la surfaco de la Tero. Aĵoj faritaj permalvarma forĝadode meteora fero estis trovita en variaj arkeologiaj kuŝejoj datitaj el tempok iam ferfandado ne estis ankoraŭ disvolvigita; kaj laInuitojenGronlandolaŭ informoj uzis feron el la meteorito de Kabo Jorko por iloj kaj ĉasarmiloj.[4]Ĉirkaŭ 1 al 20meteoritojkonsistas el unikaj fer-nikelaj mineralojtaenito(35–80% da fero) kajkamacito(90–95% da fero).[5]
Terkrusto[redakti|redakti fonton]

Kvankam fero estas la plej abunda elemento sur la Tero, ĝi estas enkalkulita nur kiel 5% el laTerkrusto;tiele ĝi estas nur la kvara plej abunda elemento, postoksigeno,silicio,kajaluminio.[6]
Plej el la fero de la krusto estas kombinita kun variaj aliaj elementoj por formi multajn fermineralojn. Grava klaso de feroksidaj mineraloj kielhematito(Fe2O3),magnetito(Fe3O4), kajsiderito(FeCO3), kiuj estas la ĉefajferercoj.Ankaŭ multajmagmorokaĵojenhavas sulfidajn mineralojnpirotinokajpentlandito.[7][8]Dumveterdisfalo,fero tendencas likiĝi el sulfidaj kuŝejoj kiel de sulfatoj kaj de silikatoj kiel hidrokarbonato. Ambaŭ el tiuj estas oksidigitaj en akveca solvaĵo kaj precipitas en eĉ milde alta pH kiel feroksido (III).[9]

Grandaj kuŝejoj de fero estas ferstriaj formaĵoj, nome tipo de rokaĵo konsistanta el ripetitaj fajnaj tavoloj de feroksidoj alternantaj kun bendoj de fer-malabunda "shale" kaj ĉerto (skisto). La ferstriaj formaĵoj kuŝiĝis en la tempo inter antaŭ 3700 kaj 1800 jaroj.[10][11]
Materialoj enhavantaj fajngrundaj fer-(III)-oksidojn aŭ oksid-hidroksidojn, kielokro,estis uzitaj kiel flavaj, ruĝaj kaj brunajpigmentojekde prahistoriaj tempoj. Ili kontribuas ankaŭ al la koloro de variaj rokaĵoj kajargiloj,kiel tute geologiaj formaĵoj kiel en Painted Hills enOregonokaj la rokaĵoj nome "Buntsandstein" ( "kolora sabloŝtono", nome brita "bunter" ).[12]Pere deEisensandstein(nome elbrun-ĵurasia'fera sabloŝtono', ekz. elDonzdorfen Germanio)[13]kaj "Bath stone" en Unuiĝinta Reĝlando, ferkomponaĵoj estas responsaj pri la flaveca koloro de multaj historiaj konstruaĵoj kaj skulptaĵoj.[14]La konata ruĝa koloro de la surfaco deMarsoestas derivita el feroksido-riĉaregolito.[15]
Gravaj kvantoj da fero estas en la fersulfida mineralopirito(FeS2), sed estas malfacile elpreni feron el ĝi kaj tiele ĝi ne estas tre ekspluatata. Fakte, fero estas tiom ofta ke la produktado ĝenerale fokusas nur al ercoj kun tre altaj fer-kvantoj.
Laŭ la informo pri metalkomerco de la "International Resource Panel", la tutmonda komerco de fero funkcianta en la socio estas de 2200 kg por persono. Pli-disvolvigitaj landoj diferencas tiukadre el malpli-disvolvigitaj landoj (7000–14000 kontraŭ 2000 kg por persono).[16]
Uzado[redakti|redakti fonton]

Fero estas kun 95 pez-procentoj la plej ofte uzata metalo en la mondo. La kialo de tio estas la larĝa uzebleco - pro la dureco kaj la tenaceco de alojoj -, kio faras ĝin relative malmultekosta. Multe da estas foruzata en la produktado deaŭtoj,ŝipojkaj en altdom-konstruo (ŝtalbetono).
La fero estas unu el la tri feromagnetaj metaloj (kobaltokajnikeloestas la aliaj du). Tio permesas ĝian teknikan aplikadon de la elektromagnetismo engeneratoroj,transformatorojkajelektromotoroj.
La pura fero uzatas preskaŭ nur en la laborejo. En laindustriodisvastiĝis diversajŝtaloj,kiuj havas la sekvajn formojn:
- Kruda feroentenas 4 - 5%-n dakarbonokaj ankaŭ diversajn kvantojn dasulfuro,fosforokajsilicio.Tio estas interprodukto de la giso- kaj ŝtalproduktado.
- Gisoentenas 2,06 - 6,67%-n da karbono kaj pliajn alojelementojn kiel ekz. silicion kajmanganon.Depende de la malvarmiga rapido, la karbono aperas en la giso kielkarbidoaŭ elementa kielgrafito.Rigardante la aspekton de la romposurfaco, oni parolas en la unua okazo pri blanka kaj en la dua okazo pri griza giso. Giso estas malmola kaj neplaste deformebla.
- Ŝtaloentenas inter 0,06%-n kaj 2,06%-n da karbonon. Male al giso, ĝi estas tre elasta kaj formebla. La mekanikaj ecoj de la ŝtaloj povas varii inter larĝaj limoj ĉe alojproduktoj, kiuj produktiĝas per konvena kombino de termaj traktadoj kaj fizikaj prilaboroj, kaj aldono de alojmaterialo.
Francisko Azorínpost difini la terminonferokielPeza, forĝebla metalo, uzata por plej diversaj konstruelementoj, instrumentoj, iloj, maŝinoj k.c.,[17]li indikasetimologionel lalatinaferrumkaj li aldonas teknikajn terminojn kiajferaĵo,por fera objekto; ferlado; ferrubo;fervojo;feristo; feraĵisto; platfero; angulfero; ronda fero; fandfero; forĝfero;gisfero;kruda fero;dolĉa fero; magneta fero; oligista fero; karbona fero; hidrata fero; silica fero; profilita fero; lamenita fero; kajFerotipio,por arto brilantigi fotografaĵon.[18]
Azorín mem klarigas pri du tipoj de uzado de feraĵoj, nome laZo-ferokaj laZoresa fero.Laŭ AzorínZo-feroestasPeco, trabo, kies transversa profilo formas Z.[19]Li indikasetimologionel Z, propra nomo de la lasta alfabeta litero. Kaj li aldonas la terminojnnormala Zo-fero,Zo-fero kun aloj malegalaj,Zo-fero kun alo oblikva,Zo-profilokajZo-formo.[18]TiukadreZoresa feroestasFeraĵ, trabo, peco, kies transversa profilo estas V-forma.[20]Li indikasetimologionel Zorés, propra nomo de franca inĝeniero, 19ª jc.[18]
Historio[redakti|redakti fonton]

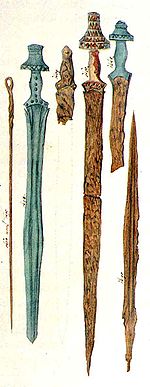
Okcident-Azio[redakti|redakti fonton]
La plej malnova homa aplikado de la fero okazis enSumerokajEgiptio,ĉirkaŭ en 4000 a. K. Temas pri pura fero demeteorŝtonoj(aerolitoj), kiuj uzatis kiel ornamaĵo aŭ lancopinto. Ĝi estis prilaborita ne per metodoj kiel fandado aŭ forĝado, sed per metodoj de la ŝtonprilaboro (ŝtonepoko).
El inter 3000 kaj 2000 a. K., oni trovis fanditajn ferojn (ĝi estas distingebla de la aerolitoj per la ĉeesto de nikelo) enMezopotamio,Anatoliokaj Egiptio. Ĝi uzatis ŝajne nur ceremonie kaj estis pli multekosta oloro.Ties origino necertas; laŭ unu ebleco ĝi estas la flankprodukto de la bronzoproduktado kiel spongofero.
Inter 1600 kaj 1200 a. K., la fero uzatis pli ofte, sed ĝi ankoraŭ ne anstataŭigis la bronzon. Ekde 1200 montriĝis enOkcidenta Aziola trairo de labronzepokoal laferepoko.Oni supozas, ke la trairo okazis ne pro la supereco de la fero, sed pro manko destano(necesa por la bronzoproduktado).
Ĉe la unuaj paŝoj de la ŝtonepoka fandado estiĝis spongofero. Per la uzado delignokarboĉe la plulaborado ligiĝis al fero karbono, tiel finfine estiginte ŝtalon (eble nur surface). Perhardado(k.e. abrupta malvarmigo, i.a. en likvaĵo) estiĝis laborpecoj kun elasteco kaj hardeco, kiuj superis tiujn elbronzo.
Hindio[redakti|redakti fonton]
La pilieroj starigitaj de imperiestroAŝokoestas el fero aparte pura, kaj kiuj de pli ol 2000 jaroj ne rustiĝis, spite la malsekan veteron. Ties pureco estas ege pli granda ol tio, kio eblas per la modernaj teknikoj; historiistoj opinias, ke estis uzata meteora fero. Pri tio vidu ekzemple artikolon priFera Piliero de Delhio.
Daniel Moiranden sia listo de proponitaj vortoj por sia traduko deLa Libro de la mirindaĵojdeMarko Polonotas la vorton "andaniko" por bonkvalita fero uzata por armiloj, vorto devena el la greka "indianiko".[21]
Ĉinio[redakti|redakti fonton]
Ankaŭ enĈiniookazis la unuaj spertoj per feroj el meteorŝtonoj. Oni trovis la unuajn arkeologiajn spurojn de forĝitaj feroj nord-okcidente, malproksime alŜinĝango,datitajn al la8-a jarcento a.K..Oni supozas, ke tiuj ĉi produktoj estis importitaj elOrienta Azio.En ĉirkaŭ 550 a. K. okazis la teknika eltrovo de altfornegoj, kio ebligis la produktadon de gisoj.
Eŭropo[redakti|redakti fonton]
Ĉar la prilabora tekniko atingis nur ĉirkaŭ1.300°C-n, la evoluo de la fandado okazis nur en la14-a jarcentoenSvedio.Tio disvastiĝis per la uzado de kanonkugloj dise en Eŭropo.
Kiam la malaperantaj arbaroj jam ne kovris la bezonon je lignokarbo, estis evoluigita lakoaksofare deAbraham Darbykiel alternativa bazmaterialo por la feroproduktado. Tiu ŝanĝo kun la eltrovo de lavapormaŝinosignifis la komencon de laindustria revolucio.
Trovejoj[redakti|redakti fonton]

La fero kune kun nikelo estas verŝajne la ĉefa parto de laterkerno.La ŝanĝiĝo de la interna solida fero kaj lalikvaekstera fero de la terkerno produktas verŝajne latermagnetan kampon. La fero estas la plej ofta elemento de laterkrustokun proporcio de 5%. La unuaj fontoj, kiujn oni ekspluatis, estis la tielnomataj gazonferoercoj kaj la liberaj ercoj, ekstere kuŝantaj. Hodiaŭ jam 40 % estasmagnetaferoerco.
La plej grava materialo por la feroproduktado estas lahematito,kies grandparto konsistas el Fe2O3.La fero estas produktata per kemia redukto pere de karbono enaltforno,kie estiĝastemperaturode ĉirkaŭ2000°C.Oni aldonas unuekokson,kiu reakcias kun laoksigenode la aero alkarbona monoksido:

- 2 C + O2→ 2 CO
La karbona monoksido reakcias kun fera oksido:
- 3 CO + Fe2O3→ 2Fe + 3CO2
La estiĝanta fero estas likva pro la alta reakcia temperaturo. La produkto cetere enhavas ankoraŭ malpuraĵojn ekz.silician dioksidon.Per la aldono dekalko(CaCO3), la silicia oksido departiĝas kielŝlako.La unua reakcia paŝo ŝanĝas la kalkon al kalcia monoksido:
- CaCO3→ CaO + CO2
Poste la kalcia monoksido reagas kun silicia dioksido:
- CaO + SiO2→ CaSiO3
La estiĝinta ŝlako uzatas en la subtera konstruado (uzatis pli frue kiel sterkaĵo).
Oni ekspluatis en jaro 2000 tutmonde ĉirkaŭ 1.000 megatunojn de feroerco, en valoro de ĉirkaŭ 25 miliaroj da eŭroj. La plej grandaj liverantoj de feroerco estasĈinio,Brazilo,Aŭstralio,RusiokajBarato.Ili liveras kune la 70% de la monda bezono. Oni produktas el 1.000 Mt de ercoj ĉirkaŭ 572 Mt da fero. Oni povas gajni ankoraŭ plian feron el la defalaĵo.
Ekspluatado[redakti|redakti fonton]

La feroerco estas ekspluatata surtere aŭ subtere. Surtera ekspluatado (tiel malmultekosta) okazas hodiaŭ enSudameriko(Brazilo), en okcidentaAŭstralio,Ĉinio,UkrainiokajKanado.En landoj, kie la facilaj trovejoj jam pli frue estis ekspluatitaj, la minado de la feroercoj malpligrandiĝis.
Ĉiama problemo estas la rekultivado de la forlasitaj minejoj.
Aktuale unu el la plej grandaj kuŝejoj da fero de la mondo (konkurence kun Carajás en Brazilo) estas Cerro Mutún, en ladepartamento de Santa Cruz,Bolivio;tiu kuŝejo havas inter 40 000 kaj 42 000 milionojn da ekspluatotaj tunoj proksimume (40% de la tutmondaj rezervejoj).
Rezervejoj da fero en la mondo[redakti|redakti fonton]
Informo disponebla por la ebla elfosado (2019):[22]
| Rango | Lando | Milionoj da tunoj |
|---|---|---|
| 1 | 50 000 | |
| 2 | 32 000 | |
| 3 | 25 000 | |
| 4 | 20 000 | |
| 5 | 6500 | |
| 6 | 6000 | |
| 7 | 5400 | |
| 8 | 2900 | |
| 9 | 2700 | |
| 10 | 2500 | |
| 11 | 1300 | |
| 12 | 1200 | |
| 13 | 18 000 |
Kemiaj ligoj[redakti|redakti fonton]

La fero ligas oksidojn 2- aŭ 3-valore. Ĉar la fero ne havas iun defendan tavolon, ĝi oksidiĝas (rustiĝas).
Oftaj oksidaj statoj kaj ligoj:
- Fe2+,
- Fe3+,
- Fe4+,troviĝas en kelkajenzimoj(ekz.peroksidazo).
- Fe6+,estas malofta (ekz. K2FeO4)
- Fe3C
La Fe2+kaj Fe3+jonoj povas aperi kiel solvebla aŭ nesolveblaBerlina bluo(malhelblua kombinaĵo) per kalia heksacianferato (II/III) (uzatas ĉe 2+ III kaj 3+ II).
Izotopoj[redakti|redakti fonton]

La fero havas 4 naturajn stabilajnizotopojn,relative oftajn:54Fe (5.8%),56Fe (91.7%), 57Fe (2.2%) kaj58Fe (0.3%). La izotopo60Fe havasduoniĝan temponde 1,5 miliono da jaroj. La ekziston de60Fe ĉe apero de la planeda sistemo pruvis korelativeco inter ofteco de60Ni,produkto de60Fe, kaj la ofteco de la stabila Fe-izotopo en kelkajmeteorŝtonoj(ekz. ĉeSemarkonakajĈervoni Kut).
Hodiaŭ ĉiu originala (estante ĉe la formiĝo de laplanedoj)60Fe tute al60Ni transformiĝis. La diferenco de nikel- kaj fero-izotopoj en la meteorŝtonoj permesas la mezuradon de izotop- kaj elementoftecon ĉe estiĝo de laSunsistemokaj la ekkonon de la regantaj cirkonstancoj antaŭ kaj dum la estiĝo de la Sunsistemo.
Nur la feroizotopo57Fe havas kernanspinonkaj pro tio uzatas en kemio kaj biologio.
Biologio[redakti|redakti fonton]
Fero estas esencaoligoelementopor preskaŭ ĉiu vivulo. Kiel centra atomo enhemoglobinokajmioglobino,troviĝas ĝi en multaj bestoj kaj respondecas pri la transportado kaj uzado de oksigeno. Tio estas en tiujproteinojĉirkaŭitaj perporfirinaringo. Fero estas parto de fer-sulfura komplekso en multaj enzimoj kiel ekz.nitrogenazokajhidrogenazo.La tria grava grupo de la feroenzimoj estas la t.n. nehema feroenzimo, ekz. metan-monooksigenazo, ribonukleotid-reduktazo kaj la hemoeritrino. Tiuj ĉi proteinoj funkciigas en diversaj organismoj la oksigen-aktivigon,oksigentransporton,redoksajn reakciojnkajhidrolizon.
La infektajbakteriojuzas ofte feron, tiel la defenda mekanismo de la korpo aperas kiel la ’’kaŝado’’ de la fero.
Rimedoj de singardo[redakti|redakti fonton]
Kvankam la fero estas gravaspurelementopor la homo, la tro multa fero en la korpo povas estitoksa.La granda kvanto de Fe2+-jonoj reagas kun peroksidoj, tiel estiĝas liberaj radikoj. La korpo kontrolas en normala stato la ferocirkulon.
Ĉirkaŭ 1 gramo da fero kaŭzas ĉe dujara infano seriozajn venenajn aperaĵojn, 3 gramo eble letale. La fero akumuliĝas en lahepatokaj kaŭzas tie siderozon (akumuliĝo de feraj saloj) kaj damaĝojn de la organo. Tiel oni proponas la feraĵojn nur ĉe feromanko.
Kombinaĵoj[redakti|redakti fonton]
Referencoj[redakti|redakti fonton]
- ↑Iron.Micronutrient Information Center, Linus Pauling Institute, Oregon State University, Corvallis, Oregon (Aprilo 2016). Alirita 6a de marto 2018.
- ↑Time without end: Physics and biology in an open universe, Freeman J. Dyson, Reviews of Modern Physics 51 (1979), pp. 447–460, doi:10.1103/RevModPhys.51.447.
- ↑Rehren T, et al., "5,000 years old Egyptian iron beads made from hammered meteoritic iron", Journal of Archaeological Science 2013text
- ↑Buchwald, V F (1992). “On the Use of Iron by the Eskimos in Greenland”,Materials Characterization29(2),p. 139–176.doi:10.1016/1044-5803(92)90112-U.
- ↑Emiliani, Cesare. (1992)Planet earth: cosmology, geology, and the evolution of life and environment.Cambridge University Press,p. 152.ISBN 978-0-521-40949-0.
- ↑Morgan, John W. (1980). “Chemical composition of Earth, Venus, and Mercury”,Proc. Natl. Acad. Sci.77(12),p. 6973–77.doi:10.1073/pnas.77.12.6973.
- ↑Pyrrhotite.Mindat.org. Alirita 2009-07-07.
- ↑Klein, Cornelis kaj Cornelius S. Hurlbut, Jr. (1985)Manual of Mineralogy,Wiley, 20th ed, pp. 278–79(ISBN 0-471-80580-7)
- ↑Greenwood kaj Earnshaw, p. 1071
- ↑(2009) “Early Earth: Oxygen for heavy-metal fans”,Nature461(7261),p. 179–181.doi:10.1038/461179a.
- ↑(1973) “Paleoecological Significance of the Banded Iron-Formation”,Economic Geology68(7),p. 1135–43.doi:10.2113/gsecongeo.68.7.1135.
- ↑Dickinson, Robert E. (1964).Germany: A regional and economic geography(2a eld.). London: Methuen.
- ↑Naturwerksteine in Baden-Württemberg.Landesamt für Geologie, Rohstoffe und Bergbau, Baden-Württemberg
- ↑Tales From The Riverbank.Minerva Stone Conservation. Alirita 22a de septembro 2015.
- ↑(2007) “Two earth years of Mössbauer studies of the surface of Mars with MIMOS II”,Hyperfine Interactions170(1–3),p. 169–77.doi:10.1007/s10751-007-9508-5.
- ↑Metal Stocks in Society: Scientific synthesis,2010, International Resource Panel, UNEP
- ↑Francisko Azorín,arkitekto,Universala Terminologio de la Arkitekturo(arkeologio, arto, konstruo k. metio), Presejo Chulilla y Ángel, Madrido, 1932, paĝo 73.
- ↑18,018,118,2Azorín, samloke.
- ↑Francisko Azorín,arkitekto,Universala Terminologio de la Arkitekturo(arkeologio, arto, konstruo k. metio), Presejo Chulilla y Ángel, Madrido, 1932, paĝo 214.
- ↑Francisko Azorín,arkitekto,Universala Terminologio de la Arkitekturo(arkeologio, arto, konstruo k. metio), Presejo Chulilla y Ángel, Madrido, 1932, paĝo 215.
- ↑Marko Polo,La Libro de la mirindaĵoj, aŭ La priskribo de la mondo,traduko, notoj, antaŭparolo, epilogo kaj postparolo deDaniel Moirand,publikigisUEA,Rotterdam,2001(Serio Oriento-Okcidento,n-ro 34, 445 paĝoj, p. 52) ISBN = 92-9017-075-1
- ↑Iron Ore Statistics and Information[1]U.S. Geological Survey.
Literaturo[redakti|redakti fonton]
- Garritz, Andoni (1998). Química. Pearson Educación. p. 856.ISBN 978-9-68444-318-1.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2a eld.). Butterworth-Heinemann.ISBN 978-0-08-037941-8.
- Parry, Robert W. (1973). Química: fundamentos experimentales. Reverte. p. 703.ISBN 978-8-42917-466-3.
- H.R. Schubert, History of the British Iron and Steel Industry... to 1775 AD (Routledge, London, 1957)
- R.F. Tylecote, History of Metallurgy (Institute of Materials, London 1992).
- R.F. Tylecote, "Iron in the Industrial Revolution" in J. Day and R.F. Tylecote, The Industrial Revolution in Metals (Institute of Materials 1991), 200–60.
- Weeks, Mary Elvira; Leichester, Henry M. (1968). "Elements known to the ancients". Discovery of the elements. Easton, PA: Journal of Chemical Education. pp. 29–40.ISBN 0-7661-3872-0.LCCN 68-15217.
Vidu ankaŭ[redakti|redakti fonton]
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

