Terpeno

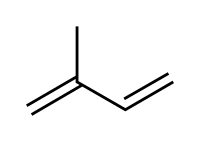

Losterpenos[1] eisoprenoidesson una vasta y diversa clase de compuestos orgánicos derivados delisopreno(o 2-metilbuta-1,3-dieno), unhidrocarburode 5átomosdecarbono.Tradicionalmente se han considerado derivadas del 2-metil-butadieno, más conocido como isopreno.
Esta llamada «regla del isopreno» ha permitido clasificarlos y estudiarlos, pero realmente los terpenos no derivan del isopreno ya que este nunca se ha encontrado como producto natural. El verdadero precursor de los terpenos es elácido mevalónico,el cual proviene del acetil coenzima A. El nombre proviene de que los primeros miembros de esta clase fueron derivados de la trementina oaguarrás(eninglés:“turpentine”,enalemán:“terpentin”).[2] Cuando los terpenos son modificados químicamente, por ejemplo poroxidacióno reorganización del esqueleto hidrocarbonado, suelen denominarseterpenoides(como lavitamina Aoretinol,que contiene un átomo deoxígeno).
Los terpenos son el principal constituyente de losaceites esencialesde algunas plantas y flores, como ellimoneroy elnaranjo.
Generalidades
[editar]Los terpenos se originan porpolimerizaciónenzimáticade dos o más unidades de isopreno, ensambladas y modificadas de muchas maneras diferentes. La mayoría de los terpenos tienen estructuras multicíclicas, las cuales difieren entre sí no solo en grupo funcional sino también en su esqueleto básico de carbono. Los monómeros generalmente son referidos como unidades de isopreno porque la descomposición por calor de muchos terpenos da por resultado ese producto; y porque en condiciones químicas adecuadas, se puede inducir al isopreno a polimerizarse en múltiplos de 5 carbonos, generando numerosos esqueletos de terpenos. Por eso se relaciona a los terpenos con el isopreno, si bien se sabe ya desde hace más de 100 años que el isopreno no es el precursor biológico de esta familia de metabolitos.[2]
Son sintetizados por las plantas, donde son importantes en numerosas interacciones bióticas (Goodwin 1971).[3] En las plantas los terpenos cumplen muchas funciones primarias: algunos pigmentoscarotenoidesson terpenos, también forman parte de laclorofilay las hormonasgiberelinayácido abscísico.Los terpenos también cumplen una función de aumentar la fijación de algunas proteínas a las membranas celulares, lo que es conocido comoisoprenilación.Losesteroidesyesterolesson producidos a partir de terpenos precursores.
Los terpenos de las plantas son extensamente usados por sus cualidades aromáticas. Juegan un rol importante en lamedicina tradicionaly en los remedios herbolarios, y se están investigando sus posibles efectos antibacterianos y otros usos farmacéuticos. Están presentes, por ejemplo, en las esencias deleucalipto,los sabores delclavoy eljengibre.También en elcitral,mentol,alcanfor,y loscannabinoides.
Clasificación
[editar]
Los terpenos sonhidrocarburosque pueden verse como una combinación de numerosas unidades isopreno, por lo general unidas de forma cabeza-cola, pero también pueden darse combinaciones cabeza-cabeza y algunos compuestos están formados por uniones cabeza-medio. Los terpenoides pueden ser considerados como terpenos modificados donde grupos metilo han sido reacomodados o removidos, o a los que se les han añadido átomos de oxígeno. Algunos autores usan el término terpeno para referirse a los terpenoides.
La clasificación de los terpenos según su estructura química, es similar a la de los terpenos, los cuales son clasificados con base al número de unidades isopreno presentes y en el caso de los triterpenos, si están ciclados. Se los clasifica en:
- Hemiterpenos.Los terpenos más pequeños, con una sola unidad de isopreno. Poseen 5 carbonos. El hemiterpeno más conocido es elisoprenomismo, un producto volátil que se desprende de los tejidos fotosintéticamente activos.
- Monoterpenos.Terpenos de 10 carbonos. Llamados así porque los primeros terpenos aislados delaguarrásen los 1850s, fueron considerados la unidad base, a partir de la cual se hizo el resto de la nomenclatura. Los monoterpenos son mejor conocidos como componentes de las esencias volátiles de las flores y como parte de losaceites esencialesde hierbas y especias, en los que ellos forman parte de hasta el 5 % en peso de la planta seca. Algunos de los más importantes son elPineno(presente en los pinos), elMirceno(presente en el lúpulo), elLimoneno(presente en los cítricos) o elLinalool(presente en la Lavanda).[4]
- Sesquiterpenos.Terpenos de 15 carbonos (es decir, terpenos de un monoterpeno y medio). Como los monoterpenos, muchos sesquiterpenos están presentes en los aceites esenciales. Además muchos sesquiterpenos actúan comofitoalexinas,compuestos antibióticos producidos por las plantas en respuesta a la aparición de microbios, y como inhibidores de la alimentación ( "antifeedant" ) de los herbívoros oportunistas. La hormona de las plantas llamadaácido abscísicoes estructuralmente un sesquiterpeno, su precursor de 15 carbonos, laxantosina,no es sintetizada directamente de 3 unidades isopreno sino producida por un "cleavage" asimétrico de un carotenoide de 40 unidades.
- Diterpenos.Terpenos de 20 carbonos. Entre ellos se incluye elfitol,que es el lado hidrofóbico de la clorofila, las hormonasgiberelinas,los ácidos de lasresinasde lasconíferasy las especies delegumbres,las fitoalexinas, y una serie de metabolitos farmacológicamente importantes, incluyendo eltaxol,un agente anticáncer encontrado en muy bajas concentraciones (0,01% de peso seco) en la madera del tejo ( "yew" ), yforskolina,un compuesto usado para tratar elglaucoma.Algunas giberelinas tienen 19 átomos de carbono por lo que no son consideradas diterpenos porque perdieron un átomo de carbono durante una reacción de "cleavage".
- Sesterterpenoides.Terpenos de 25 carbonos.
- Triterpenos.Terpenos de 30 carbonos. Son por lo general generados por la unión cabeza-cabeza de dos cadenas de 15 carbonos, cada una de ellas formada por unidades de isopreno unidas cabeza-cola. Esta gran clase de moléculas incluye a losbrassinoesteroides,componentes de la membrana que sonfitoesteroles,algunas fitoalexinas, varias toxinas y "feeding deterrents", y componentes de las ceras de la superficie de las plantas, como elácido oleanólicode lasuvas.
- Tetraterpenos.Terpenos de 40 carbonos (8 unidades de isopreno). Los tetraterpenos más prevalentes son los pigmentoscarotenoidesaccesorios que cumplen funciones esenciales en la fotosíntesis.
- Politerpenos.Los politerpenos, que contienen más de 8 unidades de isopreno, incluyen a los transportadores de electrones que son quinonas preniladas ( "prenylated quinone electron carriers" ) como laplastoquinonay laubiquinona,también poliprenoles de cadena larga relacionados con las reacciones de transferencia de azúcares (por ejemplo eldolicol), y también a enormemente largos polímeros como el caucho o goma natural ( "rubber" ), usualmente encontrado en ellátex.
- Meroterpenos.Así se llama a los metabolitos secundarios de las plantas que tienen orígenes sólo parcialmente derivados de terpenos. Por ejemplo, tanto lascitokininascomo numerososfenilpropanoidescontienen cadenas laterales de un isoprenoide de 5 carbonos. El principio activo de la marihuana son loscannabinoides,los cuales tienen una porción molecular de origenpolicétidoy la otra es terpénica. Algunosalcaloides,como las drogas anticáncervincristinayvinblastina,contienen fragmentos terpenos en sus estructuras. Además algunas proteínas modificadas incluyen una cadena lateral de 15 o 20 carbonos que es un terpeno, que es el que ancla la proteína a la membrana.
- Esteroides.Triterpenos basados en el sistema de anillosciclopentanoperhidrofenantreno( "cyclopentane perhydro-phenanthrene ring system "). Buchananet al.no los consideran terpenos.[2]
Biosíntesis
[editar]
Los terpenos se forman a través de uniones de unidades biológicas de isopreno. La unión de dos monómeros de acuerdo a laRegla Isoprénica de Wallachpueden dar el precursorpirofosfato de geranilo (GPP).Los terpenos irregulares, tales como el ácido crisantémico de laspiretrinas,no siguen esta regla. El pirofosfato de geranilo es precursor de losmonoterpenos.La incorporación de otra unidad isoprénica da como producto elpirofosfato de farnesilo (FPP),precursor de lossesquiterpenos.Una unidad más forma elpirofosfato de geranilgeranilo (GGPP),el cual es el compuesto base para formarditerpenos.Elescualeno,precursor de triterpenos y esteroides, se forma por la dimerización de dos unidades de FPP, mientras que elfitofluoeno,compuesto base para los carotenoides, se obtiene de manera homóloga por dimerización del GGPP. Los politerpenos se forman por uniones isoprénicas múltiples y repetitivas, y por regla general no presentan ciclizaciones.

Las unidades de isopreno pueden ser biosintetizadas por medio de dos vías:
- A través de intermediarios de laRuta del Ácido Mevalónico (MVA)
- A partir de compuestos derivados de laRuta del 2-C-metil-D-eritritol 4-fosfato,denominada tambiénRuta de la 5-Fosfono-1-Desoxi-D-Xilulosa (DXP).Originalmente se pensaba que los precursores biosintéticos de todos los terpenos provenían de la ruta MVA, hasta que recientemente se descubrió que diversos terpenos en plantas y bacterias se producen mediante la ruta DXP.[5]
Ruta del ácido mevalónico
[editar]Esta ruta biosintética parte de dos unidades deacetil coenzima A(Ac-CoA),en donde se condensan por medio de unareacción tipo Claisenpara daracetoacetil-CoA (AcAcCoA).Esta molécula se vuelve a condensar con una tercera unidad de AcCoA para dar como producto3-hidroxi-3-metilglutaril-CoA (HMG-CoA)como intermediario. El tioéster de la coenzima A se reduce para formar el aldehído correspondiente, elmevaldehído (MVA),el cual se reduce aácido mevalónico(MEV).Por acción de dos moléculas de adenosin trifosfato (ATP) el mevalonato se fosforila (MEV-PyMEV-PP) y descarboxila para dar como productos los precursores de los terpenos, elpirofosfato de isopentenilo (IPP)y su isómero, elpirofosfato de dimetilalilo (DMAPP).La ruta del mevalonato es prácticamente universal y se lleva a cabo en elcitosol.Por esta ruta se sintetizan principalmente sesquiterpenos, triterpenos y politerpenos.[6]

Enzimas:
- EC 2.3.1.9 Acetoacetil-CoA sintetasa (AACoAS).
- EC 2.3.3.10 3-Hidroxi-3-metilglutaril-CoA sintasa (HMGCoAS).
- EC 1.1.1.34 3-hidroxi-3-metilglutaril-CoA reductasa (HMGCoAR).
- EC 2.7.1.36 Mevalonato quinasa (MEVK).
- EC 2.7.4.2 Fosfomevalonato quinasa (PMK).
- EC 4.1.1.33 Mevalonato 5-difosfato descarboxilasa (MDD).
- EC 5.3.3.2 Difosfato de isopentenilo isomerasa (IPPI)
Ruta de la 5-Fosfono-1-Desoxi-D-Xilulosa
[editar]Flesch observó en 1988 que los patrones de marcaje isotópico en terpenos hopanoides de las bacteriaRhodopseudomonasno coincidían con los correspondientes por una biosíntesis mevalónica.[7] Estudios posteriores encontraron que existía una segunda alternativa independiente del mevalonato para biosintetizar unidades isoprénicas en bacterias y plantas. En esta ruta, una unidad deácido pirúvico (Pyr),proveniente de la degradación decarbohidratos,se condensa en una reacción deUmpolungdel grupo carbonilo del piruvato con el grupo carbonílico delD-gliceraldehído(G3P),para dar la5-Fosfono-1-desoxi-D-xilulosa (DXP).Por medio de uncondensación aldólicainversa, el carbono 1 transpone hacia la posición 2, generando así el4-fosfono-2-C-metil-D-eritritol (MEP).Este intermediario se conjuga por medio de una sustitución nucleofílica con una unidad de citidilribósido, por acción delCTP,para formar4-(CDP)-2-C-metil-D-eritritol (CDP-ME).Este compuesto se fosforila en el carbono 2, donde se forma el intermediario fosforiladoCDP-EMPy desplaza el citidilribósido para obtenerse el2-C-metil-D-eritritol-2,4-ciclofosfato (MEcPP).Por ruptura reductiva del ciclo se da una reacción de eliminación para formar elpirofosfato de 4-hidroxi-3-metil-but-2-enilo (HMB-PP).El paso final consiste en la eliminación del grupo hidroxilo para obtenerse el catiónalílicocorrespondiente, el cual puede transponerse de tal forma que se isomerizan de manera reversible el IPP y el DMAPP. Esta ruta se lleva a cabo sobre todo en losplástidosde las plantas y en muchas células procariontes. Por esta ruta se sintetizan sobre todo monoterpenos, diterpenos y carotenoides.
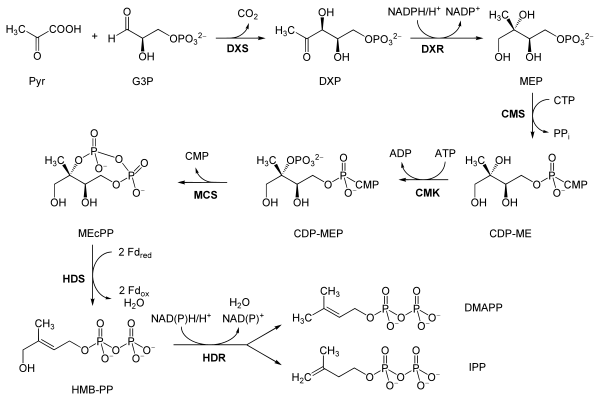
Enzimas:
- EC 2.2.1.7 5-Fosfono-1-desoxi-D-xilulosa sintasa (DXS)
- EC 1.1.1.267 5-Fosfono-1-desoxi-D-xilulosa reductoisomerasa (DXR)
- EC 2.7.7.60 2-C-metil-D-eritritol 4-fosfato citidililtransferasa (CMS)
- EC 2.7.1.148 4-difosfocitidil-2-C-metil-D-eritritol quinasa. (CMK)
- EC 4.6.1.12 2-C-metil-D-eritritol 2,4-ciclodifosfato sintasa (MCS)
- EC 1.17.7.1 4-hidroxi-3-metilbut-2-en-1-il difosfato sintasa (HDS)
- EC 1.17.1.2 4-hidroxi-3-metilbut-2-enil difosfato reductasa (HDR)
Funciones
[editar]Da coloración a los órganos vegetales y participa en la síntesis de las vitaminasA,KyE.Por ejemplo, da origen a la pigmentación anaranjada de lazanahoria.
La formación de terpenos en plantas, animales y microorganismos es hecha por enzimas muy similares, pero hay importantes diferencias en los procesos. En particular, las plantas producen una variedad muchísimo mayor que la que producen los animales o los microbios, y esta diferencia está reflejada en la compleja organización de labiosíntesisde los terpenos de las plantas al nivel del tejido, celular, subcelular, y genético. La biosíntesis de los terpenos está compartimentalizada, como también lo está la formación de su precursor el IPP. La producción de grandes cantidades de terpenos así como su subsecuente acumulación, emisión o secreción es casi siempre asociada con la presencia de estructuras anatómicamente altamente especializadas. Por ejemplo lostricomasglandulares y las cavidades secretorias de las hojas, y la epidermis glandular de los pétalos generan y almacenan o emiten terpenos que son aceites esenciales importantes para la polinización por insectos. Los conductos y ampollas de resina de las coníferas producen y acumulan unaresinadefensiva consistente en aguarrás ( "turpentine", o "monoterpene olefins" ) y rosina (ácidos resinosos diterpenos). Las ceras superficiales triterpenos son formadas y excretadas por una epidermis especializada, y los laticíferos producen ciertos triterpenos y politerpenos como el "rubber". Estas estructuras especializadas secuestran a los metabolitos secundarios lejos de los procesos metabólicos sensibles y así previenen la autotoxicidad. Muchas estructuras de este tipo son no fotosintéticas y por lo tanto dependen de células adyacentes para suplirse del carbono y la energía necesarios para biosintetizar los terpenos.
Algunos terpenos que se consideran como nutrientes: retinaldehído, elretinol,loscarotenos,lostocoferoles,lasquinonasy lasubiquinonas.Se utiliza el término vitamina A para el retinol y los carotenos; vitamina E para los tocoferoles y vitamina K para las quinonas. La vitamina A participa en elciclo visual,que permite la adaptación de losbastones retinianosa la oscuridad; mantenimiento de epitelios;respuesta inmunitaria;elgusto;laaudicióny elcrecimiento.
Según diversos reportes (Ben Shabat 1998, Ethan Russo 2001, 2011) los terpenos secretados por el cannabis modulan el efecto de los cannabinoides en el organismo, creando una sinergia que potencia sus propiedades.[8]
Rol de los terpenos en Botánica Sistemática
[editar]Algunos tipos de terpenos fueron extensamente utilizados en Botánica Sistemática para establecer relaciones de parentesco entre taxones de organismos.[9] Algunos de ellos son:
- Losaceites esencialesson característicos de losMagnoliales,Laurales,Austrobaileyales,yPiperales,y también de otros clados poco emparentados con estos, comoMyrtaceae,Rutaceae,Apiales,Lamiaceae,VerbenaceaeyAsteraceae.
- Laspiretrinasson una mezcla de compuestos orgánicos que se encuentran de modo natural en lasfloresde plantas del géneroChrysanthemum,comoChrysanthemum cinerariaefolium(denominadopiretroopelitre) oChrysanthemum coronarium.[10]
- Laslactonas sesquiterpénicasson conocidas principalmente en lasAsteraceae,pero también están presentes en otras familias, comoApiaceae,MagnoliaceaeyLauraceae.
- Elbetulinoles un triterpeno presente enBetula papyriferay especies relacionadas.
- Lassaponinas triterpénicasestán presentes en lasApiaceaeyPittosporaceae.
- Loslimonoidesycuasinoidesson derivados de triterpenos presentes enRutaceae,MeliaceaeySimaroubaceaede losSapindales.
- Loscardenólidosson glicósidos de un esteroide, están presentes en lasRanunculaceae,Euphorbiaceae,Apocynaceae,LiliaceaeyPlantaginaceae.
- Losiridoidesson derivados de monoterpenos 9-carbonados o 10-carbonados, y usualmente están presentes como glicósidos. Lossecoiridoidesestán presentes en muchas familias del clado de lasastéridas,comoGentianales,Dipsacales,y muchas familias deCornalesyAsterales.Losiridoides carbocíclicosson característicos de losLamiales,excepto porOleaceae,TetrachondraceaeyGesneriaceae.
Véase también
[editar]Referencias
[editar]- ↑Devlin, T. M. 2004.Bioquímica,4.ª edición. Reverté, Barcelona.ISBN 84-291-7208-4
- ↑abcR. Croteau, T. M. Kutchan, N. G. Lewis. "Natural Products (Secondary Metabolites)". En: Buchanan, Gruissem, Jones (editores).Biochemistry and Molecular Biology of Plants.American Society of Plant Physiologists. Rockville, Maryland, Estados Unidos. 2000. Capítulo 24.
- ↑Goodwin, T.W. 1971.Aspects of terpenoid chemistry and biochemistry.Academic Press, Londres.
- ↑Alchimia Blog,Los terpenos de la marihuana y sus efectos
- ↑Eisenreich W, Rohdich F, Bacher A. (2001). «Deoxyxylulose phosphate pathway to terpenoids.».Trends Plant Sci.6(2): 78-84.doi:10.1016/S1360-1385(00)01812-4.
- ↑Paul M. Dewick (2009).Medicinal natural products: a biosynthetic approach.John Wiley and Sons.ISBN9780470741689.
- ↑Flesch, G.; Rohmer, M. (1988). «Prokaryotic hopanoids: the biosynthesis of the bacteriohopane skeleton».European Journal of Biochemistry175(2): 405-411.doi:10.1111/j.1432-1033.1988.tb14210.x.
- ↑SC Labs,Beyond aroma: Terpenes in cannabis
- ↑"Secondary Plant Compounds". en: Judd, W. S. Campbell, C. S. Kellogg, E. A. Stevens, P.F. Donoghue, M. J. 2002.Plant systematics: a phylogenetic approach, Second Edition.Sinauer Axxoc, USA. Capítulo 4.
- ↑Pascual-Villalobos MJ. 1996. Evaluación de la actividad insecticida de extractos vegetales deChrysanthemum coronarium.Boletín de Sanidad Vegetal y Plagas22(2): 411-420.
Enlaces externos
[editar] Wikimedia Commonsalberga una galería multimedia sobreTerpeno.
Wikimedia Commonsalberga una galería multimedia sobreTerpeno.
