Testosterona
| Testosterona | ||
|---|---|---|
 | ||
 | ||
| Nombre (IUPAC) sistemático | ||
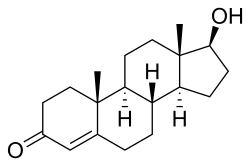
| (8R,9S,10R,13S,14S,17S)- 17-hydroxy-10,13-dimethyl- 1,2,6,7,8,9,11,12,14,15,16,17- dodecahydrocyclopenta[a]phenanthren-3-one | ||
| Identificadores | ||
| Número CAS | 58-22-0 | |
| Código ATC | G03BA03 | |
| PubChem | 6013 | |
| DrugBank | DB00624 | |
| ChemSpider | 5791 | |
| UNII | 3XMK78S47O | |
| KEGG | D00075 | |
| ChEBI | 17347 | |
| ChEMBL | CHEMBL386630 | |
| Datos químicos | ||
| Fórmula | C19H28O2 | |
| Peso mol. | 288.42 | |
|
O=C4\C=C2/[C@]([C@H]1CC[C@@]3([C@@H](O)CC[C@H]3[C@@H]1CC2)C)(C)CC4
| ||
|
InChI=1S/C19H28O2/c1-18-9-7-13(20)11-12(18)3-4-14-15-5-6-17(21)19(15,2)10-8-16(14)18/h11,14-17,21H,3-10H2,1-2H3/t14-,15-,16-,17-,18-,19-/m0/s1
Key: MUMGGOZAMZWBJJ-DYKIIFRCSA-N | ||
| Datos físicos | ||
| P. de fusión | 155 °C (311 °F) | |
| Rot. esp. | +110,2° | |
| Variación E.E.C. | −11080 kJ/mol | |
| Farmacocinética | ||
| Biodisponibilidad | Baja | |
| Metabolismo | Hígado, testículo, y próstata | |
| Vida media | 2-4 horas | |
| Excreción | Orina (90 %), heces (6 %) | |
| Datos clínicos | ||
| Cat. embarazo | X. Restricción total del uso del fármaco. Los riesgos superan los beneficios potenciales (EUA) Efectos teratogénicos | |
| Estado legal | Lista IV (CA) Lista III (EUA) | |
| Vías de adm. | Inyección intramuscular; transdérmica (parches), tópica (cremas y geles) | |
La testosterona es una hormona esteroidea sexual del grupo andrógeno y se encuentra en mamíferos, reptiles,[1] aves[2] y otros vertebrados. En los mamíferos, la testosterona es producida principalmente en los testículos de los machos y en menor medida en los ovarios de las hembras, además, las glándulas suprarrenales segregan también pequeñas cantidades. Es la principal hormona sexual masculina y también un esteroide anabólico.
En los varones, la testosterona desempeña un papel clave en el desarrollo de los tejidos reproductivos masculinos como los testículos y la próstata, y también en la promoción de los caracteres sexuales secundarios como, por ejemplo, el incremento de la masa muscular y ósea y en el crecimiento del pelo corporal.[3] Además, es esencial para la salud y el bienestar,[4] además de la prevención de la osteoporosis.[5]
En promedio, la concentración de testosterona en el plasma sanguíneo en un hombre adulto es diez veces mayor que la concentración en el plasma de una mujer adulta, pero como el consumo metabólico de la testosterona en los hombres es mayor, la producción diaria es de aproximadamente 20 veces mayor en los hombres.[6] Además, las mujeres son más sensibles a la hormona.[7]
La testosterona es conservada a través de la mayoría de los vertebrados, aunque los peces producen una ligeramente distinta llamada 11-cetotestosterona.[8] Su homólogo en los insectos es la ecdisona.[9] Estos esteroides ubicuos sugieren que las hormonas sexuales tienen una historia evolutiva antigua.[10]
Efectos fisiológicos
[editar]En general, los andrógenos promueven la biosíntesis proteica y el crecimiento de los tejidos con receptores androgénicos. Los efectos generados por la testosterona se pueden clasificar como virilizante y anabólico, aunque la distinción es un poco artificial, ya que muchos de los efectos se podrían considerar como ambos. La testosterona es anabólica, significando que promueve el crecimiento de masa ósea y muscular.
- Efectos anabólicos incluyen el crecimiento de la masa muscular y fuerza, el incremento de la densidad ósea y fuerza, y la estimulación del crecimiento longitudinal y la maduración de los huesos.
- Efectos androgénicos incluyen la maduración de los órganos sexuales, particularmente el pene y la formación del escroto en el feto, y después del nacimiento (usualmente en la pubertad) una profundización de la voz, crecimiento de la barba y vello axilar. Muchos de estos caen en la categoría de caracteres sexuales secundarios.
Los efectos de la testosterona también pueden ser clasificados por la edad de su ocurrencia. Para los efectos postnatales en ambos hombres y mujeres, estos son mayoritariamente dependientes de los niveles y duración de la testosterona libre circulante.
Prenatales
[editar]Los efectos androgénicos prenatales ocurren entre cuatro y seis semanas de gestación.
- Virilización genital (fusión de la línea media, uretra fálica, adelgazamiento escrotal, crecimiento fálico); aunque el rol de la testosterona es mucho menor que el de la dihidrotestosterona.
- Desarrollo de la próstata y las vesículas seminales.
- Identidad de género.[11]
Infancia temprana
[editar]Los efectos androgénicos en la infancia temprana son los menos entendidos. En las primeras semanas de vida del infante masculino, los niveles de testosterona aumentan. Los niveles se mantienen en el rango puberal por algunos meses, pero usualmente alcanzan los niveles apenas detectables de la niñez a los 4-6 meses de vida.[12][13] La función de este aumento en los humanos es desconocida. Se ha especulado que la "masculinización del cerebro" está ocurriendo ya que no se han identificado cambios significativos en otras partes del cuerpo.[14] Sorpresivamente, el cerebro masculino es masculinizado por la testosterona siendo aromatizada a estrógeno, que cruza la barrera hematoencefálica y entra al cerebro masculino, mientras que los fetos femeninos tienen alfa-fetoproteína que se unen a los estrógenos de modo que el cerebro femenino no es afectado.[15]
Prepuberales
[editar]Los efectos androgénicos prepuberales son los primeros efectos observables del incremento en los niveles de andrógenos al final de la infancia, ocurriendo en ambos niños y niñas.
- Olor corporal como los adultos
- Incremento aceitoso en la piel y pelo, acné
- Pubarquia (aparición de vello púbico)
- Vello axilar
- Crecimiento, maduración ósea acelerada
- Pelo en el labio superior y patillas.
Puberales
[editar]Los efectos androgénicos puberales empiezan a ocurrir cuando los niveles androgénicos han estado más altos que los de un adulto femenino por meses o años. En los varones, estos son usualmente efectos puberales que ocurren más al final de la pubertad, y ocurren en mujeres después de periodos prolongados de niveles elevados de testosterona libre en la sangre.
- Agrandamiento de las glándulas sebáceas que es el conducto por donde sale el pelo o vello. Esto podría causar acné.
- Agrandamiento fálico o clitoromegalia no patológica.
- Incremento de la libido y frecuencia de erecciones o crecimiento clitoral
- Vello púbico se extiende hacia los muslos y para arriba hacia el ombligo
- Vello facial (patillas, barba, bigote)
- Perdida del pelo (Alopecia androgénica)
- Vello pectoral, vello periareolar, vello perianal
- Vello en las piernas
- Vello axilar
- La grasa subcutánea disminuye
- Incremento de la fuerza y masa muscular[16]
- Profundización de la voz
- Crecimiento de la nuez de Adán
- Crecimiento del tejido espermatogénico en los testículos, fertilidad masculina
- Crecimiento de la mandíbula, cejas, barbilla, nariz, y remodelación de los contornos de los huesos faciales
- Los hombros se vuelven más amplios y la caja torácica se expande
- La terminación de la maduración ósea y crecimiento óseo. Esto ocurre indirectamente vía los metabolitos del estradiol y por lo tanto ocurre de forma más gradual en los hombres que las mujeres.
Adultos
[editar]Los efectos de la testosterona en adultos son claramente más demostrables en el varón que la mujer, pero son igualmente importantes para ambos sexos.[17] Algunos de estos efectos pueden disminuir cuando los niveles de testosterona disminuyen en las últimas décadas de la vida adulta.

- La testosterona es necesaria para el desarrollo normal del espermatozoide. La testosterona activa genes en las Células de Sertoli quienes promueven la diferenciación de espermatogonia.
- Regula la respuesta aguda del HHA (eje hipotalámico-hipofisario-adrenal) bajo un desafío de dominancia.[18]
- Energía física y mental.
- Mantenimiento del trofismo muscular.
- La testosterona regula la población de los receptores Tromboxano A2 en megacariocitos y plaquetas y por lo tanto la agrupación de plaquetas en humanos.[19][20]
- La testosterona no causa o produce efectos nocivos en el cáncer de próstata. En gente que se ha sometido a terapia de privación de testosterona, incrementos de testosterona más allá de niveles de castrado han demostrado incrementar la rapidez de propagación de un cáncer prostático existente.[21][22][23]
- Estudios recientes han mostrados resultados conflictivos acerca de la importancia de la testosterona en el mantenimiento de la salud cardiovascular.[24][25] Sin embargo, mantener niveles normales de testosterona en hombres de tercera edad ha demostrado la mejora de varios parámetros que se piensan que reducen el riesgo de enfermedades cardiovasculares, tales como el incremento de la masa magra, las disminución de la grasa visceral, disminución del colesterol total, y el control sobre los niveles glucémicos.[26]
- Bajo un desafío de dominancia, la testosterona puede que juegue un papel en la regulación de la respuesta de "lucha o huida".[27]
- Enamorarse disminuye los niveles de testosterona en los hombres mientras que incrementa los niveles de las mujeres. Se especula que estos cambios en los niveles de testosterona resulten en la reducción temporal de las diferencias de comportamiento entre ambos sexos.[28] Se ha comprobado que cuando la testosterona y las endorfinas en el semen eyaculado se encuentran con la pared cervical después de una relación sexual, las mujeres reciben un golpe de testosterona, endorfina, y oxitocina, y los varones después del orgasmo experimentan un incremento de endorfinas y un incremento marcado en los niveles de oxitocina.[cita requerida] Esto añade al entorno fisiológico acogedor en el tracto reproductivo femenino para la concepción, y luego para la alimentación del embrión, y estimula el sentimiento de amor, deseo, y cuidado paternal en los varones (esta es la única vez que los niveles de oxitocina del varón rivalizan con los de las mujeres).[29]
- Estudios recientes sugieren que los niveles de testosterona juegan un papel importante en la toma de riesgos durante decisiones financieras.[30][31]
- La administración de testosterona hace a los varones más egoístas y más probable que castiguen a otros por ser egoístas con ellos.[32]
- La paternidad también disminuye los niveles de testosterona en los hombres, sugiriendo que los cambios en el comportamiento y emocionales promueven el cuidado paternal.[33]
- En los animales (tetraoninos y los lagartos ágiles), los niveles altos de testosterona han sido relacionados con una reducción en la actividad del sistema inmunitario. La testosterona parece haberse vuelto parte del sistema de señalización honesta entre las potenciales parejas en el curso de la evolución.[34][35]
Cerebro
[editar]Como la testosterona afecta al cuerpo entero (a menudo agrandando ciertos órganos, como el corazón, los pulmones, el hígado, etc., los cuales suelen ser más grandes en los varones que en las mujeres), el cerebro también lo es por esta diferenciación "sexual";[11] la enzima aromatasa convierte la testosterona a estradiol que es la responsable de la masculinización del cerebro de los roedores machos. En el sexo masculino, llega a crear ciertas interacciones que pueden alterar sus sentidos, como provocar pensamientos lujuriosos y estimular el apetito sexual.
La testosterona puede hacer que el hombre tenga pensamientos lujuriosos. El sexo del hombre crea ciertos olores que pueden llegar a ser placenteros o incómodos dependiendo del nivel de testosterona. Ese aroma es originado por una glándula sudorípara que al mismo tiempo manda señales al cerebro, estimulando el apetito sexual.
Hay algunas diferencias entre el cerebro masculino y femenino (posiblemente el resultado de niveles distintos de testosterona), una de estas es el tamaño: el cerebro humano masculino es, en promedio, más grande.[36] En un estudio danés de 2003, en los hombres se encontró que tenían un largo total de 176 000 km (kilómetros) de fibras mielinizadas a la edad de 20, mientras que las mujeres tenían un total de 149 000 km.[37] Sin embargo, las mujeres tienen más conexiones dendríticas entre las células del cerebro.[38]
Un estudio realizado en 1996 no encontró ningún efecto a corto plazo en el estado de ánimo o comportamiento por la administración de dosis suprafisiológicas de testosterona durante 10 semanas en 43 hombres saludables.[16] Otro estudio encontró una correlación entre la testosterona y la tolerancia de riesgo en la elección de carrera entre las mujeres.[39]
La literatura sugiere que la atención, memoria, y habilidad espacial son funciones cognitivas afectadas por la testosterona en humanos. Evidencia preliminar sugiere que niveles bajos de testosterona puede ser un factor de riesgo para el deterioro de habilidades cognitivas y posiblemente para la demencia del tipo Alzheimer,[40][41] un argumento clave en la medicina para la prolongación de la vida y el uso de la testosterona en terapias antienvejecimiento. Sin embargo, gran parte de la literatura sugiere una relación curvilíneal o hasta cuadrática entre el rendimiento espacial y testosterona circulante,[42] donde ambas la hipo- e hipersecreción de andrógenos tienen un efecto negativo en la cognición, como se detalla más arriba.
Contrario a lo que se ha postulado en estudios antiguos y por ciertas secciones de los medios, el comportamiento agresivo no es típicamente visto en hombres con hipogonadismo quienes tienen sus niveles de testosterona son adecuadamente reemplazados al rango normal. De hecho, el comportamiento agresivo ha sido asociado con el hipogonadismo y niveles bajo de testosterona y pareciera que los niveles suprafisiológicos y bajos de testosterona y el hipogonadismo causan trastornos del estado de ánimo y el comportamiento agresivo, con los niveles normales de testosterona siendo importantes para el bienestar mental. El "agotamiento" de la testosterona es una consecuencia normal del envejecimiento en los hombres. Una posible consecuencia de esto es el incremento del riesgo de desarrollo de la enfermedad de Alzheimer.[43][44]
Agresividad
[editar]La correlación positiva entre niveles de testosterona y la agresividad en humanos ha sido demostrada en muchos estudios.[45] Aunque existen estudios que el estradiol y el estrógeno también influyen en la agresividad en humanos.[46]
Bioquímica
[editar]Estructura química
[editar]La testosterona es un andrógeno, esteroide derivado del ciclopentanoperhidrofenantreno, que tiene 19 átomos de carbono, un doble enlace entre C4 y C5, un átomo de oxígeno en C3 y un radical hidroxilo (OH) en C17. Su fórmula es C19H28O2. Esta estructura es necesaria para el mantenimiento de la actividad androgénica. La testosterona puede ser aromatizada en varios tejidos para formar estradiol, de tal manera que en el hombre es normal una producción diaria de 50 microgramos. El papel del estradiol en el hombre aún no está aclarado, pero su exceso absoluto o relativo puede provocar feminización. La testosterona del testículo es producida por las células de Leydig, pero también es sintetizada en otros tejidos a partir de los andrógenos circulantes (DHEA,DHEA-S), provenientes de la corteza suprarrenal (zona reticular).
Biosíntesis
[editar]
Como otras hormonas esteroides, la testosterona es derivada del colesterol (ver figura a la derecha).[47] El primer paso de su biosíntesis involucra la rotura oxidativa de la cadena lateral del colesterol por la enzima CYP11A, una oxidasa de citocromo P450 mitocondrial con la pérdida de seis átomos de carbono para dar una pregnenolona. En el próximo paso, dos átomos de carbonos son removidos por la enzima CYP17A en el retículo endoplasmático para la producción de una variedad de esteroides C19.[48] Además, el grupo 3-hidroxilo es oxidado por el 3-β-HSD para producir la androstenediona. En el paso final y limitante de la rapidez de producción, el grupo androstenediona C-17 keto es reducida por la 17-beta hidroxiesteroide deshidrogenasa para producir la testosterona.
La mayor parte de la producción de la testosterona (>95 %) en los varones, es producida por los testículos.[3] También es sintetizada en cantidades menores en las mujeres, por las células de la teca de los ovarios, por la placenta. También es sintetizada en ambos sexos por la zona reticular de la corteza suprarrenal. En los testículos, la testosterona es producida por las células de Leydig.[49] Las glándulas generativas también contienen células de Sertoli que requieren testosterona para la espermatogénesis. Como la mayoría de las hormonas, la testosterona es suministrada a tejidos objetivos en la sangre donde la mayor parte de ella es transportada ligada a dos proteínas del plasma, la globulina fijadora de hormonas sexuales (SHGB) y la albúmina. La SHBG liga una molécula de testosterona con alta afinidad, en tanto que la albúmina liga varias moléculas con baja afinidad. En función de estos equilibrios se define la testosterona libre o FTo como la totalidad de lo no unido, y la testosterona biodisponible como la total menos la unida a la SHBG.
Regulación
[editar]En los hombres, la testosterona es principalmente sintetizada en las células de Leydig. El número de células de Leydig es regulado por la hormona luteinizante (LH) y la hormona foliculoestimulante (FSH). La cantidad de testosterona producida por las células de Leydig existentes está bajo el control de la LH que regula la expresión de la 17-beta hidroxiesteroide deshidrogenasa.[50]

La cantidad de testosterona sintetizada es regulada por el eje hipotálamo-hipofisario-testicular (ver figura a la derecha).[51] Cuando los niveles de testosterona están bajos, la hormona liberadora de gonadotrofina (GnRH) es liberada por el hipotálamo que a su vez estimula la glándula pituitaria para liberar LH. Esta última hormona estimula los testículos para sintetizar la testosterona. Finalmente, los altos niveles de testosterona actúan en el hipotálamo y la pituitaria a través de una realimentación negativa para inhibir la liberación de GnRH y FSH/LH, respectivamente.
Factores ambientales que afectan los niveles de testosterona incluyen:
- La pérdida de estatus o dominancia en los hombres puede resultar en la disminución en los niveles de testosterona.[27]
- La motivación de poder implícito predice un incremento en la liberación de testosterona en los hombres.[52]
- El envejecimiento reduce la liberación de testosterona.[53][54]
- El hipogonadismo.
- Los movimientos oculares rápidos (MOR) durante el sueño incrementan los niveles de testosterona nocturnos.[55]
- El entrenamiento con pesas incrementa los niveles de testosterona,[56] sin embargo, en hombres de edad, ese incremento puede ser evitado al ingerir proteínas.[57]
- La deficiencia de zinc disminuye los niveles de testosterona,[58] pero la sobre suplementación de este no tiene efectos en los niveles de testosterona.[59]
- Regaliz. Los ingredientes activos en la raíz de regaliz, la glicirricina, ha sido vinculada a una pequeña, clínicamente insignificante, disminución en los niveles de testosterona.[60] En contraste, un estudio más reciente encontró que la administración de regaliz produce una disminución substancial en los niveles de testosterona en una muestra pequeña y exclusivamente femenina.[61]
- Antiandrógenos naturales o artificiales incluyendo el té de mentha spicata reducen los niveles de testosterona.[62][63][64]
La regulación de testosterona está sometida a un ciclo circadiano basado en los estímulos ambientales. De esta manera, se produce un pico de concentración de esta hormona a las 8 a. m., mientras que su acción más leve y por tanto de menor concentración plasmática se da a las 8 p. m.. En los adultos de edad más avanzada, pese a que el ciclo se mantiene, las concentraciones de testosterona son más homogéneas y bajas.[cita requerida]
Metabolismo
[editar]Aproximadamente el 7 % de la testosterona es reducida a 5α-dihidrotestosterona (DHT) por la enzima del citocromo P450 5α-reductasa,[65] una enzima altamente expresada en los órganos accesorios sexuales masculinos y folículos pilosos.[3] Aproximadamente el 0.3 % de la testosterona es convertida a estradiol por la aromatasa (CYP19A1)[66] una enzima expresada en el cerebro, hígado, y tejido adiposo.[3]
La DHT es una forma más potente de la testosterona mientras que el estradiol tiene actividades completamente distintas (feminización) comparado a la testosterona (masculinización). Finalmente, la testosterona y DHT pueden ser desactivadas o eliminadas por enzimas que hidroxilan en las posiciones 6, 7, 15 o 16.[67]
Mecanismo de acción
[editar]
Los efectos de la testosterona en los humanos y otros vertebrados ocurren a través de dos mecanismo principales: la activación del receptor androgénico (directamente o como DHT), y la conversión a estradiol y la activación de ciertos receptores de estrógeno.[69][70]
La testosterona libre (T) es transportada hacia el citoplasma de las células del tejido objetivo, donde se puede encajar en el receptor androgénico, o puede ser reducida a 5α-dihidrotestosterona (DHT) por la enzima citoplasmática 5-alfa reductasa. La DHT se encaja en el mismo receptor androgénico que la testosterona pero de manera mucho más fuerte, haciendo su potencia androgénica alrededor de 5 veces la de la T.[71] El complejo de receptores-T/-DHT se somete a un cambio estructural que le permite a la hormona ingresar al núcleo celular y encajarse directamente en secuencias específicas de nucleótidos de la ADN cromosómica. Las áreas de encaje son llamadas elementos de respuesta a hormonas (HREs), e influencian la actividad transcripcional de ciertos genes, produciendo el efecto androgénico.
En los vertebrados, los receptores androgénicos ocurren en varios sistemas de tejidos distintos, y ambos los machos como las hembras responden de manera similar a niveles similares de testosterona. La gran diferencia en los niveles de testosterona antes de nacer, durante la pubertad, y a lo largo de la vida explican las diferencias biológicas entre los machos y hembras.
Los huesos y el cerebro son dos tejidos importantes en los humanos donde el principal efecto de la testosterona es a través de la aromatización a estradiol. En el tejido óseo, el estradiol acelera la maduración del cartílago hacia hueso, llevando al cierre de la epífisis y en consecuencia la conclusión del crecimiento. En el sistema nervioso central, la testosterona es aromatizada a estradiol. Es el estradiol y no la testosterona, que sirve como la señal más importante del feedback negativo hacia el hipotálamo (específicamente afectando la secreción de LH). En muchos mamíferos, la "masculinización" prenatal de las áreas de dimorfismo sexual del cerebro son hechas por el estradiol derivado de la testosterona.
La hormona humana testosterona es producida en grandes cantidades por los varones, y menos por las mujeres. La hormona humana estrógeno es producida en grandes cantidades por las mujeres, y menos por los varones. La testosterona causa la apariencia de rasgos masculinos (engrosamiento de la voz, vello facial y púbico, incremento de la masa muscular, etc.) Al igual que los hombres, las mujeres dependen de la testosterona para mantener la libido, densidad ósea y masa muscular a los largo de sus vidas. En los hombres, los niveles inadecuadamente altos de estrógeno disminuyen los niveles de testosterona, disminuyen la masa muscular, inhibe el crecimiento en los adolescentes, introduce la ginecomastia, incrementa las características femeninas, reduce la susceptibilidad a contraer cáncer prostático, reduce la libido, causa disfunción eréctil, y causa sudoración excesiva y bochornos. Sin embargo, un nivel apropiado de estrógeno es requerido por los varones para garantizar el bienestar, mantener la densidad ósea, libido, función eréctil, etc.
Usos médicos
[editar]
El uso original y principal de la testosterona es para el tratamiento de varones con hipogonadismo con niveles de producción de testosterona endógena muy baja o nula. El tratamiento apropiado para este trastorno es la terapia de reemplazo hormonal (terapia de reemplazo de testosterona, TRT), que mantiene los niveles de testosterona dentro del rango normal.
Sin embargo, a través de los años, como todas las hormonas, la testosterona y otros esteroides anabólicos también han sido ocupados para otras condiciones y propósitos además del reemplazo, con éxitos variables pero con una mayor tasa de efectos secundarios. Ejemplos incluyen la reducción de la infertilidad, corregir la falta de libido o disfunción eréctil, corregir la osteoporosis, fomentar la ampliación del pene, fomentar el crecimiento de la altura, fomentar la médula ósea, revertir los efectos de la anemia, y hasta la estimulación del apetito. A finales de los 1940s, la testosterona estaba siendo promocionada como una droga milagrosa antienvejecimiento.[72] La disminución en los niveles de testosterona con la edad ha despertado el interés de la terapia de reemplazo de andrógenos.
Para aprovechar la ventaja de sus efectos virilizantes, la testosterona es a menudo administrada a hombres transexuales como parte de su terapia de reemplazo hormonal (mujer-a-hombre), con un "nivel objetivo" del nivel normal de testosterona de un hombre. Del mismo modo, las mujeres transexuales son a veces prescritas antiandrógenos para disminuir los niveles de testosterona en sus cuerpos y dejar que el efecto del estrógeno se desarrolle.
Los parches de testosterona son efectivos para tratar la libido bajo en las mujeres post-menopáusicas.[73] La libido bajo puede también ocurrir como síntoma o resultado del uso de anticonceptivos hormonales. Las mujeres también pueden usar terapias de testosterona para tratar o prevenir la pérdida de la densidad ósea, masa muscular y para tratar ciertos tipos de depresiones y estados de baja energía. Las mujeres en terapias de testosterona pueden experimentar una subida de peso sin un incremento en la grasa corporal debido a cambios en la densidad ósea y muscular. La mayoría de los efectos indeseados de la terapia de testosterona pueden ser controlados con estrategias de reducción de vellos, prevención de acné, etc. Existe un riesgo teórico que la terapia de testosterona pueda incrementar el riesgo de cáncer de mama o ginecológico, y mayor investigación es requerida para definir mejor cualquier tipo de riesgos.[73]
Terapia de reemplazo de andrógenos
[editar]Los niveles de testosterona en los humanos disminuyen gradualmente con la edad. La significancia de esta disminución es debatible (ver andropausia). Hay un desacuerdo sobre cuando tratar a los hombres de edad con la terapia de reemplazo de testosterona. La posición de la Sociedad Americana de Andrología respecto al tema es que "la terapia de reemplazo de testosterona en hombres de edad es indicada cuando ambos síntomas clínicos y signos que sugieren una deficiencia androgénica y niveles bajos de testosterona estén presentes."[74] La Asociación Americana de Endocrinólogos Clínicos dice que "el hipogonadismo es definido cuando los niveles de testosterona libre estén debajo del límite inferior del rango normal para adultos jóvenes. Anteriormente, la disminución relacionada con la edad de la testosterona libre fue alguna vez aceptada como normal. En la actualidad, no es considerada normal. Pacientes con niveles entre el rango bajo-normal a subnormal justifican un ensayo clínico de testosterona."[75]
No existe una concordancia total en el límite de nivel de testosterona donde un valor menor a este sería considerado como hipogonadismo; actualmente, no existen estándares en cuanto a cuándo tratar a las mujeres. La testosterona puede medirse como "libre" (es decir, biodisponible y no unida) o más comúnmente, como "total" (incluyendo el porcentaje que está químicamente unida y no disponible). En los Estados Unidos, los niveles de testosterona total de un varón debajo de 300 ng/dL (nanogramos por decilitro) de una muestra en la mañana son generalmente considerados bajos.[76] La identificación de niveles inadecuados de testosterona en un hombre que envejece únicamente por los síntomas puede ser difícil.
La terapia de reemplazo puede tomar la forma de frascos inyectables, parches transdérmicos y geles, pellets subcutáneos, y terapia oral. Efectos adversos de la suplementación de testosterona incluyen efectos secundarios menores tales como acné y piel aceitosa, y complicaciones más significantes tales como el incremento del hematocrito que requiere una venopunción para ser tratada, exacerbación del síndrome de apnea del sueño y una aceleración en el crecimiento de un cáncer prostático preexistente en individuos que se hayan sometido a privación androgénica. Otro efecto adverso puede ser la pérdida significativa del cabello y/o el adelgazamiento de este mismo. Esto podría ser prevenido usando Propecia (Finasterida), que inhibe la enzima 5-alfa reductasa (responsable de la conversión de la testosterona a DHT), durante el tratamiento. La testosterona exógena también causa la supresión de la espermatogénesis y puede llevar a la esterilidad.[77] Se recomienda que los médicos busquen por un cáncer de próstata con un examen rectal digital y un chequeo de los niveles de PSA (antígeno prostático específico) antes de empezar la terapia, y monitorear de cerca los niveles PSA y hematocrito durante la terapia.
Beneficios
[editar]Una terapia de testosterona apropiada puede mejorar el manejo de la diabetes mellitus tipo 2.[78] Bajos niveles de testosterona también conllevan un incremento en el riesgo del desarrollo de la enfermedad de Alzheimer.[43][44] Un pequeño estudio en el 2005 mostró resultados mixtos en usar la testosterona para combatir los efectos del envejecimiento.[79]
Aún faltan estudios de gran escala para evaluar la eficacia y seguridad a largo plazo de la testosterona.[80]
Efectos adversos
[editar]La suplementación de testosterona exógena viene con un número de riesgos para la salud. La fluoximesterona y la metiltestosterona son derivados sintéticos de la testosterona. La fluoximesterona y la metiltestosterona ya no son prescritas por doctores debido a sus pobres historiales de seguridad, y el reemplazo de testosterona en hombres posee un registro de seguridad muy bueno como lo demuestran más de 60 años de uso médico en hombres con hipotiroidismo.
Un artículo del 2006 en el Diario Oficial de la Asociación Americana de Neurología - El Diario de Urología señaló que: «El cáncer prostático puede ser clínicamente aparente dentro de meses a pocos años después del inicio del tratamiento con testosterona. [...] Los doctores prescribiendo la suplemento de testosterona y los pacientes recibiéndola deben estar conscientes de este riesgo, y los chequeos de los niveles de PSA y exámenes digitales del recto deberían ser realizados frecuentemente durante el tratamiento».[cita requerida]
Uso atlético
[editar]La testosterona podría ser ocupada por un atleta con el fin de mejorar su rendimiento, y es considerada en la mayoría de los deportes como una forma de dopaje. Existen varios métodos de aplicación de la testosterona, incluyendo inyecciones intramusculares, parches, geles transdérmicos, y pellets implantables.
Los esteroides anabólicos (incluyendo la testosterona) también se han utilizado para mejorar el desarrollo muscular, fuerza, o resistencia. Lo hacen directamente al incrementar la síntesis proteica de los músculos. Como resultado, las fibras musculares se vuelven más grandes y se reparan más rápido que las de una persona promedio. Después de una serie de escándalos y publicidad en la década de 1980 (tales como el rendimiento mejorado de Ben Johnson en los Juegos Olímpicos de Seúl 1988), la prohibición del uso de los esteroides anabólicos fue renovada o fortalecida por varias organizaciones deportivas. En 1990, la testosterona y otros esteroides anabólicos fueron designados «substancias controladas» por el Congreso de los Estados Unidos, con la Ley de Control de Esteroides Anabólicos (Anabolic Steroid Control Act).[81] El uso de estas substancias es visto como un problema serio en el deporte moderno, especialmente teniendo en cuenta los extremos a los que los atletas y laboratorios profesionales llegan para intentar ocultar dichos abusos de los reguladores de deportes. El abuso de esteroides anabólicos una vez más llegó al centro de atención como resultado del doble homicidio-suicidio de Chris Benoit en 2007, y el frenesí de los medios que lo rodeó. Sin embargo, no existe evidencia que indique que el uso de esteroides anabólicos fuese un factor contribuyente. [cita requerida]
Detección de abuso
[editar]Se han empleado una serie de métodos para la detección del uso de testosterona en atletas, la mayoría basadas en análisis de orina. Estos incluyen la proporción testosterona/epitestosterona (normalmente menor que 4), la proporción testosterona/hormona luteinizante y la proporción carbono-13/carbono-12 (la testosterona farmacéutica contiene menos carbono-13 que la testosterona endógena). En algunos programas de evaluación, los mismos resultados históricos del atleta pueden servir como un intervalo de referencia para la interpretación de algún hallazgo sospechoso. Otro método siendo investigado es la detección de la forma de testosterona administrada, usualmente un ester, en el pelo.[82][83][84][85]
Vías de administración
[editar]Existen muchas vías de administración de la testosterona. Las formas de testosterona para la administración humana que están disponibles en la actualidad incluyen inyectables (como cipionato o enantato de testosterona en aceite),[86] orales, bucales,[87] parches transdérmicos de piel, cremas transdérmicas, geles,[88][89] y pellets (gránulos) implantables.[90] Métodos roll-on y aerosoles nasales están actualmente en desarrollo.
Análogos sintéticos
[editar]Los derivados de la testosterona se originan a partir de modificaciones de su estructura química.
A) Testosterona oral: el agregado de grupos metilos en C1, C7 y C17 aumenta la actividad biológica. La 17-alfa-metiltestosterona es un derivado especial porque conserva su acción androgénica y es activa por vía oral. La fluoximesterona es un derivado fluorado en C9 de la metiltestosterona. Estos derivados alquilados de la testosterona son metabolizados lentamente en el hígado, después de su absorción oral. Sin embargo la hepatotoxicidad, ictericia colestásica principalmente, y la incidencia de adenocarcinoma hepático aumenta en pacientes tratados durante períodos prolongados de tiempo con estos andrógenos 17-alquil-sustituidos. La testosterona natural, en cambio, sufre una rápida degradación en su primer paso por el hígado y no produce prácticamente estos efectos adversos.
B) Testosterona parenteral: la esterificación de la testosterona en posición del OH en C17 aumenta la liposolubilidad de la testosterona y prolonga su acción. El propionato de testosterona es particularmente activo por vía parenteral y de acción relativamente corta, 1-2 días. El ciclopentilpropionato o cipionato y el enantato son andrógenos de acción prolongada. Administrados por vía intramuscular profunda producen efectos androgénicos durante dos o tres semanas. Los ésteres son convertidos en testosterona libre en la circulación. La testosterona se ha administrado también por vía subcutánea y últimamente se ha administrado testosterona por vía transdérmica a través de un parche autoadhesivo que se aplica en la piel del escroto aprovechando que en esta superficie la absorción es considerablemente mayor que en el resto de la piel (Testoderm). Aunque también hay parches cuya aplicación se debe hacer en otras partes del cuerpo como el abdomen o los muslos (Androderm). Existen también geles de reciente aparición cuya aplicación es transdermal (Testim y Testogel).
Véase también
[editar]Referencias
[editar]- ↑ Cox, R. M., John-Alder, H. B. (diciembre de 2005). «Testosterone has opposite effects on male growth in lizards (Sceloporus spp.) with opposite patterns of sexual size dimorphism». J. Exp. Biol. 208 (Pt 24): 4679-87. PMID 16326949. doi:10.1242/jeb.01948.
- ↑ Reed, W. L., Clark, M. E., Parker, P. G., Raouf, S. A., Arguedas, N., Monk, D. S., Snajdr, E., Nolan, V., Ketterson, E. D. (mayo de 2006). «Physiological effects on demography: a long-term experimental study of testosterone's effects on fitness». Am. Nat. 167 (5): 667-83. PMID 16671011. doi:10.1086/503054. Resumen divulgativo – ScienceDaily.
- ↑ a b c d Mooradian, A. D., Morley, J. E., Korenman, S. G. (febrero de 1987). «Biological actions of androgens». Endocr. Rev. 8 (1): 1-28. PMID 3549275. doi:10.1210/edrv-8-1-1.
- ↑ Bassil, N., Alkaade, S., Morley, J. E. (junio de 2009). «The benefits and risks of testosterone replacement therapy: a review». Ther Clin Risk Manag 5 (3): 427-48. PMC 2701485. PMID 19707253.
- ↑ Tuck SP, Francis RM (2009). «Testosterone, bone and osteoporosis». Front Horm Res 37: 123-32. PMID 19011293. doi:10.1159/000176049.
- ↑ Southren, Louis A., Gordon, G. (mayo de 1967). «Mean Plasma Concentration, Metabolic Clearance and Basal Plasma Production Rates of Testosterone in Normal Young Men and Women Using a Constant Infusion Procedure: Effect of Time of Day and Plasma Concentration on the Metabolic Clearance Rate of Testosterone». The Journal of Clinical Endocrinology & Metabolism 27 (5): 686-694. doi:10.1210/jcem-27-5-686. Texto « JCEM 1967 27: 686-694 » ignorado (ayuda)
- ↑ Dabbs, M., Dabbs, J. M. (2000). Heroes, rogues, and lovers: testosterone and behavior. New York: McGraw-Hill. ISBN 0-07-135739-4.
- ↑ Nelson, Randy F. (2005). An introduction to behavioral endocrinology. Sunderland, Mass: Sinauer Associates. pp. 143. ISBN 0-87893-617-3.
- ↑ De Loof, A., Arnold (octubre de 2006). «Ecdysteroids: the overlooked sex steroids of insects? Males: the black box». Insect Science 13 (5): 325-338. doi:10.1111/j.1744-7917.2006.00101.x.
- ↑ Mechoulam, R., Brueggemeier, R. W., Denlinger, D. L., R.; Brueggemeier, R. W.; Denlinger, D. L. (septiembre de 1984). «Estrogens in insects». Journal Cellular and Molecular Life Sciences 40 (9): 942-944. doi:10.1007/BF01946450.
- ↑ a b Swaab, D. F., Garcia-Falgueras, A. (2009). «Sexual differentiation of the human brain in relation to gender identity and sexual orientation». Funct. Neurol. 24 (1): 17-28. PMID 19403051.
- ↑ Forest, M. G., Cathiard, A. M., Bertrand, J. A. (julio de 1973). «Evidence of testicular activity in early infancy». J. Clin. Endocrinol. Metab. 37 (1): 148-51. PMID 4715291. doi:10.1210/jcem-37-1-148.
- ↑ Corbier, P., Edwards, D. A., Roffi, J. (1992). «The neonatal testosterone surge: a comparative study». Arch Int Physiol Biochim Biophys 100 (2): 127-31. PMID 1379488. doi:10.3109/13813459209035274.
- ↑ Dakin, C. L., Wilson, C. A., Kalló, I., Coen, C. W., Davies, D. C. (mayo de 2008). «Neonatal stimulation of 5-HT(2) receptors reduces androgen receptor expression in the rat anteroventral periventricular nucleus and sexually dimorphic preoptic area». Eur. J. Neurosci. 27 (9): 2473-80. PMID 18445234. doi:10.1111/j.1460-9568.2008.06216.x.
- ↑ «Copia archivada». Archivado desde el original el 22 de febrero de 2012. Consultado el 14 de julio de 2011.
- ↑ a b Bhasin, S., Storer, T. W., Berman, N., Callegari, C., Clevenger, B., Phillips, J., Bunnell, T. J., Tricker, R., Shirazi, A., Casaburi, R. (julio de 1996). «The effects of supraphysiologic doses of testosterone on muscle size and strength in normal men». N. Engl. J. Med. 335 (1): 1-7. PMID 8637535. doi:10.1056/NEJM199607043350101.
- ↑ «Cómo aumentar la testosterona naturalmente». Men's Health. 9 de junio de 2021. Consultado el 9 de agosto de 2022.
- ↑ Mehta, P. H., Jones, A. C., Josephs, R. A. (junio de 2008). «The social endocrinology of dominance: basal testosterone predicts cortisol changes and behavior following victory and defeat». J Pers Soc Psychol 94 (6): 1078-93. PMID 18505319. doi:10.1037/0022-3514.94.6.1078. Archivado desde el original el 19 de abril de 2009. Consultado el 14 de julio de 2011.
- ↑ Ajayi, A. A., Halushka, P. V. (mayo de 2005). «Castration reduces platelet thromboxane A2 receptor density and aggregability». QJM 98 (5): 349-56. PMID 15820970. doi:10.1093/qjmed/hci054.
- ↑ Ajayi, A. A., Mathur, R., Halushka, P. V. (junio de 1995). «Testosterone increases human platelet thromboxane A2 receptor density and aggregation responses». Circulation 91 (11): 2742-7. PMID 7758179.
- ↑ Morgentaler, A., Schulman, C. (2009). «Testosterone and prostate safety». Front Horm Res 37: 197-203. PMID 19011298. doi:10.1159/000176054.
- ↑ Rhoden, E. L., M. A. Averbeck y P. E. Teloken (2008). «Androgen replacement in men undergoing treatment for prostate cancer». J Sex Med 5 (9): 2202-8. PMID 18638000. doi:10.1111/j.1743-6109.2008.00925.x.
- ↑ Morgentaler, A. y A. M. Traish (2009). «Shifting the paradigm of testosterone and prostate cancer: the saturation model and the limits of androgen-dependent growth». Eur Urol 55 (2): 310-20. PMID 18838208. doi:10.1016/j.eururo.2008.09.024.
- ↑ Haddad, R. M., Kennedy, C. C., Caples, S. M., Tracz, M. J., Boloña, E. R., Sideras, K., Uraga, M. V., Erwin, P. J., Montori, V. M. (enero de 2007). «Testosterone and cardiovascular risk in men: a systematic review and meta-analysis of randomized placebo-controlled trials». Mayo Clin. Proc. 82 (1): 29-39. PMID 17285783. doi:10.4065/82.1.29.
- ↑ Jones, T. H., Saad, F. (abril de 2009). «The effects of testosterone on risk factors for, and the mediators of the atherosclerotic process». Atherosclerosis 207 (2): 318-27. PMID 19464009. doi:10.1016/j.atherosclerosis.2009.04.016.
- ↑ Stanworth, R. D., Jones, T. H. (2008). «Testosterone for the aging male; current evidence and recommended practice». Clin Interv Aging 3 (1): 25-44. PMC 2544367. PMID 18488876.
- ↑ a b Mehta, P. H., Josephs, R. A. (diciembre de 2006). «Testosterone change after losing predicts the decision to compete again». Horm Behav 50 (5): 684-92. PMID 16928375. doi:10.1016/j.yhbeh.2006.07.001.
- ↑ Marazziti, D., Canale, D. (agosto de 2004). «Hormonal changes when falling in love». Psychoneuroendocrinology 29 (7): 931-6. PMID 15177709. doi:10.1016/j.psyneuen.2003.08.006.
- ↑ Marazziti, D., Canale, D. (agosto de 2004). Hormonal changes when falling in love 29 (7). pp. 931-6. PMID 15177709. doi:10.1016/j.psyneuen.2003.08.006.
- ↑ Sapienza, P., Zingales, L., Maestripieri, D. (septiembre de 2009). «Gender differences in financial risk aversion and career choices are affected by testosterone». Proc. Natl. Acad. Sci. U.S.A. 106 (36): 15268-73. Bibcode:2009PNAS..10615268S. PMC 2741240. PMID 19706398. doi:10.1073/pnas.0907352106.
- ↑ Apicella, C. L., Dreber, A., Campbell, B., Gray, P. B., Hoffman, M., Little, A. C. (noviembre de 2008). «Testosterone and financial risk preferences». Evolution and Human Behavior 29 (6): 384-390. doi:10.1016/j.evolhumbehav.2008.07.001.
- ↑ Zak. P. J., et al. (2009). «Testosterone administration decreases generosity in the ultimatum game». PLoS ONE 4: e8330. Bibcode:2009PLoSO...4.8330Z. doi:10.1371/journal.pone.0008330.
- ↑ Berg, S. J., Wynne-Edwards, K. E. (2001). «Changes in testosterone, cortisol, and estradiol levels in men becoming fathers». Mayo Clinic Proceedings 76 (1): 582-592.
- ↑ Braude, S., Tang-Martinezb, Z., Taylor, G. T. (marzo de 1999). «Stress, testosterone, and the immunoredistribution hypothesis». Behavioral Ecology 10 (3): 345-350. doi:10.1093/beheco/10.3.345.
- ↑ Olsson, M., Wapstra, E., Madsen, T., Silverin, B. (noviembre de 2000). «Testosterone, ticks and travels: a test of the immunocompetence-handicap hypothesis in free-ranging male sand lizards». Proc. Biol. Sci. 267 (1459): 2339-43. PMC 1690810. PMID 11413653. doi:10.1098/rspb.2000.1289.
- ↑ Cosgrove, K. P.; Mazure, C. M., Staley, J. K. (2007). «Evolving knowledge of sex differences in brain structure, function, and chemistry.». Biol Psychiat 62 (8): 847-55. PMC 2711771. PMID 17544382. doi:10.1016/j.biopsych.2007.03.001.
- ↑ Marner, L., Nyengaard, J. R., Tang, Y., Pakkenberg, B. (2003). Marked loss of myelinated nerve fibers in the human brain with age. J Comp Neurol. 462(2):144-52. PubMed
- ↑ Rabinowicz, T., Dean, D. E., Petetot, J. M., de Courten-Myers, G. M. (1999). Gender differences in the human cerebral cortex: more neurons in males; more processes in females.. Lausanne, Switzerland: Journal of Child Neurology.
- ↑ «Testosterone Affects Some Women's Career Choices». Archivado desde el original el 28 de enero de 2012. Consultado el 14 de julio de 2011.
- ↑ Hogervorst, E., Bandelow, S., Combrinck, M., Smith, A. D. (2004). «Low free testosterone is an independent risk factor for Alzheimer's disease». Exp. Gerontol. 39 (11-12): 1633-9. PMID 15582279. doi:10.1016/j.exger.2004.06.019.
- ↑ Moffat, S. D., Zonderman, A. B., Metter, E. J., Kawas, C., Blackman, M. R., Harman, S. M., Resnick, S. M. (enero de 2004). «Free testosterone and risk for Alzheimer disease in older men». Neurology 62 (2): 188-93. PMID 14745052.
- ↑ Moffat, S. D., Hampson, E. (abril de 1996). «A curvilinear relationship between testosterone and spatial cognition in humans: possible influence of hand preference». Psychoneuroendocrinology 21 (3): 323-37. PMID 8817730. doi:10.1016/0306-4530(95)00051-8.
- ↑ a b Pike, C. J., Rosario, E. R., Nguyen, T. V. (abril de 2006). «Androgens, aging, and Alzheimer's disease». Endocrine 29 (2): 233-41. PMID 16785599. doi:10.1385/ENDO:29:2:233.
- ↑ a b Rosario, E. R., Chang, L., Stanczyk, F. Z., Pike, C. J. (septiembre de 2004). «Age-related testosterone depletion and the development of Alzheimer disease». JAMA 292 (12): 1431-2. PMID 15383512. doi:10.1001/jama.292.12.1431-b.
- ↑ Wright, J., Ellis, L., Beaver, K. (2009). Handbook of crime correlates. San Diego: Academic Press. ISBN 0-12-373612-9.
- ↑ «Testosterona en el Comportamiento y la Agresividad ? Como aumentar la testosterona». Como aumentar la testosterona. 24 de febrero de 2020. Consultado el 22 de abril de 2020.
- ↑ Waterman, M. R., Keeney, D. S. (1992). «Genes involved in androgen biosynthesis and the male phenotype». Horm. Res. 38 (5-6): 217-21. PMID 1307739. doi:10.1159/000182546.
- ↑ Zuber, M. X., Simpson, E. R., Waterman, M. R. (diciembre de 1986). «Expression of bovine 17 alpha-hydroxylase cytochrome P-450 cDNA in nonsteroidogenic (COS 1) cells». Science 234 (4781): 1258-61. Bibcode:1986Sci...234.1258Z. PMID 3535074. doi:10.1126/science.3535074.
- ↑ Brooks, R.V. (noviembre de 1975). «Androgens». Clin Endocrinol Metab 4 (3): 503-20. PMID 58744.
- ↑ Payne, A. H., O'Shaughnessy, P. (1996). «Structure, function, and regulation of steroidogenic enzymes in the Leydig cell». En Payne, A. H., Hardy, M. P., Russell, L. D., ed. Leydig Cell. Vienna [Il]: Cache River Press. pp. 260-285. ISBN 0-9627422-7-9.
- ↑ Swerdloff, R. S., Wang, C., Bhasin, S. (abril de 1992). «Developments in the control of testicular function». Baillieres Clin. Endocrinol. Metab. 6 (2): 451-83. PMID 1377467. doi:10.1016/S0950-351X(05)80158-2.
- ↑ Schultheiss, O. C., Campbell, K. L., McClelland, D. C. (diciembre de 1999). «Implicit power motivation moderates men's testosterone responses to imagined and real dominance success». Horm Behav 36 (3): 234-41. PMID 10603287. doi:10.1006/hbeh.1999.1542.
- ↑ Liu, P. Y., Pincus, S. M., Takahashi, P. Y., Roebuck, P. D., Iranmanesh, A., Keenan, D. M., Veldhuis, J. D. (enero de 2006). «Aging attenuates both the regularity and joint synchrony of LH and testosterone secretion in normal men: analyses via a model of graded GnRH receptor blockade». Am. J. Physiol. Endocrinol. Metab. 290 (1): E34-E41. PMID 16339924. doi:10.1152/ajpendo.00227.2005.
- ↑ «Suplementos para aumentar la testosterona naturalmente. ¿Funcionan?». elDiario.es. 7 de julio de 2022. Consultado el 15 de septiembre de 2022.
- ↑ Andersen, M. L., Tufik, S. (octubre de 2008). «The effects of testosterone on sleep and sleep-disordered breathing in men: its bidirectional interaction with erectile function». Sleep Med Rev 12 (5): 365-79. PMID 18519168. doi:10.1016/j.smrv.2007.12.003. Archivado desde el original el 25 de julio de 2011. Consultado el 17 de julio de 2011.
- ↑ Marin, D. P., Figueira Junior, A. J., Pinto, L. G. «One session of resistance training may increase serum testosterone and triiodetironine in young men». Medicine & Science in Sports & Exercise 38 (5): S285.
- ↑ Hulmi, J. J., Ahtiainen, J. P., Selänne, H., Volek, J. S., Häkkinen, K., Kovanen, V., Mero, A. A. (mayo de 2008). «Androgen receptors and testosterone in men--effects of protein ingestion, resistance exercise and fiber type». J. Steroid Biochem. Mol. Biol. 110 (1-2): 130-7. PMID 18455389. doi:10.1016/j.jsbmb.2008.03.030.
- ↑ Prasad, A. S., Mantzoros, C. S., Beck, F. W., Hess, J. W., Brewer, G. J. (mayo de 1996). «Zinc status and serum testosterone levels of healthy adults». Nutrition 12 (5): 344-8. PMID 8875519. doi:10.1016/S0899-9007(96)80058-X.
- ↑ Koehler, K., Parr, M. K., Geyer, H., Mester, J., Schänzer, W. (enero de 2009). «Serum testosterone and urinary excretion of steroid hormone metabolites after administration of a high-dose zinc supplement». Eur J Clin Nutr 63 (1): 65-70. PMID 17882141. doi:10.1038/sj.ejcn.1602899.
- ↑ Josephs, R. A., Guinn, J. S., Harper, M. L., Askari, F. (noviembre de 2001). «Liquorice consumption and salivary testosterone concentrations». Lancet 358 (9293): 1613-4. PMID 11716893. doi:10.1016/S0140-6736(01)06664-8.
- ↑ Armanini, D., Mattarello, M. J., Fiore, C., Bonanni, G., Scaroni, C., Sartorato, P., Palermo, M. (2004). «Licorice reduces serum testosterone in healthy women». Steroids 69 (11-12): 763-766. PMID 15579328. doi:10.1016/j.steroids.2004.09.005.
- ↑ Akdoğan M.; Tamer M. N.; Cüre E.; Cüre M.C.; Köroğlu B.K.; Delibaş N. (mayo de 2007). «Effect of spearmint (Mentha spicata labiatae) teas on androgen levels in women with hirsutism». Phytother Res 21 (5): 444-447. PMID 17310494. doi:10.1002/ptr.2074.
- ↑ Kumar, V., Kural, M. R., Pereira, B. M., Roy, P. (diciembre de 2008). «Spearmint induced hypothalamic oxidative stress and testicular anti-androgenicity in male rats - altered levels of gene expression, enzymes and hormones». Food Chem. Toxicol. 46 (12): 3563-3570. PMID 18804513. doi:10.1016/j.fct.2008.08.027.
- ↑ Grant, P. (febrero de 2010). «Spearmint herbal tea has significant anti-androgen effects in polycystic ovarian syndrome. A randomized controlled trial». Phytother Res 24 (2): 186-8. PMID 19585478. doi:10.1002/ptr.2900.
- ↑ Randall, V. A. (abril de 1994). «Role of 5 alpha-reductase in health and disease». Baillieres Clin. Endocrinol. Metab. 8 (2): 405-31. PMID 8092979. doi:10.1016/S0950-351X(05)80259-9.
- ↑ Meinhardt, U., Mullis, P. E. (agosto de 2002). «The essential role of the aromatase/p450arom». Semin. Reprod. Med. 20 (3): 277-84. PMID 12428207. doi:10.1055/s-2002-35374.
- ↑ Trager, L. (1977). Steroidhormone: Biosynthese, Stoffwechsel, Wirkung (en alemán). Springer-Verlag. p. 349. ISBN 0-3870-8012-0.
- ↑ Pereira de Jésus-Tran, K., Côté, P. L., Cantin, L., Blanchet, J., Labrie, F., Breton, R. (2006). «Comparison of crystal structures of human androgen receptor ligand-binding domain complexed with various agonists reveals molecular determinants responsible for binding affinity». Protein Sci. 15 (5): 987-99. PMC 2242507. PMID 16641486. doi:10.1110/ps.051905906.
- ↑ Hiipakka, R. A., Liao, S. (octubre de 1998). «Molecular mechanism of androgen action». Trends Endocrinol. Metab. 9 (8): 317-24. PMID 18406296. doi:10.1016/S1043-2760(98)00081-2.
- ↑ McPhaul, M. J., Young, M. (septiembre de 2001). «Complexities of androgen action». J. Am. Acad. Dermatol. 45 (3 Suppl): S87-94. PMID 11511858. doi:10.1067/mjd.2001.117429.
- ↑ Breiner, M., Romalo. G., Schweikert, H. U. (agosto de 1986). «Inhibition of androgen receptor binding by natural and synthetic steroids in cultured human genital skin fibroblasts». Klin. Wochenschr. 64 (16): 732-7. PMID 3762019. doi:10.1007/BF01734339.
- ↑ de Kruif, P. (1945). The Male Hormone. Nueva York: Harcourt, Brace.
- ↑ a b Davis, S. R., Moreau, M., Kroll, R., Bouchard, C., Panay, N., Gass, M., Braunstein, G. D., Hirschberg, A. L., Rodenberg, C., Pack, S., Koch, H., Moufarege, A., Studd, J. (noviembre de 2008). «Testosterone for low libido in postmenopausal women not taking estrogen». N. Engl. J. Med. 359 (19): 2005-17. PMID 18987368. doi:10.1056/NEJMoa0707302.
- ↑ «Testosterone replacement therapy for male aging: ASA position statement». J. Androl. 27 (2): 133-4. 2006. PMID 16474019.
- ↑ Guay, A. T., Spark, R. F., Bansal, S., Cunningham, G. R., Goodman, N. F., Nankin, H. R., Petak, S. M., Perez, J. B. (2003). «American Association of Clinical Endocrinologists medical guidelines for clinical practice for the evaluation and treatment of male sexual dysfunction: a couple's problem--2003 update». Endocr Pract 9 (1): 77-95. PMID 12917096. Archivado desde el original el 27 de diciembre de 2010. Consultado el 20 de julio de 2011.
- ↑ Holt, E. H., Zieve, D. (18 de marzo de 2008). «Testosterone». MedlinePlus Medical Encyclopedia. U.S. National Library of Medicine. Consultado el 17 de julio de 2009.
- ↑ «Contraceptive efficacy of testosterone-induced azoospermia in normal men. World Health Organization Task Force on methods for the regulation of male fertility». Lancet 336 (8721): 955-9. octubre de 1990. PMID 1977002. doi:10.1016/0140-6736(90)92416-F.
- ↑ Traish, A. M., Saad, F., Guay, A. (2009). «The dark side of testosterone deficiency: II. Type 2 diabetes and insulin resistance». J. Androl. 30 (1): 23-32. PMID 18772488. doi:10.2164/jandrol.108.005751.
- ↑ Emmelot-Vonk, M. H., Verhaar, H. J., Nakhai Pour, H. R., Aleman, A., Lock, T. M., Bosch, J. L., Grobbee, D. E., van der Schouw, Y. T. (enero de 2008). «Effect of testosterone supplementation on functional mobility, cognition, and other parameters in older men: a randomized controlled trial». JAMA 299 (1): 39-52. PMID 18167405. doi:10.1001/jama.2007.51.
- ↑ Cunningham, G. R. (25 de junio de 2008). «Testosterone treatment in aging men». EndocrineToday.com. Consultado el 17 de julio de 2009.
- ↑ «Anabolic Steroid Control Act». United States Sentencing Commission. 1990. Archivado desde el original el 27 de mayo de 2010. Consultado el 20 de julio de 2011.
- ↑ Strahm, E., Emery, C., Saugy, M., Dvorak, J., Saudan, C. (diciembre de 2009). «Detection of testosterone administration based on the carbon isotope ratio profiling of endogenous steroids: international reference populations of professional soccer players». Br J Sports Med 43 (13): 1041-4. PMC 2784500. PMID 19549614. doi:10.1136/bjsm.2009.058669.
- ↑ Kicman, A. T., Cowan, D. A. (enero de 2009). «Subject-based profiling for the detection of testosterone administration in sport». Drug Test Anal 1 (1): 22-4. PMID 20355155. doi:10.1002/dta.14.
- ↑ Pozo, O. J., Deventer, K., Van Eenoo, P., et al. Quantification of testosterone undecanoate in human hair by liquid chromatography-tandem mass spectrometry. Biomed. Chromatogr. 23: 873-880, 2009.
- ↑ Baselt RC (2008). Disposition of Toxic Drugs & Chemicals in Man (8th edición). Foster City, Calif: Biomedical Publications. pp. 1501-1504. ISBN 978-0-9626523-7-0.
- ↑ «Testosterone Information». Drugs.com.
- ↑ «Striant Official FDA information, side effects and uses.». Drugs.com. Archivado desde el original el 25 de enero de 2012. Consultado el 21 de julio de 2011.
- ↑ «AndroGel Official FDA information, side effects and uses.». Drugs.com.
- ↑ «Testim (patches and gel) medical facts». Drugs.com. Archivado desde el original el 14 de octubre de 2012. Consultado el 21 de julio de 2011.
- ↑ «Testopel Pellets». www.slatepharma.com. Archivado desde el original el 5 de noviembre de 2011. Consultado el 21 de julio de 2011.
Bibliografía
[editar]- Huckins, Grace (2021). «Cuestión de Testosterona». Investigación y Ciencia (Barcelona: Prensa Científica S.A.) (535): 40-7. ISSN 0210-136X. Consultado el 23 de abril de 2021.
- Hoberman, John M.; Yesalis, Charles E. (1995). «La historia de la testosterona sintética». Investigación y Ciencia (Barcelona: Prensa Científica S.A.) (223). Consultado el 23 de abril de 2021.
Enlaces externos
[editar]- Testosterona en MedlinePlus
- Ficha técnica de la testosterona en el sitio web del NIST (en inglés)
