Alcano

Losalcanossonhidrocarburos,es decir, son compuestos que solo contienen átomos decarbonoehidrógeno.Lafórmula generalpara alcanosalifáticos(de cadena lineal) es CnH2n+2,[1] y para cicloalcanos es CnH2n.[2] También reciben el nombre dehidrocarburos saturados,ya que carecen deenlaces dobles o triplesy, por tanto, todos sus carbonos presentanhibridación sp3.Además, carecen degrupos funcionales.
Alcanos acíclicos (primarios)
[editar]Los alcanos alifáticos pueden ser de cadena lineal o ramificada, siendo la relación decarbonoehidrógenoCnH2n+2,donde "n" representa el número de átomos de carbono de lamolécula.Su reactividad es muy reducida en comparación con otros compuestos orgánicos. Todos los enlaces de los alcanos son sencillos (esto es, detipo sigma), es decir,covalentesque comparte un par deelectronesen unorbitals,por lo cual la estructura de un alcano sería de la forma, donde cada línea o barra representa un enlace covalente donde se comparten equitativamente un par de electrones entre los átomos enlazados.

El alcano más sencillo es elmetanocon un solo átomo de carbono. Otros alcanos conocidos son eletano,propanoy elbutanocon dos, tres y cuatro átomos de carbono respectivamente. A partir de cinco carbonos, los nombres se derivan de acuerdo con el número de átomos de carbono que posea la molécula.
| C | Nombre | Fórmula | Modelo |
|---|---|---|---|
| 1 | Metano | CH4 |  |
| 2 | Etano | C2H6 |  |
| 3 | Propano | C3H8 |  |
| 4 | Butano | C4H10 | |
| 5 | Pentano | C5H12 | |
| 6 | Hexano | C6H14 | |
| 7 | Heptano | C7H16 | |
| 8 | Octano | C8H18 |  |
| 9 | Nonano | C9H20 |  |
| 10 | Decano | C10H22 | |
| 11 | Undecano | C11H24 | |
| 12 | Dodecano | C12H26 |  |

Elpolietileno(PE) es químicamente el polímero más simple representado con su unidad repetitiva (CH2-CH2)n.Se obtiene de la polimerización del etileno. Elpolietileno de ultra alto peso molecular(UHMWPE,UHMW) es un polímero de cadena lineal no ramificada extremadamente larga, con una masa molecular generalmente entre 3.5 y 7.5 millones de Daltones.[3]
Para la nomenclatura de alcanos acíclicos, consulteNomenclatura de hidrocarburos acíclicos.
Cicloalcanos
[editar]
Losalcanos cíclicosocicloalcanosson, como su nombre indica, hidrocarburos de cadena cíclica. En ellos la relación C/H es CnH2n.Sus características físicas son similares a las de los alcanos no cíclicos, pero sus características químicas difieren sensiblemente, especialmente aquellos de cadena más corta, que tienen propiedades más similares a las de losalquinos.
Para detalles de la nomenclatura de cicloalcanos, consulteNomenclatura de hidrocarburos monocíclicos,Nomenclatura de hidrocarburos policíclicos con puentes,Compuesto espiro,Sistema de nomenclatura de fusión,ynomenclatura de agrupaciones de ciclos
Abundancia
[editar]Abundancia de los alcanos en el universo
[editar]
Los alcanos son una parte importante de laatmósferade losplanetas exteriores,comoJúpiter(0,01% de metano, 0,0002% de etano),Saturno(0,2% de metano, 0,0005% de etano),Urano(1,99% de metano, 0,00025% de etano) yNeptuno(1,5% de metano, 1,5ppmde etano).Titán,un satélite de Saturno, fue estudiado por lasonda espacial Huygens,y halló que la atmósfera de Titán llueve metano líquido.[4] También se observó en Titán un volcán que arrojaba metano, y se cree que este vulcanismo es una fuente significativa de metano en la atmósfera. También parece ser que hay lagos de metano/etano cerca a las regiones polares nórdicas de Titán, como lo descubrió el sistema de imágenes por radar de lasonda Cassini.También se ha detectadometanoyetanoen la cola delcometa Hyakutake.El análisis químico mostró que la abundancia del etano y el metano son aproximadamente iguales, lo que se cree que implica que los hielos formados en el espacio interestelar, lejos del Sol, podrían haberse evaporado en forma desigual debido a la diferente volatilidad de estas moléculas.[5] También se ha detectado alcanos enmeteoritoscomo lascondritascarbonáceas.
Abundancia de los alcanos en el planeta Tierra
[editar]En la atmósfera hay trazas de gas metano (0,0001%), producido principalmente por organismos comoArchaea,que se encuentra, por ejemplo, en el estómago de las vacas.

La fuente comercial más importante para los alcanos es elgas naturaly elpetróleo.[6] El gas natural contiene principalmente metano y etano, pero también algo depropanoybutano:el petróleo es una mezcla de alcanos líquidos y otroshidrocarburos.Estos hidrocarburos se formaron cuando los animales marinos y plantas (zooplancton y fitoplancton) muertos y hundidos en el fondo de los mares antiguos y cubiertos con sedimentos en un mediowikt:anóxico(carente de oxígeno) y cubiertos por varios millones de años a alta temperatura y presión hasta su forma actual. El gas natural, por ejemplo, se puede obtener de la reacción siguiente:
- C6H12O6→ 3CH4+ 3CO2
Estos hidrocarburos fueron absorbidos en rocas porosas, y se localizaron en una cápsula impermeable de roca y ahí quedaron atrapados. A diferencia del metano, que se reforma en grandes cantidades, los alcanos superiores (alcanos con 9 átomos de carbono o más) raras veces se producen en cantidades grandes en la naturaleza. Estos depósitos, por ejemplo,campos de petróleo,se han formado durante millones de años y una vez exhaustos no pueden ser reemplazados rápidamente. El agotamiento de estos hidrocarburos es la base para lo que se conoce comocrisis energética.
Los alcanos sólidos se conocen comoalquitrány se forman cuando los alcanos más volátiles, como los gases y el aceite, seevaporande los depósitos de hidrocarburos. Uno de los depósitos más grandes de alcanos sólidos es en el lago deasfaltoconocido como ellago PitchenTrinidad y Tobago.
El metano también está presente en el denominadobiogás,producido por los animales y materia en descomposición, que es una posiblefuente renovable de energía.
Los alcanos tienen solubilidad baja en agua; sin embargo, a altas presiones y temperaturas bajas (tal como en el fondo de los océanos), el metano puede co-cristalizar con el agua para formar unhidrato de metanosólido. Aunque este no puede ser explotado comercialmente ahora, la cantidad de energía combustible de los campos de hidrato de metano conocidos excede al contenido de energía de todos los depósitos de gas natural y petróleo juntos; el metano extraído delclatratode metano es entonces considerado un candidato para combustibles futuros.
Abundancia biológica
[editar]Aunque los alcanos están presentes en la naturaleza de distintas formas, no están catalogados biológicamente como materiales esenciales. Hay cicloalcanos de tamaño de anillo entre 14 y 18 átomos de carbono en elmusk,extraído deciervosde la familiaMoschidae.Toda la información adicional se refiere a los alcanos acíclicos.
- Bacteria y archaea

Ciertos tipos debacteriapueden metabolizar a los alcanos: prefieren las cadenas de carbono de longitud par pues son más fáciles de degradar que las cadenas de longitud impar. Por otro lado, ciertasarchaea,losmetanógenos,produce cantidades grandes demetanocomo producto del metabolismo deldióxido de carbonoy otros compuestos orgánicosoxidados.La energía se libera por la oxidación delhidrógeno:
- CO2+ 4H2→ CH4+ 2H2O
Los metanógenos también son los productores delgas de los pantanosenhumedales,y liberan alrededor de dos mil millones de toneladas de metano por año—el contenido atmosférico de este gas es producido casi exclusivamente por ellos. La producción de metano delganadoy otrosherbívoros,que pueden liberar hasta 150 litros por día, y de lastermitastambién se debe a los metanógenos. También producen los alcanos más simples en elintestinode los humanos. Por tanto, las archaea metanogénicas están en el extremo delciclo del carbono,con el carbono siendo liberado en la atmósfera después de haber sido fijado por lafotosíntesis.Es posible que nuestros actuales depósitos degas naturalse hayan formado en forma similar.
- Hongos y plantas

Los alcanos también juegan un rol, si bien es cierto menor, en la biología de los tres grupos de organismoseucariotas:hongos,plantas y animales. Algunas levaduras especializadas, comoCandida tropicale,Pichiasp.,Rhodotorulasp., pueden usar alcanos como una fuente de carbono o energía. El hongoAmorphotheca resinaeprefiere los alcanos de cadena larga en lasgasolinas de aviación,y puede causar serios problemas para los aviones en las regiones tropicales. En las plantas, se encuentran alcanos sólidos de cadena larga; forman una capa firme de cera, lacutícula,sobre las áreas de las plantas expuestas al aire. Ésta protege a la planta de la pérdida de agua, a la vez que evita elleachingde minerales importantes por la lluvia. También es una protección contra lasbacterias,hongos,einsectosdañinos— estos últimos se hunden con sus patas en la sustancia cerosa suave, y tienen dificultad para moverse. La capa brillante sobre las frutas, tales como en lasmanzanas,está formada por alcanos de cadena larga. Las cadenas de carbono tienen generalmente entre veinte y treinta átomos de carbono de longitud, y las plantas las producen a partir de losácidos grasos.La composición exacta de la película de cera no solo depende de la especie, sino que cambia con la estación y factores ambientales como las condiciones de iluminación, temperatura o humedad.
- Animales
Los alcanos se encuentran en productos animales, aunque son menos importantes que los hidrocarburos insaturados. Un ejemplo es el aceite de hígado de tiburón, que es aproximadamente 14%pristano(2,6,10,14-tetrametilpentadecano, C19H40). Su abundancia es más significativa en lasferomonas,materiales que actúan como mensajeros químicos, en los cuales se fundamenta casi toda la comunicación entre insectos. En algunos tipos, como el escarabajoXylotrechus colonus,principalmente elpentacosano(C25H52), 3-metilpentaicosano (C26H54) y 9-metilpentaicosano (C26H54), se transfieren por contacto corporal. Con otras, como lamosca tsetseGlossina morsitans morsitans,la feromona contiene los cuatro alcanos 2-metilheptadecano (C18H38), 17,21-dimetilheptatriacontano (C39H80), 15,19-dimetilheptatriacontano (C39H80) y 15,19,23-trimetilheptatriacontano (C40H82), y actúa mediante el olfato en distancias grandes, una característica muy útil para elcontrol de plagas.
Relaciones ecológicas
[editar]
Un ejemplo, en el que tanto los alcanos de plantas y animales juegan un rol, es la relación ecológica entre la abejaAndrena nigroaeneay la orquídeaOphrys sphegodes;la última depende para supolinizaciónde la primera. Las abejasAndrena nigroaeneausanferomonaspara identificar a una compañera; en el caso deA. nigroaenea,las hembras emiten una mezcla detricosano(C23H48),pentacosano(C25H52) yheptacosano(C27H56) en la proporción 3:3:1, y los machos son atraídos específicamente por este olor. Laorquídeatoma ventaja de este arreglo de apareamiento para hacer que las abejas macho recolecten y diseminen su polen; no solo sus flores se parecen a dicha especie de abejas, sino que también producen grandes cantidades de los tres alcanos en la misma proporción que las abejasA. nigroaeneahembra. Como resultado, numerosos machos son atraídos a las flores e intentan copular con su compañera imaginaria; aunque este comportamiento no se corona con el éxito para la abeja, permite a la orquídea transferir su polen, que se dispersará con la partida del macho frustrado a otras florales.
Producción
[editar]Refinado del petróleo
[editar]
La fuente más importante de alcanos es elgas naturaly elpetróleo crudo.[6] Los alcanos son separados en unarefinería de petróleopordestilación fraccionaday procesados en muchos productos diferentes.
Fischer-Tropsch
[editar]Elproceso Fischer-Tropsches un método para sintetizar hidrocarburos líquidos, incluyendo alcanos, a partir demonóxido de carbonoehidrógeno.Este método es usado para producir sustitutos para losdestilados de petróleo.
Preparación en el laboratorio
[editar]Generalmente hay poca necesidad de sintetizar alcanos en el laboratorio, dado que suelen estar disponibles comercialmente. También debido al hecho de que los alcanos son, generalmente, poco reactivos química y biológicamente, y no sufren interconversioneslimpiasde grupos funcionales. Cuando se producen alcanos en el laboratorio, suele ser un subproducto de una reacción. Por ejemplo, el uso deN-butil-litiocomo unabaseproduce el ácido conjugado, n-butano como subproducto:
- C4H9Li + H2O → C4H10+LiOH
Sin embargo, a veces puede ser deseable convertir una porción de una molécula en una estructura funcionalmente alcánica (grupoalquilo) usando un método como el de arriba o métodos similares. Por ejemplo, un grupoetiloes un grupo alquilo; cuando está unido a un grupohidroxi,constituye eletanol,que no es un alcano. Para convertirlo en alcano, uno de los métodos más conocidos es lahidrogenacióndealquenosoalquinos.
- RCH=CH2+ H2→ RCH2CH3(R =alquilo)
Los alcanos o los grupos alquino pueden ser preparados directamente a partir dehaloalcanosen lareacción de Corey-House-Posner-Whitesides.Lareacción de Barton-McCombie[7][8] elimina el grupo hidroxilo de los alcoholes, por ejemplo.
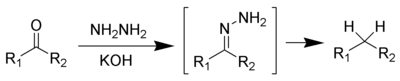
y lareducción de Clemmensen[9][10][11][12] o lareducción de Wolff-Kishnereliminan los grupos carbonilo de los aldehídos y cetonas para formar alcanos o compuestos de sustituidos de alquilo:
Otros métodos para obtener alcanos son lareacción de Wurtzy laelectrólisis de Kolbe.
Propiedades físicas de los alcanos
[editar]Punto de ebullición
[editar]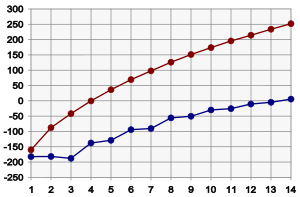
Los alcanos experimentan fuerzas intermoleculares devan der Waalsy al presentarse menores fuerzas de este tipo aumenta elpunto de ebullición,además los alcanos se caracterizan por tener enlaces simples.[6] VéaseHeneicosano.
Hay dos determinantes de la magnitud de las fuerzas de van der Waals:
- El número de electrones que rodean a la molécula, que se incrementa con la masa molecular del alcano.
- El área superficial de la molécula.
Bajocondiciones estándar,los alcanos desde el CH4hasta el C4H10son gases; desde el C5H12hasta C17H36son líquidos; y los posteriores a C18H38son sólidos. Como el punto de ebullición de los alcanos está determinado principalmente por el peso, no debería sorprender que los puntos de ebullición tengan una relación casi lineal con lamasa molecularde la molécula. Como regla rápida, el punto de ebullición se incrementa entre 20 y 30 °C por cada átomo de carbono agregado a la cadena; esta regla se aplica a otras series homólogas.[6]
Un alcano de cadena lineal tendrá un mayor punto de ebullición que un alcano de cadena ramificada, debido a la mayor área de la superficie de contacto, con lo que hay mayores fuerzas de van der Waals, entre moléculas adyacentes. Por ejemplo, compárese elisobutanoy eln-butano,que hierven a -12 y 0 °C, y el 2,2-dimetilbutano y 2,3-dimetilbutano que hierven a 50 y 58 °C, respectivamente.[6] En el último caso, dos moléculas de 2,3-dimetilbutano pueden "encajar" mutuamente mejor que las moléculas de 2,2-dimetilbutano entre sí, con lo que hay mayores fuerzas de van der Waals.
Por otra parte, los cicloalcanos tienden a tener mayores puntos de ebullición que sus contrapartes lineales, debido a las conformaciones fijas de las moléculas, que proporcionan planos para el contacto intermolecular.[cita requerida]
Punto de fusión
[editar]Elpunto de fusiónde los alcanos sigue una tendencia similar al punto de ebullición. Esto es, (si todas las demás características se mantienen iguales), la molécula más grande corresponde mayor punto de fusión. Hay una diferencia significativa entre los puntos de fusión y los puntos de ebullición: los sólidos tienen una estructura más rígida y fija que los líquidos. Esta estructura rígida requiere energía para poder romperse durante la fusión. Entonces, las estructuras sólidas mejor construidas requerirán mayor energía para la fusión. Para los alcanos, esto puede verse en el gráfico anterior. Los alcanos de longitud impar tienen puntos de fusión ligeramente menores que los esperados, comparados con los alcanos de longitud par. Esto se debe a que los alcanos de longitud par se empacan bien en la fase sólida, formando una estructura bien organizada, que requiere mayor energía para romperse. Los alcanos de longitud impar se empacan con menor eficiencia, con lo que el empaquetamiento más desordenado requiere menos energía para romperse.[13]
Los puntos de fusión de los alcanos de cadena ramificada pueden ser mayores o menores que la de los alquenos
Conductividad
[editar]Los alcanos son malos conductores de laelectricidady no sepolarizansustancialmente por uncampo eléctrico.
Solubilidad en agua
[editar]No formanpuentes de hidrógenoy son insolubles en disolventes polares como el agua. Puesto que los puentes de hidrógeno entre las moléculas individuales de agua están apartados de una molécula de alcano, la coexistencia de un alcano y agua conduce a un incremento en el orden molecular (reducción deentropía). Como no hay enlaces significativos entre las moléculas de agua y las moléculas de alcano, lasegunda ley de la termodinámicasugiere que esta reducción en la entropía se minimizaría al minimizar el contacto entre el alcano y el agua: se dice que los alcanos sonhidrofóbicos(repelen el agua).
Solubilidad en otros disolventes
[editar]Su solubilidad en disolventes no polares es relativamente buena, una propiedad que se denominalipofilicidad.Por ejemplo, los diferentes alcanos son miscibles entre sí en todas las demás proporciones.
Densidad
[editar]La densidad de los alcanos suele aumentar conforme aumenta el número de átomos de carbono, pero permanece inferior a la del agua. En consecuencia, los alcanos forman la capa superior en una mezcla de alcano-agua.
Geometría molecular
[editar]
La estructura molecular de los alcanos afecta directamente a sus características físicas y químicas. Se deriva de laconfiguración electrónicadelcarbono,que tiene cuatroelectrones de valencia.Los átomos de carbono en los alcanos siempre tienenhibridación sp3,lo que quiere decir que los electrones de valencia están en cuatro orbitales equivalentes, derivados de la combinación del orbital 2s y los orbitales 2p. Estos orbitales, que tienen energías idénticas, están orientados espacialmente en la forma de untetraedro,con un ángulo de arccos(-1/3) ≈ 109.47° entre ellos.
Longitudes de enlace y ángulos de enlace
[editar]Una molécula de alcano tiene solo enlaces simples C – H y C – C. Los primeros resultan del traslape de un orbital sp3del átomo de carbono con el orbital 1s de un átomo de hidrógeno; los últimos del traslape de dos orbitales sp3en átomos de carbono diferentes. Lalongitud de enlacees de 1,09×10−10m para un enlace C – H y 1,54×10−10m para un enlace C – C.

La disposición espacial de los enlaces es similar a la de cuatro orbitales sp3;están dispuestos tetraédricamente, con un ángulo de 109,47° entre ellos. La fórmula estructural que representa a los enlaces como si estuvieran en ángulos rectos unos con otros, aunque común y útil, no corresponde con la realidad.
Conformaciones
[editar]La fórmula estructural y losángulos de enlaceno suelen ser suficientes para describir la geometría de una molécula. Hay ungrado de libertadpara cada enlace carbono – carbono: elángulo de torsiónentre los átomos o grupos unidos a los átomos a cada extremo de un enlace. El arreglo espacial descrito por los ángulos de torsión de la molécula se conoce como suconformación.


Eletanoconstituye el caso más simple para el estudio de las conformaciones de los alcanos, dado que solo hay un enlace C – C. Si se ve a lo largo del enlace C – C, se tendrá la denominadaproyección de Newman.Los átomos de hidrógeno tanto en el átomo carbono anterior como en el átomo de carbono posterior tienen un ángulo de 120° entre ellos, resultante de la proyección de la base del tetraedro en una superficie plana. Sin embargo, el ángulo de torsión entre un átomo de hidrógeno dado del carbono anterior y un átomo de hidrógeno dado del carbono posterior puede variar libremente entre 0° y 360°. Esto es una consecuencia de la rotación libre alrededor del enlace carbono – carbono. A pesar de esta aparente libertad, solo hay dos conformaciones limitantes importantes: conformacióneclipsaday conformaciónalternada.
Las dos conformaciones, también conocidas comorotámeros,difieren en energía: la conformación alternada es 12,6 kJ/mol menor en energía (por tanto, más estable) que la conformación eclipsada (menos estable). La diferencia en energía entre las dos conformaciones, conocida como laenergía torsionales baja comparada con la energía térmica de una molécula de etano a temperatura ambiente. Hay rotación constante alrededor del enlace C-C. El tiempo tomado para que una molécula de etano pase de la conformación alternada a la siguiente, equivalente a la rotación de un grupo CH3en 120° relativo a otro, es del orden de 10−11segundos.
El caso de alcanos mayores es más complejo, pero se basa en los mismos principios, con la conformación antiperiplanar siendo más favorecida alrededor de cada enlace carbono-carbono. Por esta razón, los alcanos suelen mostrar una disposición en zigzag en los diagramas o en los modelos. La estructura real siempre diferirá en algo de estas formas idealizadas, debido a que las diferencias en energía entre las conformaciones son pequeñas comparadas con la energía térmica de las moléculas: las moléculas de alcano no tienen una forma estructura fija, aunque los modelos así lo sugieran.
| NOMBRE | Fórmula | Pto.Ebu/oC | Pto. Fus./oC | Densidad g/cm-3(20.oC) |
| Metano | CH4 | -162 | -183 | gas |
| Etano | C2H6 | -89 | -172 | gas |
| Propano | C3H8 | -42 | -188 | gas |
| Butano | C4H10 | -0.5 | -135 | gas |
| Pentano | C5H12 | 36 | -130 | 0.626 |
| Hexano | C6H14 | 69 | -95 | 0.659 |
| Heptano | C7H16 | 98 | -91 | 0.684 |
| Octano | C8H18 | 126 | -57 | 0.703 |
| Nonano | C9H20 | 151 | -54 | 0.718 |
| Decano | C10H22 | 174 | -30 | 0.730 |
| Undecano | C11H24 | 196 | -26 | 0.740 |
| Dodecano | C12H26 | 216 | -10 | 0.749 |
| Icosano | C20H42 | 343 | 37 | sólido |
Propiedades espectroscópicas
[editar]Prácticamente todos los compuestos orgánicos contienen enlaces carbono – carbono y carbono – hidrógeno, con lo que muestran algunas características de los alcanos en sus espectros. Los alcanos se distinguen por no tener otros grupos y, por tanto, por la "ausencia" de otras características espectroscópicas.
Espectroscopia RMN
[editar]La resonancia del protón de los alcanos suele encontrarse enδH= 0.5 – 1.5. La resonancia del carbono-13 depende del número de átomos de hidrógeno unidos al carbono: δC= 8 – 30 (primario, metilo, -CH3), 15 – 55 (secundario, metileno, -CH2-), 20 – 60 (terciario, metino, C-H) y cuaternario. La resonancia de carbono-13 de los átomos de carbono cuaternarios es característicamente débil, debido a la falta deefecto Overhauser nucleary el largotiempo de relajación,y puede faltar en espectros de muestras diluidas o en los que no se ha almacenado señal un tiempo suficientemente largo.
Espectrometría de masas
[editar]Los alcanos tienen una altaenergía de ionización,y el ion molecular es generalmente débil. El patrón de fragmentación puede ser difícil de interpretar, pero, en el caso de los alcanos de cadena ramificada, la cadena carbonada se rompe preferentemente en los átomos de carbono terciarios y cuaternarios, debido a la relativa estabilidad de losradicales libresresultantes. El fragmento resultante de la pérdida de solo un grupo metilo (M-15) suele estar ausente, y otros fragmentos suelen estar espaciados a intervalos de catorce unidades de masa, correspondiendo a la pérdida secuencial de grupos CH2.gg.
Propiedades químicas
[editar]En general, los alcanos muestran una reactividad relativamente baja, porque sus enlaces de carbono son relativamente estables y no pueden ser fácilmente rotos. A diferencia de muchos otros compuestos orgánicos, no tienengrupo funcional.
Solo reaccionan muy pobremente con sustancias iónicas o polares. Laconstante de acidezpara los alcanos tiene valores inferiores a 60, en consecuencia son prácticamente inertes a los ácidos y bases. Su inercia es la fuente del términoparafinas(que significa "falto de afinidad" ). En elpetróleo crudo,las moléculas de alcanos permanecen químicamente sin cambios por millones de años.
Sin embargo, es posible reacciones redox de los alcanos, en particular con el oxígeno y los halógenos, puesto que los átomos de carbono están en una condición fuertemente reducida; en el caso del metano, se alcanza el menor estado de oxidación posible para el carbono (-4). La reacción con el oxígeno conduce a la combustión sin humo; con los halógenos, a lareacción de sustitución.Además, los alcanos interactúan con, y se unen a, ciertos complejos de metales de transición (ver:activación del enlace carbono-hidrógeno).
Losradicales libres,moléculas con un número impar de electrones, desempeñan un papel importante en la mayoría de reacciones de los alcanos, tales como el cracking y el reformado, donde los alcanos de cadena larga se convierten en alcanos de cadena corta, y los alcanos de cadena lineal en los isómeros ramificados, respectivamente.
En los alcanos altamente ramificados, el ángulo de enlace puede diferir significativamente del valor óptimo (109,47°) para permitir a los diferentes grupos suficiente espacio. Esto origina una tensión en la molécula conocida comoimpedimento estérico,y puede aumentar sustancialmente la reactividad.
Reacciones con oxígeno
[editar]Todos los alcanos reaccionan conoxígenoen una reacción decombustión,si bien se torna más difícil de inflamar al aumentar el número de átomos de carbono. La ecuación general para la combustión completa es:
- CnH2n+2+ (1,5n+0,5)O2→ (n+1)H2O +nCO2
En ausencia de oxígeno suficiente, puede formarsemonóxido de carbonoo inclusivenegro de humo,como se muestra a continuación:
por ejemplometano:
- CH4+ 2O2→ CO2+ 2H2O
- CH4+ O2→ CO + 2H2O
Vertabla de calor de formación de alcanospara información detallada.
Elcambio de entalpía estándar de combustión,ΔcHo,para los alcanos se incrementa aproximadamente en 650 kJ/mol por cada grupo CH2en una serie homóloga. Los alcanos de cadena ramificada tienen menores valores de ΔcHoque los alcanos de cadena lineal del mismo número de átomos de carbono, por lo que pueden ser vistos como algo más estables.
Reacciones con halógenos
[editar]Los alcanos reaccionan conhalógenosen la denominada reacción dehalogenación radicalaria.Los átomos de hidrógeno del alcano son reemplazados progresivamente por átomos de halógeno. Losradicales libresson las especies que participan en la reacción, que generalmente conduce a una mezcla de productos. La reacción es altamenteexotérmica,y puede resultar en una explosión.
Estas reacciones son una importante ruta industrial para los hidrocarburos halogenados.
Los experimentos han mostrado que toda halogenación produce una mezcla de todos los isómeros posibles, indicando que todos los átomos de hidrógeno son susceptibles de reaccionar. Sin embargo, la mezcla producida no es una mezcla estadística: los átomos de hidrógeno secundobromación del propano:[6]

Cracking
[editar]El cracking rompe moléculas grandes en unidades más pequeñas. Esta operación puede realizarse con un método térmico o un método catalítico. El proceso de cracking térmico sigue unmecanismo de reacciónhomolíticocon formación deradicales libres.El proceso de cracking catalítico involucra la presencia de uncatalizadorácido(generalmente ácidos sólidos comosilica-alúminayzeolitas), que promueven laheterólisis(ruptura asimétrica) de los enlaces, produciendo pares deionesde cargas opuestas,generalmente uncarbocatióny elaniónhidruro,que es muy inestable.
Los radicales libres dealquiloy los carbocationes son altamente inestables, y sufren procesos de reordenamiento de la cadena, y la escisión del enlace C-C en la posiciónbeta,además de transferencias de hidrógeno o hidrurointramolecularyextramolecular.En ambos tipos de procesos, losreactivos intermediarios(radicales, iones) se regeneran permanentemente, por lo que proceden por un mecanismo de autopropagaciónen cadena.Finalmente, la cadena de reacciones termina en una recombinación de iones o radicales.
Isomerización y reformado
[editar]La isomerización y reformado son procesos en los que los alcanos de cadena lineal son calentados en presencia de un catalizador deplatino.En la isomerización, los alcanos se convierten en sus isómeros de cadena ramificada. En el reformado, los alcanos se convierten en sus formascíclicaso enhidrocarburos aromáticos,liberando hidrógeno como subproducto. Ambos procesos elevan elíndice de octanode la sustancia.
Otras reacciones
[editar]Los alcanos reaccionan convaporen presencia de uncatalizadordeníquelpara producirhidrógeno.Los alcanos pueden serclorosulfonadosynitrados,aunque ambas reacciones requieren condiciones especiales. Lafermentaciónde los alcanos aácidos carboxílicoses de importancia técnica. En lareacción de Reed,eldióxido de azufreycloroconvierten a los hidrocarburos en cloruros de sulfonilo, en un proceso inducido por luz.
Aplicaciones
[editar]Las aplicaciones de los alcanos pueden ser determinadas bastante bien de acuerdo con el número de átomos de carbono. Los cuatro primeros alcanos son usados principalmente para propósitos de calefacción y cocina, y en algunos países para generación de electricidad. Elmetanoy eletanoson los componentes principales delgas natural;son normalmente almacenados como gases bajo presión. Es, sin embargo, más fácil trasportarlos en estado líquido, lo que requiere la compresión y el enfriamiento del gas.
Elpropanoy elbutanopueden ser líquidos a presiones moderadamente bajas y son conocidos comogases licuados del petróleo(GLP). Por ejemplo, el propano se usa en el quemador de gas propano, el butano en los encendedores descartables de cigarrillos. Estos dos alcanos son usados también como propelentes enpulverizadores. Desde elpentanohasta eloctano,los alcanos son líquidos razonablemente volátiles. Se usan como combustibles enmotores de combustión interna,puesto que pueden vaporizarse rápidamente al entrar en la cámara de combustión, sin formar gotas, que romperían la uniformidad de la combustión. Se prefieren los alcanos de cadena ramificada, puesto que son menos susceptibles a la ignición prematura, que causa el cascabeleo en los motores, que sus análogos de cadena lineal. Esta propensión a la ignición prematura es medida por elíndice de octanodel combustible, donde el2,2,4-trimetilpentano(isooctano) tiene un valor arbitrario de 100, yheptanotiene un valor de cero. Además de su uso como combustibles, los alcanos medios son buenossolventespara las sustancias no polares.
Los alcanos a partir del hexadecano en adelante constituyen los componentes más importantes delaceite combustibleyaceite lubricante.La función de los últimos es también actuar como agentes anticorrosivos, puesto que su naturaleza hidrofóbica implica que el agua no puede llegar a la superficie del metal. Muchos alcanos sólidos encuentran uso comocera de parafina,por ejemplo en vela. Ésta no debe confundirse con la verdaderacera,que consiste principalmente deésteres.
Los alcanos con una longitud de cadena de aproximadamente 35 o más átomos de carbono se encuentran en elbetún,que se usa, por ejemplo, para asfaltar los caminos. Sin embargo, los alcanos superiores tienen poco valor, y se suelen romper en alcanos menores mediantecracking.
Algunospolímerossintéticos tales como elpolietilenoy elpolipropilenoson alcanos con cadenas que contienen cientos de miles de átomos de carbono. Estos materiales se usan en innumerables aplicaciones, y se fabrican y usan millones de toneladas de estos materiales al año.
Riesgos
[editar]El metano es explosivo cuando está mezclado con aire (1 – 8% CH4) es un agente muy fuerte en elefecto invernadero.Otros alcanos menores también forman mezclas explosivas con el aire. Los alcanos líquidos ligeros son altamente inflamables, aunque este riesgo decrece con el aumento de la longitud de la cadena de carbono. El pentano, hexano, heptano y octano están clasificados comopeligrosos para el medio ambienteynocivos.El isómero de cadena lineal delhexanoes unaneurotoxina.
tipos de hidrocarburos
[editar]Referencias
[editar]- ↑[1]Química: Teoría y Problemas.Escrito por José Antonio García Pérez. pag 302. books.google.es
- ↑[2]Química Orgánica.Escrito por John McMurry. pag 131. books.google.es
- ↑Stein, H. L. (1998). Ultrahigh molecular weight polyethylenes (uhmwpe). Engineered Materials Handbook, 2, 167–171.
- ↑Titan: Arizona in an Icebox?,Emily Lakdawalla,2004-01-21,verified2005-03-28
- ↑Mumma, M.J.; Disanti, M.A.; dello Russo, N.; Fomenkova, M.; Magee-Sauer, K.; Kaminski, C.D.; D.X., Xie (1996). «Detection of Abundant Ethane and Methane, Along with Carbon Monoxide and Water, in Comet C/1996 B2 Hyakutake: Evidence for Interstellar Origin».Science272:1310.PMID8650540.doi:10.1126/science.272.5266.1310.
- ↑abcdefR. T. Morrison, R. N. Boyd (1992).Organic Chemistry(6th edición). New Jersey: Prentice Hall.ISBN0-13-643669-2.
- ↑Barton, D. H. R.;McCombie, S. W.J. Chem. Soc., Perkin Trans. 11975,16,1574-1585
- ↑Crich, D.; Quintero, L.Chem. Rev.1989,89,1413-1432.
- ↑Martin, E. L.Org. React.1942,1,155. (Review)
- ↑Buchanan, J. G. St. C.; Woodgate, P. D.Quart. Rev.1969,23,522. (Review)
- ↑Vedejs, E.Org. React.1975,22,401. (Review)
- ↑Yamamura, S.; Nishiyama, S.Comp. Org. Syn.1991,8,309-313.(Review)
- ↑Boese R, Weiss HC, Blaser D (1999). «The melting point alternation in the short-chain n-alkanes: Single-crystal X-ray analyses of propane at 30 K and of n-butane to n-nonane at 90 K».Angew Chemie Int Ed38:988-992.doi:10.1002/(SICI)1521-3773(19990401)38:7<988::AID-ANIE988>3.3.CO;2-S.
Enlaces externos
[editar] Wikimedia Commonsalberga una galería multimedia sobreAlcano.
Wikimedia Commonsalberga una galería multimedia sobreAlcano.- Documento Sinorg UJI de Alcanos