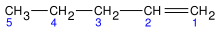Alqueno

Losalquenossonhidrocarburos insaturadosque tienendoble enlace carbono-carbonoen sumolécula.Se puede decir que unalquenoes unalcanoque ha perdido dosátomosdehidrógenoproduciendo como resultado un enlace doble entre dos carbonos. Los alquenos cíclicos reciben el nombre decicloalquenos.
Antiguamente se los denominaba comoolefinasdadas las propiedades que presentaban sus representantes más simples, principalmente eleteno,para reaccionar conhalógenosy produciróleos.
LaUnión Internacional de Química Pura y Aplicada(IUPAC) recomendó usar el nombre "alqueno" sólo para hidrocarburosacíclicoscon un solo doble enlace;alcadieno,alcatrieno,etc., opolienopara los hidrocarburos acíclicos con dos o más dobles enlaces;cicloalqueno,cicloalquadieno,etc. para loscíclico;y "olefina" para la clase general -cíclica o acíclica, con uno o más dobles enlaces.[1][2][3]
Los alquenos acíclicos, con un solo doble enlace y ningún otrogrupo funcional(también conocidos comomono-enos) forman unaserie homólogadehidrocarburoscon la fórmula generalC
nH
2n}connigual o superior a 2 (es decir, doshidrógenosmenos que elalcanocorrespondiente). Cuandones cuatro o más, son posiblesisómeros,que se distinguen por la posición yconformacióndel doble enlace.
Los alquenos son compuestos generalmente incolorosno polares,algo similares a los alcanos pero más reactivos. Los primeros miembros de la serie son gases o líquidos a temperatura ambiente. El alqueno más simple, eletileno(C
2H
4) (o "eteno" en lanomenclatura IUPAC) es elcompuesto orgánicoproducido a mayor escala industrialmente.[4]
Los compuestosaromáticossuelen dibujarse como alquenos cíclicos, sin embargo, su estructura y propiedades son lo suficientemente distintas como para no clasificarlos como alquenos u olefinas.[2] Los hidrocarburos con dos dobles enlaces superpuestos (C=C=C) se denominanalenos-el compuesto más simple de este tipo se denomina a su vezaleno-y los que tienen tres o más enlaces superpuestos (C=C=C=C,C=C=C=C=C,etc.) se denominancumulenos.Ya que los alquenos son un sin número de propiedades
Fórmula
[editar]Lafórmulageneral de un alqueno de cadena abierta con un solo doble enlace esCnH2n.Por cada doble enlace adicional habrá dos átomos de hidrógeno menos de los indicados en esta fórmula.
Nombres tradicionales
[editar]Al igual que ocurre con otroscompuestos orgánicos,algunos alquenos se conocen todavía por sus nombres no sistemáticos, en cuyo caso se sustituye la terminación-enosistemática por-ileno,como es el caso deletenoque en ocasiones se llamaetileno,opropenoporpropileno.
Nomenclatura sistemática (IUPAC)
[editar]1. Nombrar al hidrocarburo principal: Se ha de encontrar lacadena carbonadamás larga que contenga el enlace doble, no necesariamente la de mayor tamaño, colocando los localizadores que tengan el menor número en los enlaces dobles, numerando los átomos de carbono en la cadena comenzando en el extremo más cercano al enlace doble. NOTA: Si al enumerar de izquierda a derecha como de derecha a izquierda, los localizadores de las insaturaciones son iguales, se busca que los dobles enlaces tenga menor posición o localizador más bajo.
2. Si la cadena principal tiene sustituyentes iguales en el mismo átomo de carbono separando por comas los números localizadores que se repiten en el átomo, estos se separan por un guion de los prefijos: di, tri, tetra, etc. Respectivamente al número de veces que se repita el sustituyente.
3. Los sustituyentes se escriben de acuerdo con el orden alfabético con su respectivo localizador químico.
4. Si en la cadena principal existen varios sustituyentes ramificados iguales se coloca el número localizador en la cadena principal separando por un guion, y se escribe el prefijo correspondiente al número de veces que se repita con los prefijos: bis, tris, tetraquis, pentaquis, etc. Seguido de un paréntesis dentro del cual se nombra al sustituyente complejo con la terminación -IL.
5. Realizado todo lo anterior con relación a los sustituyentes, se coloca el número de localizador del doble enlace en la cadena principal separada de un guion, seguido del nombre de acuerdo con el número de átomos de carbono reemplazando la terminación -ano por el sufijo -eno.
6. Si se presentan más de un enlace doble, se nombra indicando la posición de cada uno de los dobles enlaces con su respectivo número localizador, se escribe la raíz del nombre del alqueno del cual proviene, seguido de un prefijo de cantidad: di, tri, tetra, etc. y utilizando el sufijo -eno. Ej:-dieno,-trienoy así sucesivamente.
7. De estar el alqueno fuera de la cadena principal, este se nombra como sustituyente con la terminación“-enilo",contando al carbono unido a la cadena principal como el carbono número 1.
| Fórmula | Recomendaciones IUPAC-1979 | Recomendaciones IUPAC-1993[5][6] |
|---|---|---|
| localizador - prefijo de número átomos C (acabado en -eno) | prefijo de número átomos C - localizador -eno | |
| CH3-CH2-CH=CH2 | 1-buteno | but-1-eno |
Isomería estructural
[editar]Los alquenos que tienen cuatro o más átomos decarbonopueden formar diversosisómeros estructurales.La mayoría de los alquenos son también isómeros decicloalcanos.Los isómeros estructurales de alquenos acíclicos con un solo doble enlace son los siguientes:[7]
- C
2H
4:Sóloetileno. - C
3H
6:propilenosolamente - C
4H
8:3 isómeros:1-buteno,2-buteno,eisobutileno. - C
5H
10:5 isómeros:1-penteno,2-penteno, 2-metil-1-buteno, 3-metil-1-buteno,2-metil-2-buteno. - C
6H
12:13 isómeros: 1-hexeno, 2-hexeno, 3-hexeno, 2-metil-1-penteno, 3-metil-1-penteno, 4-metil-1-penteno, 2-metil-2-penteno, 3-metil-2-penteno, 4-metil-2-penteno, 2,3-dimetil-1-buteno, 3,3-dimetil-1-buteno, 2,3-dimetil-2-buteno, 2-etil-1-buteno.
Muchas de estas moléculas presentancis-trans.También puede haber átomos de carbonochiral,especialmente en las moléculas más grandes (deC
5). El número de isómeros potenciales aumenta rápidamente con átomos de carbono adicionales.
Estructura electrónica del enlace doble C=C
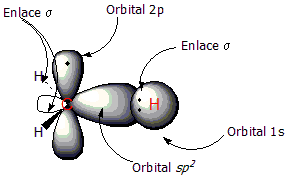
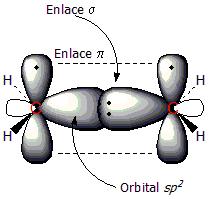
[editar]Utilizaremos eletenocomo ejemplo de compuesto con doble enlace C=C. El doble enlace tiene dos componentes: el enlace tipo σ y el enlace tipo π. Los dosátomosde carbono que comparten el enlace tienen unahibridaciónsp2,hibridación resultante de la mezcla de unorbital2sy dos orbitales2p,lo cual conduce a la formación de tres orbitalessp2degeometría trigonal plana.Al combinarse estos orbitalessp2los electrones compartidos forman un enlace σ, situado entre ambos carbonos.
En la primera figura puede observarse elradicalmetilo, con un orbitalsp2que enlaza a un átomo de hidrógeno al carbono. En la segunda figura se aprecia la formación del enlace π (línea depuntos); que se forma mediante el solapamiento de los dos orbitales2pperpendiculares al plano de la molécula. En este tipo de enlace loselectrones están deslocalizados alrededor de los carbonos, por encima y por debajo del plano molecular.
Estructura y enlace
[editar]Unión
[editar]
Un doble enlace carbono-carbono está formado por unenlace sigmay unenlace pi.Este doble enlace es más fuerte que unenlace covalentesencillo (611kJ/molpara C=C frente a 347 kJ/mol para C-C),[8] pero no el doble de fuerte. Los dobles enlaces son más cortos que los enlaces simples, con unalongitud de enlacemedia de 1,33Å(133pm) frente a 1,53 Å para un enlace simple C-C típico.[9]
Cada átomo de carbono del doble enlace utiliza sus tres sp2orbitales híbridospara formar enlaces sigma con tres átomos (el otro átomo de carbono y dos átomos de hidrógeno). Los orbitales atómicos 2p no hibridados, que se encuentran perpendiculares al plano creado por los ejes de los tres orbitales híbridos sp², se combinan para formar el enlace pi. Este enlace se encuentra fuera del eje principal C-C, con la mitad del enlace en un lado de la molécula y la otra mitad en el otro. Con una fuerza de 65 kcal/mol, el enlace pi es significativamente más débil que el enlace sigma.
La rotación alrededor del doble enlace carbono-carbono está restringida porque romper la alineación de losorbitales psde los dos átomos de carbono supone un coste energético. En consecuencia, los isómeroscisotransse interconvierten tan lentamente que pueden manipularse libremente en condiciones ambientales sin isomerización. Los alquenos más complejos pueden nombrarse con lanotaciónE-Zpara moléculas con tres o cuatrosustituyentes(grupos laterales) diferentes. Por ejemplo, de losisómeros del buteno,los dos grupos metilo del (Z)-but-2-eno(también conocido comocis-2-buteno) aparecen en el mismo lado del doble enlace, y en el (E)-but-2-eno (también conocido comotrans-2-buteno) los grupos metilo aparecen en lados opuestos. Estos dos isómeros del buteno tienen propiedades distintas.
Forma
[editar]Tal y como predice el modeloVSEPRde repulsión de pares deelectrones,lageometría molecularde los alquenos incluyeángulos de enlacealrededor de cada átomo de carbono en un doble enlace de unos 120°. El ángulo puede variar debido a latensión estéricaintroducida porinteracciones no enlazantesentregrupos funcionalessunidos a los átomos de carbono del doble enlace. Por ejemplo, el ángulo de enlace C-C-C en elpropilenoes de 123,9°.
Para los alquenos puenteados, laregla de Bredtestablece que un doble enlace no puede producirse en la cabeza de puente de un sistema de anillos puenteados a menos que los anillos sean lo suficientemente grandes.[10] Siguiendo a Fawcett y definiendoScomo el número total de átomos sin cabeza de puente en los anillos,[11] los sistemas bicíclicos requierenS≥ 7 para la estabilidad[10] y los sistemas tricíclicos requierenS≥ 11.[12]
Energía de enlace
[editar]Energéticamente, el doble enlace se forma mediante la edición de dos tipos de enlace, el σ y el π. La energía de dichos enlaces se obtiene a partir del cálculo del solapamiento de los dos orbitales constituyentes, y en este caso el solapamiento de los orbitalessp2es mucho mayor que los orbitalesp(el primero crea el enlace σ y el segundo el π) y por tanto la componente σ es bastante más energética que la π. La razón de ello es que la densidad de los electrones en el enlace π están más alejados del núcleo del átomo. Sin embargo, a pesar de que el enlace π es más débil que el σ, la combinación de ambos hace que un doble enlace sea más fuerte que un enlace simple.
Síntesis
[editar]Los alquenos se producen porcrackingde hidrocarburos. Las materias primas son principalmente componentes delcondensado de gas natural(principalmente etano y propano) en EE. UU. y Oriente Medio ynaftaen Europa y Asia. Los alcanos se rompen a altas temperaturas, a menudo en presencia de un catalizador dezeolita,para producir una mezcla de alquenos principalmente alifáticos y alcanos de menor peso molecular. La mezcla depende de la materia prima y de la temperatura, y se separa mediante destilación fraccionada. Esto se utiliza principalmente para la fabricación de pequeños alquenos (hasta seis carbonos).[13]

En relación con esto está ladeshidrogenacióncatalítica, en la que un alcano pierde hidrógeno a altas temperaturas para producir un alqueno correspondiente.[8] Es la inversa de lahidrogenación catalíticade alquenos.

.
Este proceso también se conoce comoreformado.Ambos procesos son endotérmicos y son impulsados hacia el alqueno a altas temperaturas por laentropía.
La síntesiscatalíticade α-alquenos superiores (del tipo RCH=CH2) también puede lograrse mediante una reacción del etileno con elcompuesto organometálicotrietilaluminio.trietilaluminioen presencia deníquel,cobaltooplatino.
Los alquenos se pueden sintetizar mediante las siguientes reacciones:
- Por cambio de grupo funcional
- Deshidrohalogenación
- Deshidratación
- La eliminación de agua a partir de alcoholes, por ejemplo:
- CH3CH2OH+H2SO4→ CH3CH2OSO3H + H2O → H2C=CH2+ H2SO4+ H2O
- También por lareacción de Chugaevy lareacción de Grieco.
- Deshalogenación
- BrCH2CH2Br+Zn→ CH2=CH2+ ZnBr2
- Pirólisis(con calor)
- CH3(CH2)4CH3→ CH2=CH2+CH3CH2CH2CH3
- Por formación de enlaces carbono-carbono
- Por reacciones de acoplamiento con metales:
Propiedades físicas
[editar]La presencia del doble enlace modifica ligeramente las propiedades físicas de los alquenos frente a losalcanos.De ellas, la temperatura de ebullición es la que menos se modifica. La presencia del doble enlace se nota más en aspectos como la polaridad y la acidez.
Muchas de las propiedades físicas de los alquenos yalcanosson similares: son incoloros, no polares y combustibles. Elestado físicodepende de lamasa molecular:al igual que los hidrocarburos saturados correspondientes, los alquenos más simples (etileno,propilenoybuteno) son gases a temperatura ambiente. Los alquenos lineales de aproximadamente cinco a dieciséis átomos de carbono son líquidos, y los alquenos superiores son sólidos cerosos. El punto de fusión de los sólidos también aumenta con el incremento de la masa molecular.
Los alquenos suelen tener olores más fuertes que sus correspondientes alcanos. El etileno tiene un olor dulce y rancio. Los alquenos colados, en particular, como el norborneno y eltrans-ciclooctenoson conocidos por tener olores fuertes y desagradables, un hecho coherente con los complejos π más fuertes que forman con iones metálicos, incluido el cobre.[14]
Polaridad
[editar]Dependiendo de la estructura, puede aparecer unmomento dipolardébil. El enlace alquilo-alquenilo está polarizado en la dirección del átomo con orbitalsp2,ya que la componentesde un orbitalsp2es mayor que en unsp3(esto podría interpretarse como laproporción de s a pen la molécula, siendo 1:2 ensp2y 1:3 ensp3,aunque dicha idea es simplemente intuitiva). Esto se debe a que los electrones situados en orbitales híbridos con mayor componentesestán más ligados al núcleo que losp,por tanto el orbitalsp2es ligeramente atrayente de electrones y aparece una polarización neta hacia él. Una vez que tenemos polaridad en el enlace neta, la geometría de la molécula debe permitir que aparezca un momento dipolar neto en la molécula, como se aprecia en la figura inferior.
La primera molécula escisy tenemos un momento dipolar neto, pero la segundatrans,pese a tener dos enlaces ligeramente polarizados el momento dipolar neto es nulo al anularse ambos momentos dipolares.
Acidez
[editar]El carbono alquenílico tiene mayor acidez frente a los alcanos, debido también a la polaridad del enlace. Así, el etano (alcano) tiene un pKade 50 (o unKade 10-50) frente al pKa= 44 deleteno.Este hecho se explica fácilmente considerando que, al desprenderse un protón de la molécula, queda una carga negativa remanente que en el caso del eteno se deslocaliza más fácilmente en el enlace π y σ que en el enlace σ simple que existe en un alcano. De todas formas, su acidez es menor que la de losalcoholeso losácidos carboxílicos.
Reacciones
[editar]Los alquenos son más reactivos que los alcanos. Sus reacciones características son las de adición de otras moléculas, comohaluros de hidrógeno,hidrógeno y halógenos. También sufren reacciones de polimerización, muy importantes industrialmente.
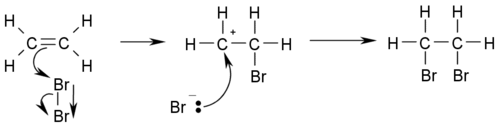
- Hidrohalogenación:se refiere a la reacción conhalurosde hidrógeno formandoalcanoshalogenados del modo CH3-CH2=CH2+HX→ CH3CHXCH3.Por ejemplo, halogenación con elácidoHBr:

Estas reacciones deben seguir laRegla de Markovnikovde enlaces dobles.
- Hidrogenación:se refiere a la hidrogenacióncatalítica(usandoPt,Pd,oNi) formando alcanos del modo CH2=CH2+H2→ CH3CH3.
- Halogenación:se refiere a la reacción con halógenos (representados por la X) del modo CH2=CH2+X2→XCH2CH2X.Por ejemplo, halogenación conbromo:
- Polimerización:Formanpolímerosdel modo n CH2=CH2→ (-CH2-CH2-)npolímero, (polietilenoen este caso).
Véase también
[editar]=
Referencias
[editar]- ↑Unión Internacional de Química Pura y Aplicada.«alkenes».Compendium of Chemical Terminology.Versión en línea(en inglés).
- ↑abUnión Internacional de Química Pura y Aplicada.«olefins».Compendium of Chemical Terminology.Versión en línea(en inglés).
- ↑Moss, G. P.; Smith, P. A. S.; Tavernier, D. (1995). «Glosario de nombres de clases de compuestos orgánicos e intermediarios reactivos basado en la estructura (Recomendaciones de la IUPAC 1995)».Pure and Applied Chemistry67(8-9): 1307-1375.S2CID95004254.
- ↑«Producción: El crecimiento es la norma».Chemical and Engineering News84(28): 59-236. 10 de julio de 2006.
- ↑Apuntes de formulación orgánicaArchivadoel 17 de marzo de 2010 enWayback Machine.. Grupo Lentiscal.
- ↑Introducción a la nomenclatura IUPAC de compuestos orgánicos.Eugenio Alvarado.Universidad de Costa Rica.
- ↑«Número de derivados del etileno con n átomos de carbono» (A000631).
- ↑abError en la cita: Etiqueta
<ref>no válida; no se ha definido el contenido de las referencias llamadasWade - ↑Smith, Michael B.; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th ed.), New York: Wiley-Interscience, p. 23,ISBN 978-0-471-72091-1
- ↑abBansal, Raj K. (1998).«Regla de Bredt».Mecanismos de Reacción Orgánica(3ª edición).McGraw-Hill Education.pp. 14-16.ISBN978-0-07-462083-0.
- ↑Fawcett, Frank S. (1950). «Regla de Bredt de los dobles enlaces en estructuras de anillos con puentes atómicos».Chem. Rev.47(2): 219-274.PMID24538877.doi:10.1021/cr60147a003.
- ↑«Regla de Bredt».Reacciones y reactivos orgánicos completos116.2010. pp. 525-528.ISBN978-0-470-63885-9.doi:10.1002/9780470638859.conrr116.
- ↑Wade, L.G. (2006).Química Orgánica(6ª edición). PearsonPrentice Hall.pp.309.ISBN978-1-4058-5345-3.
- ↑Duan, Xufang; Block, Eric; Li, Zhen; Connelly, Timothy; Zhang, Jian; Huang, Zhimin; Su, Xubo; Pan, Yiet al.(2012- 02-28).«Función crucial del cobre en la detección de odorantes de coordinación metálica».Proceedings of the National Academy of Sciences of the United States of America109(9): 3492-3497.Bibcode:2012PNAS..109.3492D.ISSN0027-8424.PMC3295281.PMID22328155.