Azobenceno
| Azobenzeno | ||
|---|---|---|
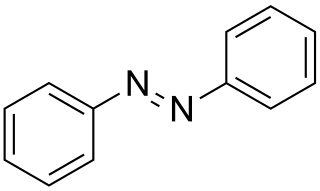 Esqueleto de la fórmula del azobenzeno | ||
 Bolas 3D de Azobenzeno | ||
| Nombre IUPAC | ||
| (E)-Diphenyldiazene | ||
| General | ||
| Otros nombres | Azobenzeno | |
| Fórmula molecular | C1/C12H10N2/c1-3-7-11(8-4-1)13-14-12-9-5-2-6-10-12/h1-10H/b14-13+KDMLAVOWQYNRWNQ-BUHFOSPRBP | |
| Identificadores | ||
| Número CAS | 103-33-3[1] | |
| ChEBI | 190358 | |
| ChemSpider | 21159446 | |
| PubChem | 2272 | |
| Propiedades físicas | ||
| Masa molar | 182,08439832g/mol | |
Elazobencenoes un compuesto químico compuesto de dos anillosfenilounidos por undoble enlaceN=N. Es el ejemplo más simple de unazoderivado.El término "azobenceno" o simplemente "azo" se usa a menudo para referirse a una amplia clase de moléculas que comparten la estructura de núcleo de azobenceno, con diferentes grupos funcionales químicos que se extienden desde los anillos de fenilo. Estos compuestos azoicos se consideran derivados deldiazeno(diimida), y a veces se denominan diazenos. Los diazenos absorben la luz fuertemente y se utilizan como tintes en una variedad de industrias.[2]
Historia
[editar]El azobenceno fue descrito por vez primera porEilhard Mitscherlichen 1834.[3][4] El azobenceno fue investigado en 1856 porAlfred Nobelcomo «gelblich-rote krystallinische Blättchen» ('cuchillas cristalinas amarillentas' en alemán).[5] La preparación original es similar a la moderna. Siguiendo el método de 1858, elnitrobenzenoes reducido por limalha de hierro en presencia delácido acético[6] En la síntesis moderna, elzinces el reductor en la presencia de una base, como descrito por Bigelow y Robinson, en modificación del método original de Alexejew.[7]
Ha sido preparado de muchas maneras diferentes, de las cuales son representativas las siguientes: puede ser obtenido por reducción de nitrobenzeno amalgama de sodio, con sulfatos alcalinos, con celulosa, molasses o dextrosa en solución alcalina, y por reducción catalítica.[7]
El azobenzeno también puede ser obtenido de la reducción de anilinadiazotadacon sales de cobre (I) (sales cuprosas).[7]
La anilina ha sido oxidada, resultando en azobenzeno, por aire y porpermanganato de potasio.[7]
La condensación de nitrobenzeno y acetato de anilina también rinde como producto azobenzeno.[7]
Isomerización trans-cis
[editar]
Una de las propiedades más intrigantes del azobenzeno (y sus derivados) es la fotoisomerización de losisomeriostransy cis. Los dos isomeros pueden pasar de uno para otro con particulareslongitudes de ondade luz:luz ultravioleta,las cuales corresponden a la energía del laguna de la transición π-π* (estado S2), para conversión trans-la-cis, y luz azul, la cual es equivalente a la transición n-π* (estado S1), para somerización cis-la-trans. Por una variedad de razones, el isómerocises menos estable que el trans (por ejemplo, tiene una configuración distorsionada y es menos acomodado - más "tenso" - del que la configuración trans). Entonces, el cis-azobenzeno irá a relajar térmicamente nuevamente al trans veía isomerizado cis-la-trans. El isómeto trans es más estable en aproximadamente 50 kJ/mol, y la barrera a la foto-isomerización es aproximadamente 200 kJ/mol.[8][9]
Clasificación espectroscópica
[editar]Laslongitudes de ondaen las cuales la isomerización del azobenzeno ocurre depende de la estructura particular de cada molécula de compuesto azo, que están típicamente agrupadas en tres clases: las moléculas del tipo azobenzeno, losaminoazobenzenos,y los pseudo-estilbenos.Estos compuestos azos son amarillos, anaranjados y rojos, respectivamente, debido a sutiles diferencias en sus espectros de absorción electrónica. Los compuestos similares a los compuestos de azobenzeno no sustituidos exhiben una baja densidad de absorción n-π* en la región del visible, y una densidad de absorción π-π* mucho más alta en la región deultravioleta.Los compuestos azo que sonorto-opara-sustituidoscon grupos donantes de electrones (tales como losaminos), son clasificados como aminoazobenzenos, y tienden a presentar un pequeño espaciado en las bandas n-π* y π-π* en el visible. La clase pseudo-estilbeno está caracterizada por la sustitución de las posiciones 4 y 4' de los dos anillos azo con donantes de electrones y electrones que retiran de los grupos (es decir, las dos extremidades opuestas del sistemaaromáticoson funcionalizadas). La adición de esta configuración "push-pull"resulta en una distribuciónelectrónicafuertemente asimétrica, la cual modifica una serie de propiedades ópticas. En particular, ella desplaza elespectro de absorciónde los isómerostransycis,de modo que ellos se solapan de forma eficaz. Así, para estos compuestos una únicalongitud de ondade luz en la región visible inducirá isomerización tanto para elciscomo eltrans.Bajo iluminación, estas moléculas quedan en ciclo entre los dos estados isoméricos.[9]
Fotofísica de la isomerización
[editar]La fotoisomerización del azobenzeno es extremadamente rápida, ocurriendo en la escala depicosegundos.La tasa del relajamiento de retorno térmico varía enormemente dependiendo del compuesto: usualmente horas para las moléculas del tipo del azobenzeno, minutos paraaminoazobenzenos,y segundos para los pseudo-estilbenos.[9]
El mecanismo de isomerización ha sido objeto de algún debate, con dos caminos identificados como viables: unarotaciónsobre la conexión N-N, con ruptura de la conexión doble, o veía unainversión,con un estado de transición híbrido y semilineal. Ha sido sugerido que la conversión de trans-para-cis ocurre vía rotación en el estado S2, mientras la inversión ocurre en la conversión cis-para-trans. Está aún en discusión cual estado excitado desempeña un papel directo en la serie del comportamiento de fotoisomerização. Sin embargo, las más recientes investigaciones enespectroscopia de transición de femtosegundohan sugeridos que el estado S2 sufre conversión interna al estado S1, y entonces ocurre la isomerización trans-para-cis. Recientemente, un otro camino de isomerización fue propuesto por Diau, la vía de la "inversión concertada" en que ambos ángulos de conexión CNN se curvan a la vez.[10]
Movimientos fotoinducidos
[editar]La fotoisomerización del azobenzeno es una forma de movimiento molecular fotoinducido.[11] Esta isomerización puede también conducir a movimiento en mayores escalas de longitud. Por ejemplo, la luzpolarizadahará que las moléculas se izomericen y relajen en posiciones aleatorias. Sin embargo, aquellas moléculas (trans) relajadas que se sitúan perpendicularmente a la polarización de la luz incidente, dejarán de ser capaces de absorber, y permanecerán inmutables. Así, existe un enriquecimiento en la estadística de loscromóforosperpendiculares a la luz polarizada (revelación de agujereo orientacional). La irradiación polarizada creará material azoanisotrópicoy, por lo tanto, ópticamentebirrefringenteydicróico.Esta foto-orientación puede también ser utilizada para orientar otros materiales (especialmente en los sistemas de cristal líquido). Por ejemplo, ha sido utilizada para orientar selectivamente dominios decristal líquido,y para crear materiales deópticas no lineales(NLO, del inglésnonlinear optical). La isomerización azo también puede ser usada para foto-alternar la fase de cristal líquido de un material de colestérico anemáticoo para cambiar elcampode una fasecolestérica.
En 1995, fue relatado que exponiéndose una película fina de azo-polímero a un gradiente de intensidad (o polarización) de luz conduce a patrones espontáneos de superficie. En esencia, el material polímero se revelará reversiblemente de cara a minimizar la cantidad de material expuesto a la luz. Este fenómeno no es laablación láser,dado que fácilmente ocurre dada la baja potencia y la transformación es reversible. El mecanismo de estaholografíade superficie parece estar asociado a un nuevo efecto fotomecánico, envolviendo la isomerización del azobenzeno.[12]
La expansión y contracción en mayores escalas de materiales azobenzénicos también fue observada. En un informe, una película fina fue hecha para doblarse y afrouxar-exponiéndose lo a la luz polarizada. La dirección del movimiento en el macroscópico podría ser controlado por la dirección de la polarización. La flexión ocurre porque la superficie libre del material se contrae más que el interior de la película más fina (debido a la absorción de luz láser que pasa a través de la película).[12]
Otros aspectos
[editar]Las moléculas de azobenzeno pueden incorporarse en matrices depolímeroscomo estabilizadores. Es también interesante notarse que la estructura, rígida como una barra de moléculas azo, les permite comportarse comomesogendecristal líquidoen muchos materiales.[13]
La modificación de la geometría en mayor escala asociada con la fotoisomerización del azobenzeno. También ha sido utilizada para controlar la actividad de proteínas con la luz. Al azobenzeno ha sido atribuida la aglutinantes (drogas) para fotomodular su afinidad a las proteínas. El azobenzeno ha sido empleado como un tirante fotointercambiable entre un aglutinante y la proteína: una extremidad del azobenzeno es sustituida por un grupo reactivo que se conecta a la proteína blanca. La otra extremidad presenta un aglutinante para la proteína. Dependiendo del local donde el azobenzeno esté acoplado, mientras elisómerotransocispresente el aglutinamiento para el local de conexión, el otro isómero impide que el fármaco se aproxime del local. Una vez más, el fotointercambio entre isómeros transforma la proteína conectándose y desconectándose. Cuando aplicado a canales iónicos en el sistema nervioso, este abordaje proporciona control óptico de la actividad eléctrica en las neuronas.[14]
Referencias
[editar]- ↑Número CAS
- ↑Unión Internacional de Química Pura y Aplicada(2009). «azo compounds».Compendium of Chemical Terminology.Versión en línea(en inglés).
- ↑Mitscherlich, E. (1834), "Ueber das Stickstoffbenzid".Ann. Pharm.,12: 311–314.doi10.1002/jlac.18340120282
- ↑ "Control over molecular motion using the cis–trans photoisomerization of the azo group" Estíbaliz Merino and María Ribagorda BeilsteinJ. Org. Chem.2012, 8, 1071–1090.doi10.3762/bjoc.8.119
- ↑Noble, Alfred (1856). «III. Zur Geschichte des Azobenzols und des Benzidins».Annalen der Chemie und Pharmacie98(2): 253-256.doi:10.1002/jlac.18560980211.
- ↑Bigelow, H. E. (1955). "Azobenzene".Org. Synth.22:28;Coll. Vol.3:103.
- ↑abcde«Azobenzene».chemeurope(en inglés).Consultado el 17 de marzo de 2017.
- ↑Fernández, Germán.«Isómeros geométricos o cis - trans».quimicaorganica.org.Consultado el 17 de marzo de 2017.
- ↑abcShahinpoor, Mohsen; Schneider, Hans-Jörg (1 de enero de 2008).Intelligent Materials(en inglés).Royal Society of Chemistry.ISBN9780854043354.Consultado el 17 de marzo de 2017.
- ↑Wei-Guang Diau, Eric (1 de febrero de 2004).«A New Trans-to-Cis Photoisomerization Mechanism of Azobenzene on the S1(n,π*) Surface».The Journal of Physical Chemistry A108(6): 950-956.ISSN1089-5639.doi:10.1021/jp031149a.Consultado el 17 de marzo de 2017.
- ↑Yu, Yanlei; Nakano, Makoto; Ikeda, Tomiki (11 de septiembre de 2003).«Photomechanics: Directed bending of a polymer film by light».Nature(en inglés)425(6954): 145-145.ISSN0028-0836.doi:10.1038/425145a.Consultado el 17 de marzo de 2017.
- ↑abYager, Kevin G.; Barrett, Christopher J. (1 de diciembre de 2006).«Photomechanical Surface Patterning in Azo-Polymer Materials».Macromolecules39(26): 9320-9326.ISSN0024-9297.doi:10.1021/ma061733s.Consultado el 17 de marzo de 2017.
- ↑Banghart, Matthew R.; Volgraf, Matthew; Trauner, Dirk (1 de diciembre de 2006).«Engineering Light-Gated Ion Channels».Biochemistry45(51): 15129-15141.ISSN0006-2960.doi:10.1021/bi0618058.Consultado el 17 de marzo de 2017.
- ↑Gorostiza, Pau; Isacoff, Ehud Y. (17 de octubre de 2008).«Optical Switches for Remote and Noninvasive Control of Cell Signaling».Science(en inglés)322(5900): 395-399.ISSN0036-8075.PMID18927384.doi:10.1126/science.1166022.Consultado el 17 de marzo de 2017.
Lectura adicional
[editar]- H. Rau, inPhotochemistry and Photophysics;Vol. 2, editado por J. Rebek (CRC Press, Boca Raton, FL, 1990), p. 119-141.
- A. Natansohn y P. Rochon,Chem.Rev. 102, 4139-4176 (2002).
- Y. Yu, M. Nakano y T. Ikeda, Nature (Londres, U. K.) 425, 145 (2003).
