Grupo carbonilo

Enquímica orgánica,ungrupo carbonilo,carbono acílicoogrupo funcional carbonílicoes ungrupo funcionalque consiste en unátomodecarbonocon undoble enlacea un átomo de oxígeno.La palabra carbonilo puede referirse también almonóxido de carbonocomo ligando en uncomplejoinorgánico uorganometálico(e.g.níquel carbonilo); en este caso, el carbono tiene un dobleenlace con el oxígeno.
Origen del término
[editar]Elácido carbónicoes unácidooxácidoproveniente delóxido de carbono (IV)(CO2), el cual existe en equilibrio con este último, por ejemplo, en elagua gasificadao lasangre.No es posible obtener ácido carbónico puro ya que la presencia de una solamoléculade agua catalizaría su descomposición inmediata en óxido de carbono (IV) y agua. Elácido pirocarbónicoes el dímero del ácido carbónico.

Los sustituyentes generados a partir del ácido carbónico se pueden nombrar de acuerdo a lo que se muestra en la siguiente tabla:

En el último renglón se puede observar que el sustituyente carbonilo se genera por el reemplazo de ambos hidroxilos por valencias disponibles. He ahí la terminación "-ilo"respectiva a todos los sustituyentes con valencias disponibles en el carbono.
Conceptualmente, el ácido carbónico puede tener varios compuestos derivados por sustitución de los grupos - OH con grupos carbonados o hidrógeno. Un reemplazo con hidrógeno genera elácido fórmico;un segundo reemplazo genera elformaldehído.Un reemplazo de un hidrógeno por un grupo alquilo genera al grupoaldehído.
Un reemplazo de los - OH con grupos alquilo genera a losácidos carboxílicos.Un segundo reemplazo por un grupo alquilo genera el grupocetona.

Tipos de grupos funcionales carbonílicos
[editar]Utilizando al ácido carbónico como referencia, así como sus números de oxidación e hidridaciones, podremos identificar los siguientes grupos funcionales carbonílicos:
- Óxidos de carbono
- Derivados carbónicos
- Derivados carboxílicos
- Derivados formílicos y alquilcarbonilos
- Cetonas
Óxidos de carbono
[editar]El carbonilo más simple es elmonóxido de carbono.Este compuesto presenta la energía de disociación de enlace más alta de todas las moléculas neutras, 11.65 eV. El carbono y el oxígeno juntos tienen un total de 10 electrones en la capa de valencia. Siguiendo la regla del octeto tanto para el carbono como para el oxígeno, los dos átomos forman un enlace triple, con seis electrones compartidos en tres orbitales moleculares de enlace, en lugar del enlace doble habitual que se encuentra en los compuestos carbonílicos orgánicos. Dado que cuatro de los electrones compartidos provienen del átomo de oxígeno y solo dos del carbono, un orbital de enlace está ocupado por dos electrones del oxígeno, formando un enlace dativo. Esto causa una polarización C ← O de la molécula, con una pequeña carga negativa en el carbono y una pequeña carga positiva en el oxígeno. Los otros dos orbitales de enlace están cada uno ocupados por un electrón del carbono y uno del oxígeno, formando enlaces covalentes (polares) con una polarización de C → O inversa, ya que el oxígeno es más electronegativo que el carbono. En el monóxido de carbono libre, una carga negativa neta δ–permanece en el extremo del carbono y la molécula tiene un momento dipolar pequeño de 0.122 D.[1] Por lo tanto, la molécula es asimétrica: el oxígeno tiene más densidad de electrones que el carbono y también tiene una carga ligeramente positiva en comparación con el carbono, que es negativo. Por el contrario, la molécula de dinitrógeno isoelectrónica no tiene momento dipolar. En consecuencia, presenta un comportamiento más desviado al ideal, y tiene valores de solubilidad mucho mayores que el dinitrógeno (solubilidad en agua de 27.6 mg / L25 °C); es soluble en cloroformo, ácido acético, acetato de etilo, etanol, hidróxido de amonio y benceno; su constante de Henry es de 1.04 atm · m3/mol.
Elmesómeromás importante del monóxido de carbono es C–≡O+.El mesómero menos representativo es la estructura carbénica sin octetos:C=O. El monóxido de carbono tiene un orden de enlace fraccional computado de 2.6, lo que indica que el "tercer" enlace es importante pero constituye algo menos que un enlace completo.[2] Así, en términos de lateoría de enlace de valencia,el mesómero–C≡O+es la estructura más probable y de mayor carácter, mientras que: C = O no cumple la regla del octeto, pero tiene una carga formal neutral en cada átomo y representa el segundo contribuyente de resonancia más importante. Debido al par solitario y la divalencia del carbono en esta estructura de resonancia, a menudo se considera que el monóxido de carbono es un carbeno extraordinariamente estabilizado..[3] Si el monóxido de carbono actúa como un ligando, la polaridad del dipolo puede revertirse con una carga neta negativa en el extremo de oxígeno, dependiendo de la estructura delcomplejo de coordinación.[4]

La longitud del enlace entre el átomo de carbono y el átomo de oxígeno es 112.8 pm.[5] Esta longitud de enlace es consistente con un enlace triple, como en el nitrógeno molecular (N2), que tiene una longitud de enlace similar (109.76 pm) y casi la misma masa molecular. Los dobles enlaces carbono-oxígeno son significativamente más largos, por ejemplo, 120.8 pm en formaldehído. El punto de ebullición (82 K) y el punto de fusión (68 K) son muy similares a los de N22 (77 K y 63 K, respectivamente). La energía de disociación de enlace de 1072 kJ / mol es más fuerte que la de N22 (942 kJ / mol) y representa el enlace químico más fuerte conocido.[6]

El estado electrónico básico del monóxido de carbono es un estado singlete,[7] ya que no hay electrones no apareados.
Otra familia de oxocarbonos son los monóxidos de carbono lineales CnO. El primer miembro, el ordinario monóxido de carbono CO, parece ser el único que es estable en estado puro a temperatura ambiente. La fotólisis de los dióxidos de carbono lineales en una matriz criogénica lleva a una pérdida de CO, resultando en cantidades detectables de monóxidos pares tales como C2O, C4O,[8] y C6O. Los miembros superiores an=9 han sido obtenidos también mediante una descarga eléctrica en C3O2gaseoso diluido en argón.[9] Los primeros tres miembros han sido detectados en el espacio interestelar.[9]
Una familia de óxidos de carbono tiene la fórmula general CnO2,o O=(C=)nO, una cadena lineal de átomos de carbono limitada por átomos de oxígeno en ambos extremos. Los primeros miembros son:
- CO2o O=C=O, el conocido dióxido de carbono.
- C2O2o O=C=C=O, la extremadamente inestable etenodiona.[10]
- C3O2o O=C=C=C=O, el metaestable subóxido de carbono o dióxido de tricarbono.
- C4O2o O=C=C=C=C=O, eldióxido de tetracarbonoo 1,2,3-butatrieno-1,4-diona[11]
- C5O2o O=C=C=C=C=C=O, eldióxido de pentacarbono,[12] estable en disolución a temperatura ambiente y puro hasta −90 °C.
Derivados del ácido carbónico
[editar]Al sustraer un protón ácido del ácido carbónico se forma el anióncarbonato ácidoobicarbonato.Si el bicarbonato tiene como contraión a un catión metálico o amónico, se forma un bicarbonato del catión. Estos compuestos son considerados inorgánicos, a menos que el contraión catiónico sea orgánico. Al sustituir un hidrógeno ácido por un sustituyente orgánico tipo alquilo, vinilo, acetilénico o arilo, se forma elmonoéster carbónicoobicarbonato de alquilo. Al sustraer dos protones ácidos del ácido carbónico se forma el anióncarbonato.Si el carbonato tiene como contraión a un catión metálico o amónico, se forma un carbonato del catión. Al sustituir dos hidrógenos ácidos por un sustituyente orgánico cualquiera tipo alquilo, vinilo, acetilénico o arilo en cada oxígeno, entonces se forma unéster carbónicoocarbonato de alquilo.Dado que el ácido carbónico es un diácido, puede haber derivados de mono o di disustitución simétricos o asimétricos. A las sales dibásicas y los diésteres del ácido carbónico se les denominacarbonatos. El ácido pirocarbónico presenta las mismas reglas.
El ácido carbónico puede tener varios derivados que se forman por reemplazo de un sustituyente hidroxilo (-OH) por un halógeno:
- Los ácidos monosustituídos son losácidos halocarbónicos(Oácidos halofórmicos,oácidos carbonohalídicos).
- Sus ésteres son loshalocarbonatos de alquilo.
- Los productos de doble sustitución se nombran comohalogenuros de carbonilo.
El ácido carbónico puede tener varios derivados que se forman por reemplazo de un sustituyente hidroxilo (-OH) por un grupo amino ( -NH2):
- El ácido monosustituido se denominaácido carbámico.
- Sus ésteres son loscarbamatos de alquilo.
- El producto de doble sustitución se nombra sistemáticamente comocarbamida,pero es más extendido su nombre común:urea.Los derivados de sustitución en el nitrógeno son denominadosureidos.
- El producto de sustitución en un ácido halocarbónico se nombra sistemática comohalogenuro de carbamilo.
Un grupo carbonilo caracteriza los tipos siguientes de compuestos (-CO quiere decir un grupo carbonilo):
| Compuesto | Estructura | Fórmula |
|---|---|---|
| Ácido carbónico | 
|
H2CO3 |
| Éster carbónico | 
|
RO(CO)OR'
|
| Ácido halocarbónico | 
|
XCOOH |
| Éster halocarbónico | 
|
XCOOR |
| Ácido carbámico | 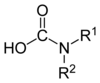
|
NRR'COOH
|
| Éster carbámico | 
|
NRR'COOR "
|
| Carbamida | 
|
NRR'(CO)NR "R" '
|
| Cloruro de carbamilo | 
|
XCONRR' |
Derivados carboxílicos
[editar]Las sustitución de un hidroxilo por un hidrógeno general un ácido muy peculiar, elácido fórmico,el cual, aunque en los sistemas de nomenclatura se le incluye como un ácido carboxílico, tiene cierto carácter de aldehído debido al hidrógeno. Por lo tanto, puede considerarse conceptualmente como un grupo funcional diferenciado de los ácidos carboxílicos típicos. Sus ésteres se denominan "ésteres fórmicos" o "formatos de alquilo" Las sustitución conceptual de un hidroxilo del ácido carbónico por un sustituyente de carbono, genera alácido carboxílicopropiamente dicho. Sus ésteres se denominan "ésteres carboxílicos" o "carboxilatos de alquilo". A este grupo funcional en particular se le llama en química orgánicaésterporantonomasia.
| Compuesto | Estructura | Fórmula |
|---|---|---|
| Ácido fórmico | 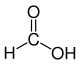
|
HCOOH |
| Éster fórmico | 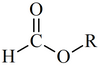
|
HCOOR |
| Ácido carboxílico | RCOOH | |
| Éster carboxílico | RCOOR' | |
| Anhídrido carboxílico | 
|
(RCO)2O
|
| Ácido peroxifórmico | 
|
HCOO2H |
| Ácido peroxicarboxílico | 
|
RCOO2H |
Existen ácidos carboxílicos con denominaciones especiales debido a que tienen variantes en reactividad química con respecto a sus análogos alifáticos:
| Compuesto | Estructura | Fórmula | Comentarios |
|---|---|---|---|
| Ácido acético | 
|
H3CCOOH | Único caso en el que un ácido carboxílico va unido a un carbono primario. |
| Ácido trifluoroacético | 
|
F3CCOOH | Único caso en el que un ácido carboxílico va unido a un carbono trifluorado. |
| Ácido piválico | 
|
(CH3)3COOH | Caso representativo y el más sencillo de un ácido carboxílico unido a un carbono cauternario. |
| Ácido oxálico | 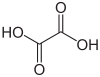
|
(COOH)2 | Único caso en el que un ácido carboxílico se encuentra conectado vecinalmente a otro carboxilo. Se oxida más favorablemente que cualquier otro ácido carboxílico. Es referencia para nombrar y denominar a los sistemas dicarbonílicos vecinales. |
| Ácido malónico | CH2(COOH)2 | Ácido dicarboxílico que es referencia para nombrar y denominar a los sistemas β--dicarbonílicos. Son muy peculiares porque sus monoésteres presentan un mecanismo dedescarboxilaciónmuy característico y representativo de modo genérico para β-cetoácidos y ácidos α-formilcarboxílicos. Sus diésteres tienen un comportamiento ácido base representativo también para β-cetoaldehídos y 1,3-dicetonas (v.Síntesis malónicayCondensación de Knoevenagel). | |
| Ácido acrílico | 
|
H2C=CHCOOH | Caso representativo y el más sencillo de los ácidos carboxílicos α,β-insaturados. |
| Ácido propargílico | HCCCOOH | Caso representativo y el más sencillo de los ácidos acetilencarboxílicos. | |
| Ácido benzoico | 
|
PhCOOH | Caso representativo y el más sencillo de los ácidos arilcarboxílicos. |
Aldehídos y cetonas
[editar]| Compuesto | Estructura | Fórmula |
|---|---|---|
| Formaldehído | 
|
CH2O |
| Aldehído | 
|
RCHO |
| Cetona | 
|
RCOR' |
| Cetena | 
|
RR'C=CO |
Existen denominaciones especiales en los siguientes aldehídos debido a sus variantes en su reactividad química con respecto a sus homólogos alifáticos:
| Compuesto | Estructura | Fórmula | Comentarios |
|---|---|---|---|
| Acetaldehído | 
|
H3CCHO | Único caso en el que el R de un aldehído va unido a un carbono primario. |
| Trifluoroacetaldehído | 
|
F3CCHO | Único caso en el que un aldehído va unido a un carbono trifluorado. |
| Pivalaldehído | 
|
(CH3)3CCHO | Caso representativo y el más sencillo de un aldehído unido a un carbono cuaternario. |
| Glioxal | 
|
(CHO)2 | Único caso en el que un aldehído se encuentra conectado vecinalmente a otro formilo. Se oxida más favorablemente que cualquier otro aldehído. Cuando el aldehído está conectado a un carboxilo se denominaácido glioxálico. |
| Acroleína | 
|
H2C=CHCHO | Caso representativo y el más sencillo de los aldehídos α,β-insaturados. |
| Propargilaldehído | 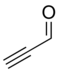
|
HCCCHO | Caso representativo y el más sencillo de los ácidos acetilencarboxílicos. |
| Benzaldehído | 
|
PhCHO | Caso representativo y el más sencillo de los arilcarbaldehídos. |
Existen denominaciones especiales en las siguientes cetonas debido a sus variantes en su reactividad química con respecto a sus homólogos alifáticos:
| Compuesto | Estructura | Fórmula | Comentarios |
|---|---|---|---|
| Metilcetona | 
|
R(CH3)CO | El carbonilo de la cetona va conectado a un carbono primario. Si R = CH3,el caso particular es de la acetona. Todas las metilcetonas dan positiva laprueba del haloformo,a diferencia del resto de las cetonas. |
| Ciclopropanona | 
|
(CH2)2CO | A diferencia del resto de las cetonas endocíclicas, reaccionan como1,3-dipoloen reacciones decicloadición,por ejemplo, con dienos cíclicos como elfurano.Esto se explica porque el anillo de propano se rompe reversiblemente. |
| Pivalona | 
|
[(CH3)3C]2CO | Caso representativo y el más sencillo de una cetona cuyo carbonilo va unido a dos carbonos cuaternarios. El altoimpedimento estéricomodifica considerablemente la velocidad e inclusive la viabilidad de las reacciones con respecto a otras cetonas. |
| 1,2-Dicetonaodiacilo | 
|
RCO-COR' | Una característica que las distingue es el largo enlace C-C que une los grupos carbonilo (aproximadamente 1,54 Å), en comparación con 1,45 Å para el enlace correspondiente en 1,3-butadieno. El efecto se atribuye a la repulsión entre las cargas positivas parciales de los átomos de carbono carbonilo. Estas cetonas son más susceptibles a la oxidación con agentes que no afectan a otras cetonas, por ejemplo elreactivo de Joneso deBaeyer. |
| Aciloínaoα-hidroxicetona | 
|
RCH(OH)-COR' | Cetonas con un alcohol como vecino. Presentan reactividad característica como latransposición de Lobry de Bruyn–van Ekensteiny lacondensación aciloínicareversa. Son tautoméricas a lasreductonas. |
| Ácido pirúvico | 
|
CH3COCOOH | Caso representativo de una alquil carboxil cetona, denominado por la IUPAC comoácido alfa-ceto.Estas cetonas son más susceptibles a la descarboxilación oxidativa con agentes que no afectan a otras cetonas, por ejemplo elreactivo de Joneso deBaeyer.Son más ácidas que los ácidos carboxílicos convencionales. |
| Ácido mesoxálico | 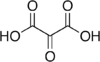
|
(COOH)2CO | Único caso en donde el carbonilo de cetona va conectado a dos carboxilos. Estas cetonas son más susceptibles a la descarboxilación oxidativa con agentes que no afectan a otras cetonas, por ejemplo elreactivo de Joneso deBaeyer. |
| Enona | 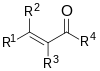
|
H2C=CHCHO | Cetonas α,β-insaturadas que se encuentran en resonancia α,β-C=O y favorecen laadición de Michael. |
| Quinona | Sistemas cetónicos especiales intercambiables con ciertos fenoles por redox. | ||
| Fenona | 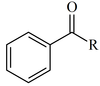
|
PhCOR | Cetonas en las que al menos un sustituyente es un grupo arilo. Cuando R = Ar, se denominan de manera genéricabenzofenonas |
Reactividad
[editar]Los grupos carbonilos pueden ser reducidos por los reactivos hidruros como NaBH4y LiAlH4,y por los reactivosorganometálicoscomo los reactivosorganolitiosy losreactivos de Grignard.
Otras reacciones importantes de este grupo incluyen:
- Reducción de Wolff-Kishner
- Reducción de Clemmensen
- Conversión entioacetales
- Hidratacióna loshemiacetalesy a loshemicetales,y luego a losacetalesy a loscetales
- Reacción con elamoníacoy con lasaminasprimarias, produciendoiminas
- Reacción con loshidroxilaminas,produciendooximas
- Reacción con el anióncianuro,produciendocianhidrinas
- Oxidación con lasoxaziridinas,producienoα-hidroxicetonas(o α-hidroxialdehídos).
- Reacción con elreactivo de Tebbeo con unreactivo de Wittig,produciendoalquenos.
- Reacción de Perkin
- Reacción de Tischenko
- Lacondensación aldólica,produciendo compuestos β-hidroxicarbonilos y luego compuestos carbonilos α,β-insaturados.
- LaReacción de Cannizzaro,produciendo alcoholes y ácidos carboxílicos
Compuestos carbonilos α,β-Insaturados
[editar]Los compuestos carbonilos α,β-insaturados son una clase importante de los compuestos carbonilos que poseen la estructura general Cβ=Cα−C=O. En estos compuestos el grupo carbonilo estáconjugadocon unalqueno,y de esto provienen algunas propiedades especiales. Algunos ejemplos de los compuestos carbonilos α,β-insaturados son laacroleína,elóxido de mesitilo,elácido acrílico,y elácido maleico.Los compuestos carbonilos insaturados pueden prepararse en el laboratorio también por lareacción aldólicao por lareacción de Perkin.
El grupo carbonilo, seaaldehídooácido,atrae hacia sí los electrones del alqueno, y entonces el grupo alqueno en un compuesto carbonílico insaturado está desactivado hacia electrófilos como elbromoo elcloruro de hidrógeno.Como regla general, con los electrófilos asimétricos, el hídrogeno se agrega a la posición α en unaadición electrofílica. Por otra parte, estos compuestos son activados hacia losnucleófilosen laadición nucleofílica.
Espectroscopía
[editar]- Espectroscopía infrarroja:eldoble enlaceC=Oabsorbe la luzinfrarrojade laslongitudes de ondaaproximadamente entre 1680–1750 cm−1.Esta zona de absorción se llama el "estiramiento carbonilo" cuando se ve en un espectro de absorción infrarrojo.
- Resonancia magnética nuclear:el doble enlaceC=Omuestra resonancias diferentes, dependiendo de los átomos vecinos.
- Espectroscopía de masas.
Otros compuestos carbonilos orgánicos
[editar]Compuestos carbonilos inorgánicos
[editar]Véase también
[editar]Referencias
[editar]- ↑Scuseria, Gustavo E.; Miller, Michael D.; Jensen, Frank; Geertsen, Jan (1991). «The dipole moment of carbon monoxide».J. Chem. Phys.94(10): 6660.Bibcode:1991JChPh..94.6660S.doi:10.1063/1.460293.
- ↑Martinie, Ryan J.; Bultema, Jarred J.; Vander Wal, Mark N.; Burkhart, Brandon J.; Vander Griend, Douglas A.; DeKock, Roger L. (1 de agosto de 2011). «Bond Order and Chemical Properties of BF, CO, and N2».Journal of Chemical Education88(8): 1094-1097.ISSN0021-9584.doi:10.1021/ed100758t.
- ↑1925-, Ulrich, Henri (2009).Cumulenes in click reactions.Wiley InterScience (Online service). Chichester, U.K.: Wiley. p. 45.ISBN9780470747957.OCLC476311784.
- ↑Lupinetti, Anthony J.; Fau, Stefan; Frenking, Gernot; Strauss, Steven H. (1997). «Theoretical Analysis of the Bonding between CO and Positively Charged Atoms».J. Phys. Chem. A101(49): 9551-9559.Bibcode:1997JPCA..101.9551L.doi:10.1021/jp972657l.
- ↑Gilliam, O. R.; Johnson, C. M.; Gordy, W. (1950). «Microwave Spectroscopy in the Region from Two to Three Millimeters».Physical Review78(2): 140-144.Bibcode:1950PhRv...78..140G.doi:10.1103/PhysRev.78.140.
- ↑Common Bond Energies (D) and Bond Lengths (r).wiredchemist
- ↑Vidal, C. R. (28 de junio de 1997).«Highly Excited Triplet States of Carbon Monoxide».Archivado desdeel originalel 28 de agosto de 2006.Consultado el 16 de agosto de 2012.
- ↑Günter Maier y Hans Peter Reisenauer (2001),Carbenes in Matrices: Specrospcopy, Structure, and Photochemical Behavior.En Udo H. Brinker (ed.),Advances in carbene chemistry,pág. 135. Elsevier, 332 páginas.ISBN 0-444-50892-9,ISBN 978-0-444-50892-8
- ↑abOgata Teruhiko, Tatamitani Yoshio (2008). «The Simplest Linear-Carbon-Chain Growth by Atomic-Carbon Addition and Ring Opening Reactions».J. Phys. Chem. A112(43): 10713-10715.PMID18834097.doi:10.1021/jp806725s.
- ↑ Detlef Schröder; Christoph Heinemann,Helmut Schwarz,Jeremy N. Harvey, Suresh Dua, Stephen J. Blanksby, John H. Bowie (1998). «Ethylenedione: An Intrinsically Short-Lived Molecule».Chemistry - A European Journal4(12): 2550-2557.doi:10.1002/(SICI)1521-3765(19981204)4:12<2550::AID-CHEM2550>3.0.CO;2-E.
- ↑Günther Maier, Hans Peter Reisenauer, Heinz Balli, Willy Brandt, Rudolf Janoschek (1990): "C4O2(1,2,3-Butatriene-1,4-dione), the First Dioxide of Carbon with an Even Number of C Atoms ". Angewandte Chemie (edición internacional en inglés), vol. 29, núm. 8, pp. 905–908.
- ↑ Günther Maier, Hans Peter Reisenauer, Ulrich Schäfer, and Heinz Balli (1988). «C5O2(1,2,3,4-Pentatetraene-1,5-dione), a New Oxide of Carbon».Angewandte Chemie International Edition in English27(4): 566-568.doi:10.1002/anie.198805661.
Bibliografía
[editar]- William Reusch. (2004)Aldehydes and KetonesArchivadoel 30 de abril de 2010 enWayback Machine.Consultado el 23 de mayo de 2005.
- ILPI. (2005)The MSDS Hyperglossary- Anhydride.
