Cloruro de sodio
| Cloruro de sodio | ||
|---|---|---|
 Cristal de cloruro de sodio. | ||
 | ||
| Nombre IUPAC | ||
| Cloruro de sodio. | ||
| General | ||
| Otros nombres |
Cloruro sódico Sal común Sal de cocina Sodio cloruro Nombre mineral:Halita | |
| Fórmula molecular | NaCl | |
| Identificadores | ||
| Número CAS | 7647-14-5[1] | |
| Número RTECS | VZ4725000 | |
| ChEBI | 26710 | |
| ChEMBL | CHEMBL1200574 | |
| ChemSpider | 5044 | |
| DrugBank | DB09153 | |
| PubChem | 5234 | |
| UNII | 451W47IQ8X | |
| KEGG | D02056 C13563, D02056 | |
| Propiedades físicas | ||
| Apariencia | Incoloro; aunque pareceblancosi son cristales finos o pulverizados. | |
| Densidad | 2160kg/m³;2,16g/cm³ | |
| Masa molar | 58,443g/mol | |
| Punto de fusión | 1074 K (801 °C) | |
| Punto de ebullición | 1738 K (1465 °C) | |
| Estructura cristalina | f.c.c. | |
| Índice de refracción(nD) | 1,544202 | |
| Propiedades químicas | ||
| Solubilidadenagua | 359g/Len agua | |
| Producto de solubilidad | 37,79mol² | |
| Termoquímica | ||
| ΔfH0gas | -181,42 kJ/mol | |
| ΔfH0líquido | -385,92 kJ/mol | |
| ΔfH0sólido | -411,12 kJ/mol | |
| S0gas, 1 bar | 229,79 J·mol–1·K | |
| S0líquido, 1 bar | 95,06 J·mol–1·K–1 | |
| S0sólido | 72,11 J·mol–1·K–1 | |
| Peligrosidad | ||
| NFPA 704 |
0
0
0
| |
| Riesgos | ||
| Ingestión | Peligroso en grandes cantidades; su uso a largo plazo en cantidades normales puede traer problemas en losriñones;Su consumo excesivo también está relacionado con lahipertensión arterial. | |
| Inhalación | Puede producir irritación en altas cantidades. | |
| Piel | Puede producir resequedad. | |
| Ojos | Puede producir irritación y molestia. | |
| Compuestos relacionados | ||
| Cloruros alcalinos | Cloruro de potasio,cloruro de litio,cloruro de cesio | |
| Haluros de sodio | Bromuro sódico,fluoruro sódico,ioduro sódico | |
| Valores en elSIy encondiciones estándar (25℃y 1atm), salvo que se indique lo contrario. | ||
Elcloruro de sodio,sal comúnosal de mesa,denominada en su forma mineral comohalita,es uncompuesto químicocon la fórmulaNaCl.El cloruro de sodio es una de lassalesresponsables de lasalinidaddelocéanoy delfluido extracelularde muchos organismos. Es también el componente de lasal común,usada comocondimentoy conservante de alimentos.
Conmasas molaresesde 22,99 y 35,45 g/mol respectivamente, 100 g de NaCl contienen 39,34 g de Na y 60,66 g de Cl. En su forma comestible, la sal (también conocida comosal de mesa) se utiliza habitualmente comocondimentoy curado, y conservante de alimentos. Se utilizan grandes cantidades de cloruro sódico en muchos procesos industriales, y es una fuente importante de compuestos de sodio ycloroutilizados comomaterias primaspara posterioressíntesis químicas.Otra aplicación importante del cloruro sódico es la descongelación de carreteras cuando el clima es bajo cero.
En la antigüedad, el cloruro de sodio era muy apetecido como un bien transable y comocondimento,y se remuneraba en la época preclásica romana a los soldados que construían laVía Salaria,que empezaba en las canteras deOstiahastaRoma,con un generososalarium argentum.
Propiedades químicas
[editar]Es uncompuesto iónicoformado por uncatiónsodio(Na+) y unanión cloruro(Cl-), y puede sufrir las reacciones características de cualquiera de estos dos iones. Como cualquier otro cloruroiónicosoluble,precipitacloruros insolubles cuando es agregado a unadisoluciónde unasalmetálica apropiada, comonitrato de plata:
Otro método para separar ambos componentes es mediante laelectrólisis.
Si se aplica una corriente eléctrica continua con un elevado potencial a unasalmueraalcalina,el productoanódicoes gasdicloro(Cl2) y loscatódicossonhidróxido de sodio(NaOH) ydihidrógeno(H2).
- electrólisis: 2 NaCl(aq) → 2 NaOH(aq) + Cl2(gas) + H2(gas)
Como la mayoría de las sales iónicas confierepropiedades coligativasa sus disoluciones, es decir, es capaz de variar lapresión de vaporde la disolución,elevar el punto de ebulliciónydescender el punto de congelaciónsegún suconcentración molal.
Estructura cristalina
[editar]Cuando el cloruro de sodio está en estado sólido, sus átomos se acomodan en unaestructura cristalina cúbica,como es de esperarse en unaunión iónicaocasionada por los campos electrostáticos de sus átomos. Cadaionse acomoda en el centro de unoctaedroregular quedando rodeado por 6 iones de cargas opuestas distribuidos en los vértices del octaedro.
Esta misma estructura básica se encuentra en muchos otros compuestos y es comúnmente conocida como la estructura cristalina de halita o sal de roca. Se puede representar como una red cúbica centrada en la cara (fcc) con una base de dos átomos o como dos redes cúbicas centradas en la cara interpenetrantes. El primer átomo se encuentra en cada punto de celosía.
Producción
[editar]El cloruro de sodio es producido en masa por laevaporacióndeagua de marosalmuerade otros recursos, comolagos salados,y minando laroca de sal,llamadahalita.
En 2002, la producción mundial de sal se estimó en 210 millones de toneladas métricas, y los principales países productores fueronEstados Unidos(40.3 millones de toneladas),China(32.9),Alemania(17.7),India(14.5) yCanadá(12.3).[2]
Regulación fisiológica
[editar]El ion Na+es causante de la regulación osmótica celular regulando elpotencial de membranaexpulsando el ion K+,facilita en gran manera el impulso nervioso y es aportado al organismo en gran medida como sal de mesa.
Aplicaciones
[editar]El cloruro de sodio es usado universalmente comoaditivo alimentario.También se usa en la producción de papel y celulosa, en los productos de baño y en detergentes. Además de los usos domésticos familiares de la sal, las aplicaciones más dominantes de la producción de aproximadamente 250 millones de toneladas por año (datos de 2008) incluyen productos químicos y descongelación.[3]
Antiséptico local y preservante de alimentos
[editar]La sal, gracias a su elevado poder osmótico, es capaz de deshidratar un amplio espectro de virus y bacterias en estado no esporulado, por lo que se usa como un doloroso antiséptico para desinfectar heridas.
Muy pocos microorganismos, como los halófilos y organismos superiores como loscrustáceobraquiópodos conocidos como lasArtemias,pueden resistirse al poder osmótico de la sal. Entre los microorganismos resistentes a la salinidad está el caso de la bacteriaB. marismortui,encontrada en elmar Muerto.
La salazón de la carne es una forma de preservar ésta de la acción bacteriana, ya que la sal retrasa la descomposiciónproteínica.Para preservar alimentos, el cloruro de sodio extrae el agua de estos, impidiendo el crecimiento de las bacterias.[4][5]
Usos industriales diversos
[editar]El cloruro sódico es muy utilizado, por lo que incluso aplicaciones relativamente menores pueden consumir cantidades masivas. En la exploración depetróleoygas,la sal es un componente importante de los fluidos de perforación en la perforación de pozos. Se utiliza paraflocularizary aumentar ladensidaddel fluido de perforación para superar las altas presiones de gas de fondo de pozo. Cada vez que un taladro golpea una formación salina, se añade sal al fluido de perforación para saturar la solución con el fin de minimizar la disolución dentro del estrato salino.[3] La sal también se utiliza para aumentar el curado del hormigón en las carcasas cementadas.[6]>.
En textiles y tintorería, la sal se utiliza como enjuague de salmuera para separar contaminantes orgánicos, para promover el "salado" de precipitados de colorantes y para mezclar con colorantes concentrados para estandarizarlos[aclaración requerida].Una de sus principales funciones es proporcionar la carga iónica positiva para promover la absorción de los iones de carga negativa de los colorantes.[6]
También se utiliza en el procesamiento dealuminio,berilio,cobre,aceroyvanadio.En la industria del papel y la pasta de papel, la sal se utiliza para blanquear la pasta de madera. También se utiliza para fabricarclorato sódico,que se añade junto conácido sulfúricoy agua para fabricardióxido de cloro,un excelente producto químicoblanqueadora base de oxígeno. El proceso del dióxido de cloro, que se originó en Alemania después de la Primera Guerra Mundial, es cada vez más popular debido a las presiones medioambientales para reducir o eliminar los compuestos blanqueadores clorados. En el curtido y el tratamiento del cuero, la sal se añade a laspielesde los animales para inhibir la actividad microbiana en la parte inferior de las pieles y para atraer la humedad de vuelta a las pieles.[6]
En la fabricación de caucho, la sal se utiliza para fabricarbuna,neoprenoy caucho blanco. La salmuera y el ácido sulfúrico se utilizan para coagular unlátexemulsionado hecho debutadienoclorado.[6][3]
También se añade sal para asegurar el suelo y dar firmeza a los cimientos sobre los que se construyen las autopistas. La sal actúa para minimizar los efectos del desplazamiento causado en el subsuelo por los cambios de humedad y la carga de tráfico.[6]
El cloruro sódico se utiliza a veces comodesecantebarato y seguro debido a sus propiedadeshigroscópicas,lo que hace de lasalazónun método eficaz deconservación de alimentoshistóricamente; la sal extrae el agua de las bacterias mediantepresión osmótica,impidiendo que se reproduzcan, una de las principales fuentes de deterioro de los alimentos. Aunque existen desecantes más eficaces, pocos son seguros para la ingestión humana.
Fundente del hielo
[editar]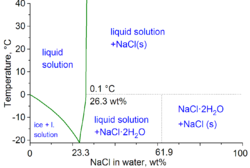
El cloruro de sodio ensalmuera(la mezcla comercial para una solución saturada alcanza los 270 g por litro) es el fundente del hielo y de la nieve más usado envialidad.Al disolverse la sal en el agua, baja elpunto de congelaciónde ésta. En contacto con el agua provoca una reacción endotérmica que precisa de aporte de calor, que toma del ambiente o de la superficie de contacto,entalpía,(ΔH= -385.820 KJ/mol).
La segunda aplicación más importante de la sal es eldeshieloy el antihielo de las carreteras, tanto en depósitos de arena como esparcida por vehículos de servicio invernal. En previsión de las nevadas, las carreteras se "antihielan" de forma óptima con salmuera (solución concentrada de sal en agua), que impide la adherencia entre la nieve y la superficie de la carretera. Este procedimiento evita el uso intensivo de sal tras la nevada. Para el deshielo, se utilizan mezclas de salmuera y sal, a veces con agentes adicionales comocloruro de calcioy/ocloruro de magnesio.El uso de sal o salmuera se vuelve ineficaz por debajo de −10 grados Celsius (14 °F).

La sal para deshielo en el Reino Unido procede predominantemente de una única mina deWinsfordenCheshire.Antes de su distribución, se mezcla con <100 ppm deferrocianuro de sodiocomo agente antiaglomerante, lo que permite que la sal gema fluya libremente fuera de los vehículos de arenado a pesar de haber sido almacenada antes de su uso. En los últimos años, este aditivo también se ha utilizado en la sal de mesa. Se han utilizado otros aditivos en la sal de carretera para reducir los costes totales. En EE. UU., por ejemplo, se mezcló con sal gema una solución de carbohidratos subproducto del procesado de la remolacha azucarera que se adhirió a la superficie de las carreteras un 40% mejor que la sal gema suelta. Al permanecer más tiempo en la carretera, el tratamiento no tenía que repetirse varias veces, lo que ahorraba tiempo y dinero.[6]
En términos técnicos de fisicoquímica, el punto de congelación mínimo de una mezcla de agua y sal es de −21,12 grados Celsius (−6,0 °F) para un 23,31% en peso de sal. Sin embargo, la congelación cerca de esta concentración es tan lenta que elpunto eutécticode −22,4 grados Celsius (−8,3 °F) puede alcanzarse con un 25 % en peso de sal.[7]
Efectos medioambientales
[editar]La sal de carretera acaba en masas de agua dulce y podría perjudicar a las plantas y animales acuáticos al alterar su capacidad deosmorregulación.[8] La omnipresencia de la sal plantea un problema en cualquier aplicación de revestimientos costeros, ya que las sales atrapadas causan grandes problemas de adherencia. Las autoridades navales y los constructores de barcos controlan las concentraciones de sal en las superficies durante la construcción. Las concentraciones máximas de sal en las superficies dependen de la autoridad y de la aplicación. La normativa de laIMOes la más utilizada y fija los niveles de sal en un máximo de 50 mg/m2de sales solubles medidas como cloruro sódico. Estas mediciones se realizan mediante untest de Bresle.La salinización (aumento de la salinidad, también conocido comosíndrome de salinización del agua dulce) y el consiguiente aumento de la lixiviación de metales es un problema constante en toda América del Norte y en las vías fluviales dulces europeas.[9].
En el deshielo de carreteras, la sal se ha asociado a lacorrosiónde los tableros de los puentes, los vehículos de motor, las barras y alambres de refuerzo y las estructuras de acero sin protección utilizadas en la construcción de carreteras. Laescorrentía superficial,la pulverización de vehículos y las acciones del viento también afectan al suelo, a la vegetación de los bordes de las carreteras y a los suministros locales de aguas superficiales y subterráneas. Aunque se han encontrado pruebas de carga ambiental de sal durante los picos de uso, las lluvias y deshielos primaverales suelen diluir las concentraciones de sodio en la zona donde se aplicó la sal.[6] Un estudio de 2009 descubrió que aproximadamente el 70% de la sal de carretera que se aplica en el área metropolitana deMinneapolis-Saint Paulse retiene en la cuenca local.[10]
Plantas
[editar]Elsodioes un nutriente no esencial para las plantas, que lo necesitan en dosis muy bajas. Excepcionalmente, ciertos grupos de plantas, como lasplantas C4,o laCAM,necesitan dosis mayores de esteelemento.
Por otra parte, el exceso de sal en elmedioresulta perjudicial para la mayor parte de las plantas (salinidad del sueloo sustrato), ya que provoca su desecación porósmosis(elaguase desplaza hacia el ámbito más salino). Un síntoma característico son las quemaduras de los bordes de las hojas. Solamente las plantas llamadashalofitashan desarrollado un proceso que evita esa pérdida de agua.
Industria alimentaria y agricultura
[editar]Muchosmicroorganismossno pueden vivir en un medio salado: el agua sale de suscélulasporósmosis.Por esta razón, la sal se utiliza paraconservaralgunos alimentos, como el tocino, el pescado o la col.
La sal se añade a los alimentos, ya sea por el productor o por el consumidor, como potenciador del sabor, conservante, aglutinante, aditivo de control de lafermentación,agente de control de la textura y revelador del color. El consumo de sal en la industria alimentaria se subdivide, en orden descendente de consumo, en otros productos de elaboración de alimentos, envasadores de carne,enlatado,panadería, productos lácteos y molinería de cereales. La sal se añade para favorecer el desarrollo del color en el tocino, el jamón y otros productos cárnicos procesados. Como conservante, la sal inhibe el crecimiento de bacterias. La sal actúa como aglutinante en losembutidospara formar un gel aglutinante compuesto de carne, grasa y humedad. La sal también actúa como potenciador del sabor y comoablandador.[6]
En muchas industrias lácteas, la sal se añade al queso como agente de control del color, la fermentación y la textura. El subsector lácteo incluye empresas que fabrican mantequilla de nata, leche condensada y evaporada, postres congelados, helados, queso natural y procesado, y productos lácteos especiales. En el enlatado, la sal se añade principalmente como potenciador del sabor yconservante.También se utiliza como portador de otros ingredientes, agente deshidratante, inhibidor de enzimas y ablandador. En panadería, la sal se añade para controlar la velocidad de fermentación de la masa de pan. También se utiliza para fortalecer elgluten(el complejo elástico proteína-agua de ciertas masas) y como potenciador del sabor, por ejemplo como cobertura de productos horneados. La categoría de procesado de alimentos también incluye productos de molinería. Estos productos consisten en moler harina y arroz y fabricar cereales para el desayuno y harina mezclada o preparada. La sal también se utiliza como condimento, por ejemplo, en patatas fritas,pretzelsy comida para perros y gatos.[6]
El cloruro sódico se utiliza en medicina veterinaria como agenteemesis-causante. Se administra como solución saturada caliente. La emesis también puede ser causada por lafaringecolocación de pequeñas cantidades de sal común o cristales de sal.
Medicina
[editar]Es el antídoto natural delnitrato de plata,metabolizándolo encloruro de plata,sustancia prácticamente atóxica que el cuerpo puede excretar con seguridad.[11]
Referencias
[editar]- ↑Número CAS
- ↑Susan R. Feldman. Sodium chloride.Kirk-Othmer Encyclopedia of Chemical Technology.John Wiley & Sons, Inc. Published online2005.doi10.1002/0471238961.1915040902051820.a01.pub2
- ↑abcWestphal, Gisbertet al.(2002) "Sodium Chloride" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim.
- ↑Parra, Sergio (6 de agosto de 2015).«El secreto para conservar alimentos durante la historia: sal, acidez y bacterias del propio alimento».Consultado el 13 de agosto de 2017.
- ↑Andresrguez (18 de febrero de 2010).«¿Por qué se emplean las salazones para conservar alimentos?».Ciencias y cosas.Consultado el 13 de agosto de 2017.
- ↑abcdefghiError en la cita: Etiqueta
<ref>no válida; no se ha definido el contenido de las referencias llamadasusgs - ↑Error en la cita: Etiqueta
<ref>no válida; no se ha definido el contenido de las referencias llamadasu1 - ↑Rastogi, Nina (16 de febrero de 2010)¿La sal de carretera perjudica al medio ambiente?slate.
- ↑«Las vías fluviales salinas están creando peligrosos 'cócteles químicos'».phys.org.
- ↑«La mayor parte de la sal de carretera llega a lagos y ríos».sciencedaily.Universidad de Minnesota. 20 de febrero de 2009.Consultado el 27 de septiembre de 2015.
- ↑Calabrese, Alberto I.; Astolfi, Emilio A. (enero de 1969).Toxicología.Buenos Aires, Argentina: Kapelusz. p. 190.OCLC14501248.

