Penicilina
| Penicilina | ||
|---|---|---|
 | ||
 | ||
| Nombre (IUPAC) sistemático | ||
| Ácido 4-tio-1-azabiciclo (3.2.0) heptano-2-carboxílico, 3,3-dimetil-7-oxo-6-((fenilacetil) amino)- (2S-(2alfa, 5alfa, 6beta)) | ||
| Identificadores | ||
| Número CAS | 61-33-6 | |
| Código ATC | J01CE01 | |
| PubChem | 5904 | |
| DrugBank | DB01053 | |
| ChEBI | 18208 | |
| Datos químicos | ||
| Fórmula | C16H18N2O4S | |
| Peso mol. | 334,4 - 356,34g/mol | |
| Datos físicos | ||
| Densidad | 1,41 g/cm³ | |
| P. de ebullición | 97 °C (207 °F) | |
| Solubilidadenagua | 0,285 mg/mL (20 °C) | |
| Farmacocinética | ||
| Biodisponibilidad |
60-75 % (humanos); 30 % (animales) | |
| Unión proteica | 50-80 %, principalmentealbúmina | |
| Metabolismo | hepático | |
| Vida media | 30min-56h | |
| Excreción | renal | |
| Datos clínicos | ||
| Cat. embarazo | Los estudios en animales no han demostrado efectos adversos sobre el feto, pero no hay estudios clínicos adecuados y bien controlados hechos en embarazadas. Puede emplearse con vigilancia médica.(EUA) | |
| Vías de adm. | intravenosa,intramuscular,oral | |
Laspenicilinassonantibióticosdel grupo de losbetalactámicosempleados en el tratamiento deinfeccionesprovocadas porbacteriassensibles. La mayoría de las penicilinas son derivados delácido 6-aminopenicilánico,difiriendo entre sí según la sustitución en lacadena lateralde sugrupo amino.Lapenicilina Go bencilpenicilina fue el primer antibiótico empleado ampliamente enmedicina.Alexander Flemingobtuvo elPremio Nobel en Fisiología o Medicinaen 1945 junto con los científicosErnst Boris ChainyHoward Walter Florey,creadores de un método para producir elfármacoen masa.
No se conoce por completo el mecanismo de acción de las penicilinas, si bien su analogía a la D-alanil-D-alanina terminal, situada en la cadena lateral peptídica de la subunidad delpeptidoglicano,sugiere que su carácterbactericidaderiva de su intervención comoinhibidordel proceso detranspeptidacióndurante la síntesis de aquel. De este modo, la penicilina actúa debilitando la pared bacteriana y favoreciendo lalisis osmóticade la bacteria durante el proceso de multiplicación.[1]
Existe una gran diversidad de penicilinas. Algunas especies dehongosdel géneroPenicilliumsintetizan de forma natural penicilinas, como el primer tipo aislado, la penicilina G. No obstante, debido a la aparición deresistencias,se han desarrollado otras familias siguiendo básicamente dos estrategias: la adición de precursores para la cadena lateral en elmedio de cultivodel hongo productor, lo que se traduce en la producción depenicilinas biosintéticas;y lamodificación químicade la penicilina obtenida por lafermentación biotecnológica,lo que da lugar a laspenicilinas semisintéticas.[2]
Las penicilinas difieren entre sí según su espectro de acción. Por ejemplo, la bencilpenicilina es eficaz contrabacterias Gram positivascomoestreptococosyestafilococos,yGram negativas,comogonococosymeningococos,pero debe administrarse porvía parenteraldebido a su sensibilidad alpHácido delestómago.La fenoximetil penicilina es, en cambio, resistente a este pH y puede administrarse por vía oral. Laampicilina,además de mantener esta resistencia, es eficaz contra otrasbacterias Gram negativascomoHaemophilus,SalmonellayShigella.[1]
Si bien las penicilinas son los antibióticos menos tóxicos, pueden causaralergiasgraves, ocasionalmente. Sin embargo, solo el 1 % de los pacientes que reciben tratamientos con betalactámicos las desarrollan.[3] Puesto que unshock anafilácticopuede conducir a la muerte del paciente, es necesario interrogarlo antes de iniciar el tratamiento.
Además de sus propiedades antibacterianas, la penicilina es un efectivoantídotocontra los efectos del envenenamiento porα-amanitina,uno de losaminoácidostóxicos de loshongosdel géneroAmanita.[4]
Historia de la penicilina
[editar]Aunque generalmente se atribuye aAlexander Flemingel descubrimiento de la penicilina, muchas épocas y culturas diferentes llegaron mediante la observación y la experiencia a conocer y emplear las propiedades bactericidas de los mohos. Se han descubierto precedentes en laGreciaeIndiaantiguas,y en los ejércitos deCeilándel sigloii.Ha estado también presente en las culturas tradicionales de regiones tan distintas y distantes comoSerbia,RusiaoChina,así como en losnativos de Norteamérica.[5][6] Se solía aplicar alimentos florecidos o tierra delsueloque contuvierahongosa lasheridasdeguerra.Desde el sigloviiipor lo menos, los médicosárabescurabaninfeccionesuntando las heridas con una pasta blanca que se formaba en losarnesesdecuerocon que se ensillaban losburrosde carga. A lo largo del sigloxviialgunosfarmacólogosy herboristasingleses,comoJohn Parkington,incluyeron el tratamiento con hongos en los registros defarmacia.[N 1]

A finales del sigloxix,Henle(uno de los grandescientíficosde la llamada «generación intermedia») suscita en su discípuloRobert Koch,en laUniversidad de Gotinga,el interés por los trabajos deAgostino BassiyCasimir Davaine,que le llevaría a investigar a losmicroorganismoscomo agentes causales de lasenfermedades.Esto le conduciría en 1876 a descubrir queBacillus anthracisera el agente causal específico delcarbunco,en la línea de lateoría microbiana de la enfermedad,y a enunciar sus célebrespostulados.[9] Más tarde,Paul Ehrlich,que trabajó con Koch enBerlín,desarrolló el concepto deMagische Kugelobala mágica,denominando así a aquellos componentes químicos que pudieran eliminar selectivamente a los gérmenes. Finalmente, en 1909 consiguió sintetizar un compuesto, el n.º 606, más tarde conocido comosalvarsán,que se mostró eficaz contra lasífilis.[10] Este descubrimiento influyó posteriormente en Alexander Fleming, hasta el punto de que existen caricaturas del joven Fleming caracterizado yapodadocomo «recluta 606».[11]
Al mismo tiempo o poco después, conocido el hecho de que lasbacteriaspodían provocar enfermedades, se sucedieron multitud de observaciones, tantoin vivocomoin vitro,de que losmohosejercían una acción bactericida. Por solo citar algunos nombres, sirvan de ejemplo los trabajos deJohn Scott Burdon-Sanderson,Joseph Lister,William Roberts,John Tyndall,Louis PasteuryJules Francois Joubert,Carl Garré,Vincenzo Tiberio,Ernest Duchesne,Andre GratiaySara Dath.
En marzo de 2000, médicos del HospitalSan Juan de DiosdeSan José(Costa Rica) publicaron los escritos del científico y médico costarricenseClodomiroCloritoPicado Twight(1887-1944). En el reporte explican las experiencias que adquirió Picado entre 1915 y 1927 acerca de la acción inhibitoria de loshongosdelgéneroPenicilliumsobre el crecimiento deestafilococosyestreptococos(bacterias causantes de una serie de infecciones humanas).[12] Aparentemente, Clorito Picado reportó su descubrimiento a laAcademia de Ciencias de París,pero no lo patentó, a pesar de que su investigación había sido iniciada unos pocos años antes que la de Fleming.[13][14]
Alexander Fleming
[editar]
El descubrimiento de la penicilina ha sido presentado como un ejemplo «icónico» de cómo procede elmétodo científicoa través de la observación, y de la habilidad singular deAlexander Fleminginterpretando un fenómeno casual.[15] El propio Fleming abona esta versión en su conferencia de recepción delPremio Nobel.[16] Sin embargo, algunos autores revisan esta historia oficial, y opinan que, sin restar méritos, está distorsionada por mitos, la necesidad depropagandaen laSegunda Guerra Mundialy también una cierta lucha por el prestigio de instituciones con influencias sobre áreas del poder y la prensa.[17][18][19] George Wong, al considerar la versión de un descubrimiento casual, hace notar los siguientes antecedentes:[20]
- Conocía a casi todos los autores mencionados en el apartado anterior. Su gran número es ya por sí solo indicador de que existía toda una corriente que investigaba en el campo con mutuo conocimiento de trabajos. El propio Fleming lo admite en su conferencia de Nobel.[16]
- Buscaba activamente una sustanciabactericida:impresionado por los campos de guerra europeos en laPrimera Guerra Mundialy las bajas por infección en las heridas, ensayó con salvarsán, descubrió lalisozimaconstatando que no afectaba a ninguno de los organismos problemáticos de la penicilina, y ello aun en contra de la línea marcada por su jefe,Almroth Wright,más interesado en lainmunización.Compara en su primer trabajo el espectro de acción de la penicilina y la lisozima.
El descubrimiento de la penicilina según Fleming ocurrió en la mañana del viernes 28 de septiembre de 1928, cuando estaba estudiandocultivos bacterianosdeStaphylococcus aureusen el sótano del laboratorio del Hospital St. Mary en Londres, situado en el Ala Clarence, ahora parte delImperial College.[21][22] Tras regresar de un mes de vacaciones, observó que muchos cultivos estaban contaminados y los tiró a una bandeja delysol.Afortunadamente, recibió una visita de un antiguo compañero y, al enseñarle lo que estaba haciendo con alguna de lasplacasque aún no habían sido lavadas, se dio cuenta de que en una de ellas, alrededor delhongocontaminante, se había creado un halo de transparencia, lo que indicaba destrucción celular. La observación inmediata es que se trataba de una sustanciadifusibleprocedente del contaminante. Posteriormente aisló y cultivó el hongo en una placa en la que disponía radialmente variosmicroorganismoscomprobando cuáles eran sensibles. La identificación del espécimen comoPenicillium notatumla realizóCharles Thom.Publicó su descubrimiento sin que recibiera demasiada atención y, según los compañeros de Fleming, tampoco él mismo se dio cuenta en un inicio del potencial de la sustancia, sino progresivamente, en especial por su baja estabilidad. En su trabajo obtuvo un filtrado libre de células que inyectó a conejos, comprobando así que carecía detoxicidad.También apreció su utilidad para aislarHaemophilus influenzaea partir deesputos.[20][23][24]
Primeras aplicaciones en medicina y aislamiento
[editar]

Debido a su carácter tímido, Fleming no conseguía transmitir entusiasmo sobre su descubrimiento, aunque continuó durante mucho tiempo trabajando en él, hasta 1934 en que lo abandonó para dedicarse a lassulfamidas.[20]
La primera demostración de que la penicilina era útil para la medicina la llevó a cabo en 1930 elpatólogoinglés Cecil George Paine, antiguo alumno de Fleming, que intentó tratar lasicosis,pero sin éxito, probablemente porque el medicamento no era administrado con suficiente profundidad. Sin embargo, logró tener éxito aplicando el filtrado enneonatospara el tratamiento de laoftalmíaneonatal, logrando su primera cura el 25 de noviembre de 1930, en un adulto y tres bebés.[25] Aunque estos resultados no fueron publicados, influyeron enHoward Walter Florey,que fue compañero de Paine en laUniversidad de Sheffield.
Entre 1928 y 1938, Florey se interesó en primer lugar por la lisozima, y posteriormente por el segundo descubrimiento de Fleming. A diferencia de este último, que casi no contaba con plantilla, formó un gran equipo con personalidades de la talla deChain,Leslie Falk, Norman Heatley y hasta otros 22 colaboradores entre investigadores y técnicos con gran cantidad de medios en la escuela de patología Sir William Dunn deOxford,aunque curiosamente, según Florey, no por su potencial farmacéutico, sino por un puro interés científico. Su capacidad de procesado superaba los 500 litros de cultivo semanales.[20]
La purificación de la penicilina se produjo en 1939, a cargo delbioquímicoHeatley, utilizando grandes volúmenes defiltradomediante un sistema a contracorriente yextracciónpor amil acetato. Edward Abraham terminó de eliminar el resto de impurezas porcromatografíaen columna dealúmina.Posteriormente se probó la sustancia enratonesinfectadosconStreptococcus.El primer ser humano tratado con penicilina purificada fue el agente depolicíaAlbert Alexander en elHospital John Radcliffe,el 12 de febrero de 1941. El paciente falleció porque no se le pudo administrar suficientefármaco.[26] Las primeras compañías en interesarse por lapatentefueronGlaxoy Kemball Bishop.[cita requerida]
En España, la primera aplicación oficial con penicilina la realizó en 1944 el Dr.Enrique Hinojosa SantanaenBollulos Par del Condado(Huelva), para tratar a su hijo de una endocarditis.[27]
Desarrollo de la producción industrial y otras penicilinas
[editar]
A partir de las investigaciones de Florey en 1939 y de Heatley en 1941, la producción industrial de la penicilina en Europa se vio en apuros económicos debido al comienzo de laSegunda Guerra Mundial.Los científicos británicos buscaron ayuda en losEstados Unidos,específicamente en los laboratorios dePeoria,Illinoisdonde sus científicos estaban trabajando en métodos defermentaciónpara acelerar el crecimiento de cultivos dehongos.[28] El 9 de julio de 1941 Florey y Heatley partieron de laUniversidad de Oxfordcon una pequeña cantidad de penicilina hacia los Estados Unidos. Bombearon aire dentro de enormes cubas llenas de maíz fermentado con otros ingredientes y aditivos claves lo que demostró poder hacer crecer rápidamente grandes cantidades de penicilina en comparación con los antiguos métodos de crecimiento sobre superficies planas.[29] La cepa dePenicilliumque tuvo el mejor rendimiento no fue la importada por los científicos británicos sino una cepa que crecía sobre un melón en uno de los mercados de Peoria, mejorando la cantidad de producción en las condiciones inmersas de la nueva técnica del laboratorio estadounidense, aproximadamente 70-80 unidades de penicilina pormililitrode cultivo.[30]
El 26 de noviembre de 1941, Heatley y Andrew J. Moyer, el experto del laboratorio en Peoria, lograron mejorar 10 veces la producción de penicilina. Con el aumento de la cantidad de penicilina también bajó el costo de una dosis. Desde el precio incalculable en 1940, el precio de la penicilina bajó a US$20 por dosis en julio de 1943 y más aún a $0,55 por dosis en 1946. Como consecuencia, los laboratorios en Gran Bretaña en 1999 y en Peoria en 2001 fueron designados como Monumento Químico Histórico Internacional (International Historic Chemical Landmark).[31][32]
Penicilinas sintéticas
[editar]Una de las varias presentaciones de la penicilina producida de modo natural es labencilpenicilinao penicilina G, la única que se usa clínicamente. A ella se asociaron la procaína y la benzatina para prolongar su presencia en el organismo, obteniéndose las respectivas suspensiones de penicilina G + procaína y penicilina G benzatina, que solo se pueden administrar por vía intramuscular.
Más tarde, se modificó la molécula de penicilina G para elaborar penicilinas sintéticas, como la penicilina V, que se pueden administrar por vía oral al resistir lahidrólisisácida delestómago.Sin embargo, el relativamente estrecho espectro de acción de la actividad de la penicilina V hizo que se sintetizaran derivados con acción sobre una más amplia gama de agentes infecciosos. El primer paso fue el desarrollo de laampicilina,efectiva frente apatógenosGram positivosyGram negativos,que además resultó considerablemente económica de adquirir. Otro avance fue el desarrollo de laflucloxacilina,usada contra bacterias productoras deβ-lactamasacomo losStaphylococcus.Actualmente existen múltiples derivados sintéticos de la penicilina, como lacloxacilinay laamoxicilina,que se administran por vía oral y de las que existe un abuso de consumo por la sociedad en general para autotratamiento deinfeccioneslevesvíricasque no precisan terapia antibiótica. Esta situación ha provocado un alto porcentaje deresistencia bacterianafrente a las penicilinas y ha llevado a la ineficacia de los betalactámicos en algunas infecciones graves.
Las penicilinas han sido ampliamente utilizadas en el campo de laveterinariadesde 1950, en que comenzaron a añadirse como aditivos en el pienso, debido a su efectividad reduciendo la mortalidad y la morbilidad frente a infecciones clínicas, así como el incremento de la tasa de engorde.[33] De hecho, la amoxicilina fue descrita en 1976 como una penicilina para uso veterinario.[34] Se ha sugerido la relación entre este uso y la selección de cepas resistentes con capacidad de infectar a humanos. Sin embargo, aunque algunos antibióticos se aplican en ambos campos, la mayoría de las resistencias en humanos se han desarrollado por un mal uso en medicina.[35]
Estructura química
[editar]
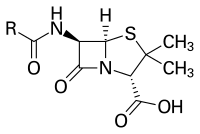
Las penicilinas pertenecen a una familia de compuestos químicos con una estructura química peculiar que le confiere una actividad característica contra un grupo determinado de bacterias.[17] A pesar de que existen diferentes variantes, la estructura química esencial de la penicilina fue descubierta porDorothy Crowfoot Hodgkinentre 1942 y 1945.[36] La mayoría de las penicilinas poseen como núcleo químico el anillo6-aminopenicilánicoy difieren entre sí según lacadena lateralanclada a sugrupo amino.Este núcleo 6-aminopenicilánico o núcleopenamconsta, a su vez, de unanillo tiazolidínico(un anillo aminofenílico de los tiazoles) enlazado a unanillo β-lactámico;[37] este último, aparentemente esencial para la actividad antimicrobiana del compuesto,[38] es hidrolizado mediantepenicilinasas(enzimastipoβ-lactamasas) por las bacterias resistentes a penicilinas.[1]
Además delnitrógenoy elazufredel anillo tiazolidínico y β-lactámico, la penicilina tiene las siguientes agrupaciones:
- Un grupocarboxiloen la posición 2.
- Un radical 2-metilen la posición 3.
- Ungrupo aminoen la posición 6, con distintos derivados del grupoacilocomo posibles sustituyentes, que son los responsables de las diversas características de las diferentes penicilinas.
En la molécula hay trescarbonosasimétricos:
- El carbono C2, que tiene una configuración absoluta S (sentido contrario a las agujas del reloj).
- Los carbonos C5 y C6, que tienen una configuración absoluta R, presentando cada uno de sushidrógenosisomeríacisentre ellos.
Propiedades
[editar]La penicilina natural o penicilina G es cristalina, totalmente soluble en agua, soluciones salinas ydextrosasisotónicas.El radical R, es el responsable de la sensibilidad a lahidrólisispor parte de las β-lactamasas, del enlace a proteínas transportadoras y del vínculo con las proteínas bacterianasPBPque transportan a la penicilina dentro de la célula.[39] Además, se le asocia a la penicilina un dipéptidocisteína-valina,haciendo que la penicilina tenga la ideal afinidad por la enzima bacterianatranspeptidasa,la cual no se encuentra en el cuerpo humano y que permite la síntesis del peptidoglucano.
Existe una analogía estructural entre la penicilina y eldipéptidoD-alanil-D-alaninaterminal asociado a las unidades depeptidoglicanoque aparecen durante la formación de lapared celularde ciertas bacterias (proceso detranspeptidación). ElnucleófiloO(-)serinade latranspeptidasaataca losgrupos carbonilosde los ß-lactámicos, como la penicilina, por esa analogía a su sustrato D-Ala-D-Ala, el dipéptido antes mencionado. De esa manera, uniéndosecovalentementea los residuos deserinadelsitio activode la enzima en forma de complejopeniciloil,la penicilina inhibe a la transpeptidasa bacteriana.[39]
Alérgenos
[editar]Los metabolitos que derivan de la molécula intacta de penicilina actúan comohaptenosy se vuelven inmunitariamente activos a través de su unión de tipocovalente,con lasproteínasendógenas en el cuerpo, preferentemente por ataques a los gruposaminode lalisinade estas proteínas transportadoras, pudiendo inducir así una reacción dehipersensibilidad.[38][40] El intermediarioantigénicode las penicilinas es elácido peniciloilque se forma al abrirse el anillo β-lactámico. El 95 % de la droga unida a los tejidos aparece en esta forma. Dicho ácido, conjugado con un transportador proteico inmunogénico es uno de los agentes más usados en las pruebas cutáneas para determinar si un paciente es alérgico a la penicilina. Otros determinantes menos frecuentes, que incluyen albenzilpeniciloatoy la amina-benzilpeniciloil son productos que se formanin vivoy pueden también encontrarse en las soluciones de penicilina preparadas para su administración comercial, que pueden inducir una reacción de hipersensibilidad.[38]
Clasificación
[editar]| Naturales | Resistentes al ácido |
Antiestafilocócicas | Gram negativas | ||
|---|---|---|---|---|---|
| Penicilina G (bencil) |
Penicilina V | Meticilina |
Isoxazolilopenicilinas: |
Temocilina | |
| Penicilina G Procaína |
Feneticilina | Nafcilina | |||
| Penicilina G benzatina |
Propicilina | ||||
| Aminopenicilinas | Antipseudomonas | Amidinopenicilinas | |||
| Amoxicilina | Ticarcilina | Mecilinam | |||
| Hetacilina | Apalcilina | Pivmecilinam | |||
| Espicilina | Ciclacilina | Azlocilina | Mezlocilina | ||

|

|

|

|

| |
|
Núcleo común |
Una aminopenicilina | ||||
Las penicilinas se clasifican en dos grupos, naturales y semisintéticas, y en cada uno de ellos hay compuestos relativamente resistentes aljugo gástricoy por lo tanto se pueden administrar por vía oral, por ejemplo, la penicilina V, ladicloxacilinay la amoxicilina.
El términopenicilinase usa a menudo, en sentido genérico, para cualquiera de las variantes que derivan de la penicilina misma, en especial, la benzilpenicilina. Estas tienen la mayor actividad contra organismos Gram positivos, cocosGram negativosy organismos anaerobios que no producen β-lactamasa. Sin embargo, presentan una baja actividad contra bacilos Gram negativos. Todos son susceptibles a la hidrólisis por β-lactamasas. La penicilamina, un metabolito de la penicilina y análogo delaminoácidocisteína,es efectivo para el alivio de laartritis reumatoidereduciendo la velocidad de aparición de nuevos daños aarticulaciones,aunque rara vez es recetado debido a su elevada toxicidad.[42] También existen en el mercado penicilinas sintéticas, como laticarcilina,lamezlocilinay lapiperacilina.
Penicilinas naturales y biosintéticas
[editar]Las penicilinas naturales son aquellas generadas sin intervención biotecnológica. Entre ellas destacan la bencilpenicilina, como producto final de interés terapéutico, y los intermediarios aislables como la isopenicilina N o la penicilina N. Las biosintéticas, en cambio, se producen mediante adición de determinados compuestos en el medio de cultivo delbiorreactorempleado durante su producción, es decir, sin que tenga lugar un aislamiento y una modificación químicaex vivo.Entre las biosintéticas destacan: la fenoximetilpenicilina, la alilmercaptometilpenicilina y, de nuevo, la bencilpenicilina (pues es posible inducir su síntesis aplicando ciertos precursores en el fermentador).[1]
Bencilpenicilina o penicilina G
[editar]
Labencilpenicilina,comúnmente conocida comopenicilina G,es el estándar de las penicilinas. Por lo general se administra porvía parenteral(intravenosa, intratecal o intramuscular), porque tiende a perder estabilidad con el jugo gástrico del estómago. Debido a que se administrainyectada,se pueden alcanzar mayores concentraciones del medicamento en los tejidos que con la penicilina V ofenoximetilpenicilina.Estas mayores concentraciones se traducen en una mayor eficacia antibacteriana.
Las ventajas de la penicilina G son su bajo costo, su fácil administración, su excelente penetración en los tejidos y su índice terapéutico favorable. En contraste, las desventajas son su degradación por el ácido gástrico, su destrucción por las β-lactamasas bacterianas y su asociación con el desarrollo de reacción adversa en cerca del 10 % de los pacientes.
Las indicaciones específicas de la penicilina G incluyen:[43]celulitis,endocarditis bacteriana,gonorrea,meningitis,neumonía por aspiración,abscesopulmonar,neumonía adquirida en la comunidad,sífilisysepsisen niños.
- Bencilpenicilina procaína
Labencilpenicilina procaína(DCI), conocida también comopenicilina G procaína,es una combinación de la penicilina G con unanestésico local,la procaína. Esta combinación tiene como fin reducir el dolor y la incomodidad asociada con la voluminosa inyección intramuscular de penicilina. Tras la administración de unainyección intramuscular,el fármaco se absorbe lentamente en la circulación y sehidrolizaa bencilpenicilina. Por ello, es administrada cuando se desea que sus concentraciones sean bajas pero prolongadas. Este antibiótico es muy utilizado enveterinaria.
La penicilina procaínica se indica para todas las infecciones locales graves por estreptococos,bacterias anaerobias,neumococosygonococos,sífilis,ántrax porB. anthracis(como coadyuvante),otitis mediaagudapurulenta,mastoiditisaguda, amigdalitis aguda por estreptococo hemolítico del grupo A,neumonía neumocócica,absceso peritonsilar y submandibular y gonorrea. Las indicaciones específicas de la procaína penicilina incluyen:[43] sífilis,[N 2] infecciones delaparato respiratoriodonde el paciente no cumple su tratamiento oral, celulitis yerisipela.
En el pasado se usaba para el tratamiento de lagonorreagenitourinaria. Sin embargo, la bacteriaNeisseria gonorrhoeaefrecuentemente produce β-lactamasas y ha llegado a desarrollar resistencia a la penicilina, por lo que se ha reemplazado porceftriaxone.También se usaba para el tratamiento de laneumonía neumocócicano complicada, pero el surgimiento delStreptococcus pneumoniaepenicilinorresistente en algunos países ha limitado su uso.
- Bencilpenicilina benzatínica
Labencilpenicilina benzatínicaopenicilina G benzatínica(DCI), es una combinación con benzatina que se absorbe lentamente en la circulación sanguínea después de una inyección intramuscular y luego se hidroliza a bencilpenicilina. Es la primera opción cuando se requiere una concentración baja de bencilpenicilina, permitiendo una acción prolongada del antibiótico por más de 2-4 semanas por cada inyección. La administración de penicilina G benzatínica o benzetacil L-A puede presentar ocasionalmente una reacción alérgicaanafilácticaen pacientes hipersensibles. La penicilina G sódica es administrada en casos dedifteria,de infecciones del aparato respiratorio o delaparato genitaly en ciertas infecciones producidas por Gram negativos, como la meningitis y laendocarditis.[42] Puede causarurticaria,pruritoy, muy rara vez,choque anafiláctico.
Las indicaciones específicas de la bencilpenicilina benzatínica incluyen:[43] profilaxis de la fiebre reumática y sífilis en fase temprana o latente.
Fenoximetilpenicilina o penicilina V
[editar]
Lafenoximetilpenicilina,comúnmente llamadapenicilina V,es la única penicilina activa por vía oral. Tiene una actividad menor que la bencilpenicilina, por lo que se administra cuando no se requiere alcanzar concentraciones elevadas en lostejidos.
Con la penicilina oral V, el espectro es prácticamente igual al de la penicilina G: estreptococos, neumococos yNeisseria,algunos anaerobios y estafilococos no productores depenicilinasa.No es inactivada por el jugo gástrico, alcanzándose en poco tiempo concentraciones adecuadas de penicilina en tejidos yplasma sanguíneo.La absorción no está influida por las comidas. Las indicaciones específicas para la penicilina V incluyen:[43] infecciones causadas porStreptococcus pyogenes(como laamigdalitis,lafaringitise infecciones de lapiel), profilaxis de lafiebre reumáticaygingivitismoderada o severa (junto conmetronidazol).
La penicilina V es la primera opción en el tratamiento de infeccionesodontológicas.Ocasionalmente puede causardiarreasque no suelen requerir suspensión de la terapia. Rara vez produce reacciones alérgicas severas y suelen ser más leves que con penicilina parenteral.
Penicilinas semisintéticas
[editar]Laspenicilinas semisintéticasson aquellas generadas mediante el aislamiento de un intermediario estable durante una producciónmicrobiológica industrial(fermentación en biorreactores) continuada por la modificación química o enzimática del compuesto aislado.[1] Se dividen según su acción antibacteriana en cinco grupos: resistentes a β-lactamasas, aminopenicilinas, antipseudomonas, amidinopenicilinas y resistentes a β-lactamasas (Gram negativas).[46]
Resistentes a β-lactamasas
[editar]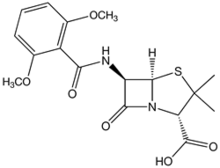
Su uso es principalmente en infecciones por estafilococos productores de β-lactamasas, como elStaphylococcus aureus.También presentan actividad, aunque reducida, frente a estreptococos, pero carecen de ella frente a enterococos.[47]
- Lameticilinaes una penicilina de espectro reducido desarrollada por la farmacéuticaBeechamen 1959. Cuando se desarrolló, era especialmente activa contra Gram positivos productores de β-lactamasas comoStaphylococcus aureus,si bien el desarrollo de resistencia por parte de estos últimos (Staphylococcus aureus resistente a meticilina (SAMR)) impide actualmente su uso clínico.
- Posteriormente aparecieron laoxacilinay lanafcilinapara uso parenteral, y dos drogas para uso oral, lacloxacilinay ladicloxacilina.
Aminopenicilinas
[editar]Su espectro de acción es muy grande, pero son sensibles a las β-lactamasas. Se administran en casos de infecciones respiratorias de las vías altas por estreptococos (sobre todo,S. pyogenesyS. pneumoniae) y por cepas deHaemophilus influenzae,infecciones urinarias por ciertas enterobacterias (comoEscherichia coliy diversas infecciones generadas porStreptococcus faecalis,Salmonella spp.,Shigella spp.yListeria monocytogenes.[48]

- Laampicilinaes el epímero D(-) de la aminopenicilina, un β-lactámico con un grupo fenil. Se desarrolló en los laboratorios Beecham (actualGlaxoSmithKline) como respuesta a la necesidad de encontrar derivados de la penicilina de mayor espectro, dada la aparición de cepas resistentes.[49] El año 1959 se descubrió que elepímeroD(-) de la aminopenicilina con un grupo fenil era el más activo de los derivados sintetizados. Administrada oralmente, la ampicilina es absorbida, se une parcialmente a proteínas plasmáticas (15 a 25 %) y es biodisponible en un 40 %. Se excreta principalmente por elriñón.
- Lapivampicilinaes un ester metilado de laampicilina,administrada en forma de pro-droga,[50] lo cual potencia labiodisponibilidaddelmedicamento,dada su mayorliposolubilidad.[51] En medicina es indicado para el tratamiento de pacientes, especialmente ancianos, con infecciones agudas de las vías aéreas inferiores, como laneumoníay labronquitis.[52]
- Laamoxicilinaes una aminopenicilina de amplio espectro. Como estrategia para potenciar la resistencia a las β-lactamasas, se presenta acompañada deácido clavulánico.Es indicada para el tratamiento de un gran número de infecciones, incluyendo las del tracto respiratorio, digestivo, genitourinario, sistema nervioso, así como en estomatología y durante la erradicación deHelicobacter pylorien casos deúlcera péptica.
Antipseudomónicas
[editar]Estas penicilinas son de amplio espectro porque su cobertura de acción comprende Gram positivos, Gram negativos y anaerobios. Dentro de este grupo existen dos subgrupos, lascarboxipenicilinasy lasureidopenicilinas,atendiendo a su eficacia frente a pseudomonas.[53]
Carboxipenicilinas
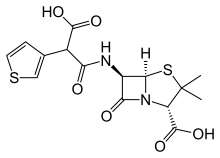
Fueron desarrolladas para ampliar el espectro de bacterias Gram negativas cubiertas por penicilinas, tales como infecciones nosocomiales causadas porPseudomonas aeruginosa.Inicialmente se produjo lacarbenicilinapor sustitución del grupo amino por un grupo carboxilo en la ampicilina y posteriormente algunas sustituciones en la carbenicilina permitieron desarrollar laticarcilina.
Presentan el mismo espectro de acción que las aminopenicilinas, pero ampliado conPseudomonasyB. fragilis.[47]
- Laticarcilinaes una carboxipenicilina empleada en el tratamiento de infecciones causadas por Gram negativos, especialmente dePseudomonas aeruginosa,incluyendo casos deneumonía,infecciones de los huesos,estómago,piel,articulaciones,sangre,ginecológicasy de lasvías urinarias.La combinación de unaminoglucósidocon carbenicilina o ticarcilina ha sido utilizada en el tratamiento de infecciones severas porPseudomonas.Como estrategia para potenciar la resistencia a las β-lactamasas, se presenta acompañada deácido clavulánico.[54]
- Actualmente, lacarbenicilinano se fábrica enEstados Unidosy se ha sustituido su uso por la ticarcilina, la cual tiene menos efectos adversos y es más eficaz frente aPseudomonas aeruginosa.[55]
Ureidopenicilinas
Se crearon derivadas de la molécula de ampicilina para ampliar aún más el espectro contra las bacterias Gram negativas y lasPseudomonas.Las ureidopenicilinas penetran bien en los tejidos y tiene excelentes concentraciones tisulares, incluyendo ellíquido cefalorraquídeoen pacientes conmeningesinflamadas, y niveles adecuados enhuesopara el tratamiento deosteomielitis.Al igual que las carboxipenicilinas, están asociadas ahipopotasemia,hipernatremiay disfunciónplaquetaria.En este grupo de penicilinas están lamezlocilina,azlocilinay lapiperacilina.
Amidinopenicilinas
[editar]Presentan gran eficacia frente a Gram negativos, pero escasa ante cocos Gram positivos, debido a su estructura química, la 6-amidinopenicilina.
- Elmecilinamactúa muy bien frente a enterobacterias. La causa de su éxito ante los Gram negativos se debe a la producción deesferoplastospor su afinidad a laPBP2 y a suefecto sinérgicojunto a otros β-lactámicos.[56] Sin embargo, el mecilinam no es capaz de actuar frente a bacterias productoras de β-lactamasas ni anteH. influenzae,P. aeruginosaniB. fragilis.Su utilización está indicada en el caso de infecciones urinarias por enterobacterias, así como también en lafiebre tifoideay lasalmonelosissepticémica.[56]
- Elpivmecilinames el éster del mecilinam y es indicada en los mismos casos, aunque presenta una ventaja en cuanto a la administración. A diferencia de la anterior amidinopenicilina, esta se puede administrar por vía oral, hidrolizándose después a mecilinam.[57]
Resistentes a betalactamasas de Gram negativos
[editar]El representante del grupo es latemocilina,el cual solo es útil frente a enterobacterias,Haemophilusspp., yNeisseria gonorrhoeae.Las bacterias Gram positivas, anaerobias yPseudomonasspp. son resistentes a su acción.[58]
Mecanismo de acción
[editar]La penicilina, como el resto de los β-lactámicos, ejerce una acciónbactericidapor alterar lapared celularbacteriana, estructura que no existe en lascélulas humanas.[59] La pared bacteriana se encuentra por fuera de lamembrana plasmáticay confiere a lasbacteriasla resistencia necesaria para soportar, sin romperse, la elevadapresión osmóticaque existe en su interior. Además, la pared bacteriana es indispensable para:[1]
- Ladivisión celular bacteriana.
- Los procesos detransportede sustancias a los que limita por sus características de permeabilidad.
- Capacidad patógena y antigénica de las bacterias, ya que contienenendotoxinasbacterianas.

Hay importantes diferencias en la estructura de la pared entre las bacterias Gram positivas y Gram negativas, de las que cabe destacar la mayor complejidad y contenido enlípidosen las Gram negativas.
La acción de la penicilina, y en general de los β-lactámicos, se desarrolla fundamentalmente en la última fase de la síntesis del peptidoglicano de la pared celular, uniéndose a una enzimatranspeptidasallamadaproteína fijadora de penicilina,[60] responsable de producir una serie deenlacescruzados entre las cadenas depéptidos.La formación de estos enlaces o puentes es la que confiere, precisamente, la mayor rigidez a la pared bacteriana. Por lo tanto, los β-lactámicos como la penicilina inhiben la síntesis del peptidoglicano indispensable en la formación de la pared celular bacteriana. Las bacterias sin su pared celularestallano son más fácilmentefagocitadaspor losgranulocitos.[1]
Esta inhibición produce una acumulación de los precursores del peptidoglicano, los cuales producen una activación de enzimas comohidrolasasyautolisinasque digieren, más aún, el remanente de peptidoglicano en la bacteria. Al perder su pared celular como consecuencia de la acción de la penicilina, las bacterias Gram positivas son denominadasprotoplastos,mientras que las Gram negativas, que no llegan a perder toda su pared celular, reciben el nombre deesferoplastos.
La penicilina muestra un efecto sinérgico con losaminoglucósidos,puesto que la inhibición de la síntesis del peptidoglicano permite que los aminoglucósidos penetren la pared celular con mayor facilidad, permitiendo así trastornos en la síntesis de proteínas dentro de la célula bacteriana (hecho que resulta en una concentración menor de antibiótico que la requerida para eliminar al microorganismo susceptible).[61]
Uso en clínica
[editar]
Inicialmente, tras la comercialización de la penicilina natural en la década de 1940, la mayoría de las bacterias eran sensibles a ella, incluso elMycobacterium tuberculosis.Pero debido al uso y abuso de esta sustancia muchas bacterias se han vuelto resistentes, aunque aún sigue siendo activa en algunas cepas deStreptococcussp,Staphylococcussp,Neisseriasp,Clostridiumsp,Listeria monocytogenes,Haemophilussp,Bacteroidessp,Escherichia coli,Proteus mirabilis,KlebsiellayEnterobacter.
La penicilina es indicada, por ejemplo, en pacientes embarazadas, a término o no, como medida profiláctica cuando se sospecha en ellas un alto riesgo de infección por elestreptococo del grupo B.
La penicilina V potásica se indica para tratar ciertas formas deneumonía bacteriana,laescarlatina,y las infecciones enoídos,pielygarganta.También se usa para prevenir lafiebre reumáticarecurrente y lacorea infecciosa.[63] En forma inyectable, la penicilina V se usa en ciertas infecciones bacterianas de loshuesos,estómago,articulaciones,sangre,meningitisy de las válvulas del corazón.[64]
El tratamiento inicial de unabacteriemia(presencia de bacterias en sangre que ocasiona fiebre alta, confusión,estupory muerte en apenas 12 horas), se lleva a cabo con la administración de penicilinas semisintéticas como lanafcilinao lametacilinaintravenosas, si el paciente no es alérgico o la infección es causada por bacterias sensibles.[65]
Laborreliosis,transmitida por lasgarrapatasy que puede cursar sin tratamiento por varias semanas o meses causandosíntomasneurológicosocardíacos,es una enfermedad que puede ser tratada con penicilina oral o amoxicilina, especialmente en niños. En los estadios avanzados se suele administrar penicilina intravenosa de 2 a 4 semanas.[65]
Los antibióticos de preferencia en el tratamiento deltétanostambién son las penicilinas a altas dosis.[65]
Aplicación veterinaria
[editar]La penicilina G se administra en preparados inyectables para el tratamiento de infecciones por organismos susceptibles en múltiples especies veterinarias, incluyendoperros,gatos,hurones domésticos,conejos,erizosyaves.La penicilina G sola o combinada se ha usado con éxito para tratarnovillasconmastitis.[66] Ciertas especies, incluyendoserpientes,pájaros,tortugas,conejillos de indiasychinchillas,han mostrado sensibilidad a la penicilina procaína.[67]
Implicaciones clínicas
[editar]La penicilina dio comienzo a la era de los antibióticos, trayendo la cura de enfermedades comunes como latuberculosisy lasífilis,haciendo que las intervenciones quirúrgicas fuesen menos arriesgadas y que la medicina de las infecciones fuese más confiable. Antes de los años 1930, personas adultas y niños morían en grandes cantidades por infecciones bacterianas como laneumoníay lafiebre reumática,desde los más pobres hasta los más ricos. En 1924, el hijo del presidente estadounidenseCalvin Coolidge,un joven de 16 años de edad, murió por unasepticemiaoriginada en una herida de un pie por sus zapatillas detenis.[17] Aunque la prevención, las vacunas y otras medidas epidemiológicas trajeron la erradicación de ciertas enfermedades, la penicilina por sí sola ha salvado más vidas desde su introducción al mercado que ningún otro medicamento.[68] Pero el mal uso de la penicilina ha traído, a su vez, resistencias en organismos fulminantes comoStaphylococcusyClostridium.Fleming, durante su discurso de aceptación del premio Nobel por su descubrimiento, dijo:
El tiempo vendrá cuando la penicilina pueda ser comprada por cualquiera en las tiendas. Y luego está el peligro de que el hombre ignorante use a menudo infradosis y, al exponer a sus microbios a cantidades no-letales de la droga, los vuelva resistentes.Alexander Fleming.[68]
Farmacología
[editar]Dado que la mayoría de las penicilinas son destruidas por eljugo gástrico,la absorción por vía oral no es buena y por ello deben ser administradas parenteralmente. La penicilina se absorbe rápidamente tanto con la administración intramuscular como subcutánea. Los niveles sanguíneos seguidos de la administración parenteral son elevados pero transitorios. La toxicidad oral (LD50), es decir, ladosis letal en el 50 %de los animales de experimentación es aproximadamente 8900 mg/kg.[69] Ciertas reacciones neurológicas se observan, incluyendoconvulsiones,si la penicilina y otros β-lactámicos llegan a alcanzar concentraciones muy elevadas en ellíquido cefalorraquídeo.[43]
La unión a proteínas séricas es variable en un rango que va desde el 15 % para las aminopenicilinas hasta el 97 % para ladicloxacilina.Lavida mediasérica es corta, aproximadamente 30 minutos para penicilina G y 60 minutos para penicilinas de amplio espectro.
La penicilina es eliminada por los riñones, de modo que una disminución o inhibición de la secreción tubular renal puede aumentar la concentración y el efecto terapéutico de la penicilina. Las dosis deben ser reconsideradas en pacientes con insuficiencia renal o que estén tomando otrosfármacoscomo elprobenecid,[61] usado en pacientes que requieran concentraciones particularmente elevadas de penicilina.[43]
Las penicilinas no son metabolizadas o solo mínimamente metabolizadas y excretadas principalmente por los riñones a través de la filtración glomerular (10 %) y la secreción tubular (90 %). El probenecid bloquea la excreción renal y así causa un aumento de los niveles séricos de penicilina. Estos antibióticos (excepto las penicilinas penicilinasa resistentes) pueden ser eliminados del organismo pordiálisis peritonealyhemodiálisis.En pacientes con disfunción renal severa son necesarios ajustes en las dosis diarias para prevenir niveles excesivos y toxicidad consecuente.
Unidades
[editar]La acción de la penicilina G se definió inicialmente en unidades. Por ejemplo, la penicilina G sódica cristalina contiene aproximadamente 1600 unidades/mg (1 unidad = 0,6 µg; 1 millón de unidades de penicilina = 0,6 g). Las penicilinas semi-sintéticas se prescriben por peso en vez de hacerlo por unidades. Laconcentración inhibitoria mínima (CIM)de cualquier penicilina (o cualquier otroantimicrobiano), por lo general viene dado en g/ml. La mayoría de las penicilinas se dispensan en forma desalesdesodioopotasiodelácidolibre. La penicilina G potásica contiene aproximadamente 1,7mEqde K+por cada millón de unidades de penicilina. Las sales de penicilina en forma cristalina seca se conservan estables por períodos largos de tiempo, llegando varios años a 4 °C. Las soluciones preparadas pierden su actividad con rapidez, unas 24 horas a 20 °C, por lo que cada solución debe ser preparada justo antes de su administración.[42]
Reacciones adversas
[editar]Se han descrito diversos tipos de reacciones, algunas de ellas fatales, en personas a las que se administró penicilina. La penicilina y sus derivados son las causas más frecuentes de reacciones dependientes de lainmunoglobulina E (IgE),aunque pueden también producirseinmunoglobulinas GyM.[61] Las reacciones adversas a la penicilina ocurren en ≤1 % de los pacientes que toman el antibiótico. Aunque la alergia a la penicilina es la forma más frecuente de alergia reportada en medicina, menos del 20 % de las personas que creen ser alérgicos verdaderamente lo son.[70] Entre las reacciones adversas más comunes están:
- Reacción dehipersensibilidadoalérgica:es elefecto adversomás importante. Puede ser inmediata (2-30 minutos), acelerada (1-72 horas) o tardía (más de 72 horas). La gravedad es variable: desde simples erupciones cutáneas pasajeras (urticariaoangioedema), hastashock anafiláctico,el cual ocurre en el 0,2 % y provoca la muerte en el 0,001 % de los casos.[43] Al revisar loshistoriales clínicas,se puede establecer que existe hasta un 50 % de la población alérgica a la penicilina. Muchos de estos eventos soncrisis vasovagalesprovocadas por el intenso dolor de lainyección intramuscular.
- Trastornos gastrointestinales: el más frecuente es ladiarrea,ya que la penicilina elimina laflora intestinal.Puede también provocarnáuseasyvómitos.
- Infecciones adicionales, incluyendocandidiasis.
Entre losefectos secundariosmenos frecuentes, que se dan en el 0,1-1 % de los pacientes, están:
- Aumento reversible deenzimasaminotransferasas,que suele pasar inadvertido.
- Trastornos hematológicos:anemia,neutropeniaytrombocitopenia.La penicilina puede estimular la producción deanticuerpos,principalmenteIgGeIgM,los cuales causan lesiones en lascélulas sanguíneas,ocasionando estos trastornoshematológicos.[61]
- Hipopotasemia:poco frecuente.
- Nefritis intersticial.
- Encefalopatía: que cursa conmioclonias,convulsionescrónicas y tónico-clónicas de extremidades que pueden acompañarse desomnolencia,estuporycoma.Laencefalopatíaes más frecuente en pacientes coninsuficiencia renal.[43]
El dolor y la inflamación del sitio de inyección son también frecuentes en las penicilinas administradas por vía parenteral, como la benzilpenicilina. Ocasionalmente se ha reportado que las penicilinas, así como otros fármacos, pueden causarnecrósis epidérmica tóxica,pénfigoyeritema multiforme.
Los pacientes confibrosis quísticatienen mayor probabilidad de sufrir reacciones adversas a la penicilina y sus derivados.[71] La penicilina no ha causado defectos de nacimiento por lo que con frecuencia es recetado a mujeres embarazadas. Las penicilinas pueden cruzar labarrera placentariay solo deben ser usadas en elembarazocuando sea absolutamente necesario y recomendado bajo supervisión médica. La penicilina puede ser tomada durante lalactancia,sin embargo, pequeñas cantidades del antibiótico pueden pasar a la leche materna y causar en el lactanteindigestión,diarreao reacciones alérgicas.[71]
Alergia a la penicilina
[editar]Las reacciones alérgicas informadas con cualquiera de los antibióticosβ-lactámicospueden ascender hasta un 10 % de los pacientes que reciben estos agentes. Sin embargo, solo el 10 % de estos informes corresponden a reacciones alergias a estos fármacos.[3] Se ha aceptado en el pasado que puede haber hasta un 10 % de sensibilidad cruzada entre los diferentes derivados de la penicilina, es decir, que un 10 % de pacientes hipersensibles a uno de los medicamentos, como lascefalosporinasycarbapenemas,también lo será para los otros derivados de la penicilina, por razón de que todas tienen un anillo β-lactámico.[72][73] Sin embargo, hallazgos recientes han mostrado que no hay un aumento de alergias cruzadas desde las cefalosporinas de segunda generación hasta las más recientes.[74][75] Ciertas investigaciones actuales han demostrado que el principal factor en la determinación de reaccionesinmunitariases la similitud que hay entre las cadenas laterales de las cefalosporinas de primera generación y las penicilinas y no necesariamente entre la estructura del β-lactámico común entre ellos.[76] En una revisión de historias clínicas, se encontró que la alergia a la penicilina es más frecuente en las mujeres que en los hombres.[77]
La vía de administración más frecuente con la cual aparecen estas reacciones alérgicas es laendovenosa,y raramente ocurre cuando se administra por vía oral. Para desarrollar la reacción se necesita de una exposición inicial al medicamento o sus determinantes antigénicos, por ejemplo, al ingerirlecheo productos de animales tratados con penicilina, a través de laleche maternao por el contacto con la droga al administrarla al individuo.[38]
La mayoría de los pacientes expuestos a la penicilina desarrollan anticuerpos frente a este antibiótico y, sin embargo, no manifiestan reacciones al exponerse nuevamente a ella.[61] Quienes desarrollan reacciones alérgicas asociadas a la administración de penicilinas muestran síntomas que varían ampliamente:anafilaxia,enfermedad del sueño,anemia hemolítica,enfermedades renales,angioedema,urticaria,vasculitisentre otros, y pueden llegar a ocasionar la muerte.[38]
Las pruebas cutáneas, como el Pre-pen y el Kremers-Urban, se diseñaron para pacientes en los que se sospechan reacciones alérgicas a la penicilina mediadas porIgEy que se anticipa su tratamiento, como en el caso de pacientes conendocarditiso mujeres embarazadas consífilis.Cerca del 25 % de los pacientes con antecedentes de alergia a la penicilina tendrán una prueba cutánea positiva, mientras que un 6 % (del 3 al 10 %) con antecedentes negativos presenta una respuesta cutánea positiva.[61] Otras pruebas, como la radioalergoadsorción o pruebasin vitro,no ofrecen ventajas sobre las pruebas cutáneas correctamente realizadas.
Como es de esperar, un gran número de pacientes (de un 50 a un 100 %) con una prueba cutánea positiva, producen reacciones alérgicas a la penicilina de ser administrado el antibiótico, mientras que un 0,5 % de los pacientes con pruebas cutáneas negativas reaccionan al fármaco, la cual tiende a ser una reacción leve o tardía, después de la administración de penicilina. Después de varios años, hasta un 80 % de los pacientes pierde la sensibilidad anafiláctica y los anticuerpos IgE.[61]
Interacciones medicamentosas
[editar]La penicilina no debe ser tomada conjuntamente con otros antibióticos como elcloranfenicol,laeritromicina,latetraciclinao laneomicina,entre otros, porque se reduce su efectividad.[78] Se sabe que la penicilina disminuye el efecto de laspastillas anticonceptivasy que las reacciones secundarias ocurren con más frecuencia al combinar la penicilina con losbeta bloqueantes.También interfiere con la absorción delatenolol,y a grandes dosis, la penicilina potencia el efecto de los medicamentosanticoagulantes.
No se recomienda tomarrefrescos carbonatadoso ciertos jugos naturales, pues el ambienteácidode estas bebidas puede destruir la droga. Por ello, las penicilinas orales deben ser ingeridos en ayunas o unas 2 horas después de comer. Laamoxicilinapuede ser administrada con la comida.
Resistencia a la penicilina
[editar]Cerca del 25 % de las cepas deStreptococcus pneumoniaeaisladas en pacientes con otitis media son resistentes a la penicilina y a la amoxicilina, y comparten esa resistencia con cerca del 33 % de cepas deHaemophilus influenzaeen estos pacientes.[61] De acuerdo a publicaciones recientes, el porcentaje de aislamientos deS. pneumoniaecon susceptibilidad a penicilina disminuida enChileyEspaña,[79] por ejemplo, es de alrededor de un 30 % en los pacientes menores de 5 años.[80] Por lo general, las infecciones causadas por estas cepas resistentes se asocian a limitaciones terapéuticas y un desenlace desfavorable de la infección.[81]
El uso, muchas veces indiscriminado, de estos fármacos ante el temor de una complicación y/o riesgo de muerte del paciente, casi siempre sin el amparo del conocimiento del agente causal de la infección y su comportamiento ante el tratamiento aplicado, provoca tal efecto sobre los microorganismos que los lleva a desarrollar una resistencia mayor. Este serio problema ha inducido a varios países a instalar políticas de uso racional de los antibióticos, basadas en el conocimiento de los parámetrosfarmacodinámicosymicrobiológicosde estosfármacosy respaldadas por la realización de pruebas de laboratorio que permitan una verdadera evaluación de la infección y del tratamiento que debe ser aplicado.[82]
Después de la aparición de serias resistencias a la penicilina, se desarrollaron derivados con mayor espectro de acción, así como penicilinas resistentes a la β-lactamasa, como es el caso de laflucloxacilina,ladicloxacilinay lameticilina.Sin embargo, estos fármacos son aún ineficaces contra las cepas delestafilococo resistente a la meticilina,si bien existen otros fármacos eficaces para tratar su infección.[83]
En general, la resistencia a antibióticos β-lactámicos en cualquier bacteria se fundamenta en la interacción entre los factores siguientes:[84][85]
- Permeabilidad de lapared bacterianaal antibiótico.
- Presencia, espectro de acción y afinidad de lasproteínas de unión a penicilinao PBPs (del inglés penicillinbindingproteins).[86]
- Existencia y eficacia de los mecanismos de excreción del compuesto.
- Afinidad del antibiótico por el sitio activo de la PBP.
Algunos de estos factores están relacionados con la ubicacióntaxonómicadel microorganismo: por ejemplo, la estructura de la pared de las bacterias Gram negativas dificulta la permeabilidad del antibiótico y, por ello, disminuye su eficacia.
Cabe destacar la existencia de enzimas que hidrolizan elementos de las penicilinas disminuyendo su actividad: son las llamadasβ-lactamasas.En las bacterias Gram negativas, la enzima se encuentra en elperiplasma,justo entre las membranas interna y externa, mientras que las Gram positivas secretan la β-lactamasa al medio que las rodea. La enzima puede ser codificada por genes delcromosomabacteriano o porplásmidos.Uno de losgenesbacterianos asociado a la producción de β-lactamasas es elblaZ,el cual puede ser localizado en un plásmido. La expresión de este gen viene determinada por dos genes reguladoresblaR1yblaI.Ciertas evidencias hacen suponer que la exposición a la penicilina provoca que la bacteria active al genblaR1,cuyo producto actúa como unaproteasaactivando al genblaIy permitiendo la síntesis de la enzima porblaZ.[87]
La β-lactamasa tiene mayor afinidad por el antibiótico que el que este tiene por su diana. Ciertos antibióticos, como laceftriaxonay lacefatazidima,son estables en presencia de β-lactamasas codificadas y producidas desde plásmidos. Sin embargo, las codificadas y producidas desde cromosomas, como en el caso deEnterobacter,son enzimas que hidrolizan prácticamente a todas las penicilinas y cefalosporinas.[61]
Se ha determinado que la mala evolución de ciertas enfermedades causadas por organismos con susceptibilidad disminuida a la penicilina, como laneumonía neumocócicainvasiva en niños, tiende a ser independiente de la susceptibilidad a la penicilina del microorganismo.[88] Sin embargo, como la resistencia a la penicilina y otros antibióticos continúa en aumento, se ha estimulado el interés en nuevos medicamentos con propiedades bactericidas en contra de organismos resistentes, drogas como lasquinolonas,cuyo blanco son las enzimasADN girasade bacterias Gram negativas ytopoisomerasatipo IV de bacterias Gram positivas.[89]
Producción biotecnológica
[editar]
La producción industrial de penicilina emergió y floreció como industria a causa de laSegunda Guerra Mundial,en especial por la cantidad de empleos disponibles en los Estados Unidos. En julio de 1943, se presentó un plan para distribuirla en masa a las tropas en el frente de batalla de Europa y, gracias a ello, se produjeron 425 millones de unidades. Por entonces, el hongo se hacía crecer sobre una capa delgada de cultivo puesto en bandejas o botellas. Para mejorar los requerimientos de espacio y de los materiales se desarrolló un nuevo método comercial defermentaciónsumergida en calderos de 20 000 a más de 100 000 litros de capacidad, haciendo que se redujesen los precios de coste y aumentase la producción. Como consecuencia, en 1945, se produjeron más de 646 billones de unidades.[90] Por tanto, lo que era un compuesto caro y difícil de aislar es hoy una «commodityquímica», es decir, un compuesto químicamente puro que se compra y vende a gran escala en un mercado competitivo.[91]
El desarrollo biotecnológico de cepas superproductoras ha sido otro campo de investigación de gran interés. El aislado original de Fleming producía alrededor de 2 u/mL (unidades internacionales por mL). Los procesos empleados a finales de la década de los 80 generaban 85 000 u/mL. El desarrollo de las cepas se ha basado en:[2][92]
- el análisis de numerosos aislados de especies y cepas distintas;
- sumutagénesismedianterayos X,metilbiscloroetilamina,nitrosoguanidina,radiación UVde onda corta y otros;
- larecombinaciónmedianteciclos parasexualesenP. chrysogenum;
- lafusión de protoplastos;
- técnicas moleculares debarajado de ADN,que permiten realizarevolución dirigidade fragmentos deADNmediantePCR.
Biosíntesis y semisíntesis
[editar]
La estrategia de producción industrial de penicilina está ligada al tipo de penicilina a sintetizar. Básicamente, esta variedad reside en la sustitución del grupo acilo de la posición 6 en el ácido 6-aminopenicilánico. Cuando la fermentación[N 3] se produce sin añadir ningúnprecursorse producen laspenicilinas naturales.De entre ellas, solo la penicilina G es útil terapéuticamente y por tanto es el compuesto a purificar. Por otra parte, de añadir otros precursores para la cadena lateral, el control de la reacción mejora y es posible producir el compuesto deseado con una alta especificidad. Esta estrategia da lugar a laspenicilinas biosintéticas,como la penicilina V o la penicilina O (en pequeñas cantidades). La aproximación al problema más empleada, no obstante, pasa por lamodificación químicadel compuesto obtenido mediante fermentación. De este modo es posible obtener una gran diversidad depenicilinas semisintéticas.[2]
La generación de penicilinas semisintéticas requiere la producción, mediante fermentación, de penicilina G (en algunos casos penicilina V), compuesto que se convierte en ácido 6-aminopenicilánico mediante una transformación química, o, más frecuentemente, enzimática. Este compuesto es luego modificado mediante la enzimapenicilina acilasade modo que se añada la cadena lateral deseada a la posición 6, lo que da lugar a la penicilina semisintética final. De hecho, el 38 % de las penicilinas producidas comercialmente se emplean en medicina humana, el 12 % enveterinariay el 43 % como precursores para el diseño de penicilinas semisintéticas.[2]
Regulación de la síntesis
[editar]El anillo tiazolidínico de la β-lactama se genera mediante la unión de los aminoácidos L-cisteína,L-valinayácido α-aminoadípico.Este último,aminoácido no proteico,se une al residuo de cisteína mediante unasíntesis de péptidos no ribosomal,a cuyo producto se fusiona una valina mediante unaepimerización,reacción que da lugar a un tripéptido. Este tripéptido se cicla mediante un proceso aún no descrito dando lugar al primer producto aislable, laisopenicilina N.La acción de lapenicilina transacetilasa,que sustituye la cadena de α-aminoadípico en el C6 por una molécula deácido fenilacéticoactivada, produce la bencilpenicilina.[93]
La producción de penicilina es un área que requiere la colaboración de científicos e ingenieros para la efectiva producción de cantidades industriales del antibiótico. La penicilina es unmetabolito secundariodel hongoPenicillium,es decir, el hongo no produce el antibiótico cuando crece bajo condiciones normales, solo cuando su crecimiento se encuentra inhibido por verse sometido a condiciones deestrés.Otros factores inhiben la producción de penicilina, incluyendo su misma ruta de producción. Por ejemplo, la lisina inhibe su síntesis debido a que inhibe a lahomocitrato sintasa,enzima implicada en la síntesis de ácido α-aminoadípico. No obstante, laretroinhibiciónpor lisina no parece ser un factor limitante en la producción industrial del compuesto. Otros elementos reguladores son: la concentración defosfato,deglucosay de ionamonio.[2]
Las células dePenicilliumson crecidas usando una técnica conocida como«fed-batch»(cultivo discontinuo alimentado), en el que se ven continuamente sujetas a condiciones de estrés y, por ende, producen penicilina en abundancia. Las fuentes de carbono disponibles son también importantes porque laglucosainhibe a la penicilina mientras que lalactosano. El valor del pH, los niveles denitrógeno,fosfatoyoxígenoson también críticos en los lotes de producción y deben controlarse automáticamente.
Véase también
[editar]Notas
[editar]- ↑Para referencias generales de esta sección, consultarAnexo:Descubrimiento de la penicilina.
- ↑EnEstados Unidos,la presentación llamadaBicillin C-R,una suspensión inyectable que contiene 1,2 millones de unidades de penicilina benzatina con 1,2 millones de unidades de procaína por 4 mL, no se recomienda para el tratamiento de la sífilis porque es una dosis menor a la recomendada para el tratamiento eficaz de dicha infección. Se han cometido errores en ese país por lo similar que resultan los nombresBicillin L-AyBicillin C-R.[44] Como resultado, se han hecho cambios en el empaque del Bicillin CR y CR 900/300 con la aclaratoria "No apto para el tratamiento de la sífilis".[45]
- ↑Entendiendo fermentación no en el sentidometabólicode la palabra, sino en el sentido biotecnológico de producción a gran escala en un biorreactor.[2]
Referencias
[editar]- ↑abcdefgPrescott, L.M. (1999).Microbiología.McGraw-Hill Interamericana de España, S.A.U.ISBN84-486-0261-7.
- ↑abcdefCrueger, Wulf; Crueger, Anneliese (1989).A texbook of industrial microbiology(2 edición). Sunderland: Sinauer Associates.ISBN0878931317.
- ↑abSolensky, R. (2003), «Hypersensitivity reactions to beta-lactam antibiotics»,Clinical reviews in allergy & immunology24(3): 201-20,PMID12721392,doi:10.1385/CRIAI:24:3:201.
- ↑Enjalbert, F., Rapior, S., Nouguier-Soulé, J., Guillon, S., Amouroux, N., Cabot, C. (2002). «Treatment of amatoxin poisoning: 20-year retrospective analysis.».J Toxicol Clin Toxicol40(6).PMID12475187.
- ↑Sokoloff, Boris (mazorca).The Story of Penicillin.Ziff-Davis.
- ↑Brown, Kevin (2004).Penicillin Man: Alexander Fleming and the Antibiotic Revolution.ISBN0-7509-3152-3.
- ↑«The Clarence Memorial Wing, St. Mary's Hospital».Br Med J.2(1669). 1892.PMCID PMC2421595.
- ↑Glynn, AA (2006).«Museum review: Alexander Fleming Laboratory Museum. St Mary's Hospital, Praed Street, London W2 1NY, UK [Curator: Kevin Brown]».Journal of Antimicrobial Chemotherapy58(1).doi 10.1093/jac/dkl148.
- ↑Volcy, Charles (2004).Lo malo y lo feo de los microbios, pg. 84.Unibiblos.ISBN958-701-400-6.
- ↑Calvo, A (2006).«Ehrlich y el concepto de "bala mágica"».Rev Esp Quimioterap19(1).
- ↑«People and discoveries:Alexander Fleming».Public Broadcasting Service.Consultado el 9 de octubre de 2008.
- ↑«Dr. Clodomiro Picado Twight Honored with WIPO medal»(PDF).WIPO Magazine:11.Consultado el 2 de marzo de 2008.
- ↑«El descubridor de la penicilina era costarricense, según dos científicos. Infomed 4 de agosto de 1999. Año 6, No. 150».Archivado desdeel originalel 24 de febrero de 2009.Consultado el 7 de octubre de 2008.
- ↑Jaramillo Antillón, Juan (2005). «El principio de la quimioterapia y los antibióticos».Historia y filosofía de la Medicina.Universidad de Costa Rica.ISBN9977679851.«Tilio von Vulgo, Édgar Cabezas y María San Román afirman la intervención de Clorito Picado en el descubrimiento de la penicilina (véanse páginas 160 y 161).»
- ↑López, MT, Gómez-Lus, ML (2006).«Las claves de una época: Wright y Flemin».Rev. Esp. Quimioterap. p. 6. Archivado desdeel originalel 6 de abril de 2010.Consultado el 31 de octubre de 2008.
- ↑abAlexander Fleming(11 de diciembre).«Penicillin. Conferencia Nobel».Consultado el 31 de octubre de 2008.
- ↑abcBud, Robert (2007).Penicillin: Triumph and Tragedy. Ver capítulo:The Brand in the Era of Propaganda.Oxford University Press.ISBN0-19-925406-0.
- ↑Clarke, Tom (2002).«Penicillin paper restores Fleming's healthy reputation».Nature419(867).doi 10.1038/419867b.Archivado desdeel originalel 6 de enero de 2009.
- ↑Hantula, Richard (2002).Alexander Fleming.Gareth Stevens.ISBN0-8368-5243-5.
- ↑abcdWong, G (2003).«Penicillin»(en inglés).Consultado el 20 de enero de 2015.
- ↑Kendall F. Haven,Marvels of Science(Libraries Unlimited, 1994) p182
- ↑«WikiJournal of Medicine/History of penicillin - Wikiversity».en.wikiversity.org(en inglés).Consultado el 31 de octubre de 2021.
- ↑Fleming, A. (1929). On the antibacterial action of cultures of a Penicillium, with special reference to their use in the isolation ofB. influenzae.British Journal of Experimental Pathology. 10: 226-236.
- ↑Acuña, G. (2012).«Descubrimiento de la Penicilina: Un Hito de la Medicina Cómo el azar puede ayudar al Científico».Consultado el 10 de junio de 2013.
- ↑Wainwright, M & Swan, HT (1986),«C.G. Paine And The Earliest Surviving Clinical Records Of Penicillin Therapy»,Medical History30(1): 42-56,PMID3511336.
- ↑«Discovery of penicillin»(en inglés).American Chemical Society.
- ↑«Un pionero de la penicilina».ABC de Sevilla.9 de marzo de 2012.Consultado el 26 de diciembre de 2023.
- ↑The Illinois Historic Preservation Agency.Penicillin: "The Miracle Drug"(artículo completo disponible en inglés). Último acceso 11 de noviembre de 2008.
- ↑«"Penicillin: Opening the Era of Antibiotics"».National Center for Agricultural Utilization Research website.7 de abril de 2006. Archivado desdeel originalel 21 de julio de 2011.Consultado el 19 de junio de 2007.
- ↑UW-Madison.Department of Botany.Tom Volk's Fungus of the Month for November 2003(artículo completo disponible en inglés). Último acceso 11 de noviembre de 2008.
- ↑Royal Society of Chemistry.Discovery and Development of Penicillin(en inglés). 19 de noviembre de 1999. The Alexander Fleming Laboratory Museum, Londres, RU. Último acceso 11 de noviembre de 2008.
- ↑Cote, Gregory.Carbohydrate Research at the USDA Laboratory in Peoria, Illinois(en inglés). Agricultural Research Service. Último acceso 11 de noviembre de 2008.
- ↑Gersema LM, Helling DK.The use of subtherapeutic antibiotics in animal feed and its implications on human health.Drug Intell Clin Pharm. 1986 Mar;20(3):214-8.
- ↑Palmer GH, Buswell JF, Dowrick JS, Yeoman GH. (1976)Amoxycillin: a new veterinary penicillin.Vet Rec. 1976 Jul 31;99(5):84-5.
- ↑Phillips I, Casewell M, Cox T, De Groot B, Friis C, Jones R, Nightingale C, Preston R, Waddell J.Does the use of antibiotics in food animals pose a risk to human health? A critical review of published data.J Antimicrob Chemother. 2004 Jan;53(1):28-52. Epub 2003 Dec 4.
- ↑Bentley, Ronald.The Molecular Structure of Penicillin(en inglés). J. Chem. Educ. 2004 81 1462.
- ↑Jeremy Berg y John Tymoczko.Figure 8.26. Structure of Penicillin.(descripción de la imagen en inglés).Biochemistry(5ª edición). National Center for Biotechnology Information. Último acceso 8 de septiembre de 2008.
- ↑abcdeALPIZAR OLIVARES, Yulién. La penicilina y sus derivados como agentes desencadenantes de la respuesta inmune. Rev Cubana Hematol Inmunol Hemoter [online]. 2000, vol. 16, no. 2 [citado 2008-11-08], pp. 99-104. Disponible en:[1].ISSN 0864-0289.
- ↑abG Zhao, WK Yeh, RH Carnahan, J Flokowitsch, TI Meier, WE Alborn Jr, GW Becker and SR Jaskunas.Biochemical characterization of penicillin-resistant and -sensitive penicillin-binding protein 2x transpeptidase activities of Streptococcus pneumoniae and mechanistic implications in bacterial resistance to beta-lactam antibiotics(artículo completo disponible en inglés). J. Bacteriol., 08 1997, 4901-4908, Vol 179, No. 15. Último acceso 20 de septiembre de 2008.
- ↑Introducción a la Microbiología.John L. Ingraham, Catherine A. Ingraham, Joaquín J. Nieto, Emilia (trad.) Quesada, Antonio Ventosa. Publicado porReverté,1871.ISBN 84-291-1871-3.
- ↑Tomado y adaptado deFarmacología humana.Autores Jesús Flórez, Juan Antonio Armijo y África Mediavilla. Publicado porElsevierEspaña, 2004; pág. 1108.ISBN 84-458-1290-4
- ↑abcKatzung, Bertram G. (2007). «Chapter 43. Beta-Lactam Antibiotics & Other Inhibitors of Cell Wall Synthesis».Basic & Clinical Pharmacology(en inglés)(9 edición).McGraw-Hill.ISBN0071451536.
- ↑abcdefghRossi S, editor, ed. (2006).Australian Medicines Handbook.Adelaide: Australian Medicines Handbook.ISBN0-9757919-2-3.
- ↑«Inadvertent use of Bicillin C-R to treat syphilis infection--Los Ángeles, California, 1999-2004»,MMWR Morb. Mortal. Wkly. Rep.54(9), 2005: 217-9,PMID15758893.
- ↑United States Food & Drug Administration."FDA Strengthens Labels of Two Specific Types of Antibiotics to Ensure Proper Use."Publicado el 1 de diciembre de 2004. Consultado el 18 de junio de 2007.
- ↑Flórez, Jesús; Armijo, Juan Antonio; Mediavilla África (2004). «Antibióticos β-lactámicos».Farmacología humana(Cuarta edición). Masson. p. 1416.ISBN8445812904.«Véase página 1108».
- ↑abCastells Molina, Silvia; Hernández Pérez, Margarita (2007).«Farmacología antiinfecciosa».Farmacología en enfermería(Segunda edición). Elsevier España. pp.654.ISBN8481749931.«Véanse páginas 396 y 397».
- ↑«Clasificación de los antimicrobianos».Archivado desdeel originalel 29 de octubre de 2008.Consultado el 10 de noviembre de 2008.
- ↑https://web.archive.org/web/20080212093836/http:// wellcome.ac.uk/doc_WTX026108.html
- ↑J. M. ENSINK, W. R. KLEIN, D. J. MEVIUS, A. KLARENBEEK, A. G. VULTO.Bioavailability of oral penicillins in the horse: a comparison of pivampicillin and amoxicillin(en inglés). Journal of Veterinary Pharmacology and Therapeutics Volume 15 (2008), Issue 3, Pages 221 - 230.
- ↑K. Roholt, B. Nielsen, and E. Kristensen.Clinical Pharmacology of Pivampicillin.Antimicrob Agents Chemother. 1974 November; 6(5): 563–571. PMCID: PMC444693
- ↑Admani AK, Somasundram U., Singh I.El Tratamiento de los Pacientes Ancianos con Infecciones Agudas de las Vías Aéreas Inferiores: Comparación entre Pivampicilina y AmoxicilinaArchivadoel 23 de septiembre de 2009 enWayback Machine.(en español). Current Medical Research and Opinion 9(8):536-541, Ref.:10, 1985/
- ↑«Clasificación de las antipseudomonas».Archivado desdeel originalel 27 de julio de 2010.Consultado el 5 de noviembre de 2008.
- ↑MedlinePlus(enero de 2003).«Inyección de Ticarcilina disódica».Enciclopedia médica en español.Archivado desdeel originalel 2 de octubre de 2008.Consultado el 23 de septiembre de 2008.
- ↑«Venta de carbenicilina».Archivado desdeel originalel 16 de octubre de 2008.Consultado el 4 de noviembre de 2008.
- ↑ab«Espectro de acción de las amidinopenicilinas».Archivado desdeel originalel 6 de febrero de 2009.Consultado el 5 de noviembre de 2008.
- ↑«Diferencias entre mecilinam y pivmecilinam».Archivado desdeel originalel 24 de octubre de 2010.Consultado el 5 de noviembre de 2008.
- ↑«Penicilinas resistentes a las betalactamasas de enterobacterias».Consultado el 4 de noviembre de 2008.
- ↑Lehninger, Albert L. (1988). «11».Principios de bioquímica.Barcelona: Omega. pp. 292-4.ISBN84-282-0738-0.
- ↑E. Gordon, N. Mouz, E. Duée and O. DidebergThe crystal structure of the penicillin-binding protein 2x from Streptococcus pneumoniae and its acyl-enzyme form: implication in drug resistance(en inglés). Journal of Molecular Biology, Volume 299, Issue 2, 2 June 2000, Pages 477-485. Último acceso 14 de noviembre de 2008.
- ↑abcdefghiHarrison Principios de Medicina Interna 16a edición (2006).«Patogenia de las reacciones a fármacos».Harrison online en español.McGraw-Hill.Archivado desdeel originalel 8 de febrero de 2012.Consultado el 9 de septiembre de 2008.
- ↑National Library of ScienceU.S. National Library of Medicine
- ↑MedlinePlus (marzo de 2003).«Penicilina V potásica oral».Enciclopedia médica en español.Consultado el 11 de noviembre de 2008.
- ↑MedlinePlus(enero de 2003).«Inyección de Penicilina G potásica o sódica».Enciclopedia médica en español.Consultado el 11 de noviembre de 2008.
- ↑abcThe PDR Family Guide to Prescription Drugs.Escrito por Medical Economics Data (Firm). Publicado por Crown Trade Paperbacks, 1996.ISBN 0-609-80068-X
- ↑Hirvonen J, Pyörälä S, Heinäsuo A, Jousimies-Somer H.Penicillin G and penicillin G-tinidazole treatment of experimentally induced summer mastitis--effect on elimination rates of bacteria and outcome of the disease(en inglés). Vet Microbiol. 1994 Dec;42(4):307-15.PMID 9133056
- ↑Patient information sheet.Penicillin G(en inglés). Consultado el 11 de noviembre de 2008.
- ↑abTraducción libre delSunday Times.Septiembre 2008.Penicillin overuse puts Fleming's legacy at risk(artículo completo en inglés). Consultado el 14 de noviembre de 2008.
- ↑Ficha de datos de seguridad(marzo de 2006).Penicillin G, Potassium(artículo completo disponible en inglés). Último acceso 29 de diciembre de 2008.
- ↑Salkind AR, Cuddy PG, Foxworth JW (2001), «Is this patient allergic to penicillin? An evidence-based analysis of the likelihood of penicillin allergy»,JAMA285(19): 2498-2505,PMID11368703,doi:10.1001/jama.285.19.2498.
- ↑abHarold M. Silverman. The Pill Book (12th Edition). Publicado por Bantam.ISBN 0-553-58892-3.
- ↑Dash CH (1975), «Penicillin allergy and the cephalosporins»,J. Antimicrob. Chemother.1(3 Suppl): 107-18,PMID1201975.
- ↑Gruchalla RS, Pirmohamed M (2006), «Clinical practice. Antibiotic allergy»,N. Engl. J. Med.354(6): 601-9,PMID16467547,doi:10.1056/NEJMcp043986.
- ↑Pichichero ME (2006),«Cephalosporins can be prescribed safely for penicillin-allergic patients»(PDF),The Journal of family practice55(2): 106-12,PMID16451776,archivado desdeel originalel 24 de febrero de 2012.
- ↑Pichichero ME (2007), «Use of selected cephalosporins in penicillin-allergic patients: a paradigm shift»,Diagn. Microbiol. Infect. Dis.57(3 Suppl): 13S-18S,PMID17349459,doi:10.1016/j.diagmicrobio.2006.12.004.
- ↑Antunez C, Blanca-López N, Torres MJ,et al(2006), «Immediate allergic reactions to cephalosporins: evaluation of cross-reactivity with a panel of penicillins and cephalosporins»,J. Allergy Clin. Immunol.117(2): 404-10,PMID16461141,doi:10.1016/j.jaci.2005.10.032.
- ↑MedlinePlus(agosto de 2007).«Alergia a penicilina es más frecuente en mujeres que en hombres».Enciclopedia médica en español.Consultado el 11 de noviembre de 2008.
- ↑DrugsInteractions between penicillin and Erythromycin,Interactions between penicillin and TetracyclineInteractions between penicillin and Chloramphenicol
- ↑Calvo A, Amores R, Valero E, Fuentes F, Gómez-Lus ML, Prieto J; Working Group for the Study of Cefpodoxime.Activity of oral antibiotics against respiratory tract pathogens in Spain.Rev Esp Quimioter. 2003 Dec;16(4):436-43. Citado 8 de noviembre de 2008.
- ↑CONTRERAS M, Lily, FICA C, Alberto, FIGUEROA C, Oscar et al. Resistencia de Streptococcus pneumoniæ a penicilina y su asociación con factores clínicos y epidemiológicos: Clinical and epidemiological aspects. Rev. méd. Chile. [online]. ene. 2002, vol.130, no.1 [citado 08 noviembre de 2008], p.26-34. Disponible en la World Wide Web:[2].ISSN 0034-9887.
- ↑Bardi, Leticia; Badolati, Adelina; Corso, Alejandra; Rossi, M. Alicia.Fracaso del tratamiento con penicilina en un caso de meningitis por Neisseria meningitidis(en español). Medicina (B.Aires);54(5,pt.1):427-30, sept.-oct. 1994. Citado 8 de noviembre de 2008.
- ↑María Espino, María J. Couto, Mario Lee, Natasha Páez y Elisa Meriño.Efecto sinérgico de penicilina G y Kanamicina en septicemia neonatal por estafilococoArchivadoel 31 de enero de 2012 enWayback Machine.(en español). Rev Cubana Pediatr 1998; 67(3). Último acceso 7 de noviembre de 2008.
- ↑Gemmell CG, Edwards DI, Fraise AP, et al.Guidelines for the prophylaxis and treatment of methicillin-resistant Staphylococcus aureus (MRSA) infections in the UK.J Antimicrob Chemother (2006) 57:589–608.
- ↑ames, P. A., and D. S. Reeves. 1996.Bacterial resistance to cephalosporins as a function of outer membrane permeability and access to their target.J. Chemother. 8(Suppl. 2):37-47
- ↑James, P. A., D. A. Lewis, J. Z. Jordens, J. Cribb, S. J. Dawson, and S. A. Murray. 1996.The incidence and epidemiology of beta-lactam resistance in Haemophilus influenzae.J. Antimicrob. Chemother. 37:737-746
- ↑GEHLREIN M.; LEYING H.; CULLMANN W.; WENDT S.; OPFERKUCH W.Imipenem resistance in Acinetobacter baumanii is due to altered penicillin-binding proteinsChemotherapy. 1991, vol. 37, no6, pp. 405-412.
- ↑TIBAVIZCO, Diego, RODRÍGUEZ, José Yesid, SILVA, Edwin et al. Enfoque terapéutico de la bacteriemia porStaphylococcus aureus.Biomédica. [online]. Apr./June 2007, vol.27, no.2 [cited 22 December 2008], p.294-307. Disponible en la World Wide Web:[3].ISSN 0120-4157.
- ↑MC Pírez García y col.Neumonía neumocócica invasiva en niños de 0 a 24 meses: ¿influye la resistencia bacteriana en la evolución?(artículo completo disponible en español). Anales de Pediatría. Septiembre de 2008; Volumen 69 - Número 03 p. 205 - 209.PMID 18775263.Último acceso 18 de septiembre de 2008.
- ↑Maninder K. Sohi, Dennis A. Veselkov, Ivan Laponogov, Xiao-Su Pan, L. Mark Fisher y Mark R. Sanderson.The Difficult Case of Crystallization and Structure Solution for the ParC55 Breakage-Reunion Domain of Topoisomerase IV from Streptococcus pneumoniae(artículo completo disponible en inglés). PLoS ONE. Septiembre de 2008; 3(9): e3201. PMCID: PMC2527675. Último acceso 18 de septiembre de 2008.
- ↑Parascandola, John. The History of Antibiotics: a Symposium. Publication No. 5, 1980.
- ↑Allen I. Laskin, Geoffrey M. Gadd, Sima Sariaslani (2008)Advances in Applied MicrobiologyAcademic Press.ISBN 0-444-53191-2,9780444531919
- ↑Shu-Jen Chiang (2004).Strain improvement for fermentation and biocatalysis processes by genetic engineering technologyArchivadoel 13 de septiembre de 2019 enWayback Machine.Journal of Industrial Microbiology and Biotechnology. DOI 10.1007/s10295-004-0131-z
- ↑S. C. Warren, G. G. F. Newton, and E. P. Abraham (1967).Use of α-aminoadipic acid for the biosynthesis of penicillin N and cephalosporin C by a Cephalosporium spBiochem J. 103(3): 891–901.
Enlaces externos
[editar] Wikimedia Commonsalberga una categoría multimedia sobrePenicilina.
Wikimedia Commonsalberga una categoría multimedia sobrePenicilina.- Modelo de estructura de la penicilina, × Dorothy Hodgkin et al., Museo de Historia de la Ciencia, Oxford
- The Discovery of Penicillin, A government produced film about the discovery of Penicillin by Sir Alexander Fleming, and the continuing development of its use as an antibiotic by Howard Florey and Ernst Boris ChainenYouTube..
- PenicillinatThe Periodic Table of Videos(University of Nottingham)
- Penicillin Released to Civilians Will Cost $35 Per PatientPopular Science,agosto de 1944, artículo en la parte superior de la página
- Robert Bud.Penicillin,publicado por Oxford University Press, 2007,ISBN 0-19-925406-0(en inglés).
- Guy de la Bedoyere.The Discovery of Penicillin,publicado por Evans Brothers, 2005,ISBN 0-237-52739-1(en inglés).
