Propileno
| Propileno (pp) | ||
|---|---|---|
 | ||
 Modelo molecular tridimensional | ||
| Nombre IUPAC | ||
| Propeno | ||
| General | ||
| Otros nombres |
Propileno Metiletileno Metileteno | |
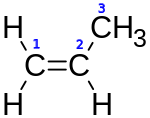
| Fórmula semidesarrollada | H2C=CH–CH3 | |
| Fórmula molecular | C3H6 | |
| Identificadores | ||
| Número CAS | 115-07-1[1] | |
| Número RTECS | UC6740000 | |
| ChEBI | 16052 | |
| ChEMBL | CHEMBL117213 | |
| ChemSpider | 7954 | |
| PubChem | 8252 | |
| UNII | AUG1H506LY | |
| KEGG | C11505 | |
| Propiedades físicas | ||
| Apariencia | Gas incoloro | |
| Densidad | 1,81kg/m³;1,83g/cm³ | |
| Masa molar | 42,08g/mol | |
| Punto de fusión | 88,3 K (−185 °C) | |
| Punto de ebullición | 225 K (−48 °C) | |
| Punto de descomposición | 342 K (69 °C) | |
| Presión crítica | 24.07atm | |
| Presión de vapor | 1020 kPa (a 20 °C) | |
| Peligrosidad | ||
| SGA |
 | |
| Punto de inflamabilidad | 165 K (−108 °C) | |
| NFPA 704 |
4
1
1
| |
| Temperatura de autoignición | 733 K (460 °C) | |
| Frases R | R12 | |
| Frases S | S9S16S33 | |
| Límites de explosividad | 2,0 - 11,1% de propeno en el aire. (a 20 °C) | |
| Riesgos | ||
| Riesgosprincipales | Inflamable | |
| Más información | Concentración máxima permitida en los lugares de trabajo: 500 ppm (VLA-ED, ACGIH-2008). | |
| Compuestos relacionados | ||
| Alquenos | Etileno,Isómeros de Butileno | |
| Otros compuestos relacionados | Propano,2-Propanol | |
| Valores en elSIy encondiciones estándar (25℃y 1atm), salvo que se indique lo contrario. | ||
Elpropilenoopropeno(H2C=CH–CH3) es unhidrocarburoperteneciente a losalquenos,incoloro y con un débil olor similar al delpetróleo,prácticamente inodoro.[2] Es un homólogo deletileno.Como todos los alquenos presenta el doble enlace como grupo funcional. Es el segundo compuesto más utilizado en la industria química en todo el mundo.[3]
Síntesis
[editar]El propeno es uno de los productos de latermólisisdelpetróleo.Se separa de los demás productos como eletilenopordestilacióna baja temperatura.
Aplicaciones
[editar]El propeno es el producto de partida en la síntesis delpolipropileno.
La adición de agua en condicionespolaresdaiso-propanol que puede ser oxidado a la acetona. En condicionesradicalariasse obtienen-propanol.
El ácido acrílico se produce actualmente utilizando el proceso de oxidación selectiva del propeno en dos etapas. El propeno es también un compuesto intermedio en la oxidación selectiva en una etapa de propano a ácido acrílico. Este último proceso se investiga intensivamente porque el propano es significativamente más barato en comparación con el propeno.[4][5][6][7]
Producción
[editar]Steam cracking
[editar]La tecnología dominante para producir propileno es el craqueo al vapor. La misma tecnología se utiliza para producir etileno a partir de etano. El craqueo del propano produce una mezcla de etileno, propileno, metano, hidrógeno, etc. El rendimiento de propileno es de aproximadamente el 15%. La otra materia prima principal es la nafta, especialmente enOriente Medioy Asia.[8]. El propileno puede separarse pordestilación fraccionadade mezclas de hidrocarburos obtenidas del craqueo y otros procesos de refinado; el propeno de grado de refinería es de aproximadamente 50 a 70%.[9] En Estados Unidos, elgas de esquistoes una fuente importante de propano.
Tecnología de conversión de olefinas
[editar]En la tecnología Phillips Triolefin oTecnología de conversión de olefinasel propileno se interconvierte conetilenoy2-butenos.Se utilizan catalizadores derenioymolibdeno:[10]
La tecnología se basa en una reacción demetátesis de olefinasdescubierta enPhillips Petroleum Company.[11][12] Se consiguen rendimientos de propileno de alrededor del 90 % en peso.
Está relacionado con el procesoMethanol-to-Olefins/Methanol-to-Propene.Conviertegas de síntesis (syngas)enmetanoly, a continuación,convierte el metanol en etileno y/o propeno.El proceso produce agua como subproducto. Elgas de síntesisse produce a partir de la reformación del gas natural o mediante la reformación inducida por vapor de productos derivados del petróleo, como la nafta, o mediante lagasificación del carbón.
Craqueo catalítico de fluidos
[editar]Elcraqueo catalítico en lecho fluido(FCC) de alta severidad utiliza la tecnología tradicional de FCC en condiciones severas (mayor relación catalizador/aceite, mayores tasas de inyección de vapor, temperaturas más elevadas, etc.) para maximizar la cantidad de propeno y otros productos ligeros. Una unidad de FCC de alta severidad suele alimentarse con gasóleos (parafinas) y residuos, y produce alrededor de un 20-25 m% de propeno en la materia prima junto con mayores volúmenes de gasolina de motor y subproductos destilados. Estos procesos de alta temperatura son caros y tienen una elevada huella de carbono. Por estas razones, las rutas alternativas al propileno siguen atrayendo la atención.[13]
Otros métodos comercializados
[editar]En el último siglo se han desarrollado tecnologías de producción de propileno con fines específicos. De ellas, las tecnologías de deshidrogenación del propano, como los procesos CATOFIN y OLEFLEX, se han hecho comunes, aunque siguen constituyendo una minoría del mercado, y la mayor parte de la olefina procede de las tecnologías de craqueo antes mencionadas. Los catalizadores de platino, cromo y vanadio son habituales en los procesos de deshidrogenación del propano.
Mercado e investigación
[editar]La producción de propeno se ha mantenido estática en torno a los 35 millones detoneladas(solo Europa y Norteamérica) de 2000 a 2008, pero ha ido aumentando en Asia oriental, sobre todo en Singapur y China.[14] La producción mundial total de propeno es actualmente aproximadamente la mitad de la de etileno.
Se ha explorado el uso deenzimasde ingeniería, pero no se ha comercializado.[15]
Se está investigando el uso de catalizadores portadores de oxígeno para la deshidrogenación oxidativa del propano. Esto presenta varias ventajas, ya que este mecanismo de reacción puede producirse a temperaturas más bajas que la deshidrogenación convencional, y puede no estar limitado por el equilibrio. Esto podría permitir alcanzar conversiones mucho mayores y eliminar la necesidad de una corriente de reciclado con una costosa etapa de separación de propano/propileno.
Reacciones
[editar]

1) Reacción de Simmons-Smith
[editar]Eldiyodometanoen una aleación dezincycobreforma elcarbenoideyoduro de yodometil zinc(CH2IZnI).[16] Mediante un mecanismo decicloadiciónse adiciona un grupometiloal propeno produciéndose elmetilciclopropano(comomezcla racémicaRyS). La reacción ocurre con buenos rendimientos.[16]
2) Hidrogenación
[editar]El propeno en presenciashidrógenoy de un catalizador (comúnmente Pd/C o PtO2llamadocatalizador de Adams) sereducecompletamente apropano.[16] Laadición electrofílicaocurre conestereoquímica syn.[16]
3) Hidrohalogenación
[editar]Lahidrohalogenaciónocurre al hacer burbujear unhalogenuro de hidrógenoen un recipiente conteniendo propeno enéter.[16] Como producto principal de la reacción se obtendrá el2-halógenopropano(P.Ej: utilizandoHBrse obtiene el2-bromopropano).
4) Hidrohalogenación en presencia de peróxidos
[editar]Cuando la hidrohalogenación del propeno ocurre el presencia de peróxidos laregioselectividadde la reacción se invierte dando como principal producto el1-halógenopropano(P.Ej: utilizadandoHClse obtiene el1-cloropropano).[16]
5) Halogenación
[editar]Al hace reaccionar el propeno con un halógeno entetraclorometanocomo solvente se produce el1,2-dihalógenopropano(P.Ej: utilizandoI2se obtiene el1,2-diyodopropano).[16]
6) Formación de halohidrinas
[editar]Cuando la halogenación se produce en presencia deaguase produce el1-halógeno-2-propanol(P.Ej: utilizandoBr2como halógeno se produce el1-bromo-2-propanol).[16]
7) Adición de ácido sulfúrico
[editar]Elácido sulfúricoconcentrado se adiciona al propeno por un mecanismo deadición electrofílicaproduciendo elsulfato ácido de isopropilo.
8) Obtención de alcoholes por oximercuración
[editar]Al tratarse conacetato de mercurio (II)entetrahidrofurano(THF) y agua y posteriormente conborohidruro de sodio(NaBH4) se produce el2-propanolcon alto rendimiento.[16]
9) Hidroboración
[editar]Mediante el tratamiento condiboranoy posteriorhidrólisis oxidativaconperóxido de hidrógeno(H2O2) elmedio alcalinose obtiene elalcoholAntimarkovnikov1-propanol.[16]
10) Dihidroxilación syn
[editar]La oxidación contetróxido de osmio(OsO4) seguido del tratamiento conbisulfito de sodioyaguaproducepropilenglicol(como mezcla racémica R y S).[16] También se producirá la reacción de dihidroxilación syn utilizandoKMnO4diluido en medio acuoso básico a baja temperatura.[16]
11) Obtención de epóxidos
[editar]Laperoxidacióndel propeno con unperoxiácido(RCO3H) a temperatura ambiente produce elóxido de propileno(como mezcla racémica R y S) mediante lareacción de Prileschajew.[17][18]
Industrialmente se produce por oxidación conoxígenoen presencia de un catalizador deóxido de plata(Ag2O) a altas temperaturas (300 °C).[17]
12) Clivaje oxidativo
[editar]La oxidación violenta del propeno conKMnO4caliente produce por clivaje oxidativoácido acéticoydióxido de carbono.[16] También se obtendrían los mismos productos porozonólisisconozono(O3) a bajas temperaturas (-78 °C) y posterior clivaje oxidativo conperóxido de hidrógeno(H2O2) en medio alcalino.[16]
13) Polimerización
[editar]Lapolimerizacióndel propileno apolipropilenose puede llevar a cabo de forma radicalaria aunque en la polimerizacióncatalíticase obtienen productos con mejores calidades que además son mejor controlables. Los catalizadores empleados eran originalmente del tipoZiegler-Natta.En la actualidad se están sustituyendo por otros sistemas basados enzirconocenos.
14) Adición de diclorocarbeno
[editar]Al tratar el propeno concloroformoy con una base fuerte comoKOHse obtiene1,1-dicloro-2-metilciclopropano(comomezcla racémicaR y S).[16]
15) Ozonólisis con clivaje reductivo
[editar]Por Ozonólisis con posterior clivaje oxidativo se obtiene como productosformaldehídoyacetaldehído.[16]
16) Hidroformilación
[editar]La hidroformilación del propeno conmonóxido de carbono,aguay un catalizador deCoa altas presiones y temperaturas producebutanalcomo principal producto.[19]
Usos
[editar]El propeno es el segundo producto de partida más importante en laindustria petroquímicadespués deletileno.Es la materia prima de una gran variedad de productos. Los fabricantes depolipropilenoconsumen casi dos tercios de la producción mundial.[20] Los usos finales del polipropileno incluyen películas, fibras, envases, embalajes y tapas y cierres. El propeno también se utiliza para la producción de importantes productos químicos comoóxido de propileno,acrilonitrilo,cumeno,butiraldehídoyácido acrílico.En el año 2013 se procesaron unos 85 millones de toneladas de propeno en todo el mundo.[20]
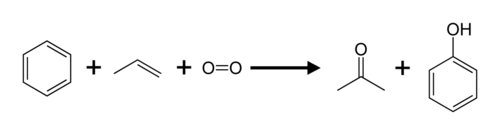
El propeno y elbencenose convierten enacetonayfenolmediante elproceso del cumeno.
El propeno también se utiliza para producirisopropanol(propan-2-ol),acrilonitrilo,óxido de propilenoyepiclorhidrina.[21] La producción industrial deácido acrílicoimplica la oxidación parcial catalítica del propeno.[22] El propileno es un intermedio en la oxidación a ácido acrílico.
En la industria y los talleres, el propileno se utiliza como combustible alternativo al acetileno ensoldadura por combustión (autógena),soldadura fuerte y calentamiento de metales para doblarlos. Se ha convertido en un estándar en los productosBernzOmaticy otros en sustitutos del MAPP,[23] ahora que el verdaderogas MAPPya no está disponible.
Información adicional
[editar]- N.º ICSC: 0559
- N.º CE: 601-011-00-9
N.º de índice (clasificación y etiquetado armonizados conforme alReglamento CLP(en:CLP_Regulation) de la UE)
Referencias
[editar]- ↑Número CAS
- ↑U.S. National Library of Medicine, National Center for Biotechnology Information (8 de diciembre de 2019).«Propylene compound summary» [Propileno resumen de compuesto](en inglés).Consultado el 12 de diciembre de 2019.
- ↑«Propylene Production from Methanol».by Intratec,ISBN 978-0-615-64811-8.
- ↑«The reaction network in propane oxidation over phase-pure MoVTeNb M1 oxide catalysts».Journal of Catalysis311:369-385. 2014.doi:10.1016/j.jcat.2013.12.008.Archivado desdeel originalel 15 de febrero de 2016.
- ↑Kinetic studies of propane oxidation on Mo and V based mixed oxide catalysts(en inglés).2011.
- ↑«Surface chemistry of phase-pure M1 MoVTeNb oxide during operation in selective oxidation of propane to acrylic acid».Journal of Catalysis285:48-60. 2012.doi:10.1016/j.jcat.2011.09.012.Archivado desdeel originalel 30 de octubre de 2016.
- ↑«Multifunctionality of Crystalline MoV(TeNb) M1 Oxide Catalysts in Selective Oxidation of Propane and Benzyl Alcohol».ACS Catalysis3(6): 1103-1113. 2013.doi:10.1021/cs400010q.
- ↑Ashford's Dictionary of Industrial Chemicals, Tercera edición, 2011,ISBN978-0-9522674-3-0,páginas 7766-9
- ↑«Evaluación de la seguridad del producto(PSA): Propileno».Dow Chemical Co. Archivado desdeel originalel 28 de agosto de 2013.Consultado el 11 de julio de 2011.
- ↑Ghashghaee, Mohammad (2018). «Catalizadores heterogéneos para la conversión en fase gaseosa de etileno a olefinas superiores».Rev. Chem. Eng.34(5): 595-655.S2CID103664623.doi:10.1515/revce-2017-0003.
- ↑Banks, R. L.; Bailey, G. C. (1964). «Olefin Disproportionation. A New Catalytic Process».Industrial & Engineering Chemistry Product Research and Development3(3): 170-173.
- ↑Lionel Delaude, Alfred F. Noels (2005). «Metátesis».Enciclopedia Kirk-Othmer de Tecnología Química(Weinheim: Wiley-VCH).ISBN978-0471238966.doi:10.1002/0471238961.metanoel.a01.
- ↑Schiffer, Zachary J.; Manthiram, Karthish (2017). «Electrificación y descarbonización de la industria química».Joule1:10-14.S2CID117360588.hdl:1721.1/124019.
- ↑Amghizar, Ismaël; Vandewalle, Laurien A.; Van Geem, Kevin M.; Marin, Guy B. (2017). «Nuevas tendencias en la producción de olefinas».Engineering3(2): 171-178.
- ↑de Guzman, Doris (12 de octubre de 2012).«Bioenergías globales en biopropileno».Green Chemicals Blog.
- ↑abcdefghijklmnñoMcMurry, John (2004). «Alquenos: reacciones y síntesis».Química Orgánica(sexta edición). Thompson. pp. 208-237.ISBN970-686-354-0.
- ↑abMcMurry, John (2004). «Éteres y epóxidos. tioles y sulfuros».Química Orgánica(sexta edición). Thompson. pp. 648-649.ISBN970-686-354-0.
- ↑Beyer, Walter (1987). «Compuestos alinfáticos».Manual de química orgánica(19º edición). Reverté. p. 79.ISBN84-291-7066-9.
- ↑Yúfera, Eduardo Primo (1996). «Hidrocarburos III. Alquenos».Química orgánica básica y aplicada:de la molécula a la industria (Volumen 1).Reveté. pp. 158-159.ISBN84-291-7953-4.
- ↑ab«Estudio de mercado: Propileno (2ª edición), Ceresana, diciembre de 2014».ceresana.Consultado el 3 de febrero de 2015.
- ↑Merck & Co., ed. (1996). «8034. Propileno».El Índice Merck, duodécima edición.Nueva Jersey. pp. 1348-1349.
- ↑J.G.L., Fierro (Ed.) (2006).Óxidos metálicos, química y aplicaciones.CRC Press. pp. 414-455.
- ↑Por ejemplo, "MAPP-Pro"
Enlaces externos
[editar]- https:// ilo.org/dyn/icsc/showcard.display?p_lang=es&p_card_id=0559Ficha ICSC del propileno en el sitio web de laOrganización Internacional del Trabajo


![{\displaystyle {\ce {CH2=CH2{}+CH3CH=CHCH3->[][{\text{Re, Mo}} \atop {\text{catalyst}}]2CH2=CHCH3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/acdd4b00da58144bb78872e0663521fe689b07b1)