Euroopium
| 63 |
2 8 25 18 8 2 |
| Eu 151,96 |
|
| Euroopium |

Euroopiumonkeemiline elementsümboligaEujajärjekorranumbriga63. Euroopium kuulublantanoididehulka ning seda loetakse seega kaharuldaseks muldmetalliks.
Tahke euroopium on hõbedavärvi pehmemetall,mis tuhmub kiirelt ja reageerib veega. Ta on lantanoididest kõigereaktsioonivõimelisemning puhtal kujul seda looduses ei esine.
Euroopiumil on 2 stabiilsetisotoopimassiarvudega151 ja 153.
Euroopiumi avastas 1901. aastalprantsusekeemikEugène-Anatole Demarçay.Ta nimetas elemendiEuroopamaailmajaojärgi.[1]
Füüsikalised omadused
[muuda|muuda lähteteksti]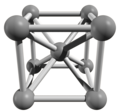
Euroopium on sepistatav metall, millekõvaduson sarnanepliiga.Tahkes vormis on euroopiumiaatomidpaigutunudkristallvõresbcc (body-centered cubic) mudeli järgi. Mõned euroopiumi omadused on tugevalt mõjutatud selle pooleldi täidetud f-elektronkihist.[2]Euroopiumitiheduson 5,24 g/cm³, mis on kõigist teistest lantanoididest väiksem.Sulamistemperatuuron 822 °C, mis on üks kõige madalamaid lantanoidide hulgas.[1]
Euroopium muutub superjuhtivaks, kui seda jahutada 1,8Kelvininija avaldada rõhku 80 GPa. See juhtub, sest metallilisena on euroopiumdivalentsesolekus, kuid rõhu tõttu toimub üleminektrivalentsesseolekusse.[3][4]
Keemilised omadused
[muuda|muuda lähteteksti]
Euroopium reageerib haruldastest muldmetallidest kõige ägedamalt. See oksüdeerub õhu käes kiirelt: juba paari tunniga muutub läikiv pind tumedaks ning sentimeetrise läbimõõduga proov on pärast paari päeva õhu käes olemist pea täielikultoksüdeerunud.[5]Reageerimisvõimeveega on sarnanekaltsiumiga,toimub reaktsioon:
2 Eu + 6 H2O → 2 Eu(OH)3+ 3 H2
Euroopium on nii hea reageerimisvõimega, et isegiõlisees hoitaval tahkel tükil ei ole enamasti läikivat pinda. Euroopium süttib õhus temperatuurivahemikus 150–180 °C, selle tulemusena tekib euroopium(III)oksiid:
4 Eu + 3 O2→ 2 Eu2O3
Euroopium lahustub hästiväävelhappelahuses ning moodustab hüdraatunud Eu3+ioonide tõttu heleroosa lahuse, tekivad nonahüdraadid:[6]
2 Eu + 3 H2SO4+ 18 H2O → 2 [Eu(H2O)9]3++ 3 SO42-+ 3 H2
Eu(II) ja Eu(III) vormid
[muuda|muuda lähteteksti]Kuigi Eu on enamasti trivalentne, esineb seeühenditeska divalentsena. See omadus eristab euroopiumi enamikust lantanoididest, sest need esinevad ühendites üksnes oksüdatsiooniastmes +3. Euroopiumi +2 olekus on aatomi elektronkonfiguratsioon 4f7 (6s orbitaali 2 elektroni on liikunud 4f orbitaale täitma), sest pooleldi täidetud f-orbitaal muudab selle vormi stabiilsemaks.[7]
Divalentne euroopium on nõrkredutseerijaning see oksüdeerub õhus Eu(III) ühendiks.
Kuigi euroopiumit leidubmaakidesväga väikeseskontsentratsioonis,on seda teistest lantanoididest võimalik päris hästi eraldada. Eraldamiseks saab kasutada ära euroopiumi stabiilset divalentset olekut, sest enamikule lantanoididele on omane ainult trivalentne olek.[8]
Kasutusalad
[muuda|muuda lähteteksti]
Esimest korda võeti euroopium kasutuselevärviteleriteekraanides punase värvuse saamiseks. Nimelt onkineskoobikatoodtoruspunasefosfoorinakasutusel euroopiumoksiid (Eu2O3).[9]
Tänapäeval kasutatakse euroopiumiluminofoorlampidesfosfooridena, punase valguse saamisel on oluline Eu3+,mis on lampides Y2O3:Eu3+(YOX) kujul. Need lambid ongi põhilised seadmed, kus kasutatakse euroopiumi. Euroopium on ka ainuke element haruldastest muldmetallidest, mis suudabkiiratapunast valgust, seega ei ole seda selles valdkonnas võimalik ühegi teise haruldase muldmetalliga asendada.[1]Punast valgust tekitavat Eu-fosfoori ei kasutata mitte ainult punastes lampides, vaid lisatakse ka uute madala energiaga elektripirnide koostisse, et muuta nende muidu külm sinakas valgus kollakamaks.[1]ValgeteLED-ide koostises kasutatakse euroopiumi mõnda teist fosfoori aktiveeriva ainena.[10]Euroopiumi saab kasutada ka sinise valguse saamiseks. Nimelt mängib selles olulist rolli Eu2+,mis on lampides BaMgAl10O17:Eu2+(BAM) kujul.[9]
Praegusel ajal väheneb luminofoorlampide kasutamine, sest neid tõrjuvad välja valgust andvaddioodid(LED-id), enamus LED-e ei sisalda euroopiumi ega teisi haruldasi muldmetalle. Samas toodetakseHiinasjaTaiwaniseuroopiumil põhinevaid LED-e, mis on tavaliste LED-idega võrreldes 25% tõhusamad. Seega võib juhtuda, et järgmise paari aasta jooksul tõrjuvad efektiivsemad LED-id traditsioonilised välja ning euroopiumi nõudlus suureneb jälle.[9]

Pikaajalisi fosfoore, mis sisaldavad Eu3+,kasutatakseteemärgistustetegemisel katurvaelementides.[9]Näiteks on Eu3+ioonid kasutuselEUROrahatähtedel helendava tindi koostises.[11]Vaadates rahatähteUV-valguseall, on näha punaselt helendavaid turvaelemente, nende puudumine aitab võltsitud rahatähti ära tunda.[1]
Euroopium on väga heaneutroniteneelaja, seetõttu kasutatakse sedatuumareaktoritekontrollvarrastekoostises.[1]Kui reaktoris tahetakse reaktsiooni aeglustada, viiakse vardad sügavamale reaktsioonisegu sisse, siis neeldub varrastel rohkem neutrone.
Viimase aja üks uuemaid avastusi on euroopiumi kasutamine kvantmälukiibi valmistamisel – praegu on seal suudetud andmeid hoida turvaliselt mitu päeva. Niimoodi saaks tulevikus kvantteavet edastada pikkade vahemaade tahakõvakettalaadselseadmel.[12]
Leiualad ja tootmine
[muuda|muuda lähteteksti]
Euroopium on maakides alati koos teiste lantanoididega ning seetõttu kaevandatakse seda koos nendega. Euroopiumi leidub põhiliseltbastnäsiidisjamonatsiidis,samuti kalopariidisjaksenotiimis.[9]
Kõige rohkem on euroopiumi varusid Hiinas,VenemaaljaUSA-s.[1]Hinnanguliselt oli 2009. aasta seisuga maapõues euroopiumi veel 0,8 miljonit tonni.[13]
Põhilised euroopiumi tootjad on tänapäeval Hiina ja Venemaa.[1]
1960. aastate lõpus ja 1970. aastate alguses saadi pea kogu toodetud euroopiumCaliforniastMountain Passkaevandusest.See kaevandus töötaski põhiliselt euroopiumi saamiseks, seal leiduv bastnäsiit sisaldas 0,1% euroopiumit.[9]1990. aastatel sai Hiinast suurim haruldaste muldmetallide varustaja –Bayan Obokaevanduses on hinnanguliselt 36 miljonit tonni haruldaste muldmetallide oksiide ning see on suurime teadaolev leiuala. Bayan Obos on suured bastnäsiidi ja monatsiidi varud ning 0,2% kõigist haruldastest muldmetallidest moodustab euroopium.[14]Teine suur haruldaste muldmetallide leiuala on VenemaalKoola poolsaarel,kus leidub lopariiti. Pealenioobiumi,tantaalijatitaanion seal kuni 30% haruldasi muldmetalle, see on suurim haruldaste muldmetallide leiuala Venemaal.[15]
Tootmine Eestis
[muuda|muuda lähteteksti]Eestis on juba 1970. aastatest toodetud haruldaste muldmetallide ühendeidSillamäelAS Silmetis. 2011. aasta märtsi seisuga moodustas Eestis toodetud haruldaste muldmetallide toodang 2% koguturust, ülejäänu tootis Hiina. Teiste hulgas toodetakse ka euroopiumiühendeid. Tootmiseks saadakse toorainet Venemaalt Koola poolsaarelt.[1]2011. aastal sai AS Silmetist USA suurtootja Molycorpi osa, 2016. aastal läks Molycorp aga pankrotti ning selle tütarettevõttestMolycorp SilmetAS on nüüd saanud NMP Silmet AS.[16]
Eraldamine
[muuda|muuda lähteteksti]Lantanoidide maagist eraldamiseks ja teineteisest lahutamiseks on välja töötatud mitu meetodit. Meetodivalik sõltub maagi koostisest ja kontsentratsioonist. Enamasti saadakse lantanoidide lahus maaki kõigepealt kuumutades ning seejärel happes ja aluses leotades. Kui lantanoididest on maagis kõige rohkemtseeriumi,siis viiakse Ce(III) üle Ce(IV) vormi jasadestatakselahusest välja. Edasi viiakse läbisolvent-ekstraktsioonvõiioonvahetuskromatograafianing seejärel saadakse suure euroopiumisisaldusega proov. Proovis olev Eu(III) redutseeritakse Eu(II) vormi kastsingi,tsink-amalgaamiga võielektrolüüsiga.Eu(II) keemilised omadused on sarnasedleelismuldmetallideganing seega saab seda sadestadakarbonaadinavõi koosbaariumsulfaadiga.[8][9]
Avastamine
[muuda|muuda lähteteksti]
Euroopiumi avastamise lugu algab teise elemendi –samaariumiavastamisest. Prantsuse keemik Paul-Émile Lecoq de Boisbaudran väitis 1879. aastal, et on saanud kätte puhta samaariumi. 1886. aastal uuris teine prantsuse keemik Eugène-Antole Demarçay samaariumi proovispektroskoobiga.Arvatava samaariumi proovi spektris oli aga näha spektrijooni, mis pidid kuuluma teisele elemendile.[17]Demarçay avaldatud tulemused tekitasid lahkarvamusi ning ta mõistis, et vajab paremat tõendit uue elemendi leidmise kohta. 1901. aastal suutiski ta puhastada samaariumi proovist välja puhta euroopiumi. Selleks viis ta läbi korduva samaariumiväljakristallimisemagneesiumnitraadiga.[18]
Bioloogiline tähtsus ja toksilisus
[muuda|muuda lähteteksti]Euroopiumil ei ole bioloogilist tähtsust. See on väikesetoksilisusega.[1]Selle soolad võivad suukaudsel tarvitamisel olla kergelt toksilised, kuid mõjusid ei ole lähemalt uuritud. Euroopium ei ole looduses ohuks ei loomadele ega taimedele. Metallitolm võib aga põhjustada tule- ja plahvatusohu.[19]
Vaata ka
[muuda|muuda lähteteksti]Viited
[muuda|muuda lähteteksti]- ↑1,001,011,021,031,041,051,061,071,081,09""Periodic Table: Europium"".Royal Society of Chemistry.Vaadatud 15.10.2016.
- ↑Holleman, A. F.; Wiberg, E. Inorganic Chemistry. Academic Press: San Diego. 2001.ISBN 0-12-352651-5.
- ↑Debessai, M.; Matsuoka, T.; Hamlin, J.; Schilling, J.; Shimizu, K."Pressure-Induced Superconducting State of Europium Metal at Low Temperatures".Phys. Rev. Lett. 2009.Vaadatud 15.10.2016.
- ↑Johansson, B.; Rosengren, A."Generalized phase diagram for the rare-earth elements: Calculations and correlations of bulk properties".Physical Review B. 1975, 11, 8, 2836–2857.
- ↑Hamric, D."Rare-Earth Metal Long Term Air Exposure Test".2007.Vaadatud 15.10.2016.[alaline kõdulink]
- ↑"Chemical reactions of Europium".Vaadatud 15.10.2016.
- ↑Cooley, R. A., Yost, D. M.; Stone, H. W. "Europium(II) Salts". Inorganic Syntheses 2.1946, pp. 69–73.ISBN 978-0-470-13233-3.
- ↑8,08,1Sayed, S. A.; Rabie, K. A.; Salama, I. E."Studies on europium separation from a middle rare earth concentrate by in situ zinc reduction technique. Studies on europium separation".Separation and Purification Technology. 2005, 46, p146.
- ↑9,09,19,29,39,49,59,6Binnemans, K.; Jones, P. T."Rare Earths and Balance Problem".J. Sustain. Metall. 2015, 1, 29–38.
- ↑Murthy, K. V. R."Phosphor for Optoelectronic Devices: A review".journal of innovation in electronics and communication. 2013, 3, 1, p 26.
- ↑Cotton, S. Euro banknotes. Lanthanide and actinide chemistry. 2006, p 77.ISBN 978-0-470-01006-8.
- ↑"Quantum hard drive breakthrough".Phys.org. 2015.Vaadatud 15.10.2016.
- ↑Izatt, R. M."Metal Sustainability: Global Challenges, Consequences, and Prospects".John Wiley and Sons: 2016. p 26.
- ↑Chengyu W."Bayan Obo Controversy: Carbonatites versus Iron Oxide-Cu-Au-(REE-U)".Resource Geology. 2007, 58, 4, 348.Vaadatud 15.10.2016.
- ↑Hedrick, J.; Sinha, S.; Kosynkin, V."Loparite, a rare-earth ore (Ce, Na, Sr, Ca)(Ti, Nb, Ta, Fe+3)".Journal of Alloys and Compounds. 1997, 250, 467–470.Vaadatud 15.10.2016.
- ↑BNS"Molycorp Silmet muutis emafirma pankrotiprotsessi tulemusel ärinime".Postimees 2016.Vaadatud 15.10.2016.
- ↑Szabadváry, F. Handbook of the Chemistry and Physics of the Rare Earths Vol. 11. Elsevier Science Publishers: 1998, p 65.
- ↑Emsley, J. Nature’s building blocks: an A-Z guide to the elements. Oxford University Press: 2003, p 140.
- ↑""Chemical properties of europium – Health effects of europium – Environmental effects of europium".Lenntech.Vaadatud 26.10.2016.
| Pildid, videod ja helifailid Commonsis:Euroopium |
| Vikisõnastiku artikkel:euroopium |
