Raud
| See artikkel räägib keemilisest elemendist; teiste tähenduste kohta vaata lehekülgeRaud (täpsustus) |
See artikkelvajabtoimetamist.(Jaanuar 2009) |
See artikkelootabkeeletoimetamist. |
| 26 |
2 14 8 2 |
| Fe 55,847 |
|
| Raud |
Raud(ladina keelesferrum;keemiline sümbolFe) onkeemiline elementjärjenumbriga26.
Raud kuulubsiirdemetallidehulka, ta kuulubperioodilisussüsteemiVIII B rühmaehk8. kõrvalrühma(raua-plaatinarühm) (või uue arvestuse järgi rühma 8 (rauarühma)) ja4. perioodi.
Tal on nelistabiilset isotoopimassiarvudega54, 56, 57 ja 58.
Raud onmetall,tal onmetallilised omadused.
Normaaltingimustelon raudtahke ainetihedusega7,87 g/cm3.Rauasulamistemperatuuron 1539°C.Raud esineb madalal rõhul neljakristallmodifikatsiooninaolenevalttemperatuurist.
Raud on kõige levinum elementMaakoostises ning levimuseltmaakooresmassisisaldusejärgihapniku,ränijaalumiiniumijärel neljandal kohal ning metallidest alumiinium] järel teisel kohal (vtkeemiliste elementide sagedused).
Maal esineb raud peale mitmesugustemaakidejarauamineraalidesulamisraudmeteoriitides.Nendest valmistati juba ennerauaaega,kohati juba 3000 aastat eKr, kultusesemeid, tööriistu ja relvi. Kaevandatakse eelkõigerauamaakemagnetiiti,hematiitijasideriiti.
Keemiliselt puhas raud onhõbevalge,suhteliselt pehme, plastiline, üsna kergesti reageeriv metall. Et raud onferromagnetilinematerjal, siismagnetidtõmbavas teda külge ja ta võib moodustada omamagnetvälju.Puhast rauda kasutatakse praktikas suhteliselt harva, kuid ta moodustab umbes 80 muu elemendigasulameid,millest tähtsamad onterasjamalm.Neil on asendamatu majanduslik ja tehniline tähtsus paljudestööstusharudes,näiteksautotööstusjamasinatööstus,samutiehituses,transpordisjaenergeetikas.
Raud on peaaegu kõikideorganismidemikroelement.Selgroogsetelon taverekoostisosahemoglobiinis,mida kannavadpunased verelibled.Raud on loomadel vajalik kavalkudemoodustamiseks.
Raua asetus perioodilisussüsteemis ja aatomi ehitus[muuda|muuda lähteteksti]
Raud kuulub perioodilisussüsteemisVIII rühma kõrvalalarühma.Rauaaatomijärjenumbrist (26) ja täisarvuni ümardatudaatommassist(56) järeldub, et rauaaatomituumas on 26prootonitja 56–26=30neutronit.Raud onneljanda perioodielement, mis tähendab, et temaelektronkatte26elektroniasuvad neljalelektronkihil:Fe: +26 / 2)8)14)2). Raua aatomielektronkonfiguratsioonon lühendatud kujul järgmine: (argooni aatomi elektronkonfiguratsioon pluss 8 ülejäänud raua elektroni)Ar3d64s2.
Keemiliste reaktsioonide käigus võib raud loovutada elektrone ka eelviimaselt elektronkihilt.
Keemiline ühendÜhendeison rauaoksüdatsiooniasteII või III, viimane neist on keemiliselt stabiilsem. Kuigi tavaliselt on raua oksüdatsiooniaste +2 või +3, võib see harvem olla ka -4, -2, -1, 0, +1, +4, +5, +6, +7.
Rauaaatomituumanukleonideseoseenergiaon üks kõrgemaid.56Fe ja58Fe tuumade seoseenergiast nukleoni kohta on suurem üksnesnikli(62Ni) aatomituuma seoseenergia. Vaata katuuma seoseenergia kõverat.
Raua füüsikalised ja keemilised omadused[muuda|muuda lähteteksti]
Füüsikalised omadused[muuda|muuda lähteteksti]



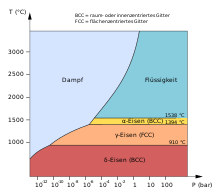

Keemiliselt puhas raud onhõbevalgesuhteliselt pehme (keskmise kõvadusega)plastilineüsna kergesti reageeriv metalltihedusega7,873 g/cm³,sulamistemperatuuriga1539±1 °C (ülipuhas raud heeliumis atmosfäärirõhul[1][2]) jakeemistemperatuuriga3070 °C.[3]Tehniliselt puhas raud sulab temperatuuril 1534±2 °C.[2]Võrreldes ülipuhta rauakeemistemperatuuriga,mis arvutatakse aururõhu järgi,[4]on tehniliselt puhta raua keemistemperatuur selgelt madalam (2860 °C),[5],kusjuures kirjanduses antud väärtused on omavahel selgelt lahknevad.[6][7][8]Vaakumisrõhuall alla 10–5mmHgsublimeerubraud temperatuuril 1100–1200 °C.[6]
Keskmise rauaaatomi mass on umbes 55 korda suurem kuivesinikuaatomil.Raua [isotoop|isotoobi]]56Feaatomituumalon üks suuremaidmassidefekteja seega kõikide aatomituumade seas üks suuremaidseoseanergiaidnukleonikohta. Selle pärast vaadeldakse teda lõppastmenatähtedestoimuvasnukleosünteesis.Absoluutselt suuri massidefektiga on siiski62Ni,millele järgneb58Fe, ja alles kolmandal kohal on56Fe.[9][10]
Toatemperatuurilon puhta raua ainuke stabiilneallotroopne[[polümorfne teisend]α-raudehk ferriit. See teisend kristalliseerubruumkesestatud kuubilisse võresse(volframitüüp))kristallograafilises rühmasnr 229võreparameetrigaa = 286,6 pm ja kahevalemiühikugaühikrakukohta. See teisend on 910 °C-st madalamal temperatuuril stabiilne. Sellest temperatuurist kõrgemal muutub taγ-modifikatsiooniksehk austeniidiks. Sellel onpindkesestatud kuubiline võre(vasetüüp) kristallograafilise rühmaga nr 225 ja võreparameetriga a = 364,7 pm.[11]
Artikli kirjutamine on selles kohas pooleli jäänud.Jätkamineon kõigile lahkesti lubatud. |
Lisandid muudavad raua kõvemaks.
Raud onplastiline,mistõttu seda on võimalikvaltsidajasepistada.Raud on heasoojus- jaelektrijuht.
Magnetomadused[muuda|muuda lähteteksti]
Raud onmagneeditav.Rauakristallvõremuutub eri temperatuuridel.
Keemilised omadused[muuda|muuda lähteteksti]
Raud on keskmise aktiivsusega metall (asubmetallide elektrokeemilise pingereakeskpaiga lähedal). Kuivas õhus ta hapnikuga ei reageeri, kuid niiskuses kattub kergesti roostekihiga. Mida lisanditevabam on metall, seda püsivam on takorrosioonisuhtes.
Rauasoolad[muuda|muuda lähteteksti]
Raud(II)sooladest on kõige tähtsamraud(II)sulfaat-vesi (1/7) (FeSO4*7H2O), mida rahvapäraselt nimetatakseraudvitrioliks.See on heleroheline vees lahustuv kristalne aine. Raud(II)sulfaat saadakse raua reageerimisel lahjendatudväävelhappega:
Fe + H2SO4= FeSO4+ H2
Raud(II)sulfaati kasutataksetaimekahjuritetõrjevahendina,värvainetesjatindisaamisel, kuid kapuiduimmutuslahustevalmistamiseks, et kaitsta puitu mädanemise eest.
Raud(III)sooladest on olulisemadraud(III)kloriid(FeCl3) jaraud(III)sulfaat(Fe2(SO4)3).
Raud(III)kloriidi võib saada vastavate lihtainete otsesel reageerimisel ja raud(III)oksiidi või -hüdroksiidi reageerimiselvesinikkloriidhappega:
Fe2O3+ 6HCl = 2FeCl3+ 3H2O
Fe(OH)3+ 3HCl = FeCl3+ 3H2O
Kasutades vesinikkloriidhappe asemel väävelhapet, saadakse raud(III)sulfaat:
2Fe(OH)3+ 3H2SO4= Fe2(SO4)3+ 6H2O
Raud(III)kloriidi ja –sulfaati kasutataksereaktiividenakeemialaborites.
VIII rühma kõrvalalarühma metallid[muuda|muuda lähteteksti]
Erinevalt perioodilisussüsteemi teistest rühmadest on VIII rühma kõrvalalarühmas elemendid kolmekaupa, triaadides. Rauatriaadi kuuluvad raud,koobaltjanikkel.Kaks järgmist triaadi sisaldavad plaatinametalle: 1) kergete plaatinametallide triaad –ruteenium,roodiumjapallaadium,2) raskete plaatinametallide triaad –osmium,iriidiumjaplaatina.
Rauasulamid[muuda|muuda lähteteksti]


Rauasulamiomadusi mõjutab oluliselt süsinikusisaldus.Terason rauasulam, milles on alla 2% süsinikku. Kui süsiniku sisaldus on 2–5%, siis on tegemistmalmiga.Kõrvuti süsinikuga sisaldub terases ja malmis veel lisandinaväävlit,räni,fosforit,mangaanijt elemente.
Eriterasedehklegeeritud terasedsisaldavad lisandina mangaani, kroomi, niklit,molübdeeni,volframitjt metalle. Kroomilisand (kuni 13%) muudab terase korrosioonikindlaks ja suurendab kõvadust, Mo ja W suurendavad terase kuumakindlust, Mn (kuni 14%) tõstab terase kulumiskindlust, Ni suurendab terase sitkust ja vähendab soojuspaisumist, sellepärast valmistatakse sellest sulamist mõõteriistade osi, Cr ja Ni koos suurendavad terase kõvadust ja püsivust keemilistele mõjutustele.
Rauamaaki töödeldakse malmiks kõrgahjudes, erilistes konverterites vähendatakse malmis süsiniku ja teiste lisandite sisaldust ning saadakse teras.
Eristataksevalu- jatöötlusmalmi.Valumalmis sisaldub süsinik grafiidina. Et selle malmi murdepind on hall, nimetatakse seda sageli halliks malmiks. Valumalm on hästi valatav, sellest valatakse näitekshoorattaid,seadmete aluseid japliidiraudu.Töötlusmalm sisaldab süsinikkuraudkarbiidiFe3C kujul. Niisuguse malmi murdepind on hele ja teda nimetatakse tihti valgeks malmiks. Töötlusmalm ei sobi valamiseks ja seda töödeldakse teraseks.
Raud looduses[muuda|muuda lähteteksti]
Raud on looduses laialt levinud element. Maakoores on rauda 6,2%. Selle näitaja järgi on raud neljas element maakoores. Raud on levinud kakosmoses.MeiePäikesesüsteemirauarikkamadplaneedidonMerkuurjaMarss.
Lihtainena esineb rauda niimaailmaruumistMaale langenudmeteoriitideskui kamagmakivimeis.Maa metalliline tuum sisaldab rauda. Meteoriitset rauda hakkas inimkond arvatavasti ka esimesena kasutama. Suurem osa rauast on maakoores ühenditena.
Rauaühendeid, mida kasutataksemalmijaterasetootmisel, nimetatakserauamaakideks.Maagi kaevandamisel saadakse koos rauaühenditega kakivimeidjamineraale,mis rauamaagi töötlemisel pole enamasti vajalikud. Selliseid jääkaineid nimetatakseaheraineteks.
Tähtsamad rauamaagid on järgmised.
- Punaneja pruun rauamaak sisaldavad põhiühendinaraud(III)oksiidi(Fe2O3), mis on hüdraaditudveemolekulidega(2Fe2O3,3H2O jt).
- Magnetiidipõhiosa moodustabtriraudtetraoksiid,mis on musta värvusega kristalne magnetiline aine. Magnetiit on kõige rauarikkam ja puhtam rauamaak. Suurim leiukoht maailmas onKurski oblast.
- Püriiti(FeS2) tavaliselt rauamaagina ei kasutata, sest väävel halvendab püriidist saadud rauasulamite kvaliteeti. Püriiti kasutatakseväävelhappetootmisel.
- Sideriitkujutab endastraudkarbonaati(FeCO3). Raudkarbonaat reageerib süsinikdioksiidi sisaldava veega, muutudes lahustuvaksraudvesinikkarbonaadiks:FeCO3+ H2O + CO2= Fe(HCO3)2
Raua saamine soomaagist[muuda|muuda lähteteksti]
 Pikemalt artiklisSoomaak
Pikemalt artiklisSoomaak
Eestis algas rauatootmine umbes 2000 aastat tagasi ja kestis arvatavasti kuni 18. sajandini[viide?].Raud oli ainus metall, mida Eestis sai toota kohalikust toorainest,soomaagist.See on tekkinud soistel aladel rauarikkast põhjaveest.
Tallinna teletorniehituse ajal1977.aastal avastatud sooraua leiukohas asub maak huumushorisondi all kohati kuni 0,7 m paksuse kihina, sisaldades kuni 40% rauda.
Eesti suurim muistne rauasulatuskeskus asus Põhja-SaaremaalTuiuküla lähistel, mida tuntakseTuiu Rauasaatme mägedena.1988. aastal tehti seal esimene katse esivanemate eeskujul soomaagist rauda sulatada, tulemuseks oli 680 g rauda, 1990 saadi seda juba rohkem kui kaks kilogrammi[viide?].
Rauasulatusahju kaks põhilist protsessi[viide?]:
2C + O2→ 2CO;... Fe2O3+ 3CO → rauamaagi taandamine → 2Fe + 3CO2
CaCO3→ CaO + CO2;... CaO + SiO2→ räbu teke → CaSiO3
Ajalugu[muuda|muuda lähteteksti]
Vanem kultuuriperioodpronksiaegläks väga aeglaselt ülerauaajaks.Mõnedel rahvastel, näiteks praeguseIndiaalal, kelle käsutuses oli kergesti sulatatavat rauamaaki, ei saa pronksi- ja rauaaega eristada.[12]Vase-ja pronksitootmisel lihtsatesselituskolletesjuhuslikult tekkinud rauaräbuoli suuresüsinikujaväävlisisaldusetõttuhaprad.Otse säärastes kolletes rauamaagist alates ajast umbes 2000 aastat eKr toodetud raud on üsna pehme,roostetabkergesti ning jääb seetõttuomadusteltpronksile (tinapronksile) alla. Raua eelised pronksi ees seisnesid eelkõige lihtsamas töötlemises. Alles siis, kui levistsementiitimineteraseks(näiteksKüproselumbes 1000 eKr) sai rauast paremmaterjalkui pronks.[13][14]Tõendeid raua kasutamisest eri kultuuridest arheoloogiliste leidudena on võrreldes pronksiga suhteliselt harva. Esiteks kasutati kõige vanematel aegadel vähe, teiseks kaldub raud niiske õhu käes, vees ja niiskes mullaskorrodeeruma,mistõttu paljud esemed ei säilinud (väga korrodeerunud tööriistad sulatati uuesti üles). Ainult erilised asjaolud või eseme suured mõõtmed takistasid eseme kaotsiminekut, nii et pronksiajast on säilinud ainult umbes 150 raudartefakti.[13][15]
Meteoriidiraua varaseim kasutamine[muuda|muuda lähteteksti]

Enne kui mitme kultuuri inimesed õppisid saama raudamaagist,kasutasid nad juba enne rauaaega tuntud ning spetsiifilise 5- kuni 15-protsendiliseniklisisaldusejärgi äratuntavatmeteoriidirauda.Harulduse tõttu oli see "taevakivi" (egiptusebj-n-pt[16]) väärtuslik ning seda töödeldi valdavalt kultusesemeteks ja eheteks. Nii leiti kahestVana-Egiptusedünastiateeelse ajahauast umbes 7,5-protsendilise niklisisaldusega ehtepärleid,[17]mis on dateeritud aega umbes 3200 eKr.[18]Samuti sai kinnitust ammune oletus, ethauapanusenevaaraoTutanchamonmuumiajuurest leitud pistoda (umbes 1350 eKr) oli valmistatud meteoriidirauast.[19]Vanas Riigiskasutati meteoriidirauda eelkõigeamulettidejasuuavamisrituaalimudeltööriistade valmistamiseks.[20]
Vanimad teadaolevad meteoriidirauast esemed pärinevadMesopotaamiast;sumeridnimetasid meteoriidiraudaurudu-an-bar'taevavask'. Muu hulgas leitiUristmeteoriidirauast (10,8% niklit) teraga ja kullatud käepidemega pistoda, mille valmistamine on dateeritud aega 3100 eKr.[21]
Raua valmistamine maagist[muuda|muuda lähteteksti]
 Pikemalt artiklisKõrgahi
Pikemalt artiklisKõrgahi
Vahemere maad ja Väike-Aasia[muuda|muuda lähteteksti]
Nähtavasti hakati ka niklivaba (maise päritoluga) rauda Mesopotaamias valmistama varajastel aegadel. Üks tõend selle kohta on niklivabast rauast teraga ja pronksist käepidemega pistoda (3000–2700 eKr), mis leitiEšnunnast(tänapäevaTell AsmarIraagis).[21]HetiitideülestähendusedḪattuša(praeguBoğazkale,varasem Boğazköy) Kesk-Anatoolias) nähtub, et rauda tunti juba kuningasAnittaajal (umbes 1800 eKr) ja rauda sulatati vähemalt ajast umbes 1300 eKr.[22][23]Ajavahemikul 1600–1200 eKr olihetiitide riigiseesrindlik rautehnoloogia, mis oli oluline tegur selle riigi mõju kasvus.[24][25][13]Hetiidid valmistasid rauast, mis oli alguses kaalu järgi kuni kaheksa korda kullast kallim,[26]alguses peamiselt ehteid.[27]Hilises hetiitide riigis oli raud juba nii levinud, et inventarinimekirjades ei mainitud seda enam mitte koosväärismetallidega,vaid koos vasega. Maisest rauast esemeidkeskmisestjahilisest pronksiajastei leidunud aga mitte ainult hetiitidel, vaid kaKreekajaKüprose,Jordaania,Liibanoni,IisraelijaEgiptusealadel.[13]Alates ajast 1200 eKr toodetiLevandisterast,st suurema süsinikusisaldusega rauda.[26]
Rauaaja algusLähis-Idaspaigutatakse üldiselt aastasse 1200 eKr – mitte sellepärast, et raud oleks sellest ajast alates olulist osa etendanud, vaid sellepärast, et pronksiaja kultuurid kukkusid väga lühikese aja jooksul kokku. Rauaaja esimesed sajandid olid "pime ajastu",mil paljud linnad hävitati,kaugkaubanduslakkas ja metallitootmine peaaegu lõpetati. Alles ajast umbes 700 eKr, kui kultuurid hakkasid toibuma, hakati rauda jälle sagedamini kasutama. Alates ajast umbes 1200. aastat eKr on selles piirkonnas tuntudDamaskuselinna järgi nimetatudDamaskuse teras,millel on väga suur süsinikusisaldus (umbes 1,5%) ja mille poleerimisel tuleb välja iseloomulik muster.
Vana-Egiptuses onrauasulataminetõestatud alles alates 6. sajandist eKr. Üks6. dünastia(2347–2216 eKr) aegne raualeid ühestAbydosehauast osutus niklivabaks ja seega maist päritolu olevaks; selle otstarvet ei õnnestunud välja selgitada, sest ese oli üleni läbi roostetanud.[17]Üks 1837. aastalCheopsi püramiidipilust ja dateeriti alguses4. dünastiaaega,[28]osutus aga uusaegseks esemeks.[29]
Halübeidpeeti rauametallurgia asjatundjateks. Nende järgi onvanakreka keelesnime saanud teras (chalybs) erinevalt tavalisest rauast (sideros).[30]Kõige varajasemad jäljed rauasulatamisest kreeklaste aladel on leitud rauaräbu näol ajast umbes 2000 eKrKreetaltAgía Triádast.[31]
Geraris(Palestiina) oli rauasulatamine tuntud umbes alates ajast 1000 aastat eKr (seda tõendavad rauasulatusahjud ja kohapeal valmistatud põllutööriistad.[30])
Artikli kirjutamine on selles kohas pooleli jäänud.Jätkamineon kõigile lahkesti lubatud. |
Vaata ka[muuda|muuda lähteteksti]
Viited[muuda|muuda lähteteksti]
- ↑Viitamistõrge: Vigane
<ref>-silt. Viide nimegaSwartzendruberon ilma tekstita. - ↑2,02,1Viitamistõrge: Vigane
<ref>-silt. Viide nimegaRoeseron ilma tekstita. - ↑Viitamistõrge: Vigane
<ref>-silt. Viide nimegaHolleman-Wibergon ilma tekstita. - ↑B. E. Hopkins. The Preparation and Properties of High-Purity Iron. –Metallurgical Reviews,1956, kd 1, nr 1, lk 117–155.
- ↑Michael F. Ashby, Hugh Shercliff, David Cebon.Materials,Elsevier Science 2013, ISBN=0-08-099435-0, lk 597-IA35.
- ↑6,06,1A. E. van Arkel, K. Lins.Reine Metalle,Springer Berlin Heidelberg 1939, lk 312.
- ↑W. Pepperhoff, M. Acet.Konstitution und Magnetismus des Eisens und seiner Legierungen,Springer: Berlin, Heidelberg 2000,ISBN 978-3-642-59765-7,ptk: Struktur des Eisens, lk 1–14.
- ↑Yiming Zhang, Julian R. G. Evans, Shoufeng Yang.'Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. –Journal of Chemical & Engineering Data,2011, kd 56, lk 328–337.
- ↑M. P. Fewell. The atomic nuclide with the highest mean binding energy. –American Journal of Physics,1995, kd 63, nr 7, lk 653–658.
- ↑G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The NUBASE evaluation of nuclear and decay properties. –Nuclear Physics,2003, kd A 729, 2003, lk 3–128.Täistekst.
- ↑François Cardarelli.Materials Handbook A Concise Desktop Reference,Springer Science & Business Media 2008,ISBN 978-1-84628-669-8,lk 65.
- ↑Jochen Stark, Bernd Wicht.Geschichte der Baustoffe,Vieweg Teubner Verlag 2013,ISBN 9783322928924,lk 106.
- ↑13,013,113,213,3Florian Neukirchen.Von der Kupfersteinzeit zu den Seltenen Erden – Eine kurze Geschichte der Metalle,Springer-Verlag 2016,ISBN 978-3-662-49347-2,lk 65.
- ↑H. Moesta.Erze und Metalle', Springer Berlin Heidelberg 2013,ISBN 978-3-540-16561-3,lk 65.
- ↑Vagn Fabritius Buchwald.Iron and Steel in Ancient Times,The Royal Danish Academy of Sciences and Letters 2005,ISBN 978-87-7304-308-0,lk 72.
- ↑Otto Johannsen.Geschichte des Eisens,3. trükk, Stahleisen: Düsseldorf 1953,ISBN 3514000026,lk 6.
- ↑17,017,1Otto Johannsen.Geschichte des Eisens,3. trükk, Stahleisen: Düsseldorf 1953,ISBN 3514000026,lk 38.
- ↑Thilo Rehren, Tamas Belgya, Albert Jambon, György Káli, Zs Kasztovszky, Zoltan Kis, Imre Kovács, Boglarka Maróti, Marcos Martinon-Torres, Gianluca Miniaci, Vincent Pigott, Miljana Radivojević, L. Rosta, László Szentmiklósi, Z. Szőkefalvi-Nagy. 5,000 years old Egyptian iron beads made from hammered meteoritic iron. –Journal of Archaeological Science,2013, kd 40, lk 4785–4792.doi:10.1016/j.jas.2013.06.002.Täistekst.
- ↑Daniela Comelli, Massimo D’orazio, Luigi Folco, Mahmud El-Halwagy, Tommaso Frizzi, Roberto Alberti, Valentina Capogrosso, Abdelrazek Elnaggar, Hala Hassan, Austin Nevin, Franco Porcelli, Mohamed G. Rashed, Gianluca Valentini. The meteoritic origin of Tutankhamun’s iron dagger blade. –Meteoritics & Planetary Science,2016, kd 51, nr 7.Täistekst.
- ↑Wolfgang Helck.Eisen.– Wolfgang Helck, Eberhard Otto (toim).Lexikon der Ägyptologie,kd 1, Harrassowitz: Wiesbaden 1975, vg 1209–1210.
- ↑21,021,1Johannsen1953-38 ">Otto Johannsen.Geschichte des Eisens,3. trükk, Stahleisen: Düsseldorf 1953,ISBN 3514000026,lk 408.
- ↑Otto Johannsen,Geschichte des Eisens,3. trükk, Stahleisen: Düsseldorf 1953,ISBN 3514000026,lk 44.
- ↑Jörg Klinger, J. David Hawkins.Herrscherinschriften und andere Dokumente zur politischen Geschichte des Hethiterreiches,Gütersloher Verlagshaus 2005, ISBN=978-3-641-21988-8.
- ↑Friedrich Cornelius.Grundzüge der Geschichte der Hethiter,5. trükk, WBG (Wissenschaftliche Buchgesellschaft) 1992,ISBN 978-3-534-06190-7.
- ↑Ünsal Yalcin. Zum Eisen der Hethiter. – Das Schiff von Uluburun, 2005.Täistekst.
- ↑26,026,1Charles Burney.Historical Dictionary of the Hittites. Historical Dictionaries of Ancient Civilizations and Historical Eras.,Scarecrow Press 2004,ISBN 0-8108-6564-5,lk 135–136.
- ↑Richard A. Gabriel.The Great Armies of Antiquity.Greenwood Publishing Group 2002,ISBN 0-275-97809-5,lk 75.
- ↑Howard Vyse.Operations carried on at the Pyramids of Gizeh in 1837,kd 1, Fraser: London 1840, lk 275–276.
- ↑Alfred Lucas, John R. Lucas.Ancient Egyptian Materials and Industries4. trükk, Arnold: London 1962, lk 237.
- ↑30,030,1Verein Deutscher Eisenhüttenleute:Gemeinfassliche Darstellung des Eisenhüttenwesens,17. trükk, Stahleisen: Düsseldorf 1970/71, lk 5.
- ↑Otto Johannsen.Geschichte des Eisens', 3. trükk, Stahleisen: Düsseldorf 1953,ISBN 3514000026,lk 45.
Välislingid[muuda|muuda lähteteksti]
| Vikisõnastiku artikkel:raud |
| Pildid, videod ja helifailid Commonsis:Raud |
| Tsitaadid Vikitsitaatides:Raud |
- Raud viib väsimustunde,buduaar.ee, 21. jaanuar 2008
- Arvi Lauringson:Kuidas soomaagist rauda saadi?
