Aldehido
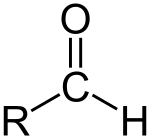

Aldehidoedoalkanalbat formilo talde bat duenkonposatu organikobat da.Formilo taldeatalde funtzionalbat da, R-CHO egiturarekin,karbonilobat zentroan (karbono atomo bat lotura bikoitzarekin oxigeno atomo batekin)hidrogenobati lotua etaR taldebatekin alboan[1].R talde hori edozeinalkiloizan daiteke. R gabeko taldearialdehido taldeaedoformilo taldeaizena ematen zaio. Aldehidoakzetonenezberdinak dira, karboniloakarbono eskeletoarenbukaeran jartzen delako, eta ez bi karbono atomoen artean. Aldehidoak oso ohikoak dirakimika organikoan.
Aldehidorik sinpleenaR-ren lekuanhidrogenoatomoa duenformaldehidoada.
Egitura eta loturak
[aldatu|aldatu iturburu kodea]Aldehidoen zentroan karbono lau bat dago eta karbono horren hibridazioa sp2da. Beraz, karbono-zentroa dute, oxigenoari loturiko lotura bikoitza eta hirogenoari loturiko lotura bakarra. Karbonoari loturiko hidrogenoaren lotura ez da gehienetan azidoa base konjokatuaren errosonantzia-estabilizazioagatik. Aldehido baten α-hidrogenoa askoz azidoagoa da alkano batena baino. (Aldehidoen Pka 17 inguruan dabil eta alkanoen azidotasuna 50 Pka inguruan)[2].
Azidotzea, formil-zentroaren elektroien erauzketaren kalitatearen edota base konjokatuaren enolatoko anioiak karga negatiboak deslokalizatzearen ondorioz gertatzen da.
Iturri naturalak
[aldatu|aldatu iturburu kodea]Aldehidoak naturan aurkitzen dira.Glukosa-karbohidratoa polihidroxaldehido bat da. Vainillina,banillazaporea ematen dion aldehidoa, naturan aurki dezakegun beste aldehido bat da.
Industriaren ikuspegitik, aldehido garrantzitsuenaformaldehidoada. Formaldehidoa usain pikantea du eta gastoxikobat da; gas hau oso erabilia da kantitate handietan industrianplastikotermoestableetako ekoizpenetarako. Formaldehidoa disoluzio batean dagoenean,ur-disoluziobatean,formoledo formalinatzat izendatzen da. Formalina edo formola desinfektatzaile gisan erabiltzen da etaehungintza-industrianehun-kontserbatzaile gisa.
Propietateak
[aldatu|aldatu iturburu kodea]Aldehidoen propietateak[3]jakiteko,molekulaosoa kontuan hartu behar da. Izan ere, bere propietateak molekularen araberakoak dira. Aldehido txikienak uretan disolbagarriak dira, adibidezformaldehidoaetaazetaldehidoaguztizdisolbagarriakdira. Aldehidoak airean degradatzen dira autodregradazioa deritzon prozesuaren bidez. Industriako aldehido garrantzitsuenak formaldehidoa eta acetaldehidoa dira oligomerizatzeko edota polimerizatzeko portaera konplexua dela eta. Aldehidoek, hidratatzeko joera dute.Oligomeroak,polimeroaketahidratoakjatorrizko aldehidoekin orekan daude.
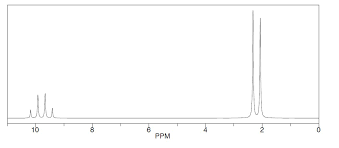
Aldehidoakmetodo espektroskopikoekinidentifikatzen dira.IR espektroskopiaerabiliz, C=O banda bat ageri da 1700 cm-1inguruan.1H NMR-ko espektroetan,formil -hidrogeno zentroak δH = 9 ingurukoakoa xurgatzen du,non, espektroaren zati bereizgarria egiten duen. Seinale honek akoplamendu ezaugarri bat erakusten du edozein alfa-karbonotako protoientzat. Kontuan hartu behar dira molekulan dauden besteatomoak.Izan ere,interakzioakdirela eta, bandak eskuinerago ala ezkerrerago desplaza daitezke.
-
Aldehido batek ematen dituen infragorri seinaleak
-
Azetaldehidoaren (etanala)1H-RMN espektroskopia
Propietate fisikoak
[aldatu|aldatu iturburu kodea]- Karbonilotaldearen lotura bikoitza alde batetiklotura kobalenteaeta beste alde batetiklotura ionikoaaurkezten du. Haukarbonilotaldearenpolarizazioadela eta sortzen da. Fenomeno honierresonantziaderitzo[4].
- Karbonilo bateko alfa-posizioan karbono sp3-ari hidrogeno bat loturik duten aldehidoekisomeria tautomerikoadaukate. Aldehidoakalkohol primarioarendeshidrataziotik lor daitezke, potasio permanganatoa (KMnO4) erabiliz.Zetonakere alkohol baten desidrataziotik lortzen dira, baina aldehidoak ez bezala,alkohol sekundariobatetik. Erreakzioa ahula izan behar da, izan ere, errekzioa bortzitza bada, azido karboxiliko bateraino doa.
- Gehiengo aldehidoak likido-fasean daude (12 karbono arterainoko aldehidoak); 12 karbonotik gorako aldehidoak solido-fasean agertzen dira.
- Aldehido guztiek ura baino dentsitate baxuagoa dute. Aldehido txikienak, formaldehidoa eta azetaldehidoa, uretan disolbagarriak dira. Baina, solubilitatea murrizten doa aldehidoaren tamaina handitzean; hau da, karbono gehiago izan ahala.
- Aldehidoek zetonek baino erreaktibotasun handiagoa dute.
Propietate kimikoak
[aldatu|aldatu iturburu kodea]- Erreaktibitateona aurkezten dute. Aldehidoek adizio, sustituzio eta kondentsazio erreakzioak dituzte.
- Erreduktoregisa jokatzen dute.
- Aldehidoen eta zetonen erreakzio tipikoena adizio nukleofilikoa da.
Nomenklatura
[aldatu|aldatu iturburu kodea]Aldehidoak, izendatutakoari -ala atzizkia gehietzen izendatzen dira. Aldehido sinpleenak metanala eta etanala dira bainaIUPACen izendatze estandarra ez dutenez betetzen beste izen batzuk dituzte.FormaldehidooaetaAzetaldehidoaerabiliagoak dira hurrenez hurren. Hurrengo aldehidoentzat serie homologo hau erabiltzen da: H-(CH2)n-CHO (n = 0, 1, 2, 3, 4,...).[5][6]
Dialdehidoak,bi aldehido talde-funtzionalekin osatutako molekula organikoak dira. Dialdehidoen nomenklatura idazterakoan, diala idazten da bukaeran, edota dialdehidoa[7][8].Glioxalada dialdehidorik sinpleena.
| Karbono-zenbakia | IUPACen nomenklatura | Nomenklatura tribiala | Formula | Irakite-puntua (°C) |
|---|---|---|---|---|
| 1 | Metanala | Formaldehidoa | HCHO | -21 |
| 2 | Etanala | Azetaldehidoa | CH3CHO | 20,2 |
| 3 | Propanala | Propionaldehidoa
Propilaldehidoa |
C2H5CHO | 48,8 |
| 4 | Butanala | n-Butiraldehidoa | C3H7CHO | 75,7 |
| 5 | Pentanala | n-Kaleraldehidoa
Amilaldehidoa n-Pentaldehidoa |
C4H9CHO | 103 |
| 6 | Hexanala | Kapronaldehidoa
n-Hexaldehidoa |
C5H11CHO | 100.2 |
| 7 | Heptanala | Enantaldehidoa
Heptilaldehidoa n-Heptaldehidoa |
C6H13CHO | 48.3 |
| 8 | Oktanala | Kaprilaldehidoa
n-OKtilaldehidoa |
C7H15CHO | ezezaguna |
| 9 | Nonanala | Pelargonaldehidoa
n-Nonilaldehidoa |
C8H17CHO | 62.47 |
| 10 | Dekanala | Kaprinaldehidoa
n-Dekilaldehidoa |
C9H19CHO | 10.2 |
Aldehidoak ordezko gisa agertzen badira, hau da, ez badira talde funtzional garrantzitsuenak, ez dira berdin izendatzen.
Sintesia
[aldatu|aldatu iturburu kodea]Alkohol primarioen oxidazioa
[aldatu|aldatu iturburu kodea]PCCa erabiliz, alkohol primarioa, aldehidora oxidatzen da.[9]
Alkenoen ozonolisia
[aldatu|aldatu iturburu kodea]Lehenik, ozonolosia egiten da eta, ondoren,erredukziobat. Agente erreduktoreak:Zn,Pd.[9]

Nitrilo-, ester- eta kloruro-azidoen erredukzioa
[aldatu|aldatu iturburu kodea]- Nitriloen erredukzioa: DIBAL-H erabiltzen da eta gerohidrolisiazidoa egiten da.
- Kloruro-azidoen erredukzioa: Tri-terc-butoxialuminioa eta litio hidruroa erabiltzen da. Erreakzio hau tenperatura hotzean egiten da.
- Esterraren erredukzioa: DIBAL-H erabiltzen da. Erreakzio hau tenperatura hotzean egiten da.[9]
Erreakzioak
[aldatu|aldatu iturburu kodea]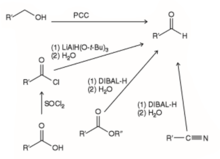
Aldehidoak oso erreaktiboak dira eta erreakzio askotan parte hartzen dute. Industria-ikuspegitik, erreakzio garrantzitsuenak: kondentsazioak, adibidez, plastifikatzaileak eta poliolak prestatzekoak direnak eta aldehidoen erredukzioetatik alkoholak lortzeko (batez ere "oxo alkoholak" ) erabiltzen direnak dira[3][10].
Oxidazioa
[aldatu|aldatu iturburu kodea]Formilo taldea erraz oxidatzen da dagokion talde karbonilikora (-COOH). Industrian gehien erabilitako oxidatzailea, oxigenoa edo airea da. Laborategian, berriz, KMnO4edo Ag2O erabiltzen da medio basikoan. Hauetaz gain, kromo (Vl) oxidoa, azido kromikoa edota azido nitrikoa erabiltzen dira[3].
Adizio nukleofilikoa
[aldatu|aldatu iturburu kodea]Nukleofilikoak erraz gehitzen dira karbonilo taldean. Produktuan, talde karboniloan dagoen karbonoa sp3hibridazioa izatera pasatzen da. Beraz, nukleofilora elkartzen da eta ondorioz oxigenoa protonatu egiten da[3].
Hidrogeno-zianuro adizio-erreakzioa
[aldatu|aldatu iturburu kodea]Aldehidoak hidrogenozianuroarekinerreakzionatzen du zianohidrina emateko[3].
Amina primarioen eta sekundarioen adizio-erreakzioa
[aldatu|aldatu iturburu kodea]- Amina primarioekin erreakzionatzen du (medio azidoan) imina emateko.
- Amina sekundarioekin erreakzionatzen du (medio azidoan) enamina emateko[3].
Erredukzioa
[aldatu|aldatu iturburu kodea]Hidruro metalikoen erredukzioen metodoa erabilgarriena da. Alkoholak lortzen dira.
- LiAlH4.Hurrengo konposatuen erredukzioa egiten du:aldehidoak,zetonak,azidoak(eta deribatuak),nitriloaketaalkil haluroak.Erreakzioetaneterraerabiltzen da disolbente bezala.
- NaBH4:Hurrengo konposatuen erredukzioa egiten du: aldehidoak eta zetonak.Disolbentebezalaetanolerabiltzen da[3].

Clemensen erredukzioa
[aldatu|aldatu iturburu kodea]Medio azidoan gertatzen da,Znamalgama erabiliz[3].

Witting erreakzioa
[aldatu|aldatu iturburu kodea]Aldehido eta iluro-fosforoarean arteko erreakzioak alkeno bat ematen du[3].

Hidrogenazioa
[aldatu|aldatu iturburu kodea]Aldehidoaren hidrogenazioakalkoholaematen du.KatalizatzailebezalaPt,NiedoPderabiltzen da[3].

Erabilerak
[aldatu|aldatu iturburu kodea]Aldehidoak hurrengo erabilerak izan ditzake[11]:
- Plastikoen fabrikazioan,erretxinaeta produktuakrilikoak[12].
- Argazki-industrian erabiliak dira koloratzaile etalehergaibezala (pentaeritrola,TNPE,..).
- Antiseptikoeta iraunarazle bezala oso ondo funtzionatzen dute.
- Herbizida,fungizidaetapestizidabezala erabili ohi dira.
- Bulkanizazioarenazelerazioan.
- Janari-industrian eta perfumeria-industrian.
- Ehungintza-industrian eta industria farmazeutikoan.
- % 40ko ur-disoluzioari formol deitzen diogu. Egurra,larrua etab. kontserbatzeko erabiltzen da.
- Etanalaispiluak fabrikatzeko erabiltzen da.
Dialdehidoak
[aldatu|aldatu iturburu kodea]Dialdehidoa bi aldehido-talde dituen konposatu kimiko organikoa da. Dialdehidoen nomenklaturak dial bukaera edo, batzuetan, dialdehidoa du. Dialdehido alifatiko laburrei diazidoa deritze batzuetan, zeinetatik baitatoz. Adibide bat butanediala da, succinaldehido (azido succinikotik) ere esaten zaiona.
Biokimika
[aldatu|aldatu iturburu kodea]Aldehido batzuk aldehido-deshidrogenasaren entzimen substratuak dira, gorputzean aldehidoak metabolizatzen dituztenak. Badira zenbait aldehidori lotutako toxikotasunak, gaixotasun neurodegeneratiboekin, bihotzeko gaixotasunekin eta minbizi mota batzuekin zerikusia dutenak[13].
Aldehidoen adibideak
[aldatu|aldatu iturburu kodea]- Formaldehidoa
- Azetaldehidoa
- Propionaldehidoa
- Butiraldehidoa
- Isovaleraldehidoa
- Bentzaldehidea
- Cinamaldehidoa
- Bainilina
- Tolualdehidoa
- Furfurala.
- Erretinaldehidoa
- Glicolaldehidoa
Dialdehidoen adibideak
[aldatu|aldatu iturburu kodea]Erreferentziak
[aldatu|aldatu iturburu kodea]- ↑IUPAC Gold BookAldehidoak
- ↑Eames, Jason, ed. (2010-09-15).Acid-Base Properties of Enols and Enolates.John Wiley & Sons, LtdISBN9780470682531.(Noiz kontsultatua: 2018-12-13).
- ↑abcdefghijGraham., Solomons, T. W.. (2011).Organic chemistry.(10th ed.. argitaraldia) WileyISBN9780470401415.PMC368018840.(Noiz kontsultatua: 2018-12-01).
- ↑1899-, Fieser, Louis Frederick,. (1985).Química orgánica fundamental.RevertéISBN8429171614.PMC54474518.(Noiz kontsultatua: 2018-12-13).
- ↑«R-5.6.1 Aldehydes, thioaldehydes, and their analogues»www.acdlabs.com(Noiz kontsultatua: 2018-12-13).
- ↑«R-5.7.1 Carboxylic acids»www.acdlabs.com(Noiz kontsultatua: 2018-12-13).
- ↑J., Leigh, G.. (2011).Principles of chemical nomenclature: a guide to IUPAC recommendations.RSC PubISBN9781849730075.PMC792762394.(Noiz kontsultatua: 2018-12-13).
- ↑«Nomenclature of Organic Chemistry. Section H: Isotopically Modified Compounds»IUPAC Standards Online2016-02-28(Noiz kontsultatua: 2018-12-13).
- ↑abcAlder, Roger W. (1985-01).«Advanced organic chemistry. reactions, mechanisms and structure. 3rd edition»Endeavour9 (4): 206.doi:.ISSN0160-9327.(Noiz kontsultatua: 2018-12-13).
- ↑John., McMurry,. (2004).Química orgánica.(6a ed. argitaraldia) International Thomson EditoresISBN9706863540.PMC60693655.(Noiz kontsultatua: 2018-12-13).
- ↑(Ingelesez)Reuss, Günther; Disteldorf, Walter; Gamer, Armin Otto; Hilt, Albrecht. (2000).«Formaldehyde»Ullmann's Encyclopedia of Industrial Chemistry(American Cancer Society)doi:.ISBN9783527306732.(Noiz kontsultatua: 2018-12-13).
- ↑(Ingelesez)Kohlpaintner, Christian; Schulte, Markus; Falbe, Jürgen; Lappe, Peter; Weber, Jürgen. (2008).«Aldehydes, Aliphatic»Ullmann's Encyclopedia of Industrial Chemistry(American Cancer Society)doi:.ISBN9783527306732.(Noiz kontsultatua: 2018-12-13).
- ↑(Ingelesez)Chen, Che-Hong; Ferreira, Julio Cesar Batista; Gross, Eric R.; Mochly-Rosen, Daria. (2014-01).«Targeting Aldehyde Dehydrogenase 2: New Therapeutic Opportunities»Physiological Reviews94 (1): 1–34.doi:.ISSN0031-9333.PMID24382882.PMCPMC3929114.(Noiz kontsultatua: 2023-02-11).