Urre
| Urrea | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 79 Platinoa ← Urrea → Merkurioa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ezaugarri orokorrak | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izena, ikurra, zenbakia | Urrea, Au, 79 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie kimikoa | Trantsizio-metalak | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Taldea, periodoa, orbitala | 11, 6, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atomikoa | 196,96655 g/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Konfigurazio elektronikoa | Xe 4f14 5d10 6s1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektroiak orbitaleko | 2, 8, 18, 32, 18, 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietate fisikoak | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Egoera | solido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dentsitatea | (0 °C, 101,325 kPa) 19300 g/L | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Urtze-puntua | 1337,33 K (1064,18 °C, 1947,52 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Irakite-puntua | 3129 K (2856 °C, 5173 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Urtze-entalpia | 12,55 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Irakite-entalpia | 324 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bero espezifikoa | (25 °C) 25,418 J·mol−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Lurrun-presioa
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietate atomikoak | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristal-egitura | kubikoa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidazio-zenbakia(k) | 3, 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegatibotasuna | 2,54 (Paulingen eskala) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionizazio-potentziala | 1.a: 890,1 kJ/mol 2.a: 1980 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Erradio atomikoa (batezbestekoa) | 135 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Erradio atomikoa (kalkulatua) | 174 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Erradio kobalentea | 144 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waalsen erradioa | 166 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Datu gehiago | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Eroankortasun termikoa | (300 K) 318 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soinuaren abiadura | (298,15 K) 317,5 m/s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopo egonkorrenak | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Urrearen isotopoak
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

Urrea elementu kimiko bat da, Au ikurra (Aurum, latinezko izena) eta 79 zenbaki atomikoa dituena. Haren forma puruan, metal distiratsua da, kolore hori gorrixkakoa, trinko, leun, xaflakorra eta harikorra. Kimikoki, urrea trantsizioko metala da, 11. taldekoa. Erreaktibotasunik txikiena duen elementu kimikoetako bat da, eta baldintza estandarretan solidoa da. Urrea, sarri, oinarrizko forma librean (natiboa) agertzen da, pipita edo alea modura, arroketan, meatan eta alubioi-deposituetan. Soluzio solidoa eratzen du zilar puruarekin (elektrum esaten zaio) eta, bestalde, aleazio naturalak sortzen ditu kobrearekin eta paladioarekin.
Urrezko konposatu mineralak ez dira hain ohikoak: agertzen direnean, telurioarekin batera da.
Azido gehienekiko erresistentea da, aqua regiatan (azido nitriko eta azido klorhidriko nahastea) disolbatzen den arren: anioi tetrakloroaurato disolbagarri bat eratzen duena. Azido nitrikotan disolbaezina da, nitrikoak zilarra eta metal arruntak disolbatzen baditu ere. Metal hori fintzeko eta objektu metalikoetan urrea dagoela egiaztatzeko, propietate hori denbora luzez erabili izan da: horrek azido-proba terminoa sortu due. Zianuro disoluzio alkalinoetan ere disolbatzen da, eta propietate hori meatzaritzan eta galbanoplastian erabiltzen da. Halaber, merkuriotan disolbatzen da, eta amalgama aleazioak eratzen ditu, baina hori ez da erreakzio kimiko bat.
Elementu erlatiboki arraroa da, metal preziatua, eta historian zehar txanponak, bitxiak eta beste objektu batzuk egiteko erabili da. Iraganean, sarri, urre-patroi bat aplikatzen zen moneta-politikatzat, baina urrezko txanponak zirkulazioan zegoen txanpon gisan egiteari utzi zitzaion 1930eko hamarkadan, eta munduko urre-patroia diru fiduziarioko sistema batekin ordezkatu zen 1971ren ondoren.
Ezaugarri fisiko-kimikoak
[aldatu | aldatu iturburu kodea]Metal astuna da, 19,3 gr/cm3-ko dentsitatea du, eta dagoen metalik harikor eta xaflakorrena da: hainbesteraino, non mikrometro bateko xafletan ere bana daitekeen. 1.063 °C-an urtzen da, eta 2.600 °C-an lurruntzen. Urak eta aireak ez diote erasotzen, ezta azidoek ere; bai, ordea, oxidatzaile indartsuek (gai halogenoek, esate baterako). Beroaren eta elektrizitatearen eroale ona da. Aqua regiak erasotzen du osagarri duen kloroarengatik eta merkuriotan disolbatzen da.
Kimikoki, trantsizio-metal tribalente eta unibalentea da. Ez du erreakzionatzen konposatu kimiko askorekin, baina kloroak, fluorrak, aqua regiak eta zianuroak eraso egiten diote. Ez da azido nitrikotan disolbatzen, zilarra eta metal basikoak bezala. Hain zuzen, urrea birfintzeko teknika baten oinarria ezaugarri horixe da. Azido nitrikoa urrearen presentzia egiaztatzeko erabili izan da, eta lagunartean erabiltzen den "azidoaren testa" terminoa, zerbaitek benetako balioa daukala adierazteko erabiltzen dena, hortik dator.
Naturan, maizenik hondarrarekin nahasturik edo zainetan agertzen da. Arazketa eta amalgamazio bidez lortzen da, eta elektrolisiaren bidez garbitzen.
Urrea metalen artean harikorrena da, hau da, deformagarriena. Horrek esan nahi du plastikoki deforma daitekeela, hautsi gabe. Horrela, urre atomo bakarra duen haria izanez gero, erraz luza daiteke, eta nanokable bat sor daiteke[1]. Nanokable horiek itxura alda dezakete dislokazioen eraketaren, orientazioaren eta migrazioaren bidez[2][3]. Urre gramo bakar batekin metro karratu bat duen orri fin bat lor daiteke. Horrela, urre-orria ia garden bihur daiteke.
Kolorea
[aldatu | aldatu iturburu kodea]
Metal gehienak grisaxkak izaten dira, edota zilarraren antzeko kolorekoak, baina urrea, ostera, hori-gorrixka izaten da[4]. Kolore hori metalaren balentzia-elektroien artean gertatzen diren plasmaren oszilazioen maiztasunarekin lotuta dago guztiz. Izan ere, maiztasun horiek zonalde ultramorean daude metal anitzetan, baina urrearen kasuan, atomoaren inguruan dauden orbitalen gainean eragiten duten efektu erlatibisten ondorioz, ikusgaiaren zonaldean daude. Fenomeno hori Cesio metalaren kasuan ere gertatzen da eta urre kolorea ematen dio horri.
Urrearen aleazio asko ezagutzen dira eta bakoitzak kolore esanguratsu bat du. Horrela, urrea kobrearekin aleatzen denean, 24 kilateko urre arrosa deritzona eratzen da. Paladio edo nikelarekin aleatzen denean, aldiz, urre zuria sortzen da, bitxigintzan oso preziatua. 14 kilateko urre-kobre aleazioaren kolorea kobreak era ditzakeen beste aleazioenen antzekoa da. 14 kilateko urre-kobre aleazioa poliziaren intsignietan erabiltzen da, besteak beste. 14 eta 18 kilateko urre-zilar aleazioek, aldiz, hori-berdexkak izaten dira: hori dela eta, urre berde esaten zaie. Urrea burdinarekin elkartzen denean, urre urdina deritzona eratzen da. Urre purpura aluminioren bitartez sortzen da[5].
Bestalde, nahiz eta ez izan oso ohikoa, manganesoarekin, indioarekin edo beste elementu batzuekin aleatzen denean, urre kolore nahiko bereziak eman ditzake. Aleazio horiek oso erabilgarriak dira aplikazio anitzetan.
Aipatzeko modukoa da urre koloidalaren kolorea aldakorra dela esekiduran dauden partikulen arabera. Horrela, partikulen tamaina txikia denean, gorria da, eta tamaina handiagoa badute, berriz, urdina[6].
Ekonomia eta aplikazioak
[aldatu | aldatu iturburu kodea]Urre-xafla meheak erabiltzen dira halaber hainbat gauza urre kolorez apaintzeko, koadroen markoak eta liburuen azalak, esaterako. Elektrolisiaren bidez beste metalei urre kolorea emateko ere erabiltzen da, eta bai, besteak beste, osagai elektronikoak egiteko, zeramikagintzan, eta, 198 isotopo erradioaktiboa badu, minbiziaren kontra. Urrea garbia dela esaten da 24 kilate dituenean. Bitxigintzan erabiltzen diren aleazioek 10/24, 14/24 eta 18/24 erlazioa izaten dute urre-pisutan. Munduko urre-ekoizle nagusiak Hegoafrika, Errusia, Kanada, Estatu Batuak, Japonia eta Australia dira.
Antzinatik erabili izan da urrea txanponak egiteko. Erdi Aroan urre eskasia zela eta, zilarra nagusitu zen mendebalean, nahiz eta XVIII. mendean zilarrarekin batera erabili izan zen (bimetalismoa). XIX. mendeko azken urteetan eta XX. mendeko lehen urteetan urre-meategi berriak aurkitu ziren Kalifornian, Australian, Alaskan eta Transvaalen, besteak beste.
Urre-patroia
[aldatu | aldatu iturburu kodea]Urre-patroia edo Gold standard izenekoa Lehen Mundu Gerra amaitu ondoren bertan behera utzi zen. 1929ko krisiaren ondorioz izan ziren prezioen beherakaden ondoren, urrearen balioa areagotu egin zen, eta haren ekoizpena asko handitu. Estatu Batuak urre-erosle nagusi bilakatu ziren; hala, 1934. urtean 35 dolarretan finkatu zuten urre-ontza bakoitzeko prezioa, eta prezio hartan edozein urre kopuru erosteko edo saltzeko konpromisoa hartu zen. 1971. urtetik aurrera urrearen eta dolarraren trukagarritasuna bertan behera utzi zen, eta 1974. urtean, lehen petrolio-krisia izan zenean, alegia, urrearen prezioa ontzako 200 dolarrera igo zen. Gaur egun, banku zentralen erreserba aktibo nagusietakoa da, eta salerosketa batik bat Zurich eta Londresko merkatuetan egiten da.
Kimika
[aldatu | aldatu iturburu kodea]
Nahiz eta urrea metal nobleetan nobleena den[7][8], beste konposatu ugarirekin erreakziona dezake. Urre-konposatuetan oxidazio-egoera -1etik +5era doa, baina Au(I) eta Au(III) dira gehienetan agertzen direnak. Au(I), oxidazio-egoera ohikoena da estekatzaile bigunekin dagoenean, hala nola, tioeterrekin, tiolatoekin eta fosfina tertziarioekin dagoenean. Au(I) duten konposatuak normalean linealak dira. Adibide ona da Au(CN)2-, zeina meatzaritzan aurkitutako urrearen forma solugarria den. Urrezko haluro bitarrek, AuCl esaterako, kate polimeriko sigi-sagatsuak eratzen dituzte, eta berriro ere koordinazio lineala azaltzen dute. Urrean oinarritutako farmako gehienak Au(I)-ren konposatuak dira[9].
Au(III) oxidazio-egoera ohikoa da, eta urre(III) kloruroa, Au2Cl6, da horren erakusgarri. Urre atomoa Au(III) konplexuetan dago zentratuta, beste d8 konposatuak bezala, normalean karratu lauak dira, eta izaera kobalente eta ionikoa duten lotura kimikoak dituzte.
Urreak ez du oxigenoarekin erreakzionatzen tenperatura edozein dela ere[10], eta 100 oC-tik gora, ozonoaren erasoarekiko erresistentea da[11].
Halogeno aske batzuek urrearekin erreakzionatzen dute baldintza jakin batzuetan[12]. Urreak fluorraren erasoa jasaten du tenperatura altuetan, eta urre(III) fluoruroa eratzen du[12]. Urre-hautsak kloroarekin erreakzionatzen du 180 °C-an, eta AuCl3 eratzen du. Urreak bromoarekin erreakzionatzen du 140 °C-an eta urre(III) bromuroa eratzen du. Baina iodoarekin oso motel erreakzionatzen du, eta monoioduroa eratzen du.
Sufrearekin ez du zuzenean erreakzionatzen[13], baina urre(III) sulfuroa era daiteke hidrogeno sulfuro, urre (III) kloruro edo azido klorauriko disoluzio batekin nahastuz gero.
Giro-tenperaturan azkar disolbatzen da merkurioarekin, eta amalgama bat eratzen du; tenperatura altuagoetan, aldiz, aleazioak ematen ditu beste zenbait metalekin. Aleazio horiek zenbait propietate metalurgiko eraldatzeko asmoz ekoizten dira, hala nola, gogortasuna, urtze-puntua edota kolorea aldatzeko[5].
Urreak ez du azido gehienen eragina nabaritzen. Ez du erreakzionatzen ez azido hidrofluorikoarekin, ez hidroklorikoarekin, ez hidrobromidrikoarekin, ezta hidroiodiko, sulfuriko edo nitrikoarekin ere. Aitzitik, azido selenikoarekin erreakzionatzen du, eta aqua regiatan disolbatzen da. Azido nitrikoak metala +3 ioira oxidatzen du, baina soilik minutu batzuetarako. Azido puruan ez ohi da detektagarria izaten, erreakzioaren ioien oreka kimikoa dela eta. Hala ere, azido hidroklorikoak ioiak orekatik kendu, eta AuCl4− ioiak edo azido kloroaurikoa sortzen ditu.
Baseekin ere antzera gertatzen da, eta urreak ez du horien eraginik jasaten. Ez du erreakzionatzen sodio eta potasio hidroxido urtsu, solido edo urtuekin. Hala ere, sodio eta potasio zianuroarekin erreakzionatzen du baldintza alkalinoetan, oxigenoa dagoenean, eta konplexu disolbagarriak eratzen dira[13].
Esan bezala, urrearen oxidazio-egoera ohikoenak +1 (urre (I) edo konposatu aurosoak) eta +3 (urre(III) edo konposatu aurikoak) dira. Urre-ioiak erraz erreduzitzen eta hauspeatzen dira metal modura, beste edozein metal agente erreduktore bezala gehituz gero . Bestalde, gehitutako metala oxidatu eta disolbatu egiten da, eta posible izaten da urrea disoluziotik erauztea eta prezipitatu solido modura berreskuratzea.
Ekoizpena
[aldatu | aldatu iturburu kodea]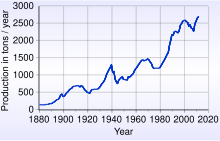
Urrearen Munduko Kontseiluak esan zuen, 2017 urtearen amaieran, “187.200 tona urre zeudela lurrazalean”. Azalera hori imajina dezakegu 21 metroko ertza duen kubo baten moduan adibidez[14]. 1.349 dolar balio du Troyako ontza bakoitzak eta, beraz, 8,9 bilioi dolar balioko lukete 187.200 tona karratuk. AEBko Zerbitzu Geologikoak esaten duenez, 2016an, 5.726.000.000 Troya ontza ( 178.000 tona) ekoizi dira hasierako zibilizaziotik, eta horietatik, % 85 oraindik erabiltzen ari dira gaur egun[15].
2017an, urre-ekoizpen handiena izan duen herrialdea Txina izan da 440 tonarekin. Bigarren ekoizle nagusiak, Australiak, 300 tona erauzi zituen urte berean, eta Errusiak 255 tona erauzi zituen[16].
Meatzaritza eta prospekzioa
[aldatu | aldatu iturburu kodea]1880ko hamarkadatik, Hegoafrika munduko urre-hornitzaile nagusietako bat izan da. Izan ere, zenbatzen den munduko urrearen % 22k Hegoafrikan du jatorria.
Hegoafrikaren ekoizpena 1970eko hamarkadan % 79koa izan zen, 1.480 tona kalkulatu zirelarik. 2007an, Txinak 276 tona ekoitzi zituen, eta, horrela, Hegoafrika gainditu zuen munduko urre-hornitzaile nagusi modura[17]. Hegoafrika urre-hornitzaile handiena ez zeneko lehenengo aldia izan zen[16].
2017an, meatzaritza-herrialde nagusia Txina izan zen, atzetik Australia, Errusia, AEB, Kanada eta Peru zituela. Hegoafrika, XX. mendean zehar urrearen hornitzaile nagusia izan zena, seigarren postura arte atzeratu zen.[10] Beste hornitzaile garrantzitsu batzuk Ghana, Burkina Faso, Mali, Indonesia eta Uzbekistan ziren, besteak beste.
Hego Amerikan,Txile eta Argentinaren mugaldeen artean, Pascua Lama proiektu eztabaidagarriak mendi altuen Atacamako basamortuaren zelai aberatsen ustiapena du helburu.
Gaur egun, oro har, gutxi gorabehera urre-horniduraren laurden bat artisau-meatzaritzatik edo eskala txikitik datorrela estimatzen da[18].
Johannesburgoko hiria, Hegoafrikan, Witwatersrand-ren urrearen sukarraren ondorioz sortu zen, eta historian erregistratu den urre-biltegi handienetakoa izan zen. Urrezko zelaiak Witwatersrand arroaren iparraldeko eta ipar-mendebaldeko ertzetara mugatzen dira, 5-7 kilometroko harri arkaikoen geruza lodi bat dena, toki gehienetan, Estatu Aske, Gauteng eta inguruko probintziaren sakonean kokatua[19]. Witwatersrandeko arroka hauek azalean daude ikusgai, Johannesburgo eta haren inguruetan, baina baita Johannesburgoko hego-ekialdeko eta hego-mendebaldeko adabaki isolatuetan ere, baita Witwatersrand arroaren erdialdetik gertu dagoen Vrefort kupularen inguruko arku batean ere[20][20]. Azaleko esposizio horietatik abiatuta, arroa asko murgiltzen da, eta, beraz, meatze-ustiapenaren zati bat ia 4.000 metroko sakoneran egin behar da, eta horrek, bereziki Johannesburgoko hego-mendebaldean dauden Savuka eta TauTona meategiak, lurreko-meategi sakonenak bihurtzen ditu. Urrea sei eremutan baino ez dago, non ipar eta ipar-mendebaldeko ibaiek harkaitzez txirikordatutako ibaien delta zabalak sortu zituzten, "Witwatersrand Itsasoan" itsasoratu aurretik, non Witwatersrandeko gainerako sedimentuak metatu ziren.[20]
Britainiar Inperioa eta Afrikaner Boersen arteko 1899-1901eko Bigarren Guda, neurri batean behintzat, meatzarien eskubideek eta Hegoafrikako urre-aberastasunen jabetzak eragin zuten.
XIX. mendean zehar, urrearen sukarra gertatzen hasi zen urre-biltegi handiak aurkitzen zirenean. Lehengoz dokumentatutako urre-aurkikuntza Estatu Batuetan Reed urrezko hobian Georgeville-tik hurbil, 1803an Ipar Karolinan egin zen. Estatu Batuetako lehenengo urre-aurkikuntza garrantzitsua Georgiaren iparraldean gertatu zen, Dahlonega izeneko hiri txiki batean[21]. Urrearen sukar gehiago gertatu ziren Kalifornian, Coloradon, Black Hills-en, Otago Zelanda Berrian, Australiako hainbat zonaldetan, Hegoafrikako Witwatersrand-en eta Kanadako Klondike-n.
Kutsadura
[aldatu | aldatu iturburu kodea]Urrearen ekoizpenak kutsadura handia sortzen du[22][23].
Lege baxuko urre mineralak metalaren ppm bat baino gutxiago izan dezake; mineral hori ehotu egiten da eta sodio zianuroarekin nahasten da urrea disolbatzeko. Zianuroa substantzia kimiko pozoitsua da, eta kontzentrazio txikietan, izaki bizidunak hil ditzake.
Urre meategietako zianuro-isuriak[24] herrialde garatuetan nahiz garapen bidean dauden herrialdeetan gertatu dira eta, ondorioz, kaltetutako ibaien tarte luzeetan ur-inguruneko bizitza desagertu da. Ingurumen alorreko adituen ustez, gertaera horiek ingurumen-hondamendi garrantzitsuak dira. [25][26]Erabilitako hogeita hamar tona mineral hondakin gisa isurtzen dira urrezko ontza troy bat sortzeko. [27]Urre-mineralaren zabortegiak elementu astun askoren iturri dira: kadmioa, beruna, zinka, kobrea, artsenikoa, selenioa eta merkurioa.
Mineral-biltegi horietan sulfuroa duten mineralak airearekin eta urarekin kontaktuan jartzen direnean, sulfuroa azido sulfuriko bihurtzen da, eta, gainera, metal astun horiek disolbatu, eta azaleko eta lurpeko uretara igarotzea errazten da. Prozesu honi meatzearen drainatze azidoa deritzo. Urre mineralaren zabortegi horiek oso arriskutsuak dira epe luzera, eta hondakin nuklearren zabortegiak soilik dira hain arriskutsuak[27].
Iraganean ohikoa zen merkurioa erabiltzea mineralaren urrea berreskuratzeko, baina gaur egun merkurioaren erabilera eskala txikiko meatzari indibidualetara mugatzen da neurri handi batean. Merkurio-konposatuen kopuru txikiak uretara irits daitezke eta metal astunen kutsadura eragin dezakete. Merkurioa, orduan, giza elikadura-katean sar daiteke metilmerkurio moduan. Gizakiari merkurioz pozoitzeak kalte sendaezina eragiten dio garun-funtzioan.
Urrearen erauzketa energia asko kontsumitzen duen industria ere bada, meatze sakonetatik minerala atera eta mineral kopuru handia ehotzeko sortutako urre gramo bakoitzeko ia 25 kWh elektrizitate behar da[28].
Toxikotasuna
[aldatu | aldatu iturburu kodea]Urre metaliko purua (elementala) ez da ez toxiko ez narritagarria irensten denean[29], eta batzuetan, elikagaien apaingarri moduan erabiltzen da xafla finetan[30]. Urre metalikoa Goldschläger, Gold Strike eta Goldwasser alkoholdun edarietako gehigarria ere bada. Urre metalikoa elikagai-gehigarri moduan onartuta dago Europar Batasunean (E175 Codex Alimentariusean). Urre-ioia toxikoa den arren, urre metalikoa elikadura-gehigarri gisa onartzearen arrazoiak dira giza gorputzean gertatzen diren prozesu kimiko ezagunekiko duen inertzia kimiko erlatiboa, korrosioarekiko erresistentzia eta gatz disolbagarri (urre-konposatu) bihurtzeko erresistentzia.
Konposatu disolbagarriak (urre-gatzak), hala nola urre kloruroa kaltegarriak dira gibelerako eta giltzurrunentarako. Urre zianuroaren gatz arruntak toxikoak dira zianuro- eta urre-edukiaren ondorioz, adibididez, urrezko galbanoplastian erabiltzen den urre eta potasio zianuroa. Zenbait kasutan pozoitze hilgarriak gertatu dira urre eta potasio zianuroz[31][32]. Urrearen toxikotasuna murriztu daiteke dimercaprol bezalako kelatzaile batekin urre kelatoa sortuz.
American Contact Dermatitis Societyk urteko alergeno gisa proposatu zuen urre metala 2001ean; urrea ukitzeagatiko alergiek emakumeei eragiten diete nagusiki.[33] Hala ere, urrea indar gutxiko kontaktu-alergenoa da, nikela bezalako metalen aldean[34].
Aspergillus niger onddoaren lagin bat aurkitu zen, urrea erauzteko soluzio batetik hazten ari zena; ziano metal konplexuak zituela aurkitu zen, urrea, zilarra, kobrea, burdina eta zinka kasu. Onddoaren eraginak ere garrantzia du metal astunen sulfuroen disolbagarritasunean[35].
Esaerak
[aldatu | aldatu iturburu kodea]- Urruneko eltzea urrez, etxera orduko lurrez .
Erreferentziak
[aldatu | aldatu iturburu kodea]- ↑ (Ingelesez) Kizuka, Tokushi. (2008-04-01). «Atomic configuration and mechanical and electrical properties of stable gold wires of single-atom width» Physical Review B 77 (15): 155401. doi:. ISSN 1098-0121. (Noiz kontsultatua: 2020-11-27).
- ↑ (Ingelesez) Lah, Nurul Akmal Che; Trigueros, Sonia. (2019-12-31). «Synthesis and modelling of the mechanical properties of Ag, Au and Cu nanowires» Science and Technology of Advanced Materials 20 (1): 225–261. doi:. ISSN 1468-6996. PMID 30956731. PMC PMC6442207. (Noiz kontsultatua: 2020-11-27).
- ↑ (Ingelesez) Schmidbaur, Hubert; Cronje, Stephanie; Djordjevic, Bratislav; Schuster, Oliver. (2005-04). «Understanding gold chemistry through relativity» Chemical Physics 311 (1-2): 151–161. doi:. (Noiz kontsultatua: 2020-11-27).
- ↑ (Ingelesez) Encyclopædia of Chemistry, Theoretical, Practical, and Analytical, as Applied to the Arts and Manufacturers: Glass-zinc. J.B. Lippincott & Company 1880 (Noiz kontsultatua: 2020-11-27).
- ↑ a b «Gold Jewellery Alloys > Utilise Gold. Scientific, industrial and medical applications, products ,suppliers from the World Gold Council» web.archive.org 2008-06-19 (Noiz kontsultatua: 2020-11-27).
- ↑ Electron microscopy in microbiology. Academic Press 1988 ISBN 978-0-08-086049-7. PMC 852764500. (Noiz kontsultatua: 2020-11-27).
- ↑ (Ingelesez) Hammer, B.; Norskov, J. K.. (1995-07). «Why gold is the noblest of all the metals» Nature 376 (6537): 238–240. doi:. ISSN 0028-0836. (Noiz kontsultatua: 2020-11-27).
- ↑ (Ingelesez) Johnson, P. B.; Christy, R. W.. (1972-12-15). «Optical Constants of the Noble Metals» Physical Review B 6 (12): 4370–4379. doi:. ISSN 0556-2805. (Noiz kontsultatua: 2020-11-27).
- ↑ (Ingelesez) Shaw, C. Frank. (1999-09). «Gold-Based Therapeutic Agents» Chemical Reviews 99 (9): 2589–2600. doi:. ISSN 0009-2665. (Noiz kontsultatua: 2020-11-27).
- ↑ (Ingelesez) «Chemistry of Oxygen (Z=8)» Chemistry LibreTexts 2013-10-02 (Noiz kontsultatua: 2020-11-27).
- ↑ Handbook of corrosion data. (2nd ed. argitaraldia) ASM International 1995 ISBN 0-87170-518-4. PMC 32661013. (Noiz kontsultatua: 2020-11-27).
- ↑ a b Wiberg, Egon.. (2001). Inorganic chemistry. (1st English ed.. argitaraldia) Academic Press ISBN 0-12-352651-5. PMC 48056955. (Noiz kontsultatua: 2020-11-27).
- ↑ a b «Wayback Machine» web.archive.org 2004-11-10 (Noiz kontsultatua: 2020-11-27).
- ↑ (Ingelesez) «Gold supply» World Gold Council (Noiz kontsultatua: 2020-11-27).
- ↑ «Wayback Machine» web.archive.org 2019-02-09 (Noiz kontsultatua: 2020-11-27).
- ↑ a b «Gold Statistics and Information» www.usgs.gov (Noiz kontsultatua: 2020-11-27).
- ↑ (Ingelesez) MarketWatch, Laura Mandaro. «China pushes to top as world's largest gold miners» MarketWatch (Noiz kontsultatua: 2020-11-27).
- ↑ «Wayback Machine» web.archive.org 2016-01-26 (Noiz kontsultatua: 2020-11-27).
- ↑ Truswell, J. F.. (1977). The geological evolution of South Africa. Purnell ISBN 0-360-00290-0. PMC 3320675. (Noiz kontsultatua: 2020-11-27).
- ↑ a b c Palmer, Douglas. (2008-06-24). «T. McCarthy & B. Rubidge 2005. The Story of Earth & Life. A Southern African Perspective on a 4.6-Billion-Year Journey. 334 pp. Cape Town: Struik Publishers/Johnnic Publishing Group). Price 189.95 Rand (paperback). ISBN 1 77007 148 2.» Geological Magazine 145 (4): 602–603. doi:. ISSN 0016-7568. (Noiz kontsultatua: 2020-11-27).
- ↑ «Gold jewellery consumption by country-FACTBOX» web.archive.org 2012-01-12 (Noiz kontsultatua: 2020-11-27).
- ↑ Abdul-Wahab, Sabah; Marikar, Fouzul. (2012-01-01). «The environmental impact of gold mines: pollution by heavy metals» Open Engineering 2 (2) doi:. ISSN 2391-5439. (Noiz kontsultatua: 2020-11-27).
- ↑ (Gaztelaniaz) «Gold production and its environmental impact | Gold | Mining» Scribd (Noiz kontsultatua: 2020-11-27).
- ↑ (Ingelesez) Press, Associated. (2000-02-14). «Cyanide spill compared to Chernobyl's N-disaster» Deseret News (Noiz kontsultatua: 2020-11-27).
- ↑ «BBC News | EUROPE | Death of a river» news.bbc.co.uk (Noiz kontsultatua: 2020-11-27).
- ↑ «AM Archive - Cyanide spill second only to Chernobyl» www.abc.net.au (Noiz kontsultatua: 2020-11-27).
- ↑ a b (Ingelesez) PERLEZ, JANE; JOHNSON, KIRK. (2010-06-14). «Behind Gold's Glitter: Torn Lands and Pointed Questions (Published 2010)» The New York Times ISSN 0362-4331. (Noiz kontsultatua: 2020-11-27).
- ↑ (Ingelesez) Norgate, Terry; Haque, Nawshad. (2012-07). «Using life cycle assessment to evaluate some environmental impacts of gold production» Journal of Cleaner Production 29-30: 53–63. doi:. (Noiz kontsultatua: 2020-11-27).
- ↑ web.archive.org (Noiz kontsultatua: 2020-11-27).
- ↑ Louis, Catherine (Chemist). (2012). Gold nanoparticles for physics, chemistry and biology. Imperial College Press ISBN 1-84816-807-1. PMC 895709329. (Noiz kontsultatua: 2020-11-27).
- ↑ (Ingelesez) Wright, I. H.; Vesey, C. J.. (1986-09). «Acute poisoning with gold cyanide» Anaesthesia 41 (9): 936–939. doi:. ISSN 0003-2409. (Noiz kontsultatua: 2020-11-27).
- ↑ (Ingelesez) Wu, Ming-Ling; Tsai, Wei-Jen; Ger, Jiin; Deng, Jou-Fang; Tsay, Shyh-Haw; Yang, Mo-Hsiung. (2001-01). «Cholestatic Hepatitis Caused by Acute Gold Potassium Cyanide Poisoning» Journal of Toxicology: Clinical Toxicology 39 (7): 739–743. doi:. ISSN 0731-3810. (Noiz kontsultatua: 2020-11-27).
- ↑ (Ingelesez) Tsuruta, Kyoko; Matsunaga, Kayoko; Suzuki, Kayoko; Suzuki, Rie; Akita, Hirotaka; Washimi, Yasuko; Tomitaka, Akiko; Ueda, Hiroshi. (2001-01). «Female predominance of gold allergy: SHORT COMMUNICATIONS» Contact Dermatitis 44 (1): 48–49. doi:. (Noiz kontsultatua: 2020-11-27).
- ↑ «Ubiquitous nickel is named contact Allergen of the Year.(Skin Disorders) - Family Practice News | HighBeam Research» web.archive.org 2011-06-24 (Noiz kontsultatua: 2020-11-27).
- ↑ Singh, Harbhajan.. (2006). Mycoremediation : fungal bioremediation. Wiley-Interscience ISBN 0-470-05059-4. PMC 85784893. (Noiz kontsultatua: 2020-11-27).
