آمینو اسید
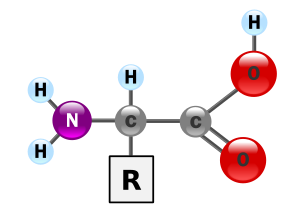
اسیدهای آمینهیاآمینواسیدهاترکیباتی آلیمتشکل ازگروههای عاملی،آمینووکربوکسیلیک اسیدهستند. بیش از ۵۰۰ آمینواسید در طبیعت وجود دارد. این ترکیبات را میتوان بر اساس مکان گروههای عاملی هسته، بهعنوان اسیدهای آمینه آلفا (α-)، بتا (β-)، گاما (γ-) یا دلتا (δ-) طبقهبندی کرد. مهمترین آنها آمینواسیدهای آلفا هستند. درزیستشیمیاسیدآمینههایی که در آنها گروههای آمینو و کربوکسیلیک اسید هر دو به کربنی یگانه چسبیدهاند، آمینواسید آلفا میگویند.
۲۲ اسیدآمینه آلفا واحدهای تشکیلدهندهپروتئینهستند. دستهبندی دیگر بر اساس قطبیت، یونیزاسیون و نوع گروه زنجیره جانبی (آلیفاتیک، غیر حلقوی، معطر، حاوی هیدروکسیل یا گوگرد و غیره) مربوط میشوند. اسیدهای آمینه در هنگام ساختهشدن پروتئینها طبقرمز ژنتیکیبر اساس الگویRNAیپک یا mRNA به یکدیگر میپیوندند. اسیدهای آمینه علاوه بر نقش در ساخت پروتئینها، در تعدادی از فرآیندها مانند انتقال پیامهای عصبی و بیوسنتز شرکت میکنند. گمان میرود که آنها نقش کلیدی درپیدایش حیاتروی زمین داشتهاند.
ساختار اسیدهای آمینه
[ویرایش]هر اسید آمینه، از یک کربن نامتقارن به نام کربن α تشکیل یافتهاست که با چهار گروه مختلفکربوکسیل(COOH) اتم هیدروژن، گروه آمینه بازی (NH۲-) و یک زنجیره غیر جانبی (R-) پیوند برقرار میکند. ریشه R ممکن است یک زنجیره کربنی یا یک حلقه کربنی باشد. عوامل دیگری مانندالکل،آمین،کربوکسیلو نیز گوگرد میتوانند در ساختمان ریشه R شرکت کنند.زنجیره جانبیخود چندین اتم کربن دارد و آنها را به ترتیبی که از کربن آلفا، فاصله میگیرند، با حروف بتا (β)، گاما (γ) و دلتا (δ) نشان میدهند. اگر در حالی که عامل COOH رویکربن آلفاقرار داد عامل NH۲ روی کربنهایی غیر آلفا قرار گیرد. نوع اسید آمینه به β، γ یا δ تغییر خواهد کرد. اسیدهای آمینه آزاد به مقدار بسیار ناچیز در سلولها وجود دارند. بیشتر اسیدهای آمینه آلفا در سنتز پروتئین شرکت میکنند، در صورتی که اسیدهای آمینه بتا، گاما و دلتا واسطههای شیمیایی هستند. بیشتر اسیدهای آمینه در pH هفت به صورت دو قطبی در میآیند یعنی گروه NH۲پروتونمیگیرد و گروه COOH هیدروژن خود را از دست میدهد و به صورت –COO- در میآید. زنجیره جانبی (گروه) R برای پروتئینها میتواند یکی از ۲۰ حالت مختلف ممکن باشد و بدین ترتیب یک الفبای بیست حرفی برای ساخت پروتئینها بهوجود میآید. این بیست اسید آمینه میتوانند با هر ترکیب و به هر تعداد در کنار هم آمده و به ساخت پروتئین منجر شوند.
هر آمینو اسید دارای چند کربن وگروه عاملیآمینو (nh2) و دارای (cooh) است
ایزومری در اسیدهای آمینه
[ویرایش]
مطابق قرارداد اگر ساختمان فضایی یک اسید آمینه را در نظر بگیریم، چنانچه عامل NH۲ که به کربن آلفا متصل است در طرف چپ باشد، میگوییم که این اسید آمینه از نوع L است و هرگاه عامل NH۲ در طرف راست کربن آلفا قرار گیرد، گوییم که این اسید آمینه از نوع D است. برخلاف قندهای طبیعی که از نوع D هستند، اسیدهای آمینه طبیعی همگی از نوع L هستند. اینایزومرهاینوری را ایزومرهایانانتیومرمیگویند. به جز سادهترین اسیدآمینه یعنیگلیسینهمهٔ آمینواسیدهای دیگر دارای انانتیومر یا ایزومرهای آینهای یا قرینه هستند؛ که به دلیل به وجود آمدنکربن نامتقارنیاکایرالدر آنها است.
ساختار و نماد تعدادی از اسیدهای آمینه
[ویرایش]بیست نوع اسید آمینه در تشکیل پروتئینها شرکت دارند. بر اساس گروه R متصل به آنها و در نتیجه خواص شیمیایی آنها، این بیست اسید به سه گروه تقسیم میشوند. این سه گروه عبارتند از:
- هیدروفوبیک
- قطبی
- باردار (مثبت و منفی)
در هریک از این دستهها میتوان زیر دستههایی با جزئیات بیشتر تعریف نمود. مانندسیکلیکیاآلیفاتیک، کوچک یا بزرگ، و غیره.
-
آلانین
(Ala / A) -
آرژنین
(Arg / R) -
آسپارژین
(Asn / N) -
اسید آسپارتیک
(Asp / D) -
سیستئین
(Cys / C) -
اسید گلوتامیک
(Glu / E) -
گلوتامین
(Gln / Q) -
گلیسین
(Gly / G) -
هیستیدین
(His / H) -
ایزولوسین
(Ile / I) -
لوسین
(Leu / L) -
لیزین
(Lys / K) -
متیونین
(Met / M) -
فنیل آلانین
(Phe / F) -
پرولین
(Pro / P) -
سرین
(Ser / S) -
ترئونین
(Thr / T) -
تریپتوفان
(Trp / W) -
تیروزین
(Tyr / Y) -
والین
(Val / V) -
سلنوسیستئین
(Sec / U) -
پیرولیزین
(Pyl / O)
جستارهای وابسته
[ویرایش]منابع
[ویرایش]- Murray, R.K., Granner, D.K., Mayes, P.A. and Rodwell, V.W., 2014.Harper’s illustrated biochemistry.Mcgraw-hill.
- آلبرت لنینگر، مایکل کاکس، دیویدلی نلسون (۱۳۸۵)،اصول بیوشیمی لنینجر، ترجمهٔ رضا محمدی، آییژ،شابک۹۶۴-۸۳۹۷-۰۵-۸
- Amino Acids and Peptides by G. C. Barrett and D. T. Elmore- Cambridge University Press, 1998- UK






















