Titaanidisulfidi
| Titaanidisulfidi | |
|---|---|
 |
|
| Tunnisteet | |
| CAS-numero | |
| PubChemCID | |
| Ominaisuudet | |
| Molekyylikaava | TiS2 |
| Moolimassa | 112,01 |
| Ulkomuoto | Kellanruskea kiteinen aine |
| Tiheys | 3,22 g/cm3[1] |
| Liukoisuusveteen | Ei liukene veteen |
Titaanidisulfidi(TiS2) elititaani(IV)sulfidiontitaani- jasulfidi-ionien muodostamaepäorgaaninenioniyhdiste.Yhdistettä voidaan käyttää elektrodimateriaalinalitliumioniakuissaja kiinteänä voiteluaineena.
Ominaisuudet
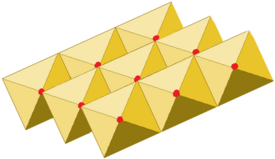
[muokkaa|muokkaa wikitekstiä]Huoneenlämpötilassa titaanidisulfidi on kellanruskeaa kiteistä ainetta. Yhdisteenalkeiskoppion heksagonaalinen. Aine on veteen liukenematonta, mutta liukenee kuumennettaessa happoliuoksiin, jolloin se myös hajoaa. Titaanidisulfidin rakenne muistuttaakadmiumjodidinrakennetta ja koostuu titaani- ja sulfidi-ionien muodostamista kerroksista. Alkalimetalli- ja maa-alkalimetallikationit sekä eräät orgaaniset anionit voivatinterkalatoituatitaani- ja sulfidi-ionikerrosten väliin.[1][2][3][4]
Valmistus ja käyttö
[muokkaa|muokkaa wikitekstiä]
Titaanidisulfidia voidaan valmistaa kuumentamalla titaanin ja rikin seosta. Tyypillisempi tapa on kuitenkintitaani(IV)kloridinjarikkivedynvälinen reaktio kuumassa posliinista valmistetussa putkireaktorissa.[1][2][3][4]
- TiCl4+ 2 H2S → TiS2+ 4 HCl
Ensimmäisenä titaanidisulfidin käyttöä litiumioniakkujen katodimateriaalina tutkiM. Stanley Whittingham[5].Litiumionit kykenevät interkalatoitumaan titaanidisulfidin kiderakenteeseen ja myös poistumaan siitä. Titaanidisulfidia elektrodimateriaalinaan käyttävät akut tuottavat suuren jännitteen. Kaupallisissa sovelluksissa titaanidisulfidin ovat kuitenkin korvanneet myöhemmin kehitetyt tehokkaammat materiaalit. Titaanidisulfidia voidaan käyttäämolybdeenidisulfidintavoin kiinteänä voiteluaineena.[1][2][3][6]
Lähteet
[muokkaa|muokkaa wikitekstiä]- ↑abcdTony Jones & Terry A. Egerton:Titanium Compounds, Inorganic, Kirk-Othmer Encyclopedia of Chemical Technology,John Wiley & Sons, New York, 2012.
- ↑abcThomas Scott, Mary Eagleson:Concise encyclopedia chemistry,s. 1111. Walter de Gruyter, 1994.ISBN 978-3110114515(englanniksi)
- ↑abcHeinz Sibum, Volker Güther, Oskar Roidl, Fathi Habashi, Hans Uwe Wolf & Carsten Siemers:Titanium, Titanium Alloys, and Titanium Compounds, Ullmann's Encyclopedia of Industrial Chemistry,John Wiley & Sons, New York, 2017.
- ↑abEgon Wiberg, Nils Wiberg, Arnold Frederick Holleman:Inorganic chemistry,s. 1333. Academic Press, 2001.ISBN 978-0-12-352651-9Kirja Googlen teoshaussa(viitattu 18.10.2019).(englanniksi)
- ↑Scientific Background on the Nobel Prize in Chemistry 2019: Lithium Ion BatteriesKungliga Vetenskaps Akademin. Viitattu 18.10.2019.(englanniksi)
- ↑Alvin J. Salkind, Martin Klein, Kathryn R. Bullock, John R. Pierson & Paul R. Gifford:Batteries, Secondary Cells, Kirk-Othmer Encyclopedia of Chemical Technology,John Wiley & Sons, New York, 2003.