Uraani
| |||||
| Yleistä | |||||
| Nimi | Uraani | ||||
| Tunnus | U | ||||
| Järjestysluku | 92 | ||||
| Luokka | Aktinoidi | ||||
| Lohko | f-lohko | ||||
| Ryhmä | - | ||||
| Jakso | 7 | ||||
| Tiheys | 19,05[1]· 103kg/m3 | ||||
| Kovuus | 6,0[2](Mohsin asteikko) | ||||
| Väri | hopeanharmaa | ||||
| Löytövuosi, löytäjä | 1789,Martin Heinrich Klaproth | ||||
| Atomiominaisuudet | |||||
| Atomipaino(Ar) | 238,02891[3] | ||||
| Atomisäde,mitattu (laskennallinen) | 175[4]pm | ||||
| Van der Waalsin säde | 186[1]pm | ||||
| Orbitaalirakenne | [Rn] 5f36d17s2 | ||||
| Elektronejaelektronikuorilla | 2, 8, 18, 32, 21, 9, 2 | ||||
| Hapetusluvut | +VI,+V, +IV, +III | ||||
| Kiderakenne | ortorombinen | ||||
| Fysikaaliset ominaisuudet | |||||
| Olomuoto | kiinteä | ||||
| Sulamispiste | 1 408[4]K(1 135°C) | ||||
| Kiehumispiste | 4 403[4]K (4 130 °C) | ||||
| Höyrystymislämpö | 420[1]kJ/mol | ||||
| Sulamislämpö | 8,520[4]kJ/mol | ||||
| Höyrynpaine | 1,19 · 10−6[2]Pa1 405 K:ssa | ||||
| Äänen nopeus | 3 155[1]m/s293,15 K:ssa | ||||
| Muuta | |||||
| Elektronegatiivisuus | 1,38[1](Paulingin asteikko) | ||||
| Ominaislämpökapasiteetti | 0,116 kJ/(kg K) | ||||
| Sähkönjohtavuus | 3,6 · 106[2]S/m | ||||
| Lämmönjohtavuus | 27,5[4]W/(m·K) | ||||
| CAS-numero | 7440-61-1 | ||||
| Tiedotnormaalilämpötilassa ja -paineessa | |||||
Uraanion alkuaine ja myrkyllinenraskasmetalli,jonka kaikki luonnossa esiintyvät ja keinotekoisetisotoopitovat radioaktiivisia, useimmitenalfa-säteilijöitä.Jaksollisessa järjestelmässä sen kemiallinen merkki on U (lat. uranium), järjestysluku 92 ja CAS-numero 7440-61-1. Merkittävimmät isotoopit ovat235Uja238U, jotka ovat234U:n ohella ainoat isotoopit, joita löydetään luonnosta. Luonnonuraaninsulamispisteon 1 135 °C jatiheys19 050 kg/m³.235U-isotooppia voidaan käyttääydinpolttoaineenaenergiantuotantoon jaydinaseidenvalmistamiseen.
Ominaisuudet
[muokkaa|muokkaa wikitekstiä]
Fysikaaliset ominaisuudet
[muokkaa|muokkaa wikitekstiä]Uraani on hopeanharmaametalli,joka on helpostitaottavaaja taipuisaa. Sen sulamispiste on 1 135 °C ja kiehumispiste 4 130 °C. Sen tiheys on 19,05 g/cm³, joka on suhteellisen suuri. Uraani onparamagneettinenja huonosähköjohde.[5][6][2]
Kemialliset ominaisuudet
[muokkaa|muokkaa wikitekstiä]Uraani kuuluuaktinoideihin.Se on kohtalaisen reaktiivinen metalli. Se reagoi hyvinepämetallien,kutenhapen,rikin,fosforinjahalogeenien,kanssa. Ilmassa metallinen uraani tummenee muodostaen oksidikerroksen.UraanidioksidiUO2on stabiilia ilmassa, ja se onkin tavallisesti muoto, jossa uraania hyödynnetään. Hienojakoinen uraani voi leimahtaa. Se reagoi myös veden kanssa. Se liukenee happoihin mutta ei emäksiin.[5][7][6]
Uraanilla on kolmeallotrooppistamuotoa. Alfamuoto on rombista ja stabiilia 667,7 °C:seen asti. Lämpötilavälillä 667,7–774,8 °C uraani on betamuodossa ja tetragoninen. Yli 774,8 °C:ssa uraani on gammamuodossa, jolloin senkiderakenneon tilakeskinen kuutio. Uraani on parhaiten työstettävissä gammamuodossa.[2]Alfamuodosta tuleesuprajohtavaa0,68 K:n lämpötilassa.[8]
Uraanin tavallisethapetusluvutovat +III, +IV, +V ja +VI, mutta se ei esiinny vesiliuoksissa vapaana hapetusluvuilla +V ja +VI, vaan ne hydrolysoituvat nopeasti jopa happamissa olosuhteissa. Samoin U3+hapettuu nopeasti vapauttaen vetyä vesiliuoksissa.[9]
Uraaninelektronikonfiguraatioon [Rn] 5f36d17s2.Sen ensimmäinenionisaatioenergiaon 597,6 kJ/mol.[10]
Yhdisteet
[muokkaa|muokkaa wikitekstiä]Uraanin yhdisteet ovat tyypillisesti vihreitä tai keltaisia. Uraani muodostaa hyvin monipuolisellastoikiometriallayhdisteitä hapen kanssa. Musta UO2on uraanin käytetyin muoto. Sitä käytetään muun muassa polttoaineissa. Lisäksi uraani muodostaa kelta-oranssiauraanitrioksidia(UO3,myös uranyylioksidi) ja vihreäätriuraanioktaoksidia(U3O8). Lisäksi uraani muodostaaperoksideja,kuten kidevedellistä UO4(UO3·H2O2·H2O). Kideveden määrä vaihtelee nollasta neljään. Nämä peroksidit ovat myös ainoita peroksideja, joita on löydetty mineraaleista. Uraani muodostaahydridinreagoidessaan noin 250 °C:n lämpötilassa olevan vedyn kanssa. Korkeammissa lämpötiloissauraanihydridi(UH3) hajoaa reversiibelisti. Tämän ominaisuuden ansiosta sitä käytetään muun muassakarbidienjanitridienlähtöaineena. UH3on pyroforista. Uraanikarbideja ja -nitridejä tunnetaan stoikiometrioilla UX2,UX3ja U2,X3,jossa X on C tai N. Karbideja voidaan muodostaa myös antamalla hiilen taihiilimonoksidinreagoida sulan metallisen uraanin kanssa. Nitridejä muodostetaan antamalla typen reagoida korkeassa lämpötilassa uraanin kanssa.[5][2][11]
Uraani muodostaa monipuolisesti yhdisteitähalidienkanssa.Kloorinkanssa se muodostaatri-,tetra-,penta-sekäheksakloridin.[12]Fluorinkanssa uraani muodostaa sekätetra-ettäheksafluoridin.Näistä heksafluoridia käytetään erityisesti uraanin väkevöinnissä. Se on voimakkaankorrosoivaaja reagoi kiivaasti veden ja öljyn kanssa.[2]
UraanyylinitraattiUO2(NO3)2on hyvin myrkyllistä. Uraani muodostaa sulfaatin UO2SO4.[2]
Uraani voi muodostaakompleksiyhdisteitähapetusluvuilla +III, +IV, +V ja +VI, ja näistä tyypillisimmät hapetusluvut ovat +III ja +VI. Se on voimakasLewis-happo,joten se voi muodostaa komplekseja erilaistenligandienkanssa. Usein ligandina onfluoridi-ioni, ja uraanin fluorokomplekseja tunnetaan esimerkiksi [UF10]4−,[UF8]3−ja [UF7]2−.Usein uraani esiintyy kompleksiyhdisteissäänuranyylikationinaUO2+ja UO22+.Toinen yleinen kompleksityyppi on happea tai typpeä sisältävät ligandit. Uraanista tunnetaan myös useitaorganometalliyhdisteitä,joista pysyvimpiä ovatsyklopentadienyylijohdannaiset.Syklopentadienyyliligandin lisäksi näissä yhdisteissä voi olla myös halogeeniligandeja.Uranoseenissaorgaanisena rakenneosana onsyklo-oktatetraeeni.[13][14][15]
Uraani muodostaa myöslejeerinkejä.Uraani-rodium-germanium-lejeerinki oli ensimmäinen tunnettu seos, joka muuttuisuprajohteeksivoimakkaassa magneettikentässä.[2]
Haitallisuus
[muokkaa|muokkaa wikitekstiä]Uraani on haitallista niin kemiallisesti kuin radiologisesti. Se tiedetäänteratogeneettiseksijakarsinogeeniseksiaineeksi, eli se voi elimistöön joutuessaan vahingoittaaDNA:ta,myös sukusolun DNA:ta, ja siten aiheuttaaepämuodostumiakehittyvässä alkiossa, keskenmenon riskiä ja alkion kuoleman. DNA-vaurio taigeenimutaatiovoi olla myös piilevä ja periytyä useaan sukupolveen.[2]
Kemiallinen terveysriski eli myrkytysriski muodostuu, jos uraania kertyymunuaisiin,maksaan ja luustoon. Suurina annoksina uraani on erityisen myrkyllistä munuaisille ja luustolle. Uraani vahingoittaa munuaisenproksimaalitiehyttä,minkä seurauksena pientenproteiinienjaglukoosineritys virtsaan lisääntyy. Suomessa porakaivonkäyttäjät saattavat altistua merkittävälle määrälle uraania, 1–2 mg/l (WHO:n ohjearvosuositus 2 μg/l), mutta vakavia terveyshaittoja ei ole huomattu.[16][17][18]
ErityisestiPersianlahden sodassamonet sotilaat altistuivatköyhdytetylle uraanille,mutta tutkimuksissa on osoittautunut, että siitä on aiheutunut lähinnä lieviä munuaisongelmia sekä perimämyrkyllisyyttä. Myös uraanin hajoamistuotteet, kutenradon,strontiumjajodi,voivat olla kemiallisesti ja radiologisesti haitallisia terveydelle.REACH-asetuksen mukaan uraani on haitallista.[6][19][10]
Isotoopit ja radioaktiivisuus
[muokkaa|muokkaa wikitekstiä]Uraani ei ole voimakkaanradioaktiivista.Kaksi tärkeintä isotooppia ovat235U ja238U. Luonnosta löydetään myös pieni määrä234U:ta, jota syntyy238U:n hajoamisen seurauksena. Kaikki kolme isotooppia hajoavatalfasäteilynkautta. Teollisesti merkittävin isotooppi on235U,jota käytetään ydinpolttoaineena.238U on uraanin pitkäikäisin isotooppi, jonka puoliintumisaika on 4,468 miljardia vuotta.[2]
|
1osuus kaikesta luonnosta löytyvästä uraanista. |
Historia
[muokkaa|muokkaa wikitekstiä]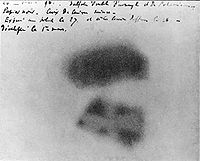
Uraanin löytäjänä pidetään saksalaista apteekkaria ja kemistiäMartin Klaprothia.1780-luvun lopulla Klaproth tutkiuraniniittiaeli pikivälkettä (saks.pechblende,pechhuono onni jablendemineraali). Tuohon aikaan luultiin, että pikivälke sisältää vain rautaa ja sinkkiä. Klaproth huomasi, että osa mineraalista ei käyttäytynyt kuten rauta tai sinkki, ja päätteli näin löytäneensä uuden alkuaineen. Hän ehdotti löytämälleen alkuaineelle nimeksiuran,joka oli kunnianosoitus muutama vuosi aikaisemmin löydetylleUranus-planeetalle. Sittemmin se muotoutui muotoonuranium.Pikivälkettä alettiin lopulta kutsua uraniniitiksi. Syyskuussa 1789 Klaproth esitteli löytönsäPreussin tiedeakatemialle.Todellisuudessa Klaproth löysiuraanidioksidia.[2][5][21]
Vuonna 1841 ranskalainen kemistiEugène-Melchior Péligoteristi tetraklooriuraanista puhdasta uraania kaliumin avulla. Vuonna 1896Henri Becquerelhavaitsi uraanin radioaktiivisuuden.Toisessa maailmansodassaelokuussa 1945 Yhdysvallat pudottiHiroshimankaupunkiin uraaniin perustuvanydinpommiLittle Boyn.Sähköä tuotettiin ensimmäisen kerran uraanin avulla vuonna 1951. Ydinvoimaa hyödynnettiin vuonna 1954USSNautiluksella.Ensimmäinen ydinvoimala avattiin lokakuussa 1956Sellafieldissä.[2][5][21]
Esiintyminen ja eristäminen
[muokkaa|muokkaa wikitekstiä]Uraanin esiintyminen
[muokkaa|muokkaa wikitekstiä]- Pääartikkeli:Uraanin esiintyminen
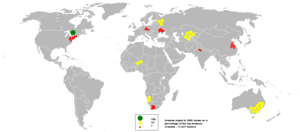

Uraanin pitoisuudeksi maankuoressa arvioidaan 1–4ppm,eli se on yhtä yleistä kuintinajabromi.Uraania esiintyy myös vesistöissä noin 3ppb.Nykyään tunnetut uraanivarat riittävät nykytietämyksen mukaan kymmeniä vuosia. Uraanin teollisesti merkittäviä mineraaleja ovaturaniniitti(pikivälke),karnotiitti,uranofaanijakoffiniitti.Uraanin mineraaleja tunnetaan useita satoja. Uraanin pitoisuuden pitää olla 0,1 %, jotta malmi olisi kaupallisesti merkittävää. Sen radioaktiivinen hajoaminen on yksi merkittävimmistämaalämmönaiheuttajista.[2][5][22][7][23]
Uraanin suurimmat tuottajat ovat Kanada, Australia ja Niger. Myös Yhdysvalloilla, Venäjällä, Kongolla, Etelä-Afrikalla, Gabonilla ja Kiinalla on merkittävät uraanivarannot. 40 % maailman tunnetuista uraanivarannoista sijaitsee Australiassa, ja suurin yksittäinen lähde onOlympic Dam Mine-kaivos Etelä-Australiassa.. Yhteensä tunnetut uraanivarannot on kolme miljoonaa tonnia, ja arvioidaan, että merissä on viisi miljardia tonnia lisää uraania. Uraanikaivokset ovat tyypillisesti avokaivoksia. Uraania myydään vain maille, jotka ovat ratifioineetydinsulkusopimukseneli käyttävät uraania vain rauhanomaisiin tarkoituksiin.[2][24]
Kaivostoiminta
[muokkaa|muokkaa wikitekstiä]- Pääartikkeli:Uraanikaivos
Suomessa ei ole tällä hetkellä yhtäkäänuraanikaivosta.Suomessa on louhittu uraania 1950- ja 1960-luvuillaPaukkajanvaarassaEnossa(nykyään osaJoensuuta). Paukkajanvaarasta louhittiin yhteensä 30 tonnia uraania.
Talvivaaran kaivostaaiemmin pyörittäneellä yhtiöllä on ollut lupa tuottaa uraania sivutuotteena, mutta kaivoksen pääasialliset louhintakohteet ovatkupari,koboltti,sinkkijanikkeli.Marraskuussa 2012 Talvivaaran kipsisakka-altaan vuodon seurauksena uraania joutui läheisiin vesistöihin merkittäviä määriä. Myös nykyisellä yhtiölläTerrafamellaon ympäristölupa uraanin louhimiseen[25],mutta ennen louhimisen aloittamista sen tulee saada lupavaltioneuvostolta.[26]Suomessa uraanin louhintaa valvooSäteilyturvakeskus,jolle on ilmoitettava kaikki luonnonvarojen hyödyntäminen, jos uraanin pitoisuus on yli 0,01 %.[27][28]
Uraanikaivos voi olla joko avolouhos tai sijaita maan alla. Uraani eristetään malmistaan tavallisesti kemiallisesti uuttamalla. Uuttamisen jälkeen syntyy lähinnä uraanioksidia U3O8,joka käsitellääntyppihapolla.Tällöin syntyy kidevedellistä uranyylinitraattia UO2(NO3)2· 6 H2O. Sitä kuumennettaessa syntyy uraanitrioksidia UO3,joka voidaan pelkistää vedyn avulla uraanidioksidiksi UO2.UO2on stabiilia ilmassa. Metallista uraania voidaan tehdäelektrolyysilläuraanitetrafluoridin ja natrium- tai kalsiumkloridiseoksesta. Uraanitetrafluoridia valmistetaan antamalla uraanidioksidin reagoida kaasumaisenvetyfluoridinkanssa. Toinen vaihtoehto on pelkistää sitä metallihalidista alkali- tai maa-alkalimetallista. Hyvin puhdasta metallista uraania voidaan valmistaa hajottamalla uraanihalideja kuumallahehkulangalla.[7][2][24]
Uraanin väkevöinti
[muokkaa|muokkaa wikitekstiä]- Pääartikkeli:Uraanin väkevöinti
Luonnossa esiintyvästä uraanista suurin osa on isotooppia238U, joka ei ole reaktiivinenfissionkautta. Uraania voidaan väkevöidä, eli235U-isotoopin suhteellista määrää kasvatetaansentrifugintai kaasudiffuusion avulla. Kaasudiffuusiossa uraaniheksafluoridi-kaasu ohjataanpuoliläpäisevän kalvonläpi, jolloin raskaampi238Udiffuntoituuhitaammin kuin kevyempi235U. Puoliläpäisevä kalvo on tyypillisesti hopeaa ja sinkkiä. Sentrifugoinnissa käytetäänuraaniheksafluoridia.Sentrifugointi on yleisin väkevöintikeino, kaasudiffuusiota käytettiin erityisesti toisen maailmansodan aikana. Muita keinoja on virittää spesifisti235U:n ja fluorin välistä sidosta, jolloin vain238U jää sitoutuneeksi fluoriin ja haluttu235U saostuu metallisena. Tavallisesti235U pitoisuus väkevöinnin jälkeen on 2–3 %, joka riittää ydinpolttoaineeksi. Ydinaseita varten uraani väkevöidään siten, että235U pitoisuus on noin 90 %.[5][6][2]
Käyttö
[muokkaa|muokkaa wikitekstiä]
Uraania on käytetty 2 000 vuotta sitten lasin ja keramiikan värjäykseen. Uraanioksidit värjäävätlasin kellanvihreäksi.Uraania on käytetty myös tekstiiliteollisuudessa väriaineen tarttumisen helpottamiseksi. Sitä on käytetty myös hehkulampuissa kiinnittämäänhehkulankalamppuun. Sähkön nopeus uraanissa on pienempi kuin langassa, joten se hidastaa sähkön nopeutta ennen kuin se osuu lamppuun. Tämä estää langan katkeamista ja ylikuumenemista.[5][22]
Nykyään uraanin pääasiallinen käyttökohde onydinpolttoaineenaydinvoimaloissa.Noin 14 % kaikesta maailman sähköstä tuotetaan uraanin avulla.[24]Kunneutroniosuu235U nuklidiin, voi tietyllä todennäköisyydellä tapahtuafissio,jossa vapautuu energiaa. Tytärnuklidien ja vapautuvien neutronien kineettinen energia sekä muiden, muun muassa tytärnuklidien, hajoamisenergiat siirtyvät ensiöpiirin veteen, joka ohjataan lämmönvaihtimeen. Toisiopiirin vesi höyrystyy ja pyörittäähöyryturbiinia,ja tämä muodostaageneraattorissasähkövirtaa. Yksi kilogramma 4-prosenttiseksi rikastettua uraanipolttoainetta tuottaa energiaa saman verran kuin 1 500 tonniakivihiiltäeli noin 20 biljoonaajoulea.Polttoaineena käytetään yleensä väkevöityä uraania, jonka235U-pitoisuus on noin 3 %.CANDU-reaktorissa voidaan käyttää luonnon uraania, joka sisältää huomattavasti vähemmän kuin 3 % uraanin isotooppia235U.[5][6][2]
Uraania (90+%235U) voidaan hyödyntää myösydinaseessa.Köyhdytettyä uraaniavoidaan käyttää panssarin läpäisevissä ammuksissa ja panssareissa, sillä uraanilla on hyvin korkea tiheys. Uraania (238U) käytetään myös suojana radioaktiivista säteilyä vastaan. Köyhdytetty uraani on myrkyllistä. Jos uraania sisältävä ammus räjähtää, voi muodostua myös kaasumaisia uraaniyhdisteitä. Jos ammus pirstoutuu tai jauhautuu pölyksi, voi uraania ja uraaniyhdisteitä joutua maaperään ja vesistöihin ja aiheuttaa terveysriskejä. Muodostunut pöly on myöspyroforista.[5][22][6]
Isotooppia238U voidaan muuttaaplutoniumiksihyötöreaktorissa.Plutoniumia voidaan hyödyntää ydinpolttoaineena.[6][2]
- 238U(n, γ) →239U(β−) →239Np(β−) →239Pu
Uraania voidaan hyödyntää myös kaikkein pitkäikäisimpien kivien iän arviointiin. Sitä voidaan käyttääröntgensäteilylähteenä.Uraania voidaan käyttäälejeeringeissätuomaan vahvuutta, sitkeyttä ja vetolujuutta.[2][29]
Lähteet
[muokkaa|muokkaa wikitekstiä]- Grenthe, Ingmar et al.:” luku 5”,Uranium,s. 253–698. Teoksessa: Morss, Lester R. et al. (toim.)The Chemistry of the Actinide and Transactinide Elements,3. painos. Dordrecht: Springer, 2006.ISBN 1402035985.Teoksen verkkoversio(PDF).(englanniksi)(Arkistoitu– Internet Archive)
- Lehto, Jukka & Hou, Xiaolin:Chemistry and Analysis of Radionuclides.Weinheim: Wiley-VCH, 2011.ISBN 8-3-528-32658-7.(englanniksi)
Viitteet
[muokkaa|muokkaa wikitekstiä]- ↑abcdeTechnical data for Uraniumperiodictable.com. Viitattu 7.7.2015.(englanniksi)
- ↑abcdefghijklmnopqrstUranium3rd1000.com. Viitattu 7.7.2015.(englanniksi)
- ↑Wieser, Michael T. & Coplen, Tyler B.: Atomic Weights of the Elements 2009 (IUPAC technical report).Pure and Applied Chemistry,2011, 83. vsk, nro 2. IUPAC.Artikkelin verkkoversio.Viitattu 16.4.2011.(englanniksi)
- ↑abcdeUranium Element Factschemicool.com. Viitattu 7.7.2015.(englanniksi)
- ↑abcdefghijUraniumchemistryexplained.com. Viitattu 7.7.2015.(englanniksi)
- ↑abcdefgUranium Element Factschemicool.com. Viitattu 13.7.2015.(englanniksi)
- ↑abcUraniuminfoplease.com. Viitattu 11.7.2015.(englanniksi)
- ↑Nagy, Sandor:Radiochemistry and Nuclear Chemistry – Volume II,s. 132. EOLSS Publications, 2009.ISBN 978-0-7506-3365-9.Kirja Googlen teoshaussa.(englanniksi)
- ↑Lehto & Hou s. 267–268
- ↑abcUraniumamericanelements.com. Viitattu 14.7.2015.(englanniksi)
- ↑Grenthe et al. s. 328–578
- ↑Grenthe et al. s. 446, 522
- ↑Greenwood, N. N. & Earnshaw, A.:Chemistry of the Elements,s. 1273–1280. 2nd Edition. Butterworth Heinemann, 1997.ISBN 0-7506-3365-4.(englanniksi)
- ↑Lehto & Hou s. 269
- ↑Grenthe et al. s. 630
- ↑Uraanin terveysvaikutukset13.8.2015. Säteilyturvakeskus. Viitattu 29.12.2015.
- ↑Päivi Kurttio, Hannu Komulainen, Aila Leino, Laina Salonen, Anssi Auvinen ja Heikki Saha: Bone as a Possible Target of Chemical Toxicity of Natural Uranium in Drinking Water.Environ Health Perspect,30.9.2004, 113. vsk, nro 1, s. 68–72. PMC.Artikkelin verkkoversio.Viitattu 29.12.2015.(englanniksi)
- ↑Komulainen, Hannu & Tuomisto, Jouko:Metallit ja metalloidit: Uraani(pdf)(s. 1079)Farmakologia ja toksikologia.Kuopio: Kustannus Medicina Oy. Viitattu 31.12.2015.
- ↑Mitä on köyhdytetty uraani13.8.2015. Säteilyturvakeskus. Viitattu 1.1.2016.
- ↑Isotopes of Uranium (Z=92)Berkeley Lab.Arkistoitu2.6.2008. Viitattu 14.7.2015.(englanniksi)
- ↑abGoldschmidt, Bertrand:Uranium's Scientific History 1789 – 1939garnet.berkeley.edu.Arkistoitu16.12.2014. Viitattu 7.7.2015.(englanniksi)
- ↑abcMarko Hamilo:Pikivälkkeestä radioaktiivisuuteen18.10.2005. Helsingin Sanomat.Arkistoitu.Viitattu 11.7.2015.
- ↑Lehto & Hou s. 266–267
- ↑abcUranium and Depleted Uraniumlokakuu 2015. world-nuclear.org.Arkistoitu31.12.2015. Viitattu 29.12.2015.(englanniksi)
- ↑Kysymyksiä ja vastauksia uraanin talteenotostaTerrafame. Viitattu 18.7.2019.
- ↑Jarmo Koponen:Uraanin talteenotto saattaa alkaa Talvivaarassa – Säteilyturvakeskus ei näe esteitä Terrafamen suunnitelmille(STT:n uutisesta) 11. kesäkuuta 2019. Yle. Viitattu 18.7.2019.
- ↑KaivostoimintaSäteilyturvakeskus. Viitattu 14.7.2015.
- ↑Talvivaaran ympäristövahinko: Talvivaaran kaivoksen ympäristöstä kerättyjen vesi- ja muiden näytteiden uraanipitoisuuksia9.1.2015. Säteilyturvakeskus. Viitattu 14.7.2015.
- ↑ATS Ydintekniikka.ATS Lehti,1989, nro 2. Helsinki: Suomen Atomiteknillinen Seura. ISSN-0356-0473.Artikkelin verkkoversio(pdf).(Arkistoitu– Internet Archive)
Aiheesta muualla
[muokkaa|muokkaa wikitekstiä]- PubChem: Uranium(englanniksi)
- Periodictable: Uranium(englanniksi)
- Toxin and Toxin Target Database (T3DB): Uranium(englanniksi)
- Toxin and Toxin Target Database (T3DB): Uranium-233(englanniksi)
- Toxin and Toxin Target Database (T3DB): Uranium-234(englanniksi)
- Toxin and Toxin Target Database (T3DB): Uranium-235(englanniksi)
- Toxin and Toxin Target Database (T3DB): Uranium-238(englanniksi)
- Webmineral: Mineral Species containing Uranium (U)(englanniksi)
- Mindat: The Mineralogy of Uranium(englanniksi)
- Dr. Duke's Phytochemical and Ethnobotanical Databases: Uranium(englanniksi)
- The Royal Society of Chemistry (RSC): Uranium(englanniksi)
| ||||||||||

