Nivolumab
Lenivolumabest unanticorps monoclonalqui se fixe aurécepteurde laprogrammed cell death 1(PD1) et le bloque. Il est utilisé contre certainscancers.
| Nivolumab | |
| |
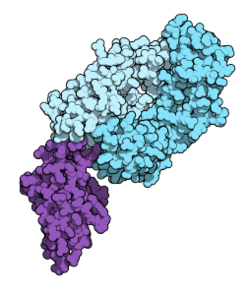
| Fab fragment(en)de nivolumab (en bleu) et du domaine extracellulaire de PD-1(en poupre). Entrée5ggrde laProtein Data Bank | |
| Identification | |
|---|---|
| NoCAS | |
| Code ATC | |
| DrugBank | DB09035 |
| Propriétés chimiques | |
| Formule | C6362H9862N1712O1995S42 |
| Masse molaire[1] | 143 597,381 ± 6,931g/mol C 53,21 %, H 6,92 %, N 16,7 %, O 22,23 %, S 0,94 %, |
| Considérations thérapeutiques | |
| Classe thérapeutique | anticorps monoclonal pour immunothérapie |
| Unités duSIetCNTP,sauf indication contraire. | |
| modifier |
|
Histoire
modifierLa société Medarex, basée à Princeton, a développé un modèle de souris transgénique permettant de produire des anticorps entièrement humains. La société a été ensuite rachetée en 2009 parBristol Myers Squibbqui a développé le nivolumab[2].
Efficacité
modifierUn cinquième à un quart desmélanomes,descancers du poumon non à petites cellules(CPNPC) et descancers rénauxrépondent à ce traitement[3].Il serait en particulier enchimiothérapie néo-adjuvantedu cancer du poumon non à petites cellules dans sa forme résécable[4].
Dans lemélanome,l'efficacité est d'autant plus importante si le traitement est associé avec de l'ipilimumab[5].Il est plus efficace que l'ipilimumab dans les formes métastatiques[6]et que ladacarbazinedans les tumeurs métastatiques non porteuses d'une mutation sur le gèneBRAF[7].
Il améliore la survie ducancer de l'estomacréfractaire aux autres traitements[8],ainsi que celui deœsophage[9].
Il est testé dans les formes réfractaires ou les rechutes de lamaladie de Hodgkin[10].
Autorisation de mise sur le marché
modifierLe,uneautorisation de mise sur le marché(AMM) a été accordée au nivolumab par le Japon dans l’indication mélanome non résécable. Il sera commercialisé par la firme japonaise Ono Pharmaceutical sous l’appellationOpdivo.Hors Asie, la molécule est sous licenceBristol-Myers Squibb[11].
Le,le nivolumab, jusqu’ici indiqué dans le traitement des patients adultes atteints d'un mélanome avancé (non résécable ou métastatique), dispose désormais d’une nouvelle AMM en monothérapie dans le traitement adjuvant des patients adultes atteints d’un mélanome avec atteinte des ganglions lymphatiques ou une maladie métastatique, et ayant subi une résection complète[12].
Le nivolumab est utilisé pour traiter les personnes souffrant[13]:
- d’un mélanome: il est utilisé seul ou avec un autre médicament anticancéreux, l'ipilimumab,dans le traitement des adultes dont le cancer s'est propagé à d'autres parties du corps ou ne peut pas être retiré par voie chirurgicale. Il est également utilisé seul chez des patients ayant subi une intervention chirurgicale pour retirer un mélanome qui s’est répandu dans les ganglions lymphatiques ou ailleurs dans le corps;
- d’un type de cancer du poumon appelécancer du poumon non à petites cellules(CPNPC) qui s'est propagé localement ou à d'autres parties du corps. Le nivolumab est utilisé seul chez des patients ayant été antérieurement traités par d'autres médicaments anticancéreux (chimiothérapie);
- d’uncarcinome rénalavancé. Le nivolumab est utilisé seul chez des patients ayant été antérieurement traités par d'autres médicaments anticancéreux;
- d’unlymphome de Hodgkinclassique, qui n'a pas régressé ou qui a récidivé après uneautogreffede cellules souches (procédure par laquelle la moelle osseuse est remplacée par les propres cellules souches du patient afin de constituer une nouvelle moelle osseuse qui produise des cellules sanguines saines). Le nivolumab est utilisé seul après un traitement parbrentuximab védotine(un autre médicament anticancéreux);
- d’un carcinome à cellules squameuses de la tête et du cou (SCCHN) qui a récidivé ou s'est propagé à d'autres parties du corps. Le nivolumab est utilisé seul chez des patients dont le cancer est en progression malgré un traitement par des médicaments anticancéreux à base deplatine;
- d’un cancer urothélial (de la vessie et des voies urinaires) qui s'est propagé localement et ne peut pas être retiré par voie chirurgicale ou qui a atteint d'autres parties du corps. Il est utilisé seul lorsque le traitement par des médicaments anticancéreux à base de platine n'a pas fonctionné.
Voir aussi
modifierLelambrolizumabest un autre anticorps monoclonal ciblant lerécepteurà laPD-1(Programmed cell death protein1).
Liens externes
modifier- Compendium suisse des médicaments: spécialités contenantNivolumab
Notes et références
modifier- Masse molaire calculée d’après«Atomic weights of the elements 2007», surwww.chem.qmul.ac.uk.
- (en)«Bristol-Myers to buy Medarex for $2.4 billion»,Reuters,(lire en ligne,consulté le)
- (en)Topalian SL, Hodi FS, Brahmer JR, Gettinger SN, Sznol Met al.,«Safety, activity, and immune correlates of anti-PD-1 antibody in cancer»,N Engl J Med,vol.366,no26,,p.2443-54.(PMID22658127,PMCIDPMC3544539,DOI10.1056/NEJMoa1200690,lire en ligne[html])
- Forde PM, Spicer J, Lu S et al.Neoadjuvant nivolumab plus chemotherapy in resectable lung cancer,N Engl J Med, 2022;386:1973-1985
- (en)Wolchok JD, Kluger H, Callahan MK, Postow MA, Sznol Met al.,«Nivolumab plus Ipilimumab in advanced melanoma»,N Engl J Med,vol.369,no2,,p.2122-33.(PMID23724867,PMCIDPMC5698004,DOI10.1056/NEJMoa1302369,lire en ligne[html])
- (en)Larkin J, Chiarion-Sileni V, Gonzalez R, Grob JJ, Cowey CLet al.,«Combined nivolumab and ipilimumab or monotherapy in untreated melanoma»,N Engl J Med,vol.373,no1,,p.23-34.(PMID26027431,PMCIDPMC5698905,DOI10.1056/NEJMoa1504030,lire en ligne[html])
- (en)Robert C, Long GV, Brady B, Dutriaux C, Ascierto PAet al.,«Nivolumab in previously untreated melanoma without BRAF mutation»,N Engl J Med,vol.372,no4,,p.320-30.(PMID25399552,DOI10.1056/NEJMoa1412082,lire en ligne[html])
- Kang YK, Boku N, Satoh T et al. |http://www.sciencedirect.com/science/article/pii/S0140673617318275Nivolumab in patients with advanced gastric or gastro-oesophageal junction cancer refractory to, or intolerant of, at least two previous chemotherapy regimens (ONO-4538-12, ATTRACTION-2): a randomised, double-blind, placebo-controlled, phase 3 trial], Lancet, 2017;390:2461-2471
- Kelly RJ, Ajani JA, Kuzdzal J et al.Adjuvant nivolumab in resected esophageal or gastroesophageal junction cancer,N Eng J Med, 2021;384:1191-1203
- Ansell SM, Lesokhin AM, Borrello I et al.PD-1 blockade with nivolumab in relapsed or refractory Hodgkin's lymphoma,N Engl J Med, 2015;372:311-319
- (en)Ono Pharmaceutical Co., Ltd., «Communiqué de presse»[PDF],(consulté le).
- «Résumé des caractéristiques du produit»[PDF],surwww.ema.europa.eu,European Medicines Agency(consulté le).
- «Opdivo (nivolumab)»[PDF],surwww.ema.europa.eu,European Medicines Agency,(consulté le).