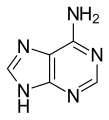
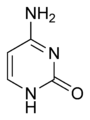
Acide ribonucléique


L'acide ribonucléiqueouARN(en anglais,RNA,pourribonucleic acid) est unacide nucléiqueprésent chez pratiquement tous lesêtres vivants,et aussi chezcertains virus.L'ARN est très proche chimiquement de l'ADNet il est d'ailleurs en général synthétisé dans lescellulesà partir d'un segment d'ADN matrice dont il est une copie. Les cellules utilisent en particulier l'ARN comme un support intermédiaire desgènespoursynthétiserlesprotéinesdont elles ont besoin. L'ARN peut remplir de nombreuses autres fonctions et en particulier intervenir dans desréactions chimiquesdumétabolisme cellulaire.
Chimiquement, l'ARN est unpolymèrelinéaire constitué d'un enchaînement denucléotides.Chaque nucléotide contient ungroupephosphate,unsucre(leribose) et unebase azotée(ou base nucléique). Les nucléotides sont liés par desliaisons phosphodiester.On trouve quatre bases nucléiques dans l'ARN: l'adénine,laguanine,lacytosineet l'uracile.
L'ARN a de nombreuses similitudes avec l'ADN,avec cependant quelques différences importantes: d'un point de vue structurel, l'ARN contient desrésidusde ribose là où l'ADN contient dudésoxyribose,ce qui rend l'ARN chimiquement moins stable; de plus lathyminede l'ADN y est remplacée par l'uracile, qui possède les mêmes propriétés d'appariementde base avec l'adénine. Sur le plan fonctionnel, l'ARN se trouve le plus souvent dans lescellulessous formemonocaténaire,c'est-à-dire de simple brin, tandis que l'ADN est présent sous forme de deux brins complémentaires formant unedouble-hélice.Enfin, les molécules d'ARN présentes dans les cellules sont plus courtes que l'ADN dugénome,leur taille variant de quelques dizaines à quelques milliers de nucléotides, contre quelques millions à quelques milliards de nucléotides pour l'acide désoxyribonucléique (ADN).
Dans la cellule, l'ARN est produit partranscriptionà partir de l'ADN (qui est situé dans lenoyauchez les Eucaryotes). L'ARN est donc une copie d'une région de l'un des brins de l'ADN. Les enzymes qui effectuent la copieADN → ARNs'appellent desARN polymérases.Les ARN ainsi produits peuvent avoir trois grands types de fonctions: ils peuvent être supports de l'information génétique d'un ou plusieurs gènes codant desprotéines(on parle alors d'ARN messagers), ils peuvent adopter unestructure secondaireettertiairestable et accomplir des fonctionscatalytiques(par exemple l'ARN ribosomique), ils peuvent enfin servir de guide ou de matrice pour des fonctions catalytiques accomplies par desfacteurs protéiques(ce qui est par exemple le cas desmicroARN).
Structure de l'ARN[modifier|modifier le code]
Ribonucléotides[modifier|modifier le code]
Structure chimique[modifier|modifier le code]

L'ARN est unacide nucléique,c'est-à-dire unemoléculeconstituée d'un enchaînement (polymère) denucléotides.Chaque nucléotide unitaire de l'ARN est constitué d'unpentose,leribose,dont les atomes decarbonesont numérotés de 1′ à 5′, d'une base azotée variable, oubase nucléique,et d'ungroupephosphate.La base nucléique est reliée par unatomed'azoteaucarbone1′ du ribose; et le groupe phosphate du nucléotide est lié au carbone 5'. Les nucléotides se lient les uns aux autres par l'intermédiaire des groupes phosphate, le groupe phosphate d'un nucléotide (lié au carbone 5') se rattachant par l'intermédiaire deliaisons phosphodiesterau niveau du carbone 3′ du nucléotide suivant.
Les quatre principales bases de l'ARN, et les seules utilisées dans l'ARN de transfert, sont l'adénine(notée A), l'uracile(noté U), lacytosine(notée C) et laguanine(notée G). Par rapport à l'ADN, lathyminede l'ADN est remplacée par l'uraciledans l'ARN[2].La différence entre ces deux bases est le remplacement d'un groupeméthyleen position 5 de la thymine par un atome d'hydrogènedans l'uracile. Cette modification de structure ne change pas les propriétés d'appariement avec l'adénine[3],[4].
Lesribozymes,notamment l'ARN ribosomalet lesARN de transfert,comprennent d'autres nucléotides modifiés, plus d'une centaine ont été identifiés[5],[6].
Stéréochimie[modifier|modifier le code]
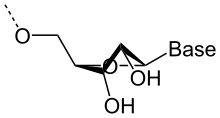

Sur le plan structurel, la présence d'un atome d'oxygène sur la position 2′ du ribose influence laconformationducyclefuranosedu ribose. Cethétérocycleà cinq atomes n'est pas plan, ce qui conduit à deuxconformèresprincipaux du sucre, appelés C2′-endo et C3′-endo. Dans l'ARN, qui comporte un atome d'oxygèneen position 2′, la position C3′-endo est privilégiée[7],ce qui modifie profondément la structure des doubles hélices comportant des brins ARN. Ces duplex d'ARN forment une hélice de type A, différente de celle qui est observée de façon majoritaire dans l'ADN classique, qui est une hélice de type B, où le désoxyribose est en conformation C2′-endo[8].
Double hélice d'ARN[modifier|modifier le code]

L'hélice de type A qu'adopte l'ARN lorsqu'il forme un duplex a des propriétés géométriques assez différentes de celles de l'hélice de type B. Tout d'abord le nombre de paires de bases par tour d'hélice est de 11 au lieu de 10 pour l'ADN en forme B. Le plan des paires de bases n'est plus perpendiculaire à l'axe de l'hélice, mais forme un angle d'environ 75° avec celui-ci[11],[12].Il en résulte un déplacement de l'axe de l'hélice qui ne passe plus par le centre de l'appariement des bases, mais à l'intérieur du grand sillon. Ceci induit une augmentation du diamètre de l'hélice qui passe d'environ20Åpour l'ADN en forme B à environ26Åpour l'ARN en forme A[13].Enfin, la géométrie des deux sillons est profondément affectée: le grand sillon devient très accessible, tandis que le petit sillon devient très profond, étroit et pincé. Ceci a un impact sur la manière dont l'ARN double brin peut interagir avec des protéines, car l'étroitesse du petit sillon est une barrière à l'accessibilité de ligands protéiques[14].
Structurein vitro[modifier|modifier le code]
La plupart des ARN naturels sont présents sous formemonocaténaire(simple brin) dans la cellule, contrairement à l'ADN qui est sous forme d'un double brin apparié[2].Lesbrins d'ARNse replient le plus souvent sur eux-mêmes, formant une structure intramoléculaire qui peut être très stable et très compacte. La base de cette structure est la formation d'appariements internes, entre bases complémentaires (AavecU,GavecCet, parfois,GavecU). La description des appariements internes entre les bases d'un ARN s'appelle lastructure secondaire.Cette structure secondaire peut être complétée par des interactions à distance qui définissent alors une structure tridimensionnelle oustructure tertiaire.
La formation de la structure des ARN est très souvent dépendante des conditionsphysicochimiquesenvironnantes et en particulier de la présence, dans lasolution,decationsdivalents,comme l'ionmagnésiumMg2+.Ces cations interagissent avec les groupes phosphate du squelette et stabilisent la structure, en particulier en faisant écran à la répulsion électrostatique entre les charges négatives de ces phosphates[15].
Lastructure tertiairedes ARN est à la base de la richesse de leurs fonctions et en particulier de leur capacité àcatalyserdesréactionschimiques (ribozymes).
Structure secondaire[modifier|modifier le code]
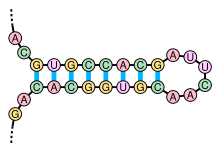
Lastructure secondaired'un ARN est la description de l'ensemble desappariementsinternes au sein d'une molécule simple brin[16].Cet ensemble d'appariements induit unetopologieparticulière, composée de régions en hélice (tiges) et de régions non-appariées (boucles). Par extension, la structure secondaire recouvre également la description de cette topologie.
La formation de structures secondaires au sein d'un ARN simple brin résulte de l'existence de régions contenant desséquences palindromiques,qui peuvent s'apparier pour former localement une structure en double hélice. Par exemple, si l'ARN contient les deuxséquencessuivantes:--GUGCCACG------CGUGGCAC--,celles-ci forment une séquence palindromique, les nucléotides du second segment étant les complémentaires de ceux du premier, après inversion de leur sens de lecture; ces deux segments peuvent alors s'apparier de manière antiparallèle pour former une région localement en duplex. La région entre les deux segments forme une « boucle » reliant les deux brins appariés, cet appariement formant une « tige ». On parle alors de structure en « épingle à cheveux », outige-boucle.
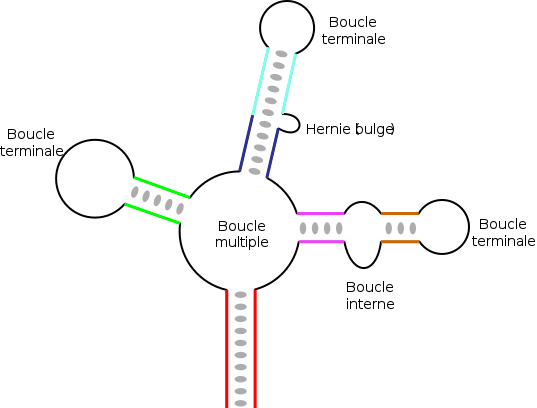
Dans des ARN de longueur plus importante, il peut exister des structures plus complexes qui résultent de l'appariement de plusieurs régions complémentaires oupalindromiques.En fonction de la manière dont sont « emboîtées » ces différentes régions, on obtient des élémentstopologiquesvariés, avec des tiges ou régions appariées, et divers types de boucles[17]:
- lesboucles terminales,situées à l'extrémité d'une tige;
- lesboucles internes,qui connectent deux tiges;
- lesboucles multiples,qui connectent trois tiges ou plus et constituent des points de branchement de la structure;
- leshernies(en anglaisbulge), ouboucles latérales,qui sont sur un seul des deux brins d'une hélice. La continuité de l'hélice n'est en général pas affectée et les bases restent empilées de manière coaxiale, de part et d'autre de la hernie.
Il n'existe pas toujours une structure unique stable pour uneséquencedonnée et il arrive que certains ARN puissent adopter plusieurs conformations alternatives en fonction de la liaison d'unligand(protéine,petite molécule…) ou des conditions physico-chimiques (force ionique,pH). On peut en général suivre la formation ou la fusion de la structure secondaire d'un ARN par des mesuresspectroscopiques.Ainsi, par exemple, l'absorption dans l'ultravioletdes bases de l'ARN est plus importante à l'état déplié qu'à l'état replié (phénomène d'hyperchromicité[18]).
Structure tertiaire[modifier|modifier le code]

Appariements non canoniques[modifier|modifier le code]
Au-delà de la topologie des boucles et des hélices composées de paires de bases standard, un ARN peut adopter une structure tridimensionnelle compacte, oustructure tertiaire,comme uneprotéine.À l'intérieur de cette structure, les hélicescanoniquessont complétées par des appariements non canoniques, c'est-à-dire distincts des appariements classiques, de typeWatson-Crick(A=UetG≡C) et bancals (wobble,G=U). On a observé une grande variété de ces appariements dans les structures tridimensionnelles d'ARN résolues parcristallographie aux rayons Xou parrésonance magnétique nucléaire.On trouve par exemple desappariements Hoogsteen[19]et des appariements « en cisaille » (sheared)[20].Il existe également des interactionsbase-ribose,notamment avec l'hydroxyle2', qui peut former desliaisons hydrogène.Une nomenclature systématique de toutes ces interactions a été proposée parÉric Westhofet ses collaborateurs[21].Plus de 150 types d'appariements ont été observés et ont été regroupés en douze grandes familles. Ces appariements non canoniques impliquent toujours desliaisons hydrogèneentre les bases, qui sontcoplanaires,comme dans les paires Watson-Crick.
Interactions à grande distance[modifier|modifier le code]
Des appariements canoniques ou non canoniques peuvent intervenir entre des régions distantes de la structure secondaire, souvent localisées dans des boucles, ce qui permet de stabiliser un repliement compact de la structure.
Parmi ces interactions non canoniques à grande distance figurent:
- lespseudonœuds,structures formées par l'interaction d'une boucle avec une région située à l'extérieur de la tige qui la délimite[22];
- lestriplex de brin,qui surviennent lorsqu'une région simple brin vient s'insérer dans le grand sillon d'une région en hélice;
- lesinteractionstétraboucle-récepteur:interactions entre boucles hyperstables de quatre nucléotides (tétraboucles) et structures en duplex ou quasi-duplex[23].
Différences entre l'ADN et l'ARN[modifier|modifier le code]
Les principales différences entre les deux molécules sont que:
- l'ARN a poursucreleriboselà où l'ADN a dudésoxyribose;
- la baseuracileremplit dans l'ARN la fonction assurée par lathyminedans l'ADN;
- l'ARN existe généralement sous forme monocaténaire (simple brin), hormis chez quelquesvirustels que lesréovirusoù il existe sous forme d'ARN double brin[24],tandis que l'ADN est double brin (bicaténaire) avec une structure en double hélice;
- l'ARN est court: de quelques dizaines à quelques milliers denucléotidespour les ARN cellulaires (ARNm ou ARN structurés), contre quelques millions à quelques milliards (trois milliards chez l'Homme) dans l'ADN qui constitue le génome de la cellule.

Les trois premières différences donnent à l'ARN une stabilité bien moindre que celle de l'ADN:
- le ribose possède un groupehydroxyleen position 2′, qui est absent dans ledésoxyribosede l'ADN.Cette fonction 2′-OH a des incidences multiples sur la structure de l'ARN. Tout d'abord sur le plan chimique, cette fonctionalcoolrend l'ARN sensible à l'hydrolyse alcaline. La présence des deux oxygènes encissur les positions 2′ et 3′ rend possible la cyclisation du phosphate sur les positions 2′ et 3′, qui se produit très rapidement lorsqu'unebasevient arracher leprotondu 2′-OH. Cette cyclisation du nucléotide provoque une coupure de la chaîne ribose-phosphate etlibère des extrémités 5′-OH et 2′, 3′ phosphate cyclique[incompréhensible][25];
- l'uracile est moins coûteux énergétiquement à produire pour les organismes vivants que la thymine, puisqu'il nécessite une étape de synthèse de moins qu'est la méthylation par lathymidylate synthase.La présence de thymine dans l'ADN permet à la cellule de détecter des lésions spontanées de lacytosinequi est sensible à l'oxydation.Ladésaminationspontanée de la cytosine en présence d'oxygène convertit cette dernière en uracile. La présence dedésoxyuridinedans l'ADN est anormale, puisque ledésoxyribonucléotidecomplémentaire de ladésoxyadénosineest lathymidine.Grâce à cette distinction entre thymine et uracile au moyen d'un groupe méthyle, le système deréparation par excision de basepeut détecter et corriger le défaut. Dans l'ARN, la désamination des cytosines produit des uraciles et n'est pas réparée. L'ARN ayant une durée de vie beaucoup plus courte que celle de l'ADN (de l'ordre de la minute), il est dégradé et recyclé;
- si un brin d'ARN monocaténaire est endommagé, la lésion n'est pas réparée et le dommage est irréversible; en revanche, si un des deux brins d'ADN est endommagé, la cellule peut utiliser l'information portée par le brin complémentaire intact pourréparer la lésion.
D'un point de vue évolutif, certains éléments permettent de penser que l'ARN serait antérieur à l'ADN comme support de l'information génétique, ce qui expliquerait ses fonctions plus étendues et sa généralisation. L'ADN serait apparu plus tard et n'aurait supplanté l'ARN que pour le rôle de stockage à long terme, en raison de sa plus grande stabilité[26].
Synthèse de l'ARN à partir de l'ADN[modifier|modifier le code]
La synthèse d'une molécule d'ARN à partir de l'ADN s'appelle latranscription.C'est un processus complexe qui fait intervenir une enzyme de la famille desARN polymérasesainsi que des protéines associées. Les différentes étapes de cette synthèse sont l'initiation, l'élongation et la terminaison. Le processus de synthèse des ARN est sensiblement différent chez les organismesprocaryoteset chez les celluleseucaryotes[27].Enfin, après la transcription proprement dite, l'ARN peut subir une série demodifications post-transcriptionnellesdans le cadre d'un processus de maturation au cours duquel sa séquence et sa structure chimique peuvent être modifiées (voir plus loin).
Initiation[modifier|modifier le code]
Le démarrage de la transcription d'un ARN par une ARN polymérase s'effectue au niveau d'uneséquencespécifique sur l'ADN, appeléepromoteur.Ce promoteur comporte un ou plusieurs éléments de séquence conservés[28]sur lesquels se fixent en général des protéines spécifiques, lesfacteurs de transcription.Juste en amont du site d'amorçage de la transcription, l'élément proximal est en général riche en nucléotidesTetA,et est pour cette raison appeléboîte TATA[29]chez les eucaryotes ouboîte de Pribnowchez les bactéries[30].Les facteurs de transcription favorisent le recrutement de l'ARN polymérase sur le promoteur et l'ouverture du duplex d'ADN. Il se forme alors ce qu'on appelle unebulle de transcriptionavec l'ADN ouvert, dont l'un des brins (la matrice) est hybridé avec l'ARN en cours de synthèse.
Élongation[modifier|modifier le code]
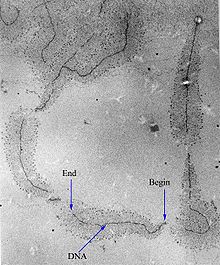
Une fois l'ARN polymérase fixée sur le promoteur et la bulle de transcription formée, elle synthétise les premiers nucléotides de manière statique sans quitter la séquence du promoteur. Les facteurs de transcription se détachent et l'ARN polymérase devient processive[32].Elle transcrit alors l'ARN dans lesens 5' vers 3',en utilisant l'un des deux brins de l'ADN comme matrice et desribonucléotidestriphosphates(ATP,GTP,CTPetUTP) comme précurseurs.
In vivo,chezEscherichia coli,la vitesse d'allongement de l'ARN polymérase est d'environ 50 à 90 nucléotides par seconde[33].
Terminaison[modifier|modifier le code]
La terminaison de la transcription de l'ARN procède selon des mécanismes complètement différents chez lesbactérieset chez leseucaryotes.
Chez les bactéries, le mécanisme principal de terminaison fait intervenir unestructureparticulière de l'ARN, leterminateur,composé d'unetige-bouclestable suivie d'une série derésidusd'uridine (U). Lorsque l'ARN polymérase synthétise cette séquence, le repliement de la tige d'ARN provoque une pause de la polymérase[34].L'ARN, qui n'est plus apparié à l'ADN matrice que par une série d'appariements A-U faibles, se détache, sans intervention d'autres facteurs protéiques. La terminaison peut aussi se faire via l'intervention d'un facteur protéique spécifique, le facteur Rho[35].
Chez les eucaryotes, la terminaison de la transcription par l'ARN polymérase II est couplée à lapolyadénylation.Deux complexes protéiques,CPSF(en)etCStF(en)reconnaissent les signaux de polyadénylation (5′-AAUAAA-3′) et de coupure de l'ARN. Ils clivent l'ARN, induisent le détachement de la polymérase de l'ADN et recrutent la poly-A polymérase qui ajoute la queue poly(A)[36](voir plus bas).
Maturation[modifier|modifier le code]
La maturation des ARN comprend un ensemble demodifications post-transcriptionnellesprincipalement observées chez les eucaryotes et jouent un rôle important dans le devenir de l'ARN maturé. Les principales modifications sont l'adjonction d'unecoiffeen 5′, lapolyadénylationen 3′, l'épissage,l'introduction de modifications chimiques au niveau de la base ou du ribose et enfin l'édition.
Coiffe[modifier|modifier le code]

Lacoiffe,ou5′-capen anglais, est unnucléotidemodifié qui est ajouté à l'extrémité 5'de l'ARN messagerdans les cellules d'eucaryotes.Elle se compose d'unrésidudeguanosineméthylélié par une liaison 5′-5′ triphosphate au premier nucléotide transcrit par l'ARN polymérase[37].Cette modification est introduite dans lenoyaude la cellule, par l'action successive de plusieurs enzymes:polynucléotide 5'-phosphatase,ARN guanylyltransférase,méthyltransférases.
La coiffe joue plusieurs rôles: elle accroît la stabilité de l'ARN en le protégeant de la dégradation par desexonucléases5′-3′ et permet également le recrutement defacteurs d'initiationde la traduction nécessaires à la fixation duribosomesur les ARN messagers cellulaires. La coiffe est donc essentielle à la traduction de la plupart des ARNm.
Polyadénylation[modifier|modifier le code]
Lapolyadénylationconsiste en l'addition d'une extension à l'extrémité 3′ de l'ARN composée exclusivement deribonucléotidesde typeadénosine(A). Pour cette raison, l'extension est appeléequeue poly(A).Bien que composée de nucléotides standard, cette queue poly(A) est ajoutée de façon post-transcriptionnelle par une enzyme spécifique appeléepoly(A) polymérase[38]et n'est pas codée dans l'ADNgénomique.La queue poly(A) est trouvée principalement à l'extrémité desARN messagers.Chez les eucaryotes, la polyadénylation des ARNm est nécessaire à leur traduction par le ribosome et participe à leur stabilisation. La queue poly(A) est en particulier reconnue par laPABP(poly(A)-binding protein,« protéine de liaison de la poly(A) »).
Chez les bactéries et dans certainesmitochondries,la polyadénylation des ARN est au contraire un signal de dégradation[39].
Épissage[modifier|modifier le code]

L'épissageest unemodification post-transcriptionnellequi consiste en l'élimination desintronset la suture desexonsdans les ARN messagers et dans certains ARN structurés comme les ARNt[2].Présents chez les organismes eucaryotes, les introns sont des segments d'ARN qui sont codés dans le génome et transcrits dans l'ARN précurseur, mais qui sont éliminés du produit final. Dans la plupart des cas, ce processus fait intervenir une machinerie spécifique complexe appelée lesplicéosome[40].L'épissage se produit dans lenoyaudes cellules eucaryotes, avant l'export de l'ARN maturé vers le cytoplasme.
Nucléotides modifiés[modifier|modifier le code]
Après leur transcription par l'ARN polymérase, certains ARN subissent des modifications chimiques sous l'action d'enzymesspécifiques. Les principaux ARN subissant des modifications sont lesARN de transfertet lesARN ribosomiques.On peut également considérer que lesméthylationsintervenant dans la synthèse de lacoiffesont des modifications denucléotidesparticulières. Dans le cas général, les modifications peuvent porter soit sur labase,soit sur leribose.Les principales modifications rencontrées sont:
- sur le ribose: des O-méthylationsde la position 2′-OH;
- sur la base:
- l'isomérisation desuridinesqui donne despseudouridines[41],
- des méthylations, soit sur des atomes de carbone (ribothymidine), soit sur des atomes d'azote (7-méthylguanosine…),
- uneréduction,qui transforme les uridines endihydrouridines,
- des thiolations,
- des modifications plus complexes (prénylation,thréonyl-carbamoylation…).
Dans les ARN de transfert, l'introduction de nucléotides modifiés contribue à augmenter la stabilité des molécules[42].
Édition[modifier|modifier le code]
L'édition des ARN consiste en une modification de la séquence de l'acide ribonucléique, postérieure à la transcription par l'ARN polymérase. À l'issue du processus d'édition, la séquence de l'ARN est donc différente de celle de l'ADN. Les changements opérés peuvent être la modification d'une base, la substitution d'une base ou encore l'ajout d'une ou plusieurs bases. Ces modifications sont effectuées par des enzymes qui agissent sur l'ARN, comme lescytidine désaminases,qui transforment chimiquement lesrésidusdecytidineenuridine.
Fonction dans la cellule[modifier|modifier le code]
Dans les cellules, les ARN remplissent quatre rôles distincts et complémentaires:
- support temporaire de l'information génétique:c'est l'ARN messagerqui remplit ce rôle, il est utilisé par lacellulepour transmettre l'information correspondant à un gène donné à l'extérieur du noyau, puis poursynthétiser des protéinesà partir de ces informations;
- catalyseur enzymatique:comme lesprotéines,les ARN peuvent se replier en trois dimensions pour former des structures complexes. Ces structures permettent à certains ARN de se comporter comme desenzymes,on parle alors deribozyme.Leribosome,laribonucléase Pet certainsintronssont desribozymes.Il existe des arguments indirects indiquant que la machinerie d'épissage des ARN messagers (lesplicéosome) est aussi un ribozyme[43],même si la démonstration formelle n'en a pas encore été apportée;
- guide pour des enzymes:certains ARN sont utilisés commecofacteurspar desprotéinespour permettre leur ciblage vers desséquencesspécifiques. Parmi ceux-ci, on peut citer les petits ARN nucléolaires (snoARN), qui guident les enzymes de modification de l'ARN ribosomique,l'ARN télomérique, qui est un cofacteur de latélomérase,l'enzyme qui fabrique les extrémités des chromosomes, ou encore lesARN interférents;
- régulateurs de l'expression génétique:certainsARN non codantsjouent un rôle dans la répression de l'expression de certains gènes ou groupes de gènes. C'est le cas par exemple des ARNantisensqui s'apparient à un ARN cible et en bloquent la traduction par le ribosome.
Une classe particulière d'ARN, les ARN de transfert, se trouve à l'interface de plusieurs de ces fonctions en guidant les acides aminés lors de latraduction.
Enfin, le génome de certainsvirusest exclusivement constitué d'ARN et non d'ADN. C'est en particulier le cas desvirus de la grippe,du SIDA,de l'hépatite C,de la poliomyéliteou encore duvirus Ebola.Suivant les cas, la réplication de ces virus peut passer par un intermédiaire ADN (rétrovirus), mais peut aussi se faire directement d'ARN en ARN.
L'ARN est donc une molécule très polyvalente, ce qui a conduitWalter Gilbert,co-inventeur duséquençagede l'ADN,à proposer en 1986 une hypothèse selon laquelle l'ARN serait la plus ancienne de toutes les macromolécules biologiques[26].Cette théorie, diteRNA world hypothesis(« hypothèse du monde à ARN »), permet de s'affranchir d'unparadoxe de l'œuf et de la poulequi survient lorsqu'on cherche à savoir qui des protéines (catalyseurs) et de l'ADN (information génétique) sont apparus en premier. Dans ce modèle, l'ARN, capable de combiner à la fois les deux types de fonctions, serait le précurseur universel.
ARN messagers[modifier|modifier le code]
L'information génétique contenue au sein de l'ADNn'est pas utilisée directement par lacellulepoursynthétiserdesprotéines.Celle-ci utilise pour cela des copies transitoires de l'information génétique que sont les ARN messagers ou ARNm[44].Chaque ARN messager porte un ou, parfois, plusieurscistrons,c'est-à-dire les instructions pour former une seule protéine. Il correspond donc à la copie d'un seul des gènes du génome (on parle alors d'ARNm monocistronique) ou parfois de quelques-uns (ARNm polycistronique)[45].
L'ARN messager ne contient la copie que d'un seul des deux brins de l'ADN, celui qui est codant, et non la séquence complémentaire. Par rapport à laséquencedugènecontenue dans l'ADN du génome, celle de l'ARNm correspondant peut contenir des modifications, en particulier dues à l'épissage(voir plus haut) qui élimine lesrégions non codantes.L'ARN messager synthétisé dans le noyau de la cellule est exporté dans le cytoplasme pour être traduit en protéine[2].Contrairement à l'ADN, qui est une molécule pérenne, présente pendant toute la vie de la cellule, les ARN messagers ont une durée de vie limitée, de quelques minutes à quelques heures, après quoi ils sont dégradés et recyclés.
Un ARN messager comporte trois régions distinctes: unerégion 5′ non traduitedite 5′-UTR, située en amont du ou descistronsqu'il porte; une région codante correspondant à ce ou à ces cistrons; et enfin, unerégion 3′ non traduitedite 3′-UTR[2].Les ARN messagers sonttraduitsenprotéinespar lesribosomes.La région 5′ non traduite contient en général les signaux de traduction permettant le recrutement du ribosome sur le cistron. Le processus de traduction fait également intervenir lesARN de transfertqui apportent au ribosome lesacides aminésnécessaires à labiosynthèse des protéines.Au sein du ribosome, par leuranticodon,les ARNt s'apparient successivement aux triplets de bases, oucodons,de la séquence de l'ARNm. Lorsque l'appariement codon-anticodon est correct, le ribosome ajoute l'acide aminé porté par l'ARNt à la protéine en cours de synthèse. Les correspondances entre codons et acides aminés constituent lecode génétique[46].
La fonction des ARN messagers est multiple. Ils permettent d'une part de préserver la matrice d'ADN originale, qui n'est pas directement utilisée pour la traduction, la cellule ne travaillant que sur la copie qu'est l'ARNm. L'existence d'ARN messagers offre surtout à la cellule un mécanisme crucial de régulation du cycle de production des protéines à partir du génome. Le besoin cellulaire en telle ou telle protéine peut varier en fonction de l'environnement, du type de cellule, du stade de développement. La synthèse protéique doit donc être activée ou arrêtée en fonction des conditions cellulaires. La régulation de la transcription de l'ADN en l'ARNm répond à cette nécessité et est contrôlée par desfacteurs de transcriptionspécifiques agissant sur lespromoteursdes gènes cibles. Lorsque la quantité d'une protéine donnée est suffisante, la transcription d'ARNm est inhibée, celui-ci est progressivement dégradé et la production protéique cesse. Il est donc important que l'ARNm soit une molécule transitoire, afin de pouvoir réaliser cette régulation essentielle.
ARN de transfert[modifier|modifier le code]
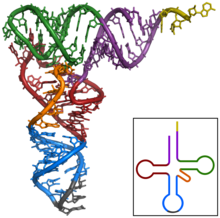
- jaune: site de l'acide aminé;
- violet: tige accepteur;
- vert: boucleTΨC;
- rouge: branche D;
- orange: boucle variable;
- bleu: boucle de l'anticodon;
- gris:anticodon.
LesARN de transfert,ou ARNt, sont de courts ARN, longs d'environ 70 à 100ribonucléotides,impliqués dans l'adressage des acides aminés vers lesribosomeslors de latraduction[48].
Les ARN de transfert ont une structure caractéristique en feuille de trèfle, composée de quatre tiges appariées. L'une de ces tiges est terminée par une boucle qui contient l'anticodon,le triplet denucléotidesqui s'apparieaucodonlors de latraductiond'unARNmpar leribosome[49].À l'autre extrémité, l'ARNtporte l'acide aminécorrespondant attaché par une liaisonesterà son extrémité 3′-OH. Cette estérification est catalysée par des enzymes spécifiques, lesaminoacyl-ARNt synthétases.En trois dimensions, la structure en feuille de trèfle se replie en « L », avec l'anticodon à une extrémité et l'acide aminé estérifié à l'autre extrémité[50].
Toutes les cellules vivantes contiennent un ensemble d'ARNt différents portant les différents acides aminés et capable de lire les différents codons.
Les ARN de transfert sont parfois désignés comme des « adaptateurs » entre laséquence génétiqueet laséquence protéique.C'estFrancis Crickqui a proposé l'existence de ces adaptateurs, avant même leur découverte en 1958[51].
ARN catalytiques ou ribozymes[modifier|modifier le code]

La découverte d'ARN possédant des capacitéscatalytiquesa été faite dans les années 1980, en particulier par l'équipe deThomas Cech,qui travaillait sur lesintronsdugènede l'ARN ribosomiqueduprotozoaireciliéTetrahymena[52],et celle deSidney Altman,qui étudiait laribonucléase P,l'enzymedematurationde l'ARNt[53].Cech et Altman ont été récompensés par leprix Nobel de chimieen 1989 pour cette découverte.
Dans ces deux cas, l'ARN seul est capable de catalyser une réaction declivage(coupure) ou detransestérificationspécifique en l'absence deprotéine.Ces ARN catalytiques ont été appelésribozymes,car ce sont desenzymesconstituées d'acide ribonucléique. Dans le cas de l'intron deTetrahymena,il s'agit d'unauto-épissage,l'intron étant son propresubstrat,tandis que la ribonucléase P est une enzyme agissant entrans,sur des substrats multiples.
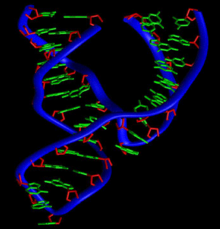
Depuis ces découvertes initiales, d'autres ribozymes naturels ont été identifiés:
- les ARN deviroïdesou devirussatellites (virusoïdes) qui sont capables de se cliver eux-mêmes[54];
- il existe aujourd'hui des arguments très forts, basés sur la résolution de sa structure 3D, pour affirmer que leribosome,le complexe deribonucléoprotéinesresponsable de latraductionde l'ARNmenprotéines,est lui-même un ribozyme[55].Les deuxsites actifsdu ribosome, le centre de décodage sur la petite sous-unité et le centrepeptidyltransférasequi forme lesliaisons peptidiques,sont en effet exclusivement composés de segments d'ARN ribosomique;
- lesplicéosome,qui catalyse l'épissagedesARNmcytoplasmiquesdeseucaryotes,est probablement aussi un ribozyme[43];
- certainsriboswitchs,qui sont des régions régulatrices structurées portées par des ARN messagers, ont une activité catalytique de coupure en présence d'unligand[56];
- il existe enfin des ribozymes synthétiques, qui ont été isolés par des méthodes d'évolutionin vitro,comme la techniqueSELEX[57],[58].On a ainsi pu isoler des ARN catalytiques synthétiques capables de catalyser une grande variété de réactions chimiques et de fixer des ligands très divers, ce qui a été interprété comme un argument en faveur de l'hypothèse dumonde à ARN.De tels ARN synthétiques sont parfois appelés desaptamères,puisqu'ils sont « aptes » à réaliser une tâche donnée[57].
De manière générale, dans tous ces ribozymes, c'est leurrepliementspécifique qui leur permet d'effectuer la reconnaissance de leur substrat et la catalyse, comme dans le cas des enzymes protéiques.
ARN guides[modifier|modifier le code]
Les ARN guides sont des ARN qui s'associent à des enzymes protéiques et servent à en guider l'action sur des ARN ou des ADN deséquencecomplémentaire.L'ARN guide s'apparie à l'acide nucléique substrat et permet de cibler l'activité de l'enzyme. On a identifié plusieurs types:
- lespetits ARN nucléolaires,ousnoARN:dans lenucléoledes cellules eucaryotes, ils dirigent l'action d'enzymes de modification de l'ARN ribosomique, en particulier les 2′-O-méthylations par les snoARN C/D et les pseudouridylations par les snoARN H/ACA[59].Ce mécanisme permet à la cellule de modifier spécifiquement de multiples positions de l'ARNr, avec une seule enzyme en utilisant différents snoARN comme guides. Les snoARN sont souvent codés par des séquencesintroniques[60];
- lesmicroARNsont également des ARN guides qui interviennent dans le processus d'interférence par ARN:associés à un complexe protéique appelé RISC (RNA induced silencing complex), ces petits ARN provoquent soit une dégradation de l'ARNm cible auquel ils s'apparient, soit unerépression de sa traduction[61];
- TERC(telomerase RNA component), la sous-unité ARN de latélomérase:cet ARN structuré est associé à latranscriptase inversequi synthétise lestélomères,extrémités deschromosomes.Il contient une séquence qui sert de substrat à la télomérase pour synthétiser l'ADN télomérique de séquence complémentaire[62].Il guide donc l'activité de l'enzyme, mais en servant de matrice, plutôt qu'en formant un appariement avec le substrat;
- leslincARN,présents chez les mammifères, sont de grands ARN intergéniques non codants mais transcrits comme les ARNm par l'ARN polyméraseII. Leur longueur leur permet d'adopter une structure tridimensionnelle complexe. Ces structures permettent leur interaction avec différent cofacteurs transcriptionnels tel quehnRNP-KouPRC2(principalement des inhibiteurs de la transcription). Ces complexes sont ensuite guidés grâce aux lincARN sur les séquences régulatrices des gènes afin d'inhiber leur expression. La liaison des lincARN avec l'ADN impliquerait un appariement des bases ARN avec les bases ADN correspondantes après désappariement de la double hélice d'ADN, voire la formation de triple hélice ADN-ADN-ARN[63].
ARN régulateurs[modifier|modifier le code]

Certains ARN jouent un rôle de régulateurs directs de l'expression génétique. C'est en particulier le cas d'ARN non codantspossédant des régions complémentaires d'ARN messagers cellulaires et qui peuvent donc s'y apparier pour former localement un double brin d'ARN. Ces ARNantisenspeuvent être issus du mêmelocusgénétique que leur ARN cible, par transcription du brin complémentaire, on parle alors d'ARNcis-régulateurs. Ils peuvent aussi être issus de la transcription d'une autre région du génome, ce sont alors des ARNtrans-régulateurs.
L'appariement de l'ARN régulateur avec son ARN messager cible peut agir sur la capacité de ce dernier à être traduit par le ribosome ou sur sa stabilité, ce qui aboutit à une régulation de la traduction du ou des gènes portés par l'ARN messager. Chez les bactéries, il existe ainsi de nombreux exemples d'ARN antisenscis- outrans-régulateurs qui bloquent le site de démarrage de la traduction[64].Par exemple, le gène codant laporineOmpF est régulé par un ARN antisens appelé MicF.
Chez leseucaryotes,il existe aussi de grands ARN régulateurs, qui interviennent dans des processus de régulationépigénétique.L'exemple le mieux connu est celui de l'ARNXistchez les mammifères. Celui-ci inactive non pas un gène, mais un chromosome entier. Xist recouvre l'un des deux chromosomes X de chaque cellule chez les individus femelles qui devient ainsi inactif[65].Un seul des deux chromosomes de la paire XX est ainsi actif, ce qui permet d'avoir le même taux d'expression des gènes portés par le chromosome X que chez les individus mâles, qui n'en ont qu'un. L'inactivation du X est un processus aléatoire, ce qui peut conduire à l'expression de différents phénotypes par différentes cellules, chez la même femelle. C'est par exemple le cas pour la couleur du pelage chez les chattes.
Utilisations thérapeutiques et biotechnologiques[modifier|modifier le code]
L'ARN est utilisé aujourd'hui dans un certain nombre d'applications en biologie moléculaire, en particulier grâce au processus d'interférence par ARN,qui consiste en l'introduction dans des cellules eucaryotes de courts fragments d'ARN double-brin appelés «petits ARN interférents». Longs d'une vingtaine de paires de bases, cespetits ARN interférents (pARNi)sont utilisés par une machinerie cellulaire capable de dégrader les ARNm de manière spécifique. Seuls les ARNm contenant une séquence correspondant à celle dupARNisont dégradés, ce qui permet de diminuer sélectivement l'expression d'une protéine donnée[66].Cette approche technologique est beaucoup plus simple et rapide que l'établissement de lignées murines inactivées (knock-out) et s'appelle unknock-down.
Des essais d'utilisation de cette technique à des fins thérapeutiques sont envisagés, par exemple en ciblant des gènes viraux pour lutter contre des infections, ou desoncogènes,dans le cas de cancers[67].Ils nécessitent cependant de stabiliser lespetits ARN interférents (pARNi)pour éviter leur dégradation par des ribonucléases et de cibler leur action vers les cellules concernées.
Historique[modifier|modifier le code]
Lesacides nucléiquesont été découverts en 1868 parFriedrich Miescher[68].Miescher appela la nouvelle substance « nucléine » car elle se trouvait dans lenoyaudes cellules. La présence d'acides nucléiques dans le cytoplasme de la levure fut identifiée en 1939[69]et leur nature ribonucléique fut établie, contrairement aux chromosomes qui contenaient de l'ADN avec des désoxyriboses.
Vers1940,le biologiste belgeJean Brachetétudia l'ADN et l'ARN, encore appelées à l'époque les « acides thymonucléiques et zymonucléiques » (respectivement l'ADN et l'ARN). Il découvrit que l'ADN est un composant deschromosomeset qu'il est synthétisé lorsque les cellules se divisent après lafécondation.Il mit en évidence l'existence d'ARN dans tous les types cellulaires: dans lenoyau,lenucléoleet lecytoplasmede toutes les cellules, alors que l'on pensait à l'époque que ces molécules étaient caractéristiques des cellules végétales et deseucaryotesinférieurs tels que leslevures.Enfin, il montra que ces acides sont particulièrement abondants dans les cellules (plus particulièrement dans l'ergastoplasme) très actives en termes desynthèse protéique.Les bases fondamentales de labiologie moléculaireétaient établies. Après la seconde guerre mondiale, Jean Brachet fut rejoint par lebiologiste moléculairebelgeRaymond Jeener,qui participa activement aux recherches sur le rôle de l'ARN dans labiosynthèse des protéines[70].
À la fin des années 1950,Severo Ochoaparvint à synthétiserin vitrodes molécules d'ARN au moyen d'une enzyme spécifique, la polynucléotide phosphorylase, ce qui permit l'étude des propriétés chimiques et physiques de l'ARN.
Le rôle de l'ARN comme « messager » intermédiaire entre l'information génétique contenue dans l'ADN et les protéines fut proposé en 1960 parJacques MonodetFrançois Jacob[71]à la suite d'une discussion avecSydney BrenneretFrancis Crick[72].La démonstration de l'existence de l'ARN messager a été faite parFrançois Gros[73].Ensuite, le déchiffrage du code génétique a été réalisé parMarshall Nirenbergdans la première moitié des années 1960. Il utilisa pour cela des ARN synthétiques de séquence nucléotidique connue dont il étudia les propriétés de codage.
Les ribosomes furent observés pour la première fois par le biologiste belgeAlbert Claudeau début des années 1940. Par des techniques de fractionnement subcellulaire et demicroscopie électronique,il mit en évidence des « petites particules » de nature ribonucléoprotéique, présentes dans tous les types de cellules vivantes. Il les baptisa « microsomes »[74],plus tard renommés ribosomes.
Lastructure secondairedesARNta été établie parRobert Holley,qui est parvenu à purifier et à analyser la séquence de l'ARNt spécifique de l'alanine en 1964[49].Ce fut un progrès majeur dans la compréhension du déchiffrage du message génétique porté par les ARN messagers. La structure tridimensionnelle d'un ARNt a été résolue en 1974, indépendamment, par les équipes deAaron Kluget Alexander Rich[50],montrant pour la première fois la structure complexe d'un ARN. L'existence de propriétés catalytiques des ARN a été établie indépendamment parSidney AltmanetTom Cechen 1982, sur laribonucléase P[53]d'une part et sur les introns autoépissables d'autre part[52].La résolution de la structure des sous-unités individuelles du ribosome en 2000 par les équipes deTom Steitz,Ada YonathetVenki Ramakrishnan[75],[76],[77],puis celle du ribosome entier par l'équipe de Harry Noller en 2001[78],constituèrent un progrès essentiel dans la compréhension du mécanisme central de la biologie qu'est la traduction des ARNm en protéines. De plus, cela permit de montrer, entre autres, que le ribosome était aussi un ribozyme.
Durant les années 1970,Timothy Leary,dans son ouvrageLa Politique de l'Extase,verra dans l'ARN la promesse d'une future modification de la conscience (possiblement via de nouvelles drogues, et/ou d'exercices spirituels), dont il serait une composante agrandissant les capacités d'apprentissage de celui qui se livrerait à de telles expériences[79].
Hypothèse du monde à ARN[modifier|modifier le code]
L'hypothèse du monde à ARNest une hypothèse suivant laquelle l'ARN serait le précurseur de toutes lesmacromoléculesbiologiques et particulièrement de l'ADN et des protéines qui auraient permis dans un environnementabiotique(caractérisé par unechimie prébiotiqueen partie hypothétique) l'apparition de premières cellules vivantes, c'est-à-dire formant un compartiment, et comportant de l'information et des sous-systèmes métaboliques.
Dans le cadre de l'étude desorigines de la vie,cette hypothèse permet une explication de l'apparition des différentes fonctions biologiques via la constitution de certains blocs biomoléculaires à partir d'intermédiaires prébiotique plausibles et de molécules basées sur le carbone[80].Il a été démontré en 2009 par l'équipe deJohn Sutherlandque des précurseurs plausibles des ribonucléotides, des acides aminés et des lipides peuvent tous être obtenus par homologation réductrice du cyanure d'hydrogène et de certains de ses dérivés. Chacun des sous-systèmes cellulaires connus pourrait donc être expliqué par la chimie du carbone, avec des réactions catalysées par lalumière ultraviolettea prioritrès présente avant l'apparition de lacouche d'ozone,à partir du sulfure d'hydrogène comme agent réducteur[80].Le cycle photoréducteur pourrait lui-même être accéléré par le cuivre [Cu(I)-Cu(II)][80].
Notes et références[modifier|modifier le code]
- (en)Rebecca K.Montangeet Robert T.Batey,«Structure of the S-adenosylmethionine riboswitch regulatory mRNA element»,Nature,vol.441,no7097,,p.1172-1175(PMID16810258,lire en ligne)
- H.Lodish,A.Berk,P.Matsudaira,C.A.Kaiser,M.Krieger,M.P.Scott,L.Zipurskyet J.Darnell,Biologie moléculaire de la cellule,Bruxelles, de Boeck,,3eéd.(ISBN978-2804148027)
- (en)WolframSaenger,Principles of nucleic acid structure,Springer,(ISBN0-387-90762-9)
- (en)JanBarciszewskiet Brian Frederic CarlClark,RNA biochemistry and biotechnology,Springer,,73-87p.(ISBN0-7923-5862-7,OCLC52403776)
- Modification and Editing of Rna. Henri Grosjean, Rob Benne. ASM Press, 1998.
- Marie-Christine Maurel, Anne-Lise Haenni: The RNA World: Hypotheses, Facts and Experimental Results.
- (en)M.Sudaralingam,«Stereochemistry of nucleic acids and their constituents. IV. Allowed and preferred conformations of nucleosides, nucleoside mono-, di-, tri-, tetraphosphates, nucleic acids and polynucleotides»,Biopolymers,vol.7,no6,,p.821-860(lire en ligne)
- (en)R.Langridgeet P.J.Gomatos,«The Structure of RNA. Reovirus RNA and transfer RNA have similar three-dimensional structures, which differ from DNA.»,Science,vol.141,no4,,p.694-698(PMID13928677)
- (en)H.R.Drew,R.M.Wing,T.Tanako,CBroka,STanaka,KItakuraet R.E.Dickerson,«Structure of a B-DNA dodecamer: conformation and dynamics.»,Proc. Natl. Acad. Sci. USA,vol.78,no4,,p.2179-2183(PMID6941276,lire en ligne)
- (en)Peter S.Klosterman,Sapan A.Shahet Thomas A.Steitz,«Crystal structures of two plasmid copy control related RNA duplexes: An 18 base pair duplex at 1.20 A resolution and a 19 base pair duplex at 1.55 A resolution.»,Biochemistry,vol.38,no45,,p.14784-14792(PMID10555960,DOI10.1021/bi9912793,lire en ligne)
- (en)J.M.Rosenberg,N.C.Seeman,J.J.Kim,F.L.Suddath,H.B.Nicholaset A.Rich,«Double helix at atomic resolution.»,Nature,vol.243,no5403,,p.150-154(PMID4706285,lire en ligne)
- (en)R.O.Day,N.C.Seeman,J.M.Rosenberget A.Rich,«A Crystalline Fragment of the Double Helix: The Structure of the Dinucleoside Phosphate Guanylyl-3',5'-Cytidine.»,Proc. Natl. Acad. Sci. USA,vol.70,no3,,p.849-853(PMID4514996,lire en ligne)
- (en)AlexanderRichet David R.Davies,«A new two stranded helical structure: Polyadenylic acid and polyuridylic acid»,J. Am. Chem. Soc.,vol.78,no14,,p.3548-3549(DOI10.1021/ja01595a086,lire en ligne)
- (en)D.E.Draper,«Protein-RNA recognition»,Annu. Rev. Biochem.,vol.64,,p.593-620(PMID7574494,lire en ligne)
- (en)S.A.Woodson,«Metal ions and RNA folding: a highly charged topic with a dynamic future»,Curr. Opin. Chem. Biol.,vol.9,no2,,p.104-9(PMID15811793,lire en ligne)
- (en)P.Doty,H.Boedtker,J.R.Fresco,R.Haselkornet M.Litt,«Secondary Structure in Ribonucleic Acids»,Proc. Natl. Acad. Sci. USA,vol.45,no4,,p.482-499(PMID16590404)
- F.Dardelet F.Képès,Bioinformatique: génomique et post-génomique,Éditions de l'École Polytechnique,,153-180p.(ISBN978-2730209274)
- (en)A.M.Michelson,«Hyperchromicity and nucleic acids»,Nature,vol.182,no4648,,p.1502-1503(PMID13613306)
- (en)K.Hoogsteen,«The crystal and molecular structure of a hydrogen-bonded complex between 1-methylthymine and 9-methyladenine»,Acta Cryst.,vol.16,,p.907-916(DOI10.1107/S0365110X63002437)
- (en)H.A.Heuset A.Pardi,«Structural features that give rise to the unusual stability of RNA hairpins containing GNRA loops»,Science,vol.253,no5016,,p.191-194(PMID1712983)
- (en)N.B.Leontiset E.Westhof,«The non-Watson-Crick base pairs and their associated isostericity matrices»,Nucleic Acids Res.,vol.30,no16,,p.3497-3531(PMID12177293)
- (en)D.W.Stapleet S.E.Butcher,«Pseudoknots: RNA Structures with Diverse Functions.»,PloS Biol.,vol.3,no6,,e213(PMID15941360,lire en ligne)
- (en)M.Costaet F.Michel,«Frequent use of the same tertiary motif by self-folding RNAs»,EMBO J.,vol.14,,p.1276-1285(PMID7720718,lire en ligne)
- (en)P.J.Gomatoset I.Tamm,«The secondary structure of reovirus RNA»,Proc. Natl. Acad. Sci. USA,vol.49,no5,,p.707-714(PMID16591092)
- (en)R.Markhamet J.D.Smith,«The Structure of Ribonucleic Acids 1. Cyclic nucleotides produced by ribonuclease and by alkaline hydrolysis»,Biochem. J.,vol.52,no4,,p.552-557(PMID13018277,lire en ligne)
- Walter Gilbert, «The RNA World»,Nature319, 1986,p.618
- Biochimie de Harper, Harold A Harper, A Harold
- (en)S.T.Smaleet J.T.Kadonaga,«The RNA polymerase II core promoter»,Ann. Rev. Biochem.,vol.72,,p.449-479(PMID12651739,lire en ligne)
- (en)R.P.Lifton,M.L.Goldberg,R.W.Karpet D.S.Hogness,«The organization of the histone genes in Drosophila melanogaster: functional and evolutionary implications»,Cold Spring Harb. Symp. Quant. Biol.,vol.42,,p.1047-1051(PMID98262,lire en ligne)
- (en)D.Pribnow,«Nucleotide sequence of an RNA polymerase binding site at an early T7 promoter»,Proc. Natl. Acad. Sci. USA,vol.72,,p.784-788(PMID1093168,lire en ligne)
- (en)B.A.Hamkaloet O.L.Miller,«Electronmicroscopy of genetic activity»,Annu. Rev. Biochem.,vol.42,,p.376-396(PMID4581229)
- (en)W.R.McClureet Y.Chow,«The kinetics and processivity of nucleic acid polymerases»,Methods Enzymol.,vol.64,,p.277-297(PMID6990186,lire en ligne)
- (en)H. Bremer et P.P. Dennis,« Modulation of chemical composition and other parameters of the cell by growth rate »,dans F.C Neidhardt, R Curtiss, III, J.L Ingraham, E.C.C Lin, K.B Low, B Magasanik, W.S Reznikoff, M Riley, M Schaechter et H.E Umbarger,Escherichia coli and Salmonella typhimurium Cellular and Molecular Biology,Washington, DC, ASM Press,(ISBN0-914826-89-1,lire en ligne),p.1553-1569
- (en)S.Adhyaet M.Gottesman,«Control of transcription termination»,Annu. Rev. Biochem.,vol.47,,p.967-996(PMID354508,lire en ligne)
- (en)M.S.Ciampi,«Rho-dependent terminators and transcription termination»,Microbiology,vol.152,,p.2515-2528(PMID16946247,lire en ligne)
- (en)M.Edmonds,«A history of poly A sequences: from formation to factors to function»,Prog. Nucleic Acid res. Mol. Biol.,vol.71,,p.285-389(PMID12102557,lire en ligne)
- (en)A.K.Banerjee,«5'-terminal cap structure in eucaryotic messenger ribonucleic acids»,Microbiol. Rev,vol.44,no2,,p.175-205(PMID6247631,lire en ligne)
- (en)M.Edmondset R.Abrams,«Polynucleotide biosynthesis: formation of a sequence of adenylate units from adenosine triphosphate by an enzyme from thymus nuclei»,J. Biol. Chem.,vol.235,,p.1142-1149(PMID13819354,lire en ligne)
- (en)M.Dreyfuset P.Régnier,«The poly(A) tail of mRNAs: bodyguard in eukaryotes, scavenger in bacteria»,Cell,vol.111,,p.611-613(PMID12464173,lire en ligne)
- (en)J.P.Staleyet C.Guthrie,«Mechanical devices of the spliceosome: motors, clocks, springs, and things»,Cell,vol.92,,p.315-326(PMID9476892,lire en ligne)
- (en)W.E.Cohn,«Pseudouridine, a carbon-carbon linked ribonucleoside in ribonucleic acids: isolation, structure, and chemical characteristics»,Journal of Biological Chemistry,vol.235,,p.1488-1498(PMID13811056,lire en ligne)
- (en)J.A.Kowalak,J.J.Dalluge,J.A.McCloskeyet K.O.Stetter,«The role of posttranscriptional modification in stabilization of transfer RNA from hyperthermophiles»,Biochemistry,vol.28,,p.7869-7876(PMID7516708)
- (en)S.Valadkhan,A.Mohammadi,Y.Jaladatet S.Geisler,«Protein-free small nuclear RNAs catalyze a two-step splicing reaction»,Proc. Natl. Acad. Sci. USA,vol.106,,p.11901-11906(PMID19549866)
- (en)S.Brenner,F.Jacobet M.Meselson,«An unstable intermediate carrying information from genes to ribosomes for protein synthesis»,Nature,vol.190,,p.576-581
- (en)B.N.Ameset R.G.Martin,«Biochemical aspects of genetics: The operon»,Annu. Rev. Biochem.,vol.33,,p.235-258(PMID14268834)
- (en)C.Yanofsky,«Establishing the triplet nature of the genetic code»,Cell,vol.128,,p.815-818(PMID17350564)
- (en)Huijing Shi et Peter B. Moore,«The crystal structure of yeast phenylalanine tRNA at 1.93 Å resolution: A classic structure revisited»,RNA,vol.6,no8,,p.1091-1105(PMID10943889,PMCID1369984,DOI10.1017/S1355838200000364,lire en ligne)
- (en)M.B.Hoagland,M.LStephenson,J.F.Scott,H.I.Hechtet P.C.Zamecnik,«A soluble ribonucleic acid intermediate in protein synthesis»,J. Biol. Chem.,vol.231,,p.241-257(PMID13538965)
- (en)R.W.Holley,J.Apgar,G.A.Everett,J.T.Madison,M.Marquisee,S.H.Merrill,J.R.Penswicket A.Zamir,«Structure of a ribonucleic acid»,Science,vol.147,,p.1462-1465(PMID14263761)
- (en)J.D.Robertus,J.E.Ladner,J.T.Finch,D.Rhodes,R.S.Brown,B.F.Clarket A.Klug,«Structure of yeast phenylalanine tRNA at 3 A resolution.»,Nature,vol.250,,p.546–551(PMID4602655),(en)S.H.Kim,F.L.Suddath,G.J.Quigley,A.McPherson,J.L.Sussman,A.H.Wang,N.C.Seemanet A.Rich,«Three-dimensional tertiary structure of yeast phenylalanine transfer RNA.»,Science,vol.250,,p.546–551(PMID4601792)
- (en)Francis H.Crick,«On protein synthesis»,Symp. Soc. Exp. Biol.,vol.12,,p.138-163(PMID13580867,lire en ligne)
- (en)K.Kruger,P.J.Grabowski,A.J.Zaug,J.Sands,D.E.Gottschlinget T.R.Cech,«Self-splicing RNA: autoexcision and autocyclization of the ribosomal RNA intervening sequence of Tetrahymena»,Cell,vol.31,,p.147-157(PMID6297745)
- (en)C.Guerrier-Takada,K.Gardiner,T.Marsh,N.Paceet S.Altman,«The RNA moiety of ribonuclease P is the catalytic subunit of the enzyme»,Cell,vol.35,,p.849-857(PMID6197186)
- (en)A.C.ForsteretDavies,«Characterization of self-cleavage of viroid and virusoid RNAs.»,Methods Enzymol.,vol.181,,p.583-607(PMID2199768)
- (en)T.R.Cech,«Structural biology. The ribosome is a ribozyme.»,Science,vol.289,,p.878-879(PMID10960319)
- (en)J.E.Barrick,K.A.Corbino,W.C.Winkler,A.Nahvi,M.Mandal,J.Collins,M.Lee,A.Roth,N.Sudarsan,I.Jona,J.K.Wickiseret R.R.Breaker,«New RNA motifs suggest an expanded scope for riboswitches in bacterial genetic control.»,Proc. Natl. Acad. Sci. USA,vol.101,,p.6421-6426(PMID15096624)
- (en)A.D.Ellingtonet J.W.Szostak,«In vitro selection of RNA molecules that bind specific ligands»,Nature,vol.346,,p.818-822(PMID1697402)
- (en)C.Tuerket L.Gold,«Systematic evolution of ligands by exponential enrichment: RNA ligands to bacteriophage T4 DNA polymerase.»,Science,vol.249,,p.505-510(PMID2200121)
- (en)Z.Kiss-László,Y.Henry,J.P.Bachellerie,M.Caizergues-Ferreret T.Kiss,«Site-specific ribose methylation of preribosomal RNA: a novel function for small nucleolar RNAs.»,Cell,vol.85,,p.1077-1088(PMID8674114)
- (en)J.Liu,«Novel intron-encoded small nucleolar RNAs.»,Cell,vol.75,,p.403-405(PMID8221882)
- (en)B.Sollner-Webb,«Control of protein synthesis and mRNA degradation by microRNAs»,Curr. Opin. Cell Biol.,vol.20,,p.214-221(PMID18329869)
- (en)D.Shippen-Lentzet E.H.Blackburn,«Functional evidence for an RNA template in telomerase»,Science,vol.247,,p.546-552(PMID1689074)
- (en)M.Huarte,T.Jackset J.L.Rinn,«A Large Intergenic Noncoding RNA Induced by p53 Mediates Global Gene Repression in the p53 Response»,Cell,vol.142,,p.409-419(PMID20673990)
- (en)E.G.Wagneret R.W.Simons,«Antisense RNA control in bacteria, phages, and plasmids»,Annu. Rev. Microbiol.,vol.48,,p.713-742(PMID3685996)
- (en)E.Heard,«Recent advances in X-chromosome inactivation.»,Curr. Opin. Cell Biol.,vol.16,,p.247-255(PMID15145348)
- (en)A.Fire,S.Xu,M.Montgomery,S.Kostas,S.Driveret C.Mello,«Potent and specific genetic interference by double-stranded RNA inCaenorhabditis elegans.»,Nature,vol.391,,p.806-811
- ClaudeHélène,«Les promesses de l'ARN thérapeutique = Genetic interference by RNA.»,Le Concours Médical,vol.124,,p.2550-2552
- (en)RDahm,«Friedrich Miescher and the discovery of DNA»,Dev. Biol.,vol.278,no2,,p.274–88(PMID15680349,DOI10.1016/j.ydbio.2004.11.028)
- (en)T.Casperssonet J.Schultz,«Pentose nucleotides in the cytoplasm of growing tissues»,Nature,vol.143,,p.602–3(DOI10.1038/143602c0)
- https://www.ulb.ac.be/ibmm/historique.html
- (en)F.JacobetJ.Monod,«Genetic regulatory mechanisms in the synthesis of proteins.»,Journal of Molecular Biology,vol.3,,p.318–356(PMID13718526)
- François Jacob,La statue intérieure,Gallimard,coll.« Folio » (no2156),,438p.(ISBN978-2-070-38246-0et2-070-38246-X,BNF35085459)
- (en)F.Gros,H.Hiatt,W.Gilbert,C.G.Kurland,R.W.Risebroughet J.D.Watson,«Unstable ribonucleic acid revealed by pulse labelling of Escherichia coli»,Nature,vol.190,,p.581-585(PMID13708983)
- (en)A.Claude,«The constitution of protoplasm»,Science,vol.97,no2525,,p.451–456(PMID17789864,DOI10.1126/science.97.2525.451)
- (en)N.Ban,P.Nissen,J.Hansen,P.B.Mooreet T.A.Steitz,«The complete atomic structure of the large ribosomal subunit at 2.4 A resolution.»,Science,vol.289,,p.905-920(PMID10937989)
- (en)F.Schluenzen,A.Tocilj,R.Zarivach,J.Harms,M.Gluehmann,D.Janell,A.Bashan,H.Bartels,I.Agmon,F.Franceschiet A.Yonath,«Structure of functionally activated small ribosomal subunit at 3.3 angstroms resolution.»,Cell,vol.102,,p.615–623(PMID11007480)
- (en)D.E.Brodersen,«Structure of the 30S ribosomal subunit.»,Nature,vol.407,,p.1143-1154(PMID11014182)
- (en)M.M.Yusupov,G.Z.Yusupova,A.Baucom,K.Lieberman,T.N.Earnest,J.H.Cateet H.F.Noller,«Crystal structure of the ribosome at 5.5 A resolution.»,Nature,vol.292,,p.883-896(PMID11283358)
- La politique de l'Extase, Timothy Leary, 1974, Ed. Fayard, Paris,p.115-120
- Bhavesh H. Patel, Claudia Percivalle, Dougal J. Ritson, Colm D. Duffy & John D. Sutherland (2015),Common origins of RNA, protein and lipid precursors in a cyanosulfidic protometabolism;Nature Chemistry (résumé)
Voir aussi[modifier|modifier le code]
Articles connexes[modifier|modifier le code]
- Liste de types d'ARN
- Acide ribonucléique messager
- Ribosome
- Ribozyme
- ARN double-brin
- microARN
- ARN interférent
- Liste d'abréviations de biologie cellulaire et moléculaire
- brin transcrit
- RNA-Seq
- Liste d'acides
Liens externes[modifier|modifier le code]
- Ressources relatives à la santé:
- Notices dans des dictionnaires ou encyclopédies généralistes:
- RNA World à l'Institut Fritz LipmanCollection de liens sur le « monde de l'ARN » (structures, sequences, outils, publications)