Acide glutamique
| Acide glutamique | |
 Acide L ouS(+)-glutamique(énantiomèrebiologique). 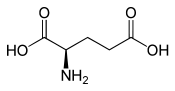 Acide D ouR(–)-glutamique. |
|
| Identification | |
|---|---|
| Nom UICPA | Acide 2-aminopentanedioïque |
| Synonymes |
E, Glu |
| NoCAS | (racémique) (D) ouR(–) (L) ouS(+) |
| NoECHA | 100.009.567 |
| NoCE | 200-293-7 |
| Code ATC | A09 |
| PubChem | 33032 |
| ChEBI | 18237 |
| NoE | E620 |
| FEMA | 3285 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C5H9NO4[Isomères] |
| Masse molaire[1] | 147,129 3 ± 0,006g/mol C 40,82 %, H 6,17 %, N 9,52 %, O 43,5 %, |
| pKa | 2,19 4,25 9,67[réf.souhaitée] |
| Propriétés physiques | |
| T°fusion | 247à249°C[réf.souhaitée] |
| Solubilité | soluble dans l'eau, peu soluble dans l'éthanol |
| Masse volumique | 1,538 g/cm3[réf.souhaitée] |
| Propriétés biochimiques | |
| Codons | GAA, GAG |
| pH isoélectrique | 3,22[2] |
| Acide aminé essentiel | selon les cas |
| Occurrence chez lesvertébrés | 5,8 %[3] |
| Propriétés optiques | |
| Indice de réfraction | 1,538[réf.souhaitée] |
| Précautions | |
| SIMDUT[4] | |
Produit non contrôlé |
|
| Unités duSIetCNTP,sauf indication contraire. | |
| modifier |
|
L'acide glutamique(abréviationsIUPAC-IUBMB:GluetE), ouglutamatesous la forme anionique de l'acide glutamique, est unacideα-aminédont l'énantiomèreLest l'un des22 acidesaminés protéinogènes,encodésur lesARN messagerspar lescodonsGAA et GAG. Il est caractérisé par la présence d'ungroupecarboxyle–COOH à l'extrémité de sachaîne latérale,ce qui en fait unrésiduacidechargé négativement dans lesprotéines.Sonrayon de van der Waalsvaut 2,109Å.Il n'est pasessentielpour l'être humain,mais peut dans certains cas êtreproduiten quantité insuffisante par l'organisme, nécessitant alors un apportalimentaire.
L'acide glutamique joue un rôle critique pour sa propre fonction cellulaire, mais n'est pas considéré comme un nutriment essentiel chez les humains car le corps peut le fabriquer à partir de composés plus simples, comme par transamination de l'α-cétoglutarate, produit intermédiaire de l'oxydation des sucres simples dans lamitochondrie(cycle de Krebs).
Le glutamate, forme ionisée de l'acide glutamique, est le neurotransmetteur excitateur le plus important du système nerveux central. Son action est contrebalancée par les effets inhibiteurs duGABAdont il est d'ailleurs le précurseur principal.
Utilisé comme exhausteur de goût car responsable du goûtumamisous sa forme de sel de sodium (glutamate monosodiqueou monosodium glutamate), il n'est généralement pas considéré comme toxique. En effet, il ne passe pas labarrière hémato-encéphaliquecar il est trop hydrophile[5],[6].Le glutamate à forte concentration et en usage chronique présente une toxicité bien documentée, malgré des résultats contrastés. Son usage chronique est accusé de provoquer des effets neurotoxiques[6],[7]et des dommages rénaux à concentration excessive[8],sans que ces éléments ne soient parfaitement éclaircis.
Lorsque l'équilibre est rompu et que la concentration en glutamate atteint un niveau excessif dans lafente synaptique,ou encore lorsqu'il demeure trop longtemps dans cette fente synaptique, il peut hyperstimuler les neurones et provoquer leur mort.
Neurotransmetteur
[modifier|modifier le code]L'acide glutamique n'est pas seulement l'une des briques élémentaires utilisées pour labiosynthèse des protéines,c'est aussi leneurotransmetteurexcitateur le plus répandu dans lesystème nerveux central(encéphale + moelle épinière) et un précurseur duGABAdans les neurones GABAergiques. Il serait le médiateur de près de 50 % des neurones centraux[9].C'est le neurotransmetteur excitateur principal desneurones pyramidaux,neurones de projection trouvés dans les connexions corticostriatales et corticothalamiques.
Le glutamate active lesrécepteurs ionotropesAMPA,NMDAetkaïnateKAR, ainsi que lesrécepteurs métabotropes.L'acide glutamique lui-même ne franchit que mal labarrière hémato-encéphalique,à moins d'avoir été transformé en L-glutamineutilisable par le cerveau comme carburant cellulaire et pour la synthèse protéique, ou pour la constitution des stocks présynaptiques de glutamate.
Le glutamate est formé dans les mitochondries des neurones suivant deux voies: soit par une transamination de l'alpha-cétoglutarate (un métabolite ducycle de Krebsmitochondrial), soit par une désamination oxydative de laglutaminepar l'enzyme glutaminase. Il est ensuite stocké dans les vésicules des neurones glutaminergiques.
Lorsqu'un potentiel d'action arrive à l'extrémité de l'axone,les vésicules déversent parexocytose,leur glutamate dans la fente synaptique.
Le glutamate se lie alors à divers récepteurs post-synaptiques. Les récepteurs-canaux, NMDA, AMPA et KAR (ou récepteurs ionotropes) laissent entrer des cations (Na+,K+,Ca2+). L'entrée de charges positives active les canaux sodiques voltage-dépendants qui déclenchent la décharge d'un potentiel d'action.
Lesrécepteurs couplés aux protéines G,mglu1 à mglu8 (ou récepteurs métabotropes) activent indirectement des canaux ioniques par l'intermédiaire d'une cascade de réactions impliquant lesprotéines G.L'intervention de ces nombreux intermédiaires ralentit le traitement de l'information mais permet des activations multiples.
Dans la fente synaptique, le glutamate n'est pas métabolisé. Les molécules qui ne sont pas captées par les récepteurs post-synaptiques sont alors principalement captées par lescellules glialesvoisines et métabolisées englutamine:
Glutamate +ATP+ NH3→ Glutamine +ADP+ phosphate
 |
 |
La glutamine est ensuite exportée dans le milieu extracellulaire où elle sera captée par les neurones glutaminergiques. Ce recyclage bicellulaire est nommécycle glutamate-glutamine.
Les récepteurs ionotropes du glutamate, NMDA, AMPA, KAR
[modifier|modifier le code]Cesrécepteurs-canauxsont constitués de l'association de sous-unités différentes, sous forme généralement de tétramères. Ces sous-unités sont desprotéinestransmembranaires codées par des gènes donnés dans le tableau ci-dessous. Cette diversité serait encore augmentée par l'épissagealternatif de plusieurs sous-unités[10],[11].
| Famille de récepteurs | Sous-unité | Gène | Chromosome (humain) |
|---|---|---|---|
| NMDA | NR1 | GRIN1 | 9q34.3 |
| NR2A | GRIN2A | 16p13.2 | |
| NR2B | GRIN2B | 12p12 | |
| NR2C | GRIN2C | 17q24-q25 | |
| NR2D | GRIN2D | 19q13.1qter | |
| NR3A | GRIN3A | 9q31.1 | |
| NR3B | GRIN3B | 19p13.3 | |
| AMPA | GluR1 | GRIA1 | 5q33 |
| GluR2 | GRIA2 | 4q32-33 | |
| GluR3 | GRIA3 | Xq25-26 | |
| GluR4 | GRIA4 | 11q22-23 | |
| KAR | GluR5 | GRIK1 | 21q21.1-22.1 |
| GluR6 | GRIK2 | 6q16.3-q21 | |
| GluR7 | GRIK3 | 1p34-p33 | |
| KA-1 | GRIK4 | 11q22.3 | |
| KA-2 | GRIK5 | 19q13.2 |
Les sous-unités des récepteurs ionotropes du glutamate comportent toutes uneextrémité C-terminaleintracellulaire et 3 hélices transmembranaires.
 |
 |
Les récepteurs NMDA sont des tétramères, formés de deux sous-unités NR1 et de deux sous-unités NR2 (NR2A, NR2B, NR2C ou NR2D). Les sous-unités NR1 sont obligatoires, tandis que les sous-unités NR2 spécifient les propriétés électrophysiologiques des récepteurs NMDA, telles leur sensibilité au glutamate, leur perméabilité au calcium, l'inhibition du magnésium. Les sous-unités NR3 A et B ont un effet inhibiteur sur l'activité des récepteurs.
Le L-glutamate se fixe à l'extrémité N-terminale des sous-unités NR2A et NR2B durécepteur NMDA.Pour l'activer, laglycinedoit aussi se fixer sur NR1. C'est un coagoniste du glutamate. La fixation du glutamate sur le domaine extracellulaire entraîne un changement de conformation des sous-unités et l'ouverture du pore de façon progressive.
Plusieurs molécules sont aussi susceptibles de moduler l'activité des récepteurs NMDA. C'est le cas des ionsmagnésiumMg2+qui se fixent sur des sites situés dans le canal ionique et les obstruent. La dépolarisation membranaire, induite par l'activation desrécepteurs AMPA,permet de déloger ces ions et de lever le blocage.
Lesrécepteurs NMDAsont largement répandus dans tout le système nerveux, généralement colocalisés avec les récepteurs AMPA. Ils sont très nombreux dans le cerveau antérieur avec une densité élevée dans la région CA1 de l'hippocampe[9].
La stimulation des récepteurs post-synaptiques génère despotentiels post-synaptiques excitateurs.Elle s'accompagne d'entrée de calciumentraînant la stimulation de la protéine kinase activée par le couple calcium-calmoduline,CAM-kinase 2,impliquée dans le phénomène depotentialisation à long terme(LTPlong term potentialisation). Ce phénomène de LTP est à la base desprocessus d'apprentissage et de mémorisation.
L'entrée excessive de calcium par hyperstimulation des récepteurs NMDA peut induire une mort neuronale parapoptosequi serait impliquée dans la neurodégénérescence observée dans lamaladie de Parkinson,lamaladie d'Alzheimeret les accidents ischémiques cérébraux.
L'activation des récepteurs AMPA déclenche l'ouverture d'un canal perméable au potassium et au sodium. Ainsi, le potassium sortira de la cellule alors que le sodium y entrera. Dans certains cas, il y a en plus une entrée de calcium, cela dépendant de la structure de l'AMPA (plus particulièrement de la présence ou non d'une sous-unité GluR2 éditée). Ainsi, il permettra la dépolarisation de la membrane du neurone cible du glutamate.
Lesrécepteurs kaïnate KARsont en général présynaptiques et situés sur des synapses glutamatergiques ou gabaergiques. On en trouve principalement dans l'hippocampe et dans les couches infragranuleuses du cortex cérébral. Les récepteurs KAR présynaptiques sont inhibiteurs par activation des protéines G trimériques Gi et Gq qui diminuent l'exocytose du glutamate ou du GABA. Il existe aussi des récepteurs KAR postsynaptiques excitateurs.
Les récepteurs métabotropes, mglu
[modifier|modifier le code]Lesrécepteurs métabotropesdu glutamate se présentent sous la forme d'homodimèresreliés par desponts disulfures[9].
Cesrécepteursmglu sont localisés sur lesneuronesdusystème nerveux centralet sur lescellules gliales.
Les récepteurs mglu1 et mglu5postsynaptiquesparticipent au phénomène depotentialisation à long terme.Les mglu1 sont abondants dans l'hippocampeet lethalamus.Les mglu5 se trouvent dans le cortex, le striatum ventral et des parties de l'hippocampe, de l'amygdale cérébraleet du thalamus. Ces deux récepteurs sont couplés aux protéines Gq et aux phospholipases C, ces dernières catalysant la formation dudiacylglycérol(DAG) et de l'inositol trisphosphate(IP3). Le DAG est un activateur de laprotéine kinase C.L'IP3, lui, se lie à son récepteur situé sur leréticulum endoplasmiqueet permet la libération decalciumdu réticulum vers lecytoplasme.
Le récepteur mglu6 lui aussi présent au niveaupostsynaptique,produit unedépolarisationlente.
Les récepteurs mglu2, 3, 4, 7, et 8 sont présynaptiques et provoquent une diminution de libération du glutamate.
Rôles
[modifier|modifier le code]Le glutamate est soupçonné de jouer un rôle dans les fonctions cérébrales d'apprentissageet demémorisation.Il est en effet un neurotransmetteur d'importance majeure. Un déséquilibre de son fonctionnement, essentiellement dans le cadre d'intoxications (kétamine,LSD), est susceptible d'entraîner des effets pathologiques comme ceux rencontrés dans lasclérose latérale amyotrophique,lamaladie d'Alzheimer,lelathyrisme.
Lepsychotropephencyclidine(plus connu sous le nom de PCP oupoudre d'ange) est uninhibiteur non compétitifdu glutamate pour lerécepteur NMDApar stabilisation des canaux ioniques de ces récepteurs dans l'état ouvert. Il provoque un comportement semblable à laschizophrénie.D'autre part, des doses dekétamine,un antagoniste des récepteurs NMDA, inférieures à celles utilisées enanesthésiologieentraînent des effets dissociatifs et deshallucinations.
L'action des glutamates se révèle très difficile à étudier de par sa nature éphémère. Une équipe de l'université Stanforda développé un nanodétecteur protéique pour observer parfluorescence/luminescencela sortieneuronaledu glutamate.
Ce détecteur, uneprotéine,possède une paire delobesarticulés autour d'une charnière, comme le piège de laplante carnivoreDionée attrape-mouche.Quand le glutamate se lie aux protéines, les lobes se referment. Deux protéinesfluorescentes,extraites d'uneméduse,sont fixées au détecteur. L'une d'entre elles émet uneluminescencebleue qui excite la seconde qui émet à son tour une luminescence jaune. Au moment où les lobes se referment sur le glutamate, la protéine bleue s'éloigne de la jaune diminuant l'intensité de la luminescence. Cette diminution signale que le glutamate est sorti duneurone.Ce détecteur ne peut, pour le moment, que se situer sur la surface de lacellule:il ne peut donc indiquer la présence de glutamate qu'à l'extérieur de la cellule[12].
On peut provoquer parultravioletla libération d'une forme spécifique de glutamate (glutamate en cage, « caged glutamate », après la stimulation UV, le glutamate est actif, « uncaged glutamate ») à un endroit choisi d'un ou de plusieurs neurones. Cette méthode dephotostimulations'est révélée très efficace pour cartographier les connexions interneuronales.
Le glutamate monosodique est utilisé dans le cadre d'expérience pour induire l'obésitéderatsavec des objectifs expérimentaux tels que la détermination des mécanismes de l'obésité[13].
Neurotoxicité
[modifier|modifier le code]En concentrations excessives dans le cerveau le glutamate déclenche un processus dit d'excitotoxicité,délétère, voire mortel, pour les neurones, particulièrement en cas d'activation desrécepteurs NMDA.
Sa toxicité peut être reliée à:
- un influx excessif et incontrôlé deCa2+dans la cellule, dépassant sa capacité de stockage. Il s'ensuit des altérationsmitochondriales[14],conduisant à une libération decytochromep450,menant à l'apoptose;
- une surexpression defacteurs de transcriptionde gènes pro-apoptotiques, ou une répression des facteurs anti-apoptotiques, médiée par le glutamate et le calcium.
Ces théories se fondent sur l'observation post-mortem de neurodégénération chez des patientsépileptiquesconnus.
Accès d'épilepsie
[modifier|modifier le code]Le glutamate a été impliqué dans les crises d'épilepsie,au vu de ladépolarisationfoudroyante (uneseconde) qu'il provoque in vitro par microinjection intraneuronale, laquelle dépolarisation reproduit le phénomène de shift de dépolarisation paroxystique observé sur EEG lors d'une crise in vivo[15].
Un mécanisme suggéré est la baisse du potentiel membranaire de repos au niveau du foyer épileptique, qui provoquerait l'ouverture de canaux voltage-dépendants, provoquant un influx de glutamate qui entretiendrait la dépolarisation.
Glutamate libre naturellement présent dans les aliments
[modifier|modifier le code]L'acide glutamique est unacide aminétrès commun, présent dans de nombreusesprotéinesvégétales et animales. C'est même l'acide aminé le plus abondant de l'alimentation humaine. Sa saveur spécifique n'est détectable que s'il est présent à l'état libre. Cette saveur, différente du sucré, du salé, de l'acide et de l'amer, a été reconnue pour la première fois en 1908, par le scientifique japonais Kikunae Ikeda, qui la nommaumami("le goût de ce qui est bon").
En tant que composant des protéines, le glutamate reste sans saveur, mais il peut exprimer toute sa sapidité en étant libéré par hydrolyse des protéines lors des processus defermentation,vieillissement, mûrissement ou cuisson des produits alimentaires[16].
L'acide glutamique libre est naturellement abondant dans desfromagescomme leparmesan,la sauce soja ou les tomates. C'est lui qui joue un rôle fondamental dans la saveur des fromages, des crustacés et des bouillons de viande. Voici les principales mesures faites par Kumiko Ninomiya[17](1998):
| Glutamate libre dans les aliments (d'après Ninomiya, 1998) | ||
| Classe | Produit alimentaire | Glutamate libre (mg/100g) |
|---|---|---|
| Fromages | Parmesan | 1 680 |
| Emmental | 308 | |
| Algues | Kelp | 1 608 |
| Wakame(Undaria) | 9 | |
| Sauce soja | chinoise | 926 |
| japonaise | 782 | |
| coréenne | 1 264 | |
| Végétaux | Tomate | 246 |
| Petits pois | 106 | |
| Chou | 50 | |
| Viandes | Bœuf | 10 |
| Poulet | 22 | |
| Crustacés | Coquille Saint-Jacques | 140 |
| Crabe royal | 72 | |
Dans certains aliments, le glutamate peut être très abondant sous sa forme liée et être libéré en partie lors de la préparation culinaire. Voici quelques mesures plus anciennes de Giacometti[18](1979):
| Glutamate lié ou libre dans les aliments, en mg/100g(d'après Giacometti, 1979) | |||
| Classe | Produit alimentaire | Glutamate lié | Glutamate libre |
|---|---|---|---|
| Poisson | Morue | 2 101 | 9 |
| Saumon | 2 216 | 36 | |
| Végétaux | Petits pois | 5 583 | 200 |
| Tomates | 238 | 140 | |
| Produits laitiers | Lait de vache | 819 | 2 |
| Parmesan | 9 847 | 1 200 | |
| Viandes | Poulet | 3 309 | 44 |
| Bœuf | 2 846 | 33 | |
Le glutamate, additif alimentaire
[modifier|modifier le code]Sous le code de E620, le glutamate est utilisé commeexhausteur de goûtdes aliments. Il est additionné aux préparations alimentaires pour renforcer leur goût.
Outre le glutamate[19],lecodex Alimentariusa reconnu aussi comme exhausteurs de goût ses sels de sodium (E621), de potassium (E622), calcium (E623), ammonium (E624) et magnésium (E625):
| no | Descriptif |
|---|---|
| E620 | Acide glutamique |
| E621 | Glutamate monosodique,GMS |
| E622 | Glutamate monopotassique |
| E623 | Diglutamate de calcium |
| E624 | Glutamate d'ammonium |
| E625 | Diglutamate de magnésium |
Leglutamate monosodique(GMS), sel sodique de l'acide glutamique, apporte une saveur semblable à celle de cet acide aminé avec l'avantage de contenir 3 fois moins de sodium que lesel de table.
Le glutamate (ou ses sels) est souvent présent dans les plats tout prêts (soupes, sauces, chips, plats cuisinés). Il est aussi couramment utilisé en cuisine asiatique.
Il est actuellement fréquemment utilisé en combinaison avec desarômesdans les apéritifs (goût bacon, goût fromage). Cela permet de rehausser le goût de bacon, du fromage,etc.Il est rare de trouver un apéritif qui n'en contienne pas. On en trouve aussi dans certaines capsules de médicaments, mais pas pour ses fonctions gustatives. Enfin, il est le composant majoritaire des auxiliaires de cuisine (bouillons cubes, fonds de sauces, sauces,etc.) courants dans la grande distribution, certains auxiliaires « bio » en contiennent beaucoup moins ou pas du tout.
Amélioration du goût et régime diététique
[modifier|modifier le code]Des études ont montré que l'addition de glutamate de sodium (GMS) augmentait la palatabilité[20]des aliments et stimulait l'appétit (Belliste[21]1998, Yamaguchiet al.[22]2000). Cet effet est plus net chez les enfants et les adultes que chez les personnes âgées. En faisant goûter des aliments avec différentes concentrations de GMS, on observe que certains ne sont pas améliorés (comme les produits sucrés) et que les autres ont une concentration optimum préférée[23].Cette concentration optimum varie d'un individu à l'autre. D'après les études de F. Bellisle[23],la concentration préférée des Européens (qui se trouve dans la fourchette de 0,6 à 1,2 %), tend à être supérieure à celle des Asiatiques. En général, l'assaisonnement au glutamate convient bien aux produits salés et aigrelets. La dose à ajouter, recommandée par Jinap et Hajeb[19],est de 0,5 à 4gpour 500gde nourriture, soit très peu (de 0,1 à 0,8 %), car un excès gâche rapidement le goût.
L'addition de GMS à un aliment, en améliorant son goût, ne risque-t-elle pas d'induire une consommation excessive, pouvant éventuellement conduire à une prise de poids? Cette hypothèse a été testée chez un groupe de personnes âgées (de 84 ans en moyenne) vivant dans des maisons spécialisées durant un an[21].L'addition de GMS à des aliments intéressants sur le plan nutritionnel (soupe, légumes, féculents) a induit une augmentation de leur consommation. Mais la taille totale de la prise alimentaire n'a pas varié, puisque l'accroissement de la consommation de produits assaisonnés au glutamate a été compensée par la diminution de la prise d'aliments servis plus tard, comme les desserts sucrés. La même observation a été faite auprès de patients diabétiques hospitalisés. À nouveau, les patients consommaient spontanément plus de produits recommandés assaisonnés de glutamate et moins d'autres produits, ce qui ne changeait pas l'apport énergétique global des repas. L'addition de GMS permet donc de réorienter les choix alimentaires.
Le « syndrome du restaurant chinois »
[modifier|modifier le code]Quelques cas d'intolérance au glutamate monosodique ont été rapportés, mais aucune recherche n'a permis d'établir un rapport entre glutamate monosodique et des intolérances d'une façon concluante.
De manière générale, le glutamate monosodique a longtemps été décrit comme responsable du « syndrome du restaurant chinois » du fait que la cuisine asiatique est très riche en glutamate[19].En cas de réaction, le premier symptôme est unflush(coloration rouge intense et passagère du visage, du cou et du torse). Peuvent apparaître aussi: yeux injectés de sang, céphalées, sensation de brûlures survenant au niveau du tronc et irradiant vers la périphérie, impression d'oppression thoracique,brûlures de la tête, bouffées de chaleur, nausées et vomissements, sensation d'étouffement, difficultés à respirer, tendance à faire des malaises,etc.
Cette affection survient un quart d'heure à une demi-heure après ingestion et peut durer jusqu'à deux heures. La puissance de cette réaction n'est pas forcément proportionnelle à la dose ingérée, quelques milligrammes suffisent. Son lien direct avec l'ingestion de glutamate n'est pas scientifiquement prouvé. À peu près une personne sur 5 000 serait sensible à son ingestion, mais curieusement une sur 50 000 dans les pays asiatiques.
Une étude randomisée, en double aveugle et contre placebo, menée en commun par quatre grandes universités américaines[24],publiée en 2000, et portant sur les effets potentiels de la consommation de glutamate[25]n'a pas conclu à l'influence du glutamate sur le « syndrome du restaurant chinois »[26].
De nombreux aliments utilisés dans la cuisine occidentale sont naturellement riches en glutamate libre[27]comme leparmesan(1 200mg/100g), leroquefort(1 280mg/100g)[28],latomate(140mg/100g), la pomme de terre (entre 30 et 100mg/100g)[27],lepois(200mg/100g) ainsi que la plupart des fruits de mer. Ils ne sont pas connus comme pouvant déclencher les symptômes du syndrome du restaurant chinois. Un repas dans un restaurant chinois peut contenir de 10 à 1 500mgde glutamate pour 100g.
Notes et références
[modifier|modifier le code]- Masse molaire calculée d’après«Atomic weights of the elements 2007», surwww.chem.qmul.ac.uk.
- (en)Francis A. Carey, «Table of pKa and pI values», surDépartement de chimie de l'université de Calgary,(consulté le).
- (en)M. Beals, L. Gross et S. Harrell, «Amino Acid Frequency», surThe Institute for Environmental Modeling (TIEM) à l'université du Tennessee(consulté le).
- «Acide glutamique (l-)» dans la base de données de produits chimiquesReptoxde laCSST(organisme québécois responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009.
- MatthewFreeman,«Reconsidering the effects of monosodium glutamate: a literature review»,Journal of the American Academy of Nurse Practitioners,vol.18,no10,,p.482–486(ISSN1041-2972,PMID16999713,DOI10.1111/j.1745-7599.2006.00160.x,lire en ligne,consulté le).
- H. N.Mallick,«Understanding safety of glutamate in food and brain»,Indian Journal of Physiology and Pharmacology,vol.51,no3,,p.216–234(ISSN0019-5499,PMID18341218,lire en ligne,consulté le).
- A.McCall,B. S.Glaeser,W.Millingtonet R. J.Wurtman,«Monosodium glutamate neurotoxicity, hyperosmolarity, and blood-brain barrier dysfunction»,Neurobehavioral Toxicology,vol.1,no4,,p.279–283(ISSN0191-3581,PMID121936,lire en ligne,consulté le).
- AmodSharma,«Monosodium glutamate-induced oxidative kidney damage and possible mechanisms: a mini-review»,Journal of Biomedical Science,vol.22,,p.93(ISSN1423-0127,PMID26493866,PMCIDPMC4618747,DOI10.1186/s12929-015-0192-5,lire en ligne,consulté le).
- Jean-Pierre Gies et Yves Landry,Pharmacologie. Des cibles vers l'indication thérapeutique,Dunod,,2eéd.
- (en)Dingledine R., Borges K., Bowie D. et Traynelis S.F., «The glutamate receptor ion channels»,Pharmacol. Rev.,vol.51,no1,,p.7–61(PMID10049997).
- (en)Andersson O., Stenqvist A., Attersand A. et von Euler G., «Nucleotide sequence, genomic organization, and chromosomal localization of genes encoding the human NMDA receptor subunits NR3A and NR3B»,Genomics,vol.78,no3,,p.178–84(PMID11735224,DOI10.1006/geno.2001.6666).
- (en)Sakiko Okumotoet al.,«Detection of glutamate release from neurons by genetically encoded surface-displayed FRET nanosensors»,Proceedings of the National Academy of Sciences,(PMID15939876,PMCIDPMC1143584,DOI10.1073/pnas.0503274102,résumé).
- (en)Rosana CTMori,Regina B.Guimarães,Cláudia MONascimentoet Eliane B.Ribeiro,«Lateral hypothalamic serotonergic responsiveness to food intake in rat obesity as measured by microdialysis»,Can. J. Physiol. Pharmacol.,vol.77,no4,,p.286–292(DOI10.1139/cjpp-77-4-286).
- (en)Manev H., Favaron M., Guidotti A. et Costa E., «Delayed increase of Ca2+influx elicited by glutamate: role in neuronal death»,Mol. Pharmacol.,vol.36,no1,,p.106–12(PMID2568579,lire en ligne).
- B.S. Meldrum *, M. T. Akbar, A. G. Chapman,«Glutamate receptors and transporters in genetic and acquired models of epilepsy»,Epilepsy Research,vol.36,,p.189-204.
- S. Jinap, P. Hajeb,«Glutamate. Its application in food and contribution to health»,Appetite,vol.55,,p.1-10.
- Kumiko Ninomiya,«Natural occurrence»,Food Reviews International,vol.14,nos2-3,(lire en ligne).
- (en)L.J. Filer, M.R. Garattini, M.R. Kare, W.A. Reynolds et R.J. Wurtman,Glutamic acid, advances in biochemistry and physiology,Raven Press,.
- S. Jinap, P. Hajeb,«Glutamate. Its application in food and contribution to health»,Appetite,vol.55,,p.1-10.
- définie comme l'évaluation hédonique des caractéristiques orosensorielles des aliments dans des conditions standardisées (Sorensenet al.2003)
- (en)FranceBellisle,«Effects of monosodium glutamate on human food palatability»,Ann. N. Y. Acad. Sci.,vol.855,,p.438-41.
- (en)Yamaguchi S. et Ninomiya K., «Umami and food palatability»,J. Nutri.,vol.130 (4S suppl),.
- (en)FranceBellisle,«Experimental studies of food choices and palatability responses in European subjects exposed to the Umami taste»,Asia Pac. J. Clin. Nutr.,vol.17 (suppl 1),.
- Boston University, Harvard University, Northwestern UniversityetUCLA.
- (en)Raif S. Geha, Alexa Beiser, Clement Ren, Roy Patterson, Paul A. Greenberger, Leslie C. Grammer, Anne M. Ditto, Kathleen E. Harris, Martha A. Shaughnessy, Paul R.Yarnold, Jonathan Corren et Andrew Saxon, «Multicenter, double-blind, placebocontrolled, multiple-challenge evaluation of reported reactions to monosodium glutamate»,Journal of Allergy Clinical Immunology,vol.106,no5,,p.973-980.
- Les 130 sujets recrutés qui disaient avoir connu le syndrome du restaurant chinois ont été soumis à une série de tests sur une boisson contenant 5gde GMS versus placebo. S'ils répondaient positivement au premier test, par au moins deux symptômes, ils étaient examinés suivant un second protocole, cherchant un effet de dépendance de dose et une reproduction des réactions. Or, seulement la moitié de ceux qui avaient eu une réaction à 5gde GMS et pas au placebo réagirent de manière similaire au protocole suivant, suggérant une inconsistance dans les réponses. Dans les protocoles suivants, les sujets qui avaient répondu positivement à 5gde GMS et pas au placebo, devaient avaler des capsules (pour qu'ils n'aient aucun indice de goût), à jeun ou au cours d'un petit déjeuner. Seuls deux sujets manifestèrent des réponses consistantes au glutamate. Finalement, les résultats suggèrent que de fortes doses de GMS prises sans nourriture peuvent induire plus de symptômes que des placebos chez des individus qui pensent être sensibles au glutamate. Mais aucun effet persistant n'a été observé au cours des tests successifs.
- (en)«Umami Information Center», surUmami Information Center(consulté le).
- «Les enzymes et le 5ème goût « Umami», surtakabio.com viaWikiwix(consulté le).


