Alfred Werner
| Naissance | |
|---|---|
| Décès | |
| Sépulture |
Cimetière de Rehalp(d) |
| Nationalités | |
| Formation | |
| Activités | |
| Conjoint |
Emma Werner(d) |
| A travaillé pour | |
|---|---|
| Directeur de thèse | |
| Distinction | |
| Archives conservées par |
Archives de l'École polytechnique fédérale de Zurich(en)(CH-001807-7:Hs 373)[1] Bibliothèque centrale de Zurich(Nachl. A. Werner 1 - 14)[2] |
Alfred Werner(àMulhouse,Haut-Rhin[3]-àZurich) est unchimistesuisse.Il est lauréat duprix Nobel de chimiede 1913 pour, entre autres, des travaux enchimie inorganique[4].Il fut le premier à recevoir unprix Nobelpour des travaux en chimie inorganique, et le seul jusqu’à 1973.
Biographie
[modifier|modifier le code]Il naît le 12 décembre 1866 dans une riche famille catholique d'Alsace,alors française pour quatre ans. De 1872 à 1878, il étudie à l'École libre des Frères puis à l'École professionnelle où il commence lachimiejusqu'en 1885[5].
Après une année de service militaire dans l'armée allemande, il intègre l'École polytechnique de Zurich,où il passe son doctorat en 1890. Après un séjour postdoctoral àParis,il retourne àZurichpour enseigner dès 1892, et devient professeur en 1895 ainsi que citoyen suisse en 1894[5].
Il a reçu leprix Nobel de chimieen1913pour avoir expliqué les structures des complexes desmétaux de transitiondont certains possèdent une configurationoctaédrique.Plus précisément,« en reconnaissance de son travail sur le lien entre lesatomesdans lesmoléculesgrâce auquel il a jeté un nouvel éclairage sur des recherches antérieures et a ouvert de nouveaux champs de recherche, spécialement enchimie inorganique[4]».
Travaux enchimie de coordination
[modifier|modifier le code]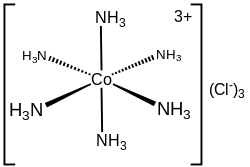
Vers 1893, Werner était le premier à bien formuler les structures des composés de coordination contenant des ionscomplexes,auquel un atome central d’un métal de transition est entouré par desligandsneutres ou ioniques.
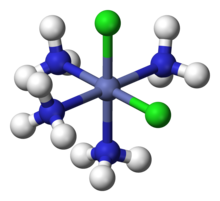
Par exemple, il était déjà connu que le cobalt(III) peut former un « complexe » CoCl3•6NH3,mais la nature de l’association indiquée par le point était mystérieuse. Werner proposa la structure [Co(NH3)6]Cl3,avec le Co3+entouré par 6 NH3aux 6 sommets d’unoctaèdre.Les 3 Cl−sont desionsdissociés, ce qui fut confirmé par mesure de laconductivité électriqueen solution aqueuse.

Pour d’autres composés, Werner a réussi à expliquer les nombres d’isomèresobservés. Par exemple CoCl3peut aussi réagir avec 4 molécules de NH3pour former deux composés différents, de couleurs verte et violette. Selon Werner ce sont deux 2 isomères géométriques [Co(NH3)4Cl2]Cl. L’atome de Co est entouré par 4 NH3et 2 Cl aux sommets d’un octaèdre. L’isomère vert est « trans », avec les 2 Cl aux sommets opposés, et l’isomère violet est « cis », avec les 2 Cl aux sommets voisins.
Avec desligandsbidentés tels que l'éthylènediamineWerner a préparé des isomères optiques, et en 1914 il prépare le premier composéchiralsans le carbone, à savoir l'«hexol(en)» de formule [Co(Co(NH3)4(OH)2)3]Br6.Le fait que des complexes métalliques puissent avoir des isomères optiques a été perçu comme une preuve indiscutable de leur nature octaédrique. En effet, les autres formes qui étaient envisagées, à savoir leprisme triangulaireet l'hexagonene donnent pas une paire d'énantiomères lors de la liaison de 3 ligands bidentés.
Travaux autour de la nature devalence
[modifier|modifier le code]Avant Werner, les chimistes définissaient lavalenced’un élément comme le nombre de liaisons formées par lui, sans distinguer les divers types de liaison. Aux complexes comme le [Co(NH3)6]Cl3par exemple, Werner a distingué entre les liaisons Co—Cl qui constituent selon lui une valence primaire de 3 à longue distance, et les liaisons Co—N qui font une valence secondaire de 6 à plus courte distance. Après la découverte de l’électron, les idées de Werner ont aidéG.N. Lewisa formuler ses théories sur la nature électronique de la liaison chimique.
AuXXIesiècle, la valence primaire de Werner correspond à l'état d'oxydation,tandis que sa valence secondaire correspond à lacoordinenceou nombre de voisins de l’atome central. Les liaisons Co—Cl sont maintenant classées comme ioniques, et chaque liaison Co—N comme une liaison de coordinence entre unacide de Lewis(Co3+) et unebase de Lewis(NH3).
Notes et références
[modifier|modifier le code]- «http://archivdatenbank-online.ethz.ch/hsa/#/content/7a6e56b8b4234445a40b0ca25f69ba88»(consulté le)
- «https://www.zbcollections.ch/home/#/content/c97ad2e3fc674d67905eef48ecfd5c7e»(consulté en)
- René Burgun, « Alfred Werner », inNouveau dictionnaire de biographie alsacienne,vol. 40,p.4191
- (en)«in recognition of his work on the linkage of atoms in molecules by which he has thrown new light on earlier investigations and opened up new fields of research especially in inorganic chemistry»inPersonnel de rédaction, «The Nobel Prize in Chemistry 1913»,Fondation Nobel,2010. Consulté le 7 août 2010
- (en)«Alfred Werner | Swiss chemist», surEncyclopedia Britannica(consulté le)
Liens externes
[modifier|modifier le code]
- Notices dans des dictionnaires ou encyclopédies généralistes:
- (en)Biographiesur le site de lafondation Nobel(le bandeau sur la page comprend plusieurs liens relatifs à la remise du prix, dont un document rédigé par la personne lauréate — leNobel Lecture— qui détaille ses apports)
- Ouvrage de Werner Alfrednumérisé par le SCD de l'université de Strasbourg
- Lauréat du prix Nobel de chimie
- Chimiste inorganicien
- Lauréat suisse du prix Nobel
- Chimiste suisse
- Chimiste français du XIXe siècle
- Chimiste français du XXe siècle
- Professeur à l'université de Zurich
- Personnalité liée au canton de Zurich
- Étudiant de l'École polytechnique fédérale de Zurich
- Allemand natif d'Alsace
- Naissance à Mulhouse
- Naissance en décembre 1866
- Décès à Zurich
- Décès en novembre 1919
- Décès à 52 ans


