Ammoniac
| Ammoniac | |
  Molécule d'ammoniac. |
|
| Identification | |
|---|---|
| Nom UICPA | azane |
| Synonymes |
nitrure d'hydrogène |
| NoCAS | |
| NoECHA | 100.028.760 |
| NoCE | 231-635-3 |
| NoRTECS | BO0875000 |
| PubChem | |
| ChEBI | 16134 |
| FEMA | 4494 |
| SMILES | |
| InChI | |
| Apparence | gaz comprimé liquéfié, incolore à légèrement coloré, d'odeur âcre, intense, suffocante, irritante[2]. |
| Propriétés chimiques | |
| Formule | NH3 |
| Masse molaire[5] | 17,030 5 ± 0,000 4g/mol H 17,76 %, N 82,25 %, |
| pKa | 9,23[réf.souhaitée] |
| Moment dipolaire | 1,471 8± 0,000 2D[3] |
| Diamètre moléculaire | 0,310nm[4] |
| Propriétés physiques | |
| T°fusion | −77,7°C[6],−77,74°C |
| T°ébullition | −33,35°C[6] |
| Solubilité | dans l'eau à20°C:540g l−1[2],dans l'alcoolsoit14,8gpour100gd'alcool à 95° à20°C,l'éther éthyliqueet les solvants organiques |
| Paramètre de solubilité δ | 33,4MPa1/2(25°C)[7]; 29,2J1/2cm−3/2(25°C)[4] |
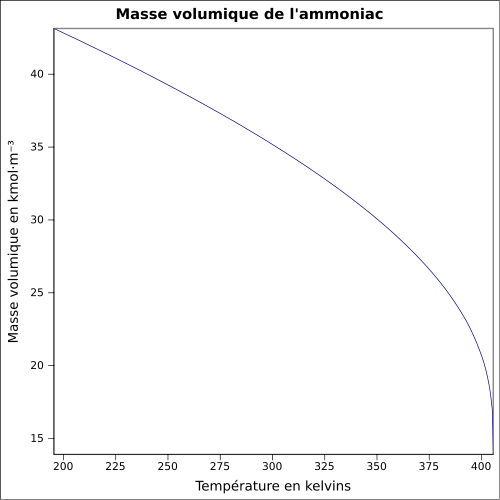
| Masse volumique | 0,86kg/m3(1,013bar,point d'ébullition) 0,769kg/m3(CNTP)[8] |
| T°d'auto-inflammation | 651°C[2] |
| Limites d’explosivité dans l’air | Inférieure: 15,5[12] Supérieure: 27[12] |
| Pression de vapeur saturante | à26°C:1 013kPa[2]
|
| Point critique | 112,8bar,132,35°C[13] |
| Thermochimie | |
| S0gaz, 1 bar | 192,77J mol−1K−1[réf.souhaitée] |
| ΔfH0gaz | −39,222kJ mol−1(−273,15°C) −46,222kJ mol−1(24,85°C)[6] |
| ΔfH0liquide | −40,2kJ/mol[réf.souhaitée] |
| ΔvapH° | 23,33kJ mol−1(1atm,−33,33°C) 19,86kJ mol−1(1atm,25°C)[14] |
| Cp | 2 097,2J·kg-1·K-1(0°C) 2 226,2J·kg-1·K-1(100°C) |
| PCS | 382,8kJ·mol-1(25°C,gaz)[15] |
| PCI | 317,1kJ mol−1[16] |
| Propriétés électroniques | |
| 1reénergie d'ionisation | 10,070± 0,020eV(gaz)[17] |
| Cristallographie | |
| Symbole de Pearson | [18] |
| Classe cristallineougroupe d’espace | P213 (n° 198)[18] |
| Strukturbericht | D1[18] |
| Structure type | NH3[18] |
| Propriétés optiques | |
| Indice de réfraction | 1,325[4],même valeur pour l'ammoniac liquide à16,5°Csous pression |
| Précautions | |
| SGH[19],[20] | |
| H221,H314,H331,H400,P210,P261,P273,P280,P305,P310,P338etP351 |
|
| SIMDUT[21] | |
    A,B1,D1A,E, |
|
| NFPA 704 | |
| Transport | |
| Inhalation | Les vapeurs sont très irritantes et corrosives. |
| Peau | Les solutions concentrées peuvent provoquer des brûlures. |
| Yeux | Dangereux, Irritation |
| Ingestion | L'ingestion peut provoquer des brûlures de la bouche, langue, œsophage. |
| Écotoxicologie | |
| Seuil de l’odorat | bas:0,04ppm haut:53ppm[22] |
| Unités duSIetCNTP,sauf indication contraire. | |
| modifier |
|
L'ammoniacest uncomposé chimiquede formuleNH3(du groupe générique desnitrures d'hydrogène). Dans lesconditions normales de température et de pression,c'est un gaz; ce gaz est incolore et irritant, d'odeur piquante à faible dose, il brûle les yeux et les poumons à concentration plus élevée.
Dans l'industrie, l'ammoniac est produit par leprocédé Haber-Boschà partir dediazoteet dedihydrogène.C'est l'un des composés les plus synthétisés au monde, utilisé commeréfrigérantet pour la synthèse de nombreux autres composés (dont desengraisen grand nombre). À l'état liquide (par exemple à8bar et20°C), on l'utilise aussi commesolvant.
L'auto-ionisationde l'ammoniac liquide est très faible, caractérisée par uneconstante de dissociationioniqueKi= [NH4+] [NH2−] qui vaut environ 10−33mol2l−2à−50°C.
Dans lesolvant protiqueNH3liquide,le cationammoniumNH4+est l'acide le plus fort alors que l'anion amide NH2−est la base la plus forte.
Son doublet électronique en fait à la fois unebase,unnucléophile,unligandet unréducteur[24].Sa propriété basique le rend utile pour divers sels d'ammonium. Ses propriétés de nucléophile en font un réactif de base enchimie organiquepour la préparation desamides,desimides,etc. Ses propriétés de ligand sont connues depuis le début de lachimie de coordinationet le fameux débat scientifique entreSophus Mads JørgensenetAlfred Werner,qui attira l'attention du jury duprix Nobel,décerné à ce dernier en 1913. Enfin, sa propriété de réducteur lui permet d'être industriellement oxydé enacide nitriqueet enhydrazinenotamment, deux produits industriels d'usage intensif.
Engénie chimique,le système (air – NH3– eau) constitue un modèle très étudié de phases liquide-gaz, puisque l'ammoniac est un gaz très soluble dans l'eau, avec une solubilité de 89,9gpour 100gd'eau à0°Cet seulement 7,4gà96°C.Le gaz est soluble dans l'eau, sous forme de NH3aqueuxfaiblement dissocié en cations ammonium et anionshydroxyle;cette solution aqueuse est nomméeammoniaque[25].
Sur le plan biologique, l'ammoniac joue un rôle majeur en agriculture; c'est grâce à l'ammoniac que l'azote est artificiellement incorporé par les plantes. Chez l'animal, il est impliqué dans l'élimination de l'azote du corps et la régulation dupHsanguin.
Sur Terre, il est essentiellement piégé dans l'écorce terrestre (sels ammoniacaux minéraux tels que bicarbonates, nitrates, nitrites, chlorures, phosphates) ou dans la matière organique (charbon,tourbe,pétrole). En excès dans l'air, c'est unpolluantacidifiant eteutrophisantde l'environnement. Après une amélioration de 1990 à 2011[26],ses teneurs dans l'air, maintenant suivies par satellite, sont en hausse en Europe et en France, en raison essentiellement des pratiques agricoles plus industrielles (donnée 2016)[27].En ville et sur les axes de transport, il est issu du trafic routier pour 40 à 60 %[28],mais à échelle du pays, en2011,il provient à 94 % des émissions de NH3[29]d'origine agricole. L'élevage, à cause desfumierset deslisiers,en représente la première source[30],[31].Sa teneur dans l'air devrait être infime (hormis en présence d'excrémentsouurinesen décomposition, d'unefermentationpar des micro-organismes en milieu confiné ou d'uneputréfactionen milieuanaérobie).
Histoire
[modifier|modifier le code]Le motammoniac,attesté auXIVesiècle, vient du latinammoniacum,lui-même issu dugrec ancien:ἀμμωνιακόν,« sel ammoniac ou gomme ammoniaque »[32],qui évoquait le nom du dieu égyptienAmon(car enLibye,c'est près du temple de Jupiter Ammon qu'on extrayait un minéral[33](salmiac) pouvant libérer de l'ammoniac). Cetalcaliétait en outre, dans l'Antiquité,produit en chauffant des excréments frais ou un mélange de sel et d'urines.On pouvait le sentir et on savait utiliser son action alcaline sur d'autres matières (au moins dès laXIIedynastie égyptienne soit 2 000 ansav. J.-C.). Mais comme toute matière gazeuse, il est resté longtemps mal compris.
Au Moyen Âge, lesforgeronsobtenaient cet alcali d'Amôn par distillation decorneset desabotsdebœufs(matières riches en azote).
Le chimiste britanniqueRobert Boyleinvente des tests de détection de cet alcali gazeux (teinture de tournesol ou sirop de violette virant au bleu en présence de ce gaz)[34].
Un siècle plus tard environ, avec l'essor de lapneumochimieà cuve à mercure, sa préparation et son isolement sont facilités parJoseph Priestleyen1774,par simple chauffage de sels d'ammonium avec de lachauxCaO ou du calcaire commepierre à chaux;avec une cuve à eau, on obtient, par piégeage dans l'eau de la cuve, de l'ammoniaqueou eau ammoniaquée.
En1785,le chimisteBertholletconfère à ce corps chimique une formule de un azote pour trois hydrogènes.
À partir desannées 1850,lecycle de l'azotecommence à être perçu: on comprend notamment que l'ammoniac atmosphérique peut être directement absorbé et utilisé par les plantes: De Ville (1850) et Schlösing (1874) exposent des plantes jusque-là maintenues en déficit d'azote à un air enrichi en ammoniac et ils montrent qu'elles peuvent l'absorber et le métaboliser[35],[36].À la même époque, Boussingault (1856) montre le rôle fondamental desnitrates[37]alors que l'on commence à mesurer les dépôts d'ammonium(NH4+) dans les précipitations (environ 5kgN-NH4+par hectare et par an selon Lawes et Gilbert au milieu duXIXesiècle (1851)[38]). Peu après, Bineau (1854) piège (dans un « piège acide ») et mesure les dépôts secs d'ammoniac à partir de l'air ambiant deCaluireet àLyon:15 à 50kgN-NH3par hectare et par an[39].De la même manière, Heinrich (1881) à Rostock[40](Allemagne), Kellneret al.(1886) à Tokyo[41],mesurent respectivement des dépôts de 31 et 12kgN-NH3par hectare et par an. Puis Hall et Miller (1911) ont l'idée de protéger leur piège à ammoniac des poussières et insectes par une fine grille (ce qui a pu leur faire sous-estimer les dépôts secs, note Loubet dans sa thèse en 2000[42]) et de disposer de tels pièges à différentes hauteurs, ce qui leur a permis de mettre en évidence des gradients de « concentration » au-dessus de la végétation et de repérer des zones « puits » (non fertilisées) et des zones sources (émissions probablement au-dessus de zones fertilisées)[43].
Plus tard, les physiciens constateront le mouvement d'oscillation de la molécule NH3gaz,où l'azote passe entre la base triangulaire formée par les trois H pour atteindre sa double position en sommet de l'agencement pyramidal[44].Ce mouvement oscillant régulier de la molécule d'ammoniac est à l'origine de la premièrehorloge atomique,duBureau of stantardsaux États-Unis en1948.
Après laSeconde Guerre mondiale,le développement de l'agriculture industrielleet productiviste relance les études sur la perte d'azote à partir d'engrais organiques (minéralisation) et d'engrais chimiques (lessivage des nitrates, perte qui est source d'un coûteux gaspillage d'engrais, et d'une pollution croissante et générale des nappes phréatiques ainsi que d'uneeutrophisationdes eaux de surface dont on ne s'alarmera que bien plus tard). Allison (1955) démontre que la volatilisation de nitrates a par le passé été sous-estimée. Ces pertes font encore l'objet de recherche (ex.:Whitehead et Raistrick, 1990[45]).
Histoire sémantique
[modifier|modifier le code]Le terme d'origine adjectivaleammoniacqualifiait autrefois[46]une substance médicinale, lagomme ammoniaque,utilisée par lesapothicaires,présentée comme suit en1752par leDictionnaire français-latin de Trévoux:
« Ammoniac; une gomme dont on se sert en Pharmacie. Gummi ammoniacum. On nous l'apporte des Indes Orientales, & on croit qu'elle découle d'une planteumbellifére.Elle doit être en larmes séches, blanchâtres en dedans, un peu roussâtres en dehors, faciles à se fondre, gommeuses & résineuses, un peu amères, d'une odeur & d'un goût acre, tenant de l'ail. On en apporte aussi en masses remplies de petites larmes bien nettes & bien blanches. Cette gomme roussit en vieillissant;Dioscoride&Plineen font mention. Dioscoride dit que l'ammoniac est le jus d'une espèce deférulequi croît en Afrique auprès deCirènede Barbarie. La plante qui le porte, & sa racine, s'appellent Agafillis. Le bon ammoniac est haut en couleur, & n'est brouillé ni de raclure de bois, ni de sable, ni de pierres. Il a force petits grains comme l'encens,retire à l'odeur ducastoreum,& est amer au goût […] Pline appelle l'arbre dont il découleMétopion[…] L'ammoniac desapothicairesest réduit en masse comme poix résine, au lieu d'être fraisé & menu comme de l'encens. On prétend qu'il servoit d'encens aux Anciens dans leurs sacrifices. Cette gomme entre dans plusieurs compositions; elle estpurgative,fondante, & résolutive, étant appliquée extérieurement. Gafer en tire un esprit & une huile, qui ont, à ce qu'il dit, de grandes vertus, lesquelles ne procèdent que du sel volatile qu'elle contient. Mais comme il est mêlé d'un acide qui empêche son activité, il donne le moyen de séparer ces deux esprits, lesquels sont capables, selon lui, de produire des effets tout différens […] Il y a un sel qu'on appelle aussi armoniac, ou ammoniac. »
L'adjectifammoniacque,attesté en1575dans les écrits français d'André Thevet,qualifie une gomme ou un sel ammoniac recueillis près du temple d'Amon enLibye[47].Le « sal ammoniac » est simplement lesalmiacpurifié, facilement sublimable. La gomme est probablement un mélange de substance végétale molle ou pâteuse contenant du salmiac.
En1787,Guyton de Morveauintroduit dans la nomenclature chimique française le substantifammoniac,définissant le corps chimique. Le termeammoniacal,caractérisant les solutions aqueuses d'ammoniac ouammoniaque,est attesté toutefois vers1748.Le motammonisation,désignant la transformation d'azote organique en azote ammoniacal, est attesté dans le vocabulaire commun par leGrand Laroussede1933.Aujourd'hui selon la nomenclature IUPAC, l'ammoniac est le plus simple desazanes[48],ouhydrures d'azoteacycliques.
Production industrielle
[modifier|modifier le code]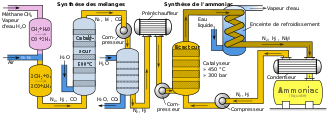




La production industrielle de l'ammoniac se fait essentiellement par synthèse directe à partir dedihydrogèneet dediazote.L'hydrogène peut venir du méthane et l'azote de l'air. La mise au point du premier réacteur est l'œuvre de chimistes allemands et est encore secrète lorsqu'elle aboutit en1913avec leprocédéHaber-Bosch,portant le nom de ses chimistes développeurs du catalyseur à base de fer (Fe) et nickel (Ni) et du procédé en réacteur-tube à une température de550°C.
- =−92,2kJ/mol
La synthèse de l'ammoniac est exothermique, dégageant12,9calories par mole à la pression atmosphérique. Elle implique deux gaz, l'azote et l'hydrogène. Dans les conditions « ambiantes », le produit final se présente sous la forme d'un gaz incolore (produisant une fumée de condensation à haute concentration) et dégageant une très désagréable odeur putride.
La production industrielle d'ammoniac, appelée banalement pour les besoins en engrais, était alors stratégique, car elle était capitale pour l'industrie d'armement et celle conjointe des explosifs, et dépendant alors essentiellement des exportations de nitrates du chili,de factocontrôlées par l'empire maritime britannique[49].En 1901, la réaction avait été étudié par le chimiste françaisLe Chatelier,avec un catalyseur à base de Fe, K sur support d'alumine.
Le procédé Haber-Bosch, déjà amélioré au niveaucinétiquepar une pression modulée jusqu'à plus de200atmpendant les années duconflit mondial,est récupéré par les nations alliées victorieuse, en particulier le groupe ONIA àToulouse[50].Les groupes chimiques français et italien peuvent investir afin de le modifier et perfectionner sur le continent. Ainsi apparaissent au moins quatre procédés dans l'entre-deux-guerres,attestant la vitalité du secteur des gaz industriels en France:
- leprocédé ONIA,fondé sur le procédé Haber-Bosch récupéré mais modifié en un process avec tube à catalyse à500°Cet300atm,en matière réfractaire et avec échangeur-récupérateur de chaleur. Il est à l'origine du procédé NEC desusines Kulhmann,au cours des années 1960 àLa Madeleine-lès-Lille[51];
- leprocédé Georges Claude,ainsi nommé en l'honneur de grand spécialiste français des gaz.Georges Claudeperfectionne en 1918 la rentabilité du procédé allemand d'un facteur 15 et comprime le mélange gazeux de800à1 000bar. De l'usine pionnière de Montereau le procédé sera adapté sur les sites deSaint-Étienne,Béthune,Grand-Quevilly,Mazingarbe.Le mélange est comprimé à1 000atmou1 000bar à une température entre500°Cet600°C.Si la rentabilité est excellente, la dépense d'énergie est jugée importante;
- leprocédé Casale,à partir d'une température de mélange réactif abaissée à460°Cet d'une pression de400–450atm,promu dans les années 1960. Il était en vigueur en 1990 àLens,Hénin-Liétard,AnzinouSaint-Auban,et son évolution moins gourmande en énergie influence les installations récentes[52];
- leprocédé Fauser,mis au point enItalie,adopté tardivement par ONIA dans son usine de Soulon, qui se fonde à partir d'un mélange à250atmet550°C[53].
Le procédé basse pression du Mont-Cenis se caractérise par une pression plus faible de100à150bar à une température avoisinant430°C.

Dès les années 1960, le gaz industriel ammoniac est vendu dans des récipients en acier calibrés à une pression de12atm.Par sa chaleur d'évaporation élevée à la température normale de0°C,il est nécessaire à l'industrie de la réfrigération.
Depuis lesannées 1990,la géographie de la synthèse industrielle d'ammoniac est chamboulée par la multiplication de nouvelles unités de productions des dérivés d'ammoniac et d'urée, stimulée par une demande croissante d'engrais chimiqueset la volonté de pays producteurs de gaz naturel de l'utiliser, notamment sous forme de production d'ammoniac. En 2000,Trinité-et-Tobagoavaient l'unité la plus grosse au monde, mais dès 1998, legolfe Persique,bien placé pour livrer le marché asiatique qui absorbe plus du tiers de la productions mondiale d'ammoniac de l'époque, se dote d'unités àAbu Dhabide 400 000tonnes/an,leQatarde 300 000tonnes/an,suvi parOman,etc.
En pratique, le diazote vient de l'airet ledihydrogèneduvaporeformage du méthane(gaz naturel), procédé le plus utilisé pour laproduction d'hydrogèneselon les réactions:
- .
Le bilan des réactions est alors:.
Production mondiale à partir de H2et N2:elle a été estimée à122 millionsde tonnes en 2006. Exprimée le plus souvent en millions de tonnes d'azote N, elle approcherait de 136,5 en 2012[54].
Anciennes méthodes de fabrication modernes
[modifier|modifier le code]Il a été fabriqué par synthèses indirectes, à partir d'eaux ammoniacales. Ainsi pouvait-il être obtenu pardistillationdupurinet dufumier.Il l'était plus communément à partir de minerai, lors de carbonisation de lahouille,voire ducokeaprès1880(sous-produit du traitement des gaz de fours à coke).
Au début duXXesiècle,différents procédés de synthèse ont été imaginés.
L'un d'entre eux se base sur l'hydrolysede lacyanamide calcique,elle-même obtenue à partir ducarbure de calcium.
L'autre utilise l'hydrolyse dunitrured'aluminium,lui-même produit parnitrurationà haute température de l'alumine.
Il faudra attendre1913pour voir apparaître le procédéHaber-Boschencore employé auXXIesiècle.
Méthode de fabrication pour l'avenir
[modifier|modifier le code]L'ammoniac apparait comme un produit qui restera important, et la recherche est active pour de nouveaux procédés. Tous se heurtent à la grande stabilité chimique de la molécule dediazote,qu'il faut activer d'une manière ou d'une autre.
On sait qu'il est possible de réaliser cela sans recourir à des pressions et des températures extrêmes comme dans le procédé Haber-Bosch, puisque des bactéries le font: leursenzymesnitrogénasescatalysent la réduction de N2en NH3dans les conditions usuelles de température et de pression. Une des voies de recherche est donc lebiomimétisme:la création de catalyseurs reproduisant le fonctionnement des nitrogénases, mais d'une façon industrialisable, par exemple à l'université de Tokyo qui utilise l'iode, le samarium et le molybdène[55],[56].
Statistiques de production
[modifier|modifier le code]Production mondiale en millions tonnes en 2021[57]:
| Pays | Production | % mondial | |
|---|---|---|---|
| 1 | Chine | 39 | 26,0 |
| 2 | Russie | 16 | 10,7 |
| 3 | États-Unis | 15 | 10,0 |
| 4 | Inde | 12 | 8,0 |
| 5 | Indonésie | 5,9 | 4,0 |
| 6 | Arabie saoudite | 4,3 | 2,9 |
| 7 | Trinité-et-Tobago | 4,2 | 2,8 |
| 8 | Égypte | 4,2 | 2,8 |
| 9 | Canada | 3,9 | 2,6 |
| 10 | Iran | 3,6 | 2,4 |
| 11 | Qatar | 3,3 | 2,2 |
| 12 | Pakistan | 3,3 | 2,2 |
| 13 | Ukraine | 2,3 | 1,5 |
| 14 | Allemagne | 2,2 | 1,5 |
| 15 | Algérie | 2,2 | 1,5 |
| … | Reste du monde | 28,6 | 19,1 |
| Total monde | 150 | 100 | |
Propriétés physico-chimiques
[modifier|modifier le code]- Aspects moléculaires et atomiques:l'ammoniac est une molécule pyramidale à base trigonale: l'atome d'azote (N) est au sommet et les trois atomes d'hydrogène (H) occupent les trois coins (sommets) de la base triangulaire équilatérale. Plus précisément, l'atome d'azote « monte » et « descend » entre ce « sommet » de la pyramide et celui de la pyramide opposée, traversant ainsi la base triangulaire des atomes d'hydrogène. Cette « oscillation » s'effectue à une fréquence fondamentale de 24GHzet a été mise à contribution dans les premièreshorloges atomiques.
- Transitions de phase:àpression atmosphérique,l'ammoniac se liquéfie à−33,35°Cet se solidifie à−77,7°C[6].À haute pression on connaît unephasedite « superionique », dont la courbe de fusion a été déterminée en 2023: au-dessus de100GPal'ammoniac (superionique) fond à plus basse température que l'eau et saconductivité électriqueest supérieure, ce qui a des implications pour la génération duchamp magnétiqueà l'intérieur d'Uranuset deNeptune[58],[59].
- Odeur:très âcre et facilement reconnaissable, nocif par inhalation (mortel à hautes doses).
- Inflammabilité et explosibilité:sous forte pression, l'ammoniac peut former un mélange explosif avec les huiles de lubrification, le mélange air-ammoniac s'enflamme et explose violemment, mais la source d'ignition doit être énergétiquement importante.
- Surchauffe de compression:la valeur élevée du rapportα=Cp/Cv= 1,335 à0°Climite rapidement le taux de compression admissible du fait des hautes températures des vapeurs de refoulement, températures qui risqueraient au-delà d'une température de120°Cune altération des huiles de lubrification et la formation d'un mélange détonant.
- Corrosion des métaux, joints et lubrifiants:attaque lecuivreet tous ses alliages, ce pourquoi les installations frigorifiques fonctionnant à l'ammoniac sont réalisées avec des tuyauteries enacier.
- Miscibilité et solubilité:non miscible avec les huiles naphténiques et les huiles de synthèse. Très soluble dans l'eau, il y forme une solution aqueuse dénomméeammoniaquedont l'équilibre chimique est peu dissocié. Le cation ammoniumNH4+en solution comporte alors unatome d'hydrogèneaux quatre sommets dutétraèdre.En milieu aqueux, l'acide conjugué de l'ammoniac est le cation ammonium, ce qui peut s'expliquer par le fait qu'une molécule d'ammoniac ait bien fixé ou capté un proton, dans le cadre de la théorie acide-base deThomas LowryetJoannes Brønsted.
- Ammoniacbase de Lewis:en 1923, à peine trois années après l'exposition des théories Lowry-Brønsted, le cas particulier de l'ammoniac, muni de son doublet électronique si caractéristique, a motivé les travaux deGilbert Lewis.
- Ammoniac soluté donneur de proton:en absence d'espèces chimiques comportant des hydrogènes acides (l'eau et les alcools inclus), l'ammoniac peut également perdre un proton, H+,et donner l'ionamidure,NH2−,qui est unebase forte.
- Ammoniac liquide, un solvant protique:la gamme de pH mesurable dans l'ammoniac liquide oscille entre 0 et 29. Dans ce solvant spécifique où l'ion amidure est la base la plus forte et le cation ammonium l'acide le plus fort, l'acide acétiqueest dissocié totalement, et se comporte comme unacide fort.
L'ammoniac dans l'environnement
[modifier|modifier le code]
Dans la nature
[modifier|modifier le code]L'azote est un élément essentiel desacides aminésconstitutifs des protéines. Il est donc indispensables à tout être vivant. Bien que constituant 75 % du volume de l'atmosphère, très peu d'êtres vivants savent l'utiliser directement pour biosynthétiser leurs acides aminés.

Seuls quelques micro-organismes extraient l'azote directement de l'air grâce à un groupe enzymatique appelé lanitrogénase;ce sont notamment descyanobactériesou desprotéobactéries(dontAzotobacter). Les végétaux sont incapable de capter l'azote atmosphérique, cependant la plupart deslégumineuses,telles que lesharicots,trèflesetlupinsont développé des symbioses avec certaines bactéries comme lesrhizobiums,qui leur permettent de capter le diazote atmosphérique (N2) pour produire des acides aminés. Inversement il existe des puits d'ammoniac, principalement liés à l'absorption d'ammoniac par des bactéries et des plantes et liés à la conversion de l'ammoniac en nitrites par des bactéries dugenreNitrosomonas,c'est ce qu'on appelle la nitrification.
Dans l'environnement, il est essentiellement présent sous sa forme acide, le cationammonium(NH4+), qui est une source d'azote directement assimilable par les plantes. En temps normal il est transformé ennitritespuis ennitratesdans lecycle de l'azote,ce dernier étant la principale voie d'assimilation de l'azote par les plantes. Mais en excès l'azote est source dedystrophisation.
Ammoniac naturel
[modifier|modifier le code]Il provient essentiellement de la décomposition de l'uréeCO(NH2)2et de l'acide uriquequi en dérive (l'urée est le produit ultime de déjection azotée dumétabolisme cellulaireanimal, par exemple des mammifères, il est produit par des bactéries et deslevures,et aussi par certaines plantes via unenzyme:l'uréase.L'ammoniac est ainsi le gaz piquant qui caractérise les caves d'affinage de fromages, notamment les pâtes molles lavées à l'eau salée que sont lemaroilles,lemunsterou le géromé, soumises à l'action de fermentation bactérienne et à certains enzymes.
Dans la nature, les réactions produisant l'ammoniac se déroulent de manière diffuse dans les eaux douces et marines sur et dans les sols. Dans le monde en volume, 25 à 30 % de tout l'ammoniac naturel proviendrait de l'océan (première source d'ammoniac atmosphérique) puis de la décomposition des urines, excréments et cadavres d'animaux sauvages terrestres, de diversexcrétats,phanères,etc.et un peu de certains végétaux). La part des émissions naturelles a fortement diminué dans les pays et régions d'agriculture intensive. Tout comme dans les stations d'épuration et les élevages, l'ammoniac naît de la décomposition de l'urée et de l'acide urique (contenu en grande quantité dans ces excrétats) en cation ammoniumNH4+,sous l'action hydrolysante de l'enzymeuréase(aussi présente dans lesfaeces); selon la réaction:
- CO(NH2)2+ 3 H2O→ 2NH4++ HCO3−+ OH−.
En solution (phase liquide), le cation ammonium est en équilibre avec NH3(sabase conjuguée,elle-même en équilibre avec NH3en phase gazeuse). Ces réactions contribuent à une volatilisation de l'ammoniac vers l'atmosphère, plus ou moins rapide selon la température (plus rapide quand il fait chaud et donc en climat tropical) et selon le pH de la solution.
Dans l'atmosphère,après lediazote(N2), la forme la plus présente de l'azote est le gaz NH3(ammoniac). Il provient aujourd'hui d'abord desengrais chimiqueset des parcs d'engraissement de l'élevage industriel,suivis de la combustion de labiomassefossile (charbon,pétrole,gaz naturel) ou de biomasse parfois (dont via lesincendies de forêt)[60].Il est possible que des sols dégradés et réchauffés libèrent aussi un peu d'ammoniac[61].Il est rabattu au sol par les pluies qu'indirectement il acidifie et rend eutrophisantes[62].Il acidifie secondairement le sol et contribue ainsi également à l'eutrophisation des milieux. Alors que la pollution soufrée desannées 1970-1980 a diminué, il est devenu la cause principale des pluies acides et de l'acidification des eaux douces.
Dans lesocéans,Bouwmanet al.estimaient en 1997 que les mers sont la première source naturelle d'ammoniac[63],mais aussi la plus incertaine et mal comprise (ex.:plus l'eauest froide, plus elle peut dissoudre d'ammoniac, mais bien d'autres facteurs interviennent et une même mer est à la fois un puits et une source d'ammoniac: quand la concentration d'ammoniac de l'eau de surface dépasse celle de l'air il y a émission de l'océan vers l'atmosphère, et inversement. Asmanet al.ont montré en 1994 que les zones polluées de lamer du Nordémettent l'ammoniac alors qu'ailleurs elle est un puits. La présence d'ammoniac (naturel ou anthropique) dans les eaux de surface est liée aux apports terrigènes (dépôts secs et pluviaux, apports par les fleuves et estuaires), mais aussi liée à l'activité zooplanctonique et à la décomposition de phytoplancton ou de zooplancton ou d'autres organismes marins. Les apports d'ammoniac dépendent aussi des courants marins, d'upwellings ou d'endo-upwellings et encore de la photochimie et du degré d'intensité des puits chimiques de NH3dans latroposphèresituée au-dessus de la mer, laquelle intensité dépend de l'éventuelle formation d'aérosols sulfatés (NH4)2SO4où le sulfate provient d'une oxydation par les radicaux OH° et NO3dudiméthylsulfide(DMS), uncomposé organosulfuréde formule (CH3)2S massivement produit par le phytoplancton et nébulisé ou évaporé dans l'air. Un autre puits chimique d'ammoniac est l'oxydation d'NH3par les radicauxhydroxyde.
Ammoniac anthropique
[modifier|modifier le code]Il a trois grandes origines: l'industrie chimique, la décomposition de nos urines et excréments, et des urines, fientes et excréments (lisiers et fumiers) émis par les animaux vivant en condition d'élevage dense ou hors-sol.
À titre indicatif, en 1987, Buijsmanet al.ont estimé[64]que dans les élevages européens, les animaux qui émettent le plus d'ammoniac sont lesbovins(18kgNH3par tête en moyenne par an), devant leschevaux(9,4kg), lesmoutons(3,1kg), lesporcs(2,8kg) puis lesvolailles(0,26kg), chiffres variant selon le type d'élevage, et à rapporter au nombre de têtes par élevage ou par hectare, et qui ne peut être dupliqué aux régions tropicales.
Son seuil de toxicité varie selon les espèces, la durée et le niveau d'exposition et leur environnement, mais l'excès d'ammoniac dans l'air ou dans un milieu est toxique et écotoxique.
Le gaz ammoniac (NH3) est source d'ammonium dans les précipitations (pluies, neiges, mais aussi rosée, brumes). De 1980 à 2008, les émissions de NH3françaises n'ont diminué que de 4 % (d'après leCentre interprofessionnel technique d'études de la pollution atmosphérique[65]). Le dépôt d’ammonium est indirectement acidifiant quand dans le sol il libère des cations H+par transformation ennitrites(NO2−) ounitrates(NO3−), touten eutrophisantle milieu où il s'est déposé[65];l'ammoniac n'étant pas la seule forme de l'azote en cause, l'étude de la pollution ammoniacale doit être faite dans le cadre d'une approche plus globale faisant le bilan des effets environnementaux en termes d'azote total.
Chez la plante
[modifier|modifier le code]La plupart des plantes terrestres exploitent l'ammoniac et d'autres déchets azotés incorporés dans lesolpar les matières endécomposition.Quelques-unes sontparasitesou hémiparasites d'autres plantes. D'autres, comme leslégumineusesfixatrices d'azote, bénéficient de relationssymbiotiquesavec lesrhizobiumsqui créent ammoniac à partir de l'azote atmosphérique[66],mais un excès d'ammoniac dans le sol ou même dans l'air peut en revanche avoir des effets négatifs sur de nombreuses espèces végétales[60],dès que les effets toxiques du NH3dépassent la vitesse et capacité de désintoxication in vivo des plantes qui y sont exposées.
À partir des sources agricoles ou industrielles, l'ammoniac se dépose en moyenne assez rapidement (dans les premiers quatre à cinq kilomètres après avoir été émis par sa source[60]). En contact avec les feuilles, le NH3peut entraîner:
- des dommages foliaires visibles;
- une croissance réduite;
- une productivité moindre;
- la formation de composés toxiques dans les tissus;
- une moindre tolérance et résilience face à lasécheresseet augel;
- une moindre résistance aux parasites et insectes nuisibles ainsi qu'aux maladies causées par des micro-organismes (pathogènes);
- une dégradation des associations symbiotiques oumycorhizienne;
- une concurrence faussée entre espèces au détriment de labiodiversitéet en faveur de quelques espèces ubiquistes ou résistantes.
Avant de retomber au sol, une partie du NH3anthropique ou naturel aura déjà été convertie dans l'atmosphère ennanoparticuleset enaérosolsdeNH4+(ammonium) qui eux posent un problème à des échelles au moins régionales. En effet, selon les données scientifiques disponibles, la charge critique à ne pas dépasser pour les milieux les plus vulnérables (landes, tourbières, zones humides oligotrophes, et certains milieux abritant descryptogames) serait de 5 à 10kgd'azote total parhectare(charge par an en dépôt sec et/ou humide combinée de toutes les formes de l'azote atmosphérique). Les plantes autochtones sont les plus vulnérables; les forêts semblent pouvoir supporter des charges plus élevées (de 10-20kg/haet par an), plus ou moins selon les conditionsédaphiques,mais la plupart des cryptogames (lichens, bryophytes, hépatiques) qu'elles hébergent y sont néanmoins très vulnérables au NH3ainsi qu'à d'autreseutrophisantsazotés. Sans doute parce que sélectionnées depuis des milliers d'années pour supporter les apports de fumiers et lisiers, les plantes cultivées sont celles qui supportent le mieux les retombées de NH3[60].Ces seuils critiques sont très fréquemment dépassés dans les régions industrielles et d'agriculture intensive (un hectare cultivé peut perdre jusqu'à 40kg/and'azote sous forme d'ammoniac[67]).
Dessynergiesou effets additionnels conjoints avec d'autres polluants (ozoneetCO2notamment qui semblent en augmentation presque partout) sont fortement suspectés mais avec des mécanismes toxicologiques et écotoxicologiques encore mal compris.
Chez l'animal
[modifier|modifier le code]Chez l'animal, l'ammoniac joue un rôle à la fois dans laphysiologienormale et anormale. En tant que polluant de l'air il affecte les animaux, plus ou moins selon les espèces et selon la durée d'exposition. À l'intérieur de la cellule, en tant que déchet dumétabolismedesacides aminés,il est rapidement toxique, pour la cellule puis pour l'organisme[68].L'organisme doit donc le gérer et l'éliminer.
- Les animaux aquatiques vivants l'évacuent facilement dans leur milieu ambiant (ammoniotélisme) car l'ammoniac est très soluble dans l'eau; ils n'ont donc pas besoin de produire de le transformer en complexes non-toxiques pour le stocker avant de l'évacuer.
- Les animaux terrestres le convertissent, eux, en intermédiaires non-toxiques avant de l’excréter (via l'urine et/ou les excréments secs).
Les deux intermédiaires les plus utilisés dans le monde animal sont:
- L'acide uriqueinsoluble dans l'eau (chez les insectes, oiseaux et reptiles ditsuricotéliques) qui l'excrétent sous forme de solide (uricotelia) ce qui est intéressant pour les espèces vivant en milieux arides et ne disposant que de peu d'eau, ou pour les oiseaux qui doivent rester légers pour consommer moins d'énergie[69];
- L'uréerelativement non-toxique et hydrosoluble (ureotelia) qui peut ensuite être évacuée dans l'urine. C'est le cas pour tous lesmammifèresqui doivent convertir l'ammonium (transporté dans le foie) en urée puis l'évacuer. L'ensemble des réactions permettant cette détoxication est ditecycle de l'urée[70].Un dysfonctionnementhépatique,tel que celui observé chez l'humain avec lacirrhose,peut conduire à un empoisonnement du sang par de l'ammoniac (hyperammoniémie). De même, le fonctionnement défectueux des enzymes responsables de cycle de l'urée, tels que l'ornithine transcarbamylase,conduit à une hyperammoniémie. Cette dernière contribue à laconfusion mentaleet peut conduire aucomade l'encéphalopathie hépatique,ainsi qu'à des maladies neurologiques (fréquentes chez les personnes présentant des anomalies du cycle de l'urée et desaciduriesorganiques[71]).
Remarque: l'urée peut être ensuite (re)fractionnée en ammoniac et endioxyde de carbonepar l'enzyme uréase présente dans certaines plantes (soja, haricot), certains invertébrés et dans certaines bactéries (notamment retrouvées dans lerumendesruminantsce qui explique que leurs bouses et fumiers sont plus ammoniacaux que chez d'autres espèces (première source anthropique d'ammoniac dans l'environnement)[72].
L'ammoniac participe chez les animaux aux équilibres acide-base normaux. Après la formation d'ammonium à partir deglutamine,l'α-cétoglutaratepeut être décomposé en produisant deux molécules debicarbonatequi deviennent disponibles comme« tampon »pour les acides alimentaires. L'ammonium est excrété dans lesurines,entraînant une perte nette d'acide.
L'ammoniac peut en outre se diffuser à travers lestubules rénauxet s'y combiner avec un ion hydrogène, permettant ainsi l'excrétion supplémentaire d'acide[73].
Chez l'humain
[modifier|modifier le code]
L'ammoniac peut passer dans l'organisme humain, principalement par inhalation, ou parfois il y est issu d'une production pathologique par l'organisme lui-même («intoxication endogène») à la suite d'un dysfonctionnement durein,dufoie,desmuscles,ou de l'intestin)[74].C'est« un gaz particulièrement toxique. À une concentration de 500ppmpour une exposition de 30min,il produit des effets irréversibles. À une concentration de 3 400ppm,il est mortel en 60min»[75].Les expositions aux fortes doses sont cependant rares (liées à un contexte industriel ou accidentel).
L'exposition chronique à de faibles doses touche par contre une grande partie du monde; dans les régions cultivées, sa première source de NH3est l'engrais azoté (« de 0 à 90 % de la quantité totale d'azote ammoniacal apportée peut s'évaporer »sous forme d'ammoniac)[67]et ses usines de fabrication. En Europe, l'ammoniac volatilisé perdu par les engrais agricole (minéraux et organiques) est après la lixiviation le second poste de pertes d’azote. Jusqu'à 20 % des apports d’engrais minéraux (selon les formes, le sol et conditions d'apport) et jusqu'à 70 % de la fraction ammoniacale deslisierspeuvent être perdus dans l'atmosphère, en quelques jours à quelques semaines après épandage[76],avec jusqu'à 40kg/haet par an[67].
Enpathologiehumaine et vétérinaire, une augmentation du taux d'ammoniac sanguin est signe de dysfonctionnement dufoie.Du NH3est naturellement issu de la dégradation desacides aminés.Il est transformé enuréedans le foie, pour être éliminé de l'organisme (détoxication) via l'urine;toute dégradation de fonctionnement du foie entraîne donc une augmentation du taux d'ammoniac dans le sang. Et l'excès d'ammoniac sanguin peut notamment entraîner uneencéphalopathie,avec divers symptômes:
L'ammoniac absorbé (ou anormalement produit) par l'organisme induit[74]:
- un altération desastrocytes,en modifiant les protéines astrocytaires (Glial fibrillary acidic protein);
- une altération des échanges ioniques cellulaires;
- une altération des sécrétions des NT.
L'origine d'une hyperammoniémie peut être directe (éventuellement génétiquement acquise):
- une acidose (le plus souvent, production deNH4+associée à un défaut d'élimination rénale);
- uneinsuffisance hépatiquesévère;
- unetoxicose médicamenteuse(ex.:valproate);
- uneprématurité,avec défaut deperfusion,liée à une immaturité hépatique (chez le bébé, dans les 24 à72 heuressuivant la naissance, se traduisant par desvomissements,unehypothermie,hyperventilationet conduisant aucoma).
L'origine peut aussi être indirecte[74],avec:
- une acidurie organique;
- un déficit de la B oxydation des AG;
- un déficit de lachaîne respiratoire.
Le taux sanguin normal d'ammoniac est 11 à 45µmol/l.Au-delà de 50µmol/l,on peut parler d'hyperammoniémie (quelques centaines à plus de 1 000µmol/l) qui peut être déclenchée par un changement important dans l'alimentation, un stress important, une infection.
Les symptômes en sont: des douleurs abdominales, unehépatomégalie,cytolyse,IHCavec troubles digestifs (anorexie,un dégoût pour les mets protéinés en particulierviandeetpoisson), troubles neuropsychologiques (asthénie,somnolence,etc.),troubles de l'humeur,troubles du comportementet de la personnalité (irritabilité…), de l'élocution,hallucinations,crises ataxiquesouconvulsivespuis «comahyperammoniémique »). Ces symptômes n'étant pas spécifiques, le diagnostic peut être difficile à poser. Chez l'adulte, il peut être suggéré par unretard mentalet/oupsychomoteur,des troubles du comportement, unemicrocéphalieavec atrophie cérébrale, un régime végétarien lié à une aversion pour les protéines, unsyndrome de Reye[74].
L’ammoniac étantlabile,le prélèvement sanguin (au moins1mlde sérum en tube hépariné ou avecEDTA) doit être fait si possible lors d'une crise et rapidement transporté dans de la glace (en moins de 15min) puis centrifugé et décanté le plus vite possible par un laboratoire prévenu de son arrivée. Il peut être conservé2 heuresà4°Cou48 heuresà−20°C[74].Le sang veineux en contient naturellement près de deux fois plus que le sang artériel ou capillaire, et le nouveau-né en produit naturellement plus (34–102µmol/lpour le sang veineux, et 50 à 128µmol/lpour le sang artériel pour un nouveau-né de trois jours) que l'enfant ou l'adulte[74].
Diagnostic différentiel
[modifier|modifier le code]Il doit faire éliminer[74]:
- d'autres formes d'encéphalite;
- l'épilepsie;
- uneintoxication alimentaire;
- uneporphyrie;
- lathrombose veineuse cérébrale;
- unetumeur cérébrale;
- etc.
Santé environnementale, santé au travail
[modifier|modifier le code]Les adsorbants commerciaux utilisés dans lesmasques à gazsont descharbons actifs,parfois imprégnés d’oxydes de cuivre.En 2017, ils sont encore moyennement efficaces pour l'ammoniac. Des adsorbants microporeux divers sont étudiés pour mieux adsorber le NH3:ce sont des charbons, zéolithes etmetal–organic frameworks(MOF); certains MOF detype UiO-66se sont montrés efficaces en conditions sèches et humides)[75].
Seuils à ne pas dépasser au travail: unedirective européennea fixé des seuils d'émission à ne pas dépasser (plafonds) pour réduire les émissions européennes de NH3à horizon 2010 puis 2020. Le NH3est l'un des principaux précurseurs de particules fines dont les effets sanitaires négatifs sont largement démontrés[67].
Pour l'exposition des ouvriers et autres employés de l'Industrie, l'American Conference of Governmental Industrial Hygienists (ACGIH), et le Canada recommandent de ne pas dépasser:
- 25 ppm, pour la TLV (valeur de limite d'exposition) et TWA (moyenne pondérée en fonction du temps)[77];
- 35 ppm, comme valeur plafond et STEL (limite d'exposition de courte durée)[77].
Utilisations
[modifier|modifier le code]Engrais
[modifier|modifier le code]Le NH3est principalement utilisé dans la production d'engrais;De l'ammoniac (contenant 82 % d'azote) sert parfois aussi d'engrais azoté gazeux; il est alors injecté directement dans le sol sous forme d'ammoniac liquéfié sous pression. Étant très soluble dans l'eau, une grande partie du gaz se dissout dans l'eau du sol.
Explosifs
[modifier|modifier le code]Sous forme gazeuse, l'ammoniac est aussi utilisé par l'industrie pour la fabrication d'explosifs.
Polymères
[modifier|modifier le code]L'ammoniac est un ingrédient de la fabrication de diverspolymères(plastiques,fibre synthétique,etc.).
Tabac
[modifier|modifier le code]On le trouve aussi dans lacigaretteou le tabac de pipe. Les fabricants l'ajoutent lors de la préparation du tabac, car en réagissant avec lanicotine(alcaloïde) l'ammoniac produit un composé nicotinique basique libre, encore plus assimilable par l’organisme que sous sa forme acide. Ceci multipliant très fortement l’effet addictifde la nicotine sur le cerveau; le fumeur est ainsi prisonnier de son addiction et fortement poussé à consommer toujours plus de tabac[78],[79],[80].
Réfrigération
[modifier|modifier le code]L'ammoniac est unfluide frigorigèneaux capacitésthermodynamiqueset thermiques excellentes, malgré les contraintes qu'il implique; alors désigné par la référenceR717:
- la lettre « R » signifie réfrigérant;
- « 7 »: les fluides frigorigènes d'origine inorganique sont répertoriés dans la série des 700. Le chiffre des centaines est donc un 7;
- « 17 »: le chiffre des dizaines et celui des unités ici représentent lamasse molairede la molécule, soitM(NH3)=17,0g/mol.
L'ammoniac est très utilisé dans le secteur du froid industriel dans les installations à puissance importante (plusieurs centaines de kW). En Suisse, plus de 90 % des équipements industriels y ont recours. Son utilisation devrait augmenter avec le bannissement des gaz nocifs pour l'environnement comme lesHFC[81].En raison de sa toxicité, il doit être confiné en salle des machines.
Carburant
[modifier|modifier le code]
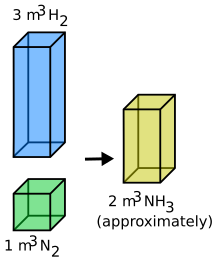
L'ammoniac est unvecteur énergétiquecar il permet de transporter de l'hydrogène sous une forme dont le stockage est relativement simple[82].Il brûle difficilement dans l'air mais la combustion est facilitée par une décomposition partielle par passage sur uncatalyseur.Il peut être utilisé comme carburant dans des moteurs adaptés, avec toutefois des problèmes encore à résoudre decorrosion,decatalyseur,d'additifs,d'émissions d'imbrûlés et une contribution à l'émission deNOxpolluants.
En1872,le docteurÉmile Lamm,dentiste français émigré aux États-Unis, dépose plusieurs brevets pour un moteur à ammoniac et met ce système en application sur une des lignes detramwaysdeLa Nouvelle-Orléans.
Pendant laSeconde Guerre mondiale,des véhicules (notamment desautocarsen Belgique) ont fonctionné avec de l'ammoniac. Dans lesannées 1960,l'armée américaine s'y est intéressée dans le cadre du concept MED (Mobile Energy Depot) qui visait à produire directement les carburants sur le champ de bataille à partir de réacteurs nucléaires transportables[83],[84].
AuXXIesiècle, l'ammoniac fait l'objet de nouvelles études pour des moteurs thermiques classiques (sans émissions de CO2) et pour le fonctionnement depiles à combustible.Il est particulièrement étudié pour le transport maritime[85],[86],[87],[88],[89].
Détection des fuites
[modifier|modifier le code]Son odeur particulière rend une fuite d'ammoniac facilement signalée, mais la recherche du point de fuite sur une installation ammoniac ne doit toujours se faire qu'à l'aide d'unappareil respiratoire isolantdu fait de sa très forte toxicité. On utilisait autrefois une baguette soufrée, qui enflammée au voisinage d'émanation d'ammoniac produit une fumée blanche dense permettant ainsi de localiser l'origine de la fuite; technique aujourd'hui interdite en raison de sa dangerosité. La recherche de fuite se fait, le plus souvent, à l'aide dedétecteurs électroniquesou de papiers imbibés dephénolphtaléine.
En tant que polluant
[modifier|modifier le code]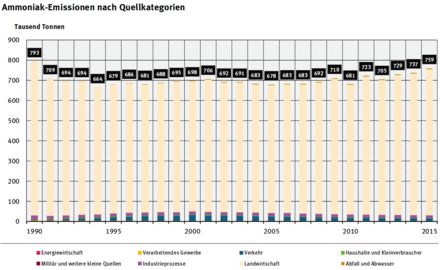


Caractéristiques et cinétique environnementale
[modifier|modifier le code]Hormis à faible dose, l'ammoniac est un gaz écotoxique, acidifiant et eutrophisant. Autour de ses sources (agricoles le plus souvent[42]), sous forme de dépôts humides ou secs, et à des distances plus ou moins grandes selon la quantité de gaz émise, et selon l'humidité environnante, la force et direction du vent, il contribue à l'acidification des pluies,brumes, brouillards, rosées (car très soluble dans l'eau) et de l'environnement.
Dans les eaux douces ou marines, il contribue notamment auxefflorescences algales[90],contribue au réchauffement[91].
Il se dépose rapidement sur les cuticules des feuilles dans lesquelles il peut aussi entrer via les stomates, et sur le sol où il est un puissanteutrophisant[92],[93].
Il est aussi indirectement source departicules fines(de typePM2.5(les plus dangereuses car pénétrant profondément les voies respiratoires), ce qui explique que y être chroniquement exposé diminue l’espérance de vie[94].Il peut s'adsorber sur des poussières en suspension[42].
Concernant les bâtiments d'élevage, ils sont souvent bas, ce qui encourage des retombées à leur proximité plutôt que très loin, ce que confirme l'observation des plantes nitrophiles (orties, gaillet et herbacées telles queDeschampsia flexuosaetHolcus lanatus), qui sont plus densément présentes à proximité d'unpoulailler(dans ce cas situé en zone tempérée proche d'une forêt de résineux) dont les émissions de NH3atteignaient 50μgd'ammoniac par mètre cube d'air et près duquel les dépôts d'azote dépassaient 40kgde N-NH3par hectare et par an)[95].Les feuilles d'arbres et plus encore debryophytesvoient aussi leur teneur en azote croitre dans les centaines ou dizaines de mètres situés autour du bâtiment, surtout sous le vent dominant (la teneur en azote des feuilles de bryophytes grimpe jusqu'à environ 3 % du poids sec de la feuille quand le taux d'ammoniac de l'air dépasse 20 à 40μg/m3d'air[96].Ces modifications floristiques (nitrophiles surfavorisées) sont cependant moins visibles dès que l'on s'éloignait d'un élevage (en moyenne 90 % de la flore était à nouveau normale à une cinquantaine de mètres en moyenne autour du poulailler Cependant les espèces très vulnérables à l'eutrophisation étaient en régression visible jusqu'à environ 300mautour des mêmes élevages[96].
Il a été montré que les élevages émettent aussi de l'ammoniac lanuit,mais qu'il est alors moins dispersé (en moyenne il y a moins de vent et de turbulence d'air la nuit[97]). La chaleur et l'humidité de l'air,qui varient beaucoup selon les régions du monde sont aussi des facteurs entrant en jeu.
Des modèles mécanistes de dispersion et de dépôt d'NH3ont été mis au point[42];ils montrent tous, comme les observations de terrain, que les dépôts secs cumulés peuvent varier de quelques dixièmes de % à près de 20 % de la quantité émise à 400men aval d'une source (ces paramètres variant principalement en fonction de la hauteur de la source par rapport au couvert végétal, mais aussi selon la stratification thermique, la force et direction du vent)[42].
Le degré de «contamination» des plantes dépend des conditions météo et d'interactions avec les résistances stomatiques et cuticulaires des feuilles: quand il fait chaud et sec, c'est par les stomates que l'ammoniac pénètre dans la plante. Quand il fait frais/humide c'est la voie cuticulaire qui prédomine (et elle est encore mal comprise)[42].
Sources d'émissions polluantes
[modifier|modifier le code]


Dans le monde, les principales sources diffuses d'ammoniac sont devenues (à une écrasante majorité) l'agriculture intensive(élevage intensif, engrais azotés, épandages), loin devant les transports (les véhicules équipés depots catalytiquessont sources d'ammoniac rappelle leCITEPA[98]). Une pollution diffuse mal mesurée est liée auxbrûlis(en France métropolitaine, l'écobuageest jugé responsable de 0,2 % des émissions) et incendies de forêt, auxégouts,aux sols et eaux réchauffés qui perdent de l'ammoniac[61].Les données satellitaires récentes montrent que les usines d'engrais sont souvent encore des hotspots d'émissions intenses, et plus localement certaines stations d'épuration, certains lieux de stockages de matières organiques (lisiers, fumiers, déchets organiques) ou très localement et ponctuellement certains postes d'unités deméthanisation[99].
Selon les études disponibles, à la fin duXXesiècle l'agriculture est devenue la source de 80 à 96 % de l'ammoniac anthropique[100].L'utilisation d'engrais minéraux azotés pour la fertilisation (nitrate et/ou ammonium) entraîne la volatilisation d'une partie de l'ammoniac responsable selon les auteurs scientifiques de 15 à 20 % de toutes les émissions, principalement en zones tropicales où les conditions climatiques favorisent ce phénomène. Les pays en développement sont donc les plus concernés (80 % des émissions en provenaient à la fin des années 1990 selon Bouwman et van der Hoek en 1997, ce qui a été ensuite confirmé par les données satellitales).
Remarque: selon le climat, l'époque de l'année et selon le type de pratiques agricoles qui y sont appliquées, unchampou uneprairiepeuvent être « puits » ou « source » d'ammoniac pour l'air et le sol et l'eau[101].
Quantités
[modifier|modifier le code]En tant que polluant environnemental, l'ammoniac a été longtemps méconnu car ses sources agricoles en sont très dispersées et donnaient l'impression d'être éloignées voire sans effets sur les zones peuplées. Il est maintenant planétairement suivi à distance, sur toute la planète, dans la colonne d'air, grâce à l'interféromètre atmosphérique de sondage dans l'infrarouge(IASI, un capteur interférométrique ultrasensible, mis au point par leCentre national d'études spatiales(CNES) etEUMETSAT) embarqué sur les satellites météorologiques européensMetOpet grâce au satelliteAquade la NASA quantifiant à grande échelle le NH3dans l'atmosphère, montrant une hausse constante des taux d'ammoniac de 2002 à 2016 à partir des centres agricoles des États-Unis, de Chine et d’Inde et un peu moins de l'Europe; selon la NASA, une petite partie de cette augmentation pourrait être due à lachimie atmosphérique(la lutte contre les pluies acides a efficacement réduit le taux de SOxde l'air, or ces derniers retiraient de l'atmosphère une partie de l'ammoniac anthropique) et au réchauffement des sols (qui retiennent alors moins d’ammoniac)[61].
Huit ans de données accumulées (2008-2016) ont permis au CNRS et à l'Université libre de Bruxelles de publier en 2018 la première cartographie mondiale de l’ammoniac atmosphérique avec un détail sans précédent (maille au km2).
En 2018, dans la revueNature[102]Van Dammeet al.confirmaient que la pollution azotée par l'élevage intensifavait été très sous-estimée par les inventaires et cartographies de la pollution de l'air, à échelle planétaire; Cette pollution est en outre devenue chronique et catastrophique (à des échelles presque continentale) enInde du Nordet au sud de l’Afrique de l’Ouest (où le nuage de pollution azotée s'étend largement au-dessus de l'océan Atlantique). Ailleurs, dans les pays riches les zones très polluées par l'ammoniac sont plus petites et centrées sur des usines chimiques ou des élevages industriels particulièrement intensifs. Ce travail confirme la responsabilité majeure de l’élevage intensifet de la production industrielle d’engrais (à partir de pétrole). Il montre aussi que de très nombreuses sources n’avaient pas été auparavant identifiées, faute de mesuresin situ.Sur 248 grandes sources de NH3très nettement visibles de satellite (de diamètre de moins de 50km) les deux tiers n’avaient pas encore été repérées par les États ou les autorités environnementales. 83 étaient des fermes d’élevage intensif et 130 des usines d’engrais. La région la plus émissive au monde (sources agro-industrielles principalement) est lavallée du Gangequi émet 475kgde NH3par seconde, soit 1,1 × 1017molécules par centimètre carré (PakistanetInde du Nord). Pour les élevages, le record est une émission moyenne de 0,81kg/s,observé dans les fermes géantes de Bakersfield et Tulare (Californie) qui abritent des centaines de milliers de vaches[102].Quant à l’usine la plus polluante (0,75kg/s), il s’agit d’un complexe chimique d'Ouzbékistan,de lavallée de Ferghana,fabriquant des engrais dans une région par ailleurs d’agriculture intensive[102].La cartographie par satellite n'a permis de détecter qu'un unique foyer naturel, enTanzanie[102].
Impact environnemental
[modifier|modifier le code]Les impactstoxicologiquesde l'ammoniac semblent assez bien connus, mais ses impactsécotoxicologiques,autres que liés à son caractère basique oueutrophisantsont moins bien étudiés.
On sait que:
- les quantités d'ammoniac rejetées dans l'atmosphère en font l'un des principaux responsables de l'acidification de l'eauetdes sols[103],ainsi qu'un facteur favorisant lespluies acides[104].En France et en Europe, le secteur de l'agricultureest à l'origine de 95 % des émissions d'ammoniac[105].80 % des émissions proviennent de la volatilisation des déjections animales; les 20 % restants sont principalement liés à la production desengraisazotés et à leur épandage, difficile à adapter aux aléas climatiques[105];
- il s'agit du principal responsable de l'eutrophisationdes milieux aquatiques[103];
- avec unpotentiel de réchauffement global(enanglais:global warming potential,GWP) de 0[106],l’ammoniac est un fluide frigorigène sans effet sur leréchauffement climatique,contrairement aux fluides frigorigènes typeHFCcouramment utilisés dans les climatiseurs et pompes à chaleur dont le GWP peut varier de 1 430 (R134a)[106]à 3 900 (R404A)[106];
- de même, avec unpotentiel de déplétion ozonique(ODP) de 0[107],l'ammoniac est un fluide frigorigène sans effet sur la couche d'ozone, contrairement aux fluides frigorigènes typeHCFCdont le plus connu est leR22encore courant dans les systèmes de climatisations anciens;
- la production d'ammoniac est une grande consommatrice d'électricité, représentant jusqu'à 2 % de la production mondiale[108];
- dans l'eau, bien que considéré comme non toxique aux doses où il est aujourd'hui présent, il semble discrètement affecter le métabolisme de toustéléostéens(l'infra-classe desTeleosteiqui regroupe l'écrasante majorité des espèces de poissons actuels, soit environ 23 600 espèces actuellement connues), par exemple en diminuant les réflexes de ces poissons[109],[110];
- une certaine toxicité est également constatée chez des animaux primitifs comme lesamphipodes[111].
En France, selon leCITEPA,les émissions d’ammoniac atmosphérique ont légèrement baissé en trente ans (de 1980 à 2012; en moyenne de 0,5 % par an sur cette période pour arriver à 636 000tonnes/anen 2012)[112].Leprotocole de Göteborgfixe une nouvelle diminution: −4 % de 2005 à 2020, soit 636 000tonnes/an[112].
Polluant transfrontalier:en Europe, avec l'European Monitoring and Evaluation Programme(EMEP) et en application de la convention de Genève diteconvention sur la pollution atmosphérique transfrontière à longue distanceet de son « protocole »[113]sur l'acidification, l'eutrophisation et l'ozone, l'acidité des pluies fait l'objet d'un suivi, centralisé pour la partie française par EcoLab (Laboratoire écologie fonctionnelle et environnement), accueille le point focal national chargé de la modélisation des charges critiques atmosphériques)[114].
En France, l'acidité des pluies a diminué grâce à une forte diminution des émissions dedioxyde de soufre(SO2), mais leur teneur en ammoniac n'a pas diminué, alertait le ministère de l'Environnement en 2011[65],alors que le protocole de la convention demande aux États signataires d'appliquer« les meilleures techniques disponibles pour prévenir et réduire les émissions d'ammoniac énumérées dans le document d'orientation Vadopté par l'Organe exécutif à sa dix-septième session (décision 1999/1) et tous amendements y relatifs »notamment par de« bonnes pratiques agricoles respectueuses de l'environnement »[113].Sonarticle 8stipule que les parties doivent élaborer des« stratégies visant à réduire davantage les émissions de soufre, d'oxydes d'azote,d'ammoniac et decomposés organiques volatilsen se fondant sur les charges critiques et les niveaux critiques ainsi que sur les progrès techniques, et amélioration de la modélisation de l'évaluation intégrée pour calculer la répartition optimisée au niveau international des réductions des émissions compte tenu de la nécessité d'éviter des coûts excessifs pour quelque Partie que ce soit. Une importance particulière devrait être accordée aux émissions imputables à l'agriculture et aux transports »[113].
Pour la France, second pays européen le plus émetteur d’ammoniac derrière la fédération de Russie, le niveau de 1990 avait été évalué à 814 000tde gaz NH3par an, et la convention de Genève imposait de descendre sous un « plafond » de 780 000t/an,soit un effort de −4 %[115]alors qu'on demandait à laSlovaquiequi émettait 62 000t/ande réduire ses émissions de 37 %.
Écotoxicologie
[modifier|modifier le code]Peu de données sont disponibles à ce sujet dans les écosystèmes car l'ammoniac ne semble pas être un produit très présent dans un écosystème normal. Il est cependant démontré que:
- il endommage le système respiratoire des animaux d'élevages intensifs qui y sont parfois fortement et souvent fréquemment ou chroniquement exposés[116].Ainsi chez le porc adulte, 25ppmpeuvent après six jours d'exposition causer une inflammation nasale, une hyper-réactivité trachéale et réduire la croissance corporelle[116].Et à partir de 50ppm,des dommages pulmonaires apparaissent, qui probablement peuvent favoriser diverses maladies pulmonaires[116];
- dans l'eau, sa toxicité pour lesamphipodes[117]et lesamphibiensnotamment, varie aussi selon le pH du milieu[118];
- il se montre très toxique pour certaines espèces decrustacésduzooplanctonmarin (copépodespar exemple)[119];
- au moins pour certaines espèces, sa toxicité varie considérablement selon la température de l'eau: ainsi le NH3est beaucoup plus toxique à10°Cqu'à20°Cpour le copépodeAcartia pacifica,mais cette toxicité ne varie pas de manière non linéaire avec la température; dans ce dernier cas, la toxicité de l'ammoniac« tend à diminuer avec l'augmentation de la température jusqu'à un certain point, au delà duquel elle augmente considérablement avec l'augmentation de la température »[120].).
Phrases de risqueetconseils de prudenceselon l'INRS
[modifier|modifier le code]

- R10 – Inflammable (relativement peu)
- R23 – Toxique par inhalation
- R34 – Provoque des brûlures
- R50 – Très toxique pour les organismes aquatiques
- S9 – Conserver le récipient dans un endroit bien ventilé
- S16 – Conserver à l’écart de toute flamme ou source d’étincelle. Ne pas fumer
- S26 – En cas de contact avec les yeux laver immédiatement et abondamment avec de l’eau et consulter un spécialiste
- S36/37/39 – Porter un vêtement de protection approprié, des gants et un appareil de protection des yeux/du visage
- S45 – En cas d’accident ou de malaise, consulter immédiatement un médecin (si possible lui montrer l’étiquette)
- S61 – Ne pas rejeter dans l’environnement. Consulter les instructions spéciales / la fiche de données de sécurité
Référence ONU pour le transport des matières dangereuses
[modifier|modifier le code]- Classe 2
- numéros:
- 1005 (ammoniac anhydride)
- 3318 (ammoniac en solution aqueuse de densité inférieure à 0,880 à15°Ccontenant plus de 50 % d'ammoniac)
- 2073 (ammoniac en solution aqueuse de densité inférieure à 0,880 à15°Ccontenant plus de 35 % mais au maximum 50 % d'ammoniac)
- numéros:
- Classe 8
- numéro 2672 (ammoniac en solution aqueuse de densité comprise entre 0,880 et 0,957 à15°Ccontenant plus de 10 % mais au maximum 35 % d'ammoniac)
Notes et références
[modifier|modifier le code]- P.H. Nysten,Dictionnaire de médecine, de chirurgie, de pharmacie, des sciences accessoires et de l'art vétérinaire,Société typographique belge,,p.345.
- AMMONIAC (ANHYDRE),Fiches internationales de sécurité chimique.
- (en)David R.Lide,CRC Handbook of Chemistry and Physics,Boca Raton, CRC Press/Taylor & Francis,,89eéd.,2736p.(ISBN9781420066791,présentation en ligne),p.9-50.
- (en)Yitzhak Marcus,The Properties of Solvents,vol.4, Angleterre,John Wiley & Sons,,239p.(ISBN0-471-98369-1).
- Masse molaire calculée d’après«Atomic weights of the elements 2007», surwww.chem.qmul.ac.uk.
- (en)T.A. Czupponet al.,Kirk-Othmer Encyclopedia of Chemical Technology: Ammonia,vol.2,John Wiley & Sons,4eéd.
- (en)James E. Mark,Physical Properties of Polymer Handbook,Springer,,2eéd.,1076p.(ISBN978-0-387-69002-5et0-387-69002-6,lire en ligne),p.294
- «Gases – Densities»(consulté le).
- Yost, Don M.,Systematic Inorganic Chemistry,READ BOOKS,,440p.(ISBN978-1-4067-7302-6,lire en ligne),« Ammonia and Liquid Ammonia Solutions »,p.132
- Blum, Alexander, «On crystalline character of transparent solid ammonia»,Radiation Effects and Defects in Solids,vol.24,no4,,p.277(DOI10.1080/00337577508240819)
- (en)Robert H.Perryet Donald W.Green,Perry's Chemical Engineers' Handbook,États-Unis, McGraw-Hill,,7eéd.,2400p.(ISBN0-07-049841-5),p.2-50
- Weiss, 1985.[source insuffisante]
- «Properties of Various Gases», surflexwareinc.com(consulté le)
- (en)David R.Lide,CRC Handbook of Chemistry and Physics,Boca Raton, CRC Press/Taylor & Francis,,90eéd.,2804p.(ISBN9781420090840,présentation en ligne).
- (en)David R.Lide,CRC Handbook of Chemistry and Physics,Boca Raton, CRC Press,,83eéd.,2664p.(ISBN0849304830,présentation en ligne),p.5-89
- Magalie Roy-Auberger, Pierre Marion et Nicolas Boudet,Gazéification du charbon,éd. Techniques de l'ingénieur, réf.J5200,10 décembre 2009,p.4
- (en)David R.Lide,CRC Handbook of Chemistry and Physics,Boca Raton, CRC Press/Taylor & Francis,,89eéd.,2736p.(ISBN9781420066791,présentation en ligne),p.10-205.
- «The Ammonia (NH3,D1) Structure», surcst-www.nrl.navy.mil(consulté le)
- Numéro indexdans le tableau 3.1 de l'annexe VIdurèglement CEno1272/2008,16 décembre 2008.
- Sigma-Aldrich.
- «Ammoniac» dans la base de données de produits chimiquesReptoxde laCSST(organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- «Ammonia», surhazmap.nlm.nih.gov(consulté le)
- «ESIS»(consulté le)
- Le doublet électronique explique facilement sa réactivité, notamment son comportement debase faibleou de réducteur, sa polarisabilité ou son rôle de ligand en chimie générale ou minérale, voire de nucléophile en chimie organique.
- NH3aqueuxest une base faible, pKa= 9,23.
- EurostatAgriculture - ammonia emission statistics,données extraites en juin 2015.
- Jobert Marine,Air: l’ammoniac repart à la hausse,8 juillet 2016.
- Programme de recherche NUAGE, coordonné par AgroParistech, et financé par l'Ademe: voir CORTEA Connaissance et réduction des émissions de polluants dans l'air -5erestitution du programme CORTEA. Synthèse et recueil des résumés des projets CORTEA achevés en 2020,https://librairie.ademe.fr/cadic/5135/CORTEA_Connaissance_et_r__duction_des___missions_de_polluants_dans_l_air_-_5__me_restitution_du_programme_.zip(voir chapitreMesure des émissions d’ammoniac).
- Agence européenne de l'environnement,Ammonia (NH3) emissions.
- Webb J., Chadwick D. et Ellis, S. (2004),Emissions of ammonia and nitrous oxide following rapid incorporation of farmyard manures stored at different densities,Nutrient Cycling in Agroecosystems,70, 67-76.
- Webb J., Henderson D. et Anthony S.A. (2001),Optimising livestock manure applications to reduce nitrate and ammonia pollution: scenario analysis using the MANNER model,Soil Use and Management,17, 188-94.
- Dioscoride,3, 98.
- Oscar BlochetWalther von Wartburg(préf.Antoine Meillet),Dictionnaire étymologique de la langue française,P.U.F.,(1reéd.1932),p.23,s.v.
- Robert Boyle,Experiments and considerations touching colors,1664.
- De Ville G., 1850,Note sur l'assimilation de l'azote de l'air par les plantes, et sur l'influence qu'exerce l'ammoniaque dans la végétation,Comptes rendus de l'Acad. Sci., Paris, 31, 578-580.
- Schlösing Th. (1874),Sur l'absorption de l'ammoniaque de l'air par les végétaux,Comptes rendus de l'Acad. Sci., Paris, 78, 1700-1703.
- Boussingault J.B (1856),Recherches sur la végétation,Troisième mémoire,De l'action du salpêtre sur le développement des plantes,Ann. Chim. Phys. Ser.,3, 46, 5-41.
- Lawes J.B. et Gilbert J.H. (1851),On agricultural chemistry,J. R. Agr. Soc.,12, 1-40.
- Bineau A. (1854),Études chimiques sur les eaux pluviales et sur l'atmosphère de Lyon et de quelques points des environs,Lyon (cité dans Hall et Miller, 1911).
- Heinrich R. (1881),Über die Ammoniakmengenwelche der Atmosphäre im Lauf eines Jahres durch Salzeure entzogen werden,Wollnys Forschungen, 4, 446-452.
- Kellner (1986),Über das Maximum auf gebundenen Stickstoff Welches des Ackerboden der Atmosphäre zuenziehen vermag,Landwirtschaftliche Jahrb., 15, 701-711.
- Benjamin Loubet (2000),Modélisation du dépôt sec d’ammoniac atmosphérique à proximité des sources,université Paul-Sabatier, URL:https://tel.archives-ouvertes.fr/tel-00003250/document
- Hall A.D et Miller N.H.J (1911),On the absorption of ammonia from the atmosphere,J. Agric. Sci.,4, 56-68.
- L'agencement de la molécule est pyramidale, avec une distance N-H équivalant à 1Å,et un angle HNH de l'ordre de 107°.
- Whitehead D.C. et Raistrick N. (1990),Ammonia volatilisation from five nitrogen compounds used as fertilizers following surface application to soils of differing characteristics,J. Soil Sci.,41, 387-394.
- Dictionnaire français-latin de Trévoux;Dictionnaire universel francois et latin:Contenant La Signification Et La Definition tant des mots de l'une & de l'autre Langue, avec leurs differens usages, que des termes propres de chaque État & de chaque Profession, édité à Paris, par la compagnie des libraires associés en1752(numérisé parGoogle Livres).
- Il vient du mot latinammoniacum,emprunté au grecammôniakon,de même emploi. L'évolution médiévale a parfois engendré les termes synonymesarmoniacouarmognac,voirearmagnac.
- (en)«azanes»,IUPAC,Compendium of Chemical Terminology[«Gold Book»], Oxford, Blackwell Scientific Publications, 1997, version corrigée en ligne: (2019-),2eéd.(ISBN0-9678550-9-8)
- La production industrielle de l'ammoniac a ouvert la voie à une filière industrielle, qui se déploie vers les composés nitrés, par exemple par le biais de la fabrication d'acide nitriquevia leprocédé Ostwald.L'adsorption alcaline terminale de ce procédé pour récupérer les restes d'acide nitrique peut s'opérer avec une solution d'ammoniaque, pour obtenir dunitrate d'ammonium,à l'origine des engraisammonitrates.
- Selon le formulaireChimie techniquerédigé par H. Ibert et traduit par Francis Pichon, pour les éditions Mac-Graw Hill,op. cit.,le procédé Haber-Bosch classique se caractérise par une pression du mélange gazeux initial à proportions stœchiométriques, comprise entre200et250bar et une température optimale de550°C.Tant que les catalyseurs sont à base de Ni et de Fe, sur des supports d'oxydes d'aluminium et de silicates, et même si les températures et pressions des gaz sont modifiés largement, il est possible de classer l'ensemble de ces procédés dans la famille des procédés Haber-Bosch. Peu importe l'origine des gaz, le (di)azote N2issus dugaz à l'airou de procédés de fabrication d'azote liquide Linde, le gaz hydrogène H2dugaz à l'eauou par voies électrolytiques en milieu aqueux. Notons les progrès remarquables au cours duXXesiècle, mais à l'époque assez bien tenus secrets, pour l'obtention de support à grandes surfaces spécifiques. Ce qui permet des gains en termes de temps de passage et même d'énergie.
- Selon H. Ibert,op. cit.,le procédé Haber Bosch modifié opte pour une pression plus élevée de325bar sans modifier la température. Le procédé de laNitrogen Engineering Corporation,entreprise américaine, serait optimum à300bar et550°C.
- Selon H. Ibert, cité supra, le procédé italien Casale serait resté à des pressions de600bar pour500°C.
- Selon Ibert, cité supra,250bar et550°C.
- Pour une présentation actualisée des entreprises productrices et des pays producteurs, lire la ficheammoniacde laSociété chimique de France(SCF), mise à jour par Jean-louis Vigne en 2014, lien externe cité.
- (en)«Cleaner, cheaper ammonia UTokyo researchers dramatically clean up ammonia production and cut costs», suru-tokyo.ac.jp,.
- Daphné Lecellier, «Synthèse d’ammoniac à partir d’azote et d’eau», surFrance diplomatie,(consulté le).
- (en)USGS,«Nitrogen (Fixed)—Ammonia»,Mineral Commodity Summaries,(lire en ligne[PDF]).
- «De l'ammoniac superionique créé et analysé en laboratoire», surCNRS,(consulté le).
- (en)J.-A. Hernandez, M. Bethkenhagen, S. Ninet, M. French, A. Benuzzi-Mounaixet al.,«Melting curve of superionic ammonia at planetary interior conditions»,Nature Physics,(DOI10.1038/s41567-023-02074-8)(correctionle).
- Krupa S.V. (2003),Effects of atmospheric ammonia (NH3) on terrestrial vegetation: a review,Environmental Pollution,124: 179–221 (résumé).
- «NASA satellite identifies global ammonia ‘hotspots'», surNASA,(consulté le),résume notamment une étude publiée dansGeophysical Research Letters.
- Houdijk A, Smolders A et Roelofs J (1993),The effects of atmospheric nitrogen deposition on the soil chemistry of coniferous forests in the Netherlands,Environmental Pollution,80, 73-78.
- Tableau I.3 dans Loubet B. (2000),Modélisation du dépôt sec d’ammoniac atmosphérique à proximité des sources[PDF],thèse de physique, université Paul-Sabatier, 361p.
- Buisman E, Maas H.F et Asma W (1987),Anthropogenic NH3emissions in Europe,Atmospheric Environment,21(5), 1009-1022.
- CGDD (2011),La qualité des eaux de pluie: acidité en baisse mais pas de progrès pour les dépôts d’azote[PDF],ministère de l'Écologie, du Développement durable, des Transports et du Logement, Service de l'Observation et des statistiques,Le point sur,no88, juin 2011, 4p.
- Adjei, M.B.; Quesenberry, K.H. et Chamblis, C.G. (juin 2002),Nitrogen Fixation and Inoculation of Forage Legumes,University of Florida IFAS Extension.
- Comifer/Groupe AzoteCalcul de la fertilisation azotée[PDF],Groupe azote Comifer, avril 2011, 92p.
- PubChem Substance Summary(consulté le 7 juillet 2009).
- (de)Stickstoff-Exkretion,dans Römpp Online, Georg Thieme Verlag, 13 juin 2014.
- (de)(Harnstoff-Cyclus, Cycle de l'urée).Dans Römpp Online, Georg Thieme Verlag, 13 juin 2014.
- Zschocke, Johannes, et Georg Hoffman (2004),Vademecum Metabolism.Friedrichsdorf, Allemagne, Milupa GmbH.
- (de)Urease.Dans Römpp Online, Georg Thieme Verlag, 13 juin 2014.
- Rose Burton,Renal pathophysiology: the essentials,Baltimore, Williams & Wilkins,,351p.(ISBN978-0-683-07354-6,OCLC424442230).
- Gaspard Beaune,Les hyperammoniémies[ppt],Laboratoire de biochimie CHRA, 26 septembre 2002 (consulté le 4 octobre 2011).
- Khabzina Y. et Farrusseng D. (2017),Application des MOFs à l’adsorption de gaz toxiques industriels,dans33eréunion annuelle du Groupe francais des zéolithes, mars,résumé.
- Nicolardot B., Mary B., Houots S. et Recous S. (1997),La dynamique de l'azote dans les sols cultivés.InMaîtrise de l'azote dans les agrosystèmes,Annales colloques INRA 83, Reims (France), 19-20 novembre 1996, INRA Éd., 87-103.
- CCHST,Fiche Ammoniac,centre canadien d'hygiène et de sécurité au travail (consulté le 9 décembre 2018).
- Revue médicale suisse;[1]Modification de la composition des cigarettes durant le XXe siècle: rôle de l’industrie du tabac et effet sur la dépendance tabagique
- «Dis pourquoi Papa: Pourquoi l'ammoniac rend dépendant du tabac?», surww3.ac-poitiers.fr(consulté le)
- «Composants du tabac», surQuebec sans tabac(consulté le)
- «Installations de réfrigération: Prudence avec l’ammoniac», surbafu.admin.ch,(consulté le).
- Feuillade G. (1984),Le stockage chimique de l'énergie,IV.Utilisation des nouveaux vecteurs d'hydrogène dans les moteurs thermiques. Élaboration d'un programme prospectif général,Entropie,20(119), 57-68 (Notice Inist-CNRS/résumé).
- (en)Burwell, S. B., Carlson, J. A. et Clark, R. G., «Mobile energy depot feasibility study: summary report», surosti.gov,(consulté le).
- C.G. Garabedian et J.H. Johnson,The theory of operation of an ammonia burning internal combustion engine,US Army tank automotive center, Warren Michigan, 1963.
- Adeline Descamps, «Transport maritime: le grand consensus autour de l'ammoniac», surjournalmarinemarchande.eu,.
- Cédric Philibert, «Des cargos écolos grâce à l’ammoniac vert», surrevolution-energetique.com,.
- Japanese firms working on ammonia-fueled engines.
- Stockage de l’énergie via l’ammoniac.
- Ammonia-fueled vessel gets approval.
- Paerl H.W., Gardner W.S., McCarthy M.J., Peierls B.L. et Wilhelm S.W. (2014),Algal blooms: noteworthy nitrogen,Science,346, 175.
- Shindell D.T.et al.(2009),Improved attribution of climate forcing to emissions,Science,326, 716–718.
- Galloway J.et al.(2003),The nitrogen cascade,Bioscience,53, 341–356 (2003).
- Bobbink, R.et al.,Global assessment of nitrogen deposition effects on terrestrial plant diversity: a synthesis,Ecol. Appl.,20, 30–59 (2010).
- Lelieveld J, Evans J.S, Fnais M, Giannadaki D et Pozzer A (2015), «The contribution of outdoor air pollution sources to premature mortality on a global scale»,Nature,525, 367–371.
- Kaupenjohann M., Döhler H. et Bauer M. (1989),Effects of N-immissions on nutrients status and vitality of Pinus sylvestris near a hen-house,Plant Soil,113, 279-282.
- Pitcairn C.E.R., Leith I.D., Sheppard L.J., Sutton M.A., Fowler D., Munro R.C., Tang S. et Wilson D. (1998),The relationship between nitrogen deposition, species composition and foliar nitrogen concentrations in woodland flora in the vicinity of livestock farms,Environ. Pollut.,102 (S1), 41-48.
- Jacobs A.F, van Boxel J.H et El-Kilani R.M (1994),Night-time free convection characteristics within a plant canopy,Boundary-Layer Meteorol.,71:375-391.
- Lire en ligne,surcitepa.org(consulté le 28 juin 2019).
- Dirrenberger P, Nicot T, Mont N., Kunz-Iffli J, Grosjean, J, Galland B,… et Bruant D (2018),Évaluation des niveaux d’exposition à différents composés délétères dans les unités de méthanisation,Archives des Maladies Professionnelles et de l'Environnement,79 (3), 373.
- Tableau I.2: Exemple d'émissions d'ammoniac liée à l'activité anthropique, à l'échelle globale; d'après Schlesinger et Hartley (1992), Dentener et Crutzen (1994), et Bouwmanet al.(1997), cités par Benamin Loubet inModélisation du dépôt sec d’ammoniac atmosphérique à proximité des sources,Physique, université Paul-Sabatier, 2000,p.38/361
- David M. (2002),Échange d'ammoniac entre une prairie et l'atmosphère: sources et puits à l'échelle du couvert prairial et influence des pratiques agronomiques(Doctoral dissertation, Paris 11) (résumé).
- Van Damme, M., Clarisse, L., Whitburn, S., Hadji-Lazaro, J., Hurtmans, D., Clerbaux, C. et Coheur, P.-F (2018),Industrial and agricultural ammonia point sources exposed,Nature,564, 99-103,DOI10.1038/s41586-018-0747-1
- Ifen.
- Ademe.
- Commission européenne.
- International Institute of refrigeration,Ammonia as a Refrigerant,3eéd.,DrA.B. Pearson, 2008.
- Michèle Mondot, Ahmed Bensafi et Christophe Marvillet,L'après R22 - Guide des fluides frigorigènes pour la climatisation,Publications duCETIAT,2002.
- (en)«Water and air are all you need to make one of world’s most important chemicals», surtheconversation.com
- McKenzie, D.J., Shingle, A., Claireaux, G. et Domenici, P. (2009),Sub-lethal concentrations of ammonia impair performance of the teleost fast-escape response,Physiol.Biochem. Zool.,82, 353–362.
- McKenzie, D.J., de bardeaux, A., Claireaux, G. et Domenici, P. (2009).[source insuffisante]
- Prenter, J., MacNeil, C., Dicka, J.T.A., Riddella, G.E. et Dunn, A.M. (2004),Lethal and sublethal toxicity of ammoniato native, invasive, and parasitised freshwater amphipods,Water Res.,38, 2847–2850.
- Ammoniac,Centre interprofessionnel technique d'études de la pollution atmosphérique (CITEPA).
- ONU (2000),Protocole à la convention de 1979 sur la pollution atmosphérique transfrontière à longue distance, relatif à la réduction de l'acidification, de l'eutrophisation et de l'ozone troposphérique[PDF],74p.
- ECOLABEcolab.
- Tableaup.24/74 duprotocole de Genève de 2000.
- Gustin, P., Urbain, B., Prouvost, J. et Ansay, M. (1999),Impact de l'ammoniac sur le système respiratoire du porc,Bulletin et mémoire, Académie royale de médecine de Belgique, 154 (6, SPI), 371-376.
- Ankley G.T, Schubauer-Berigan M.K et Monson P.D (1995),Influence of pH and hardness on toxicity of ammonia to the amphipod Hyalella azteca,Canadian Journal of Fisheries and Aquatic Sciences,52 (10), 2078-2083 (résumé).
- Dejours P, Armand J et Beekenkamp H (1989),La toxicité de l'ammoniac est fonction du pH de l'eau.Étude chez la salamandre Pleurodeles waltl. Comptes rendus de l'Académie des sciences, série 3, Sciences de la vie, 308(2), 55-60.
- Shang J. Lu M et Yu Q (2018),Acute Effects of Ammoniac Nitrogen on Marine Copepod Acartia pacifica When Exposed to Different Temperature Conditions,Aquatic Science and Technology,6 (2), 6-11.
- Shang, J., Lu, M. et Yu, Q. (2018),Acute Effects of Ammoniac Nitrogen on Marine Copepod Acartia pacifica When Exposed to Different Temperature Conditions,Aquatic Science and Technology,6 (2), 6-11 (résumé).
Voir aussi
[modifier|modifier le code]Articles connexes
[modifier|modifier le code]- Ammoniaque
- Amine
- Amidure
- Carburant
- Biochimies hypothétiques
- Hydrate d'ammoniac
- Procédé Ostwald
- Procédé Haber
Liens externes
[modifier|modifier le code]- Fiche ammoniac de la SCF mise à jour par Jean-louis Vigne en 2014
- Expérience du jet d'eau: solubilité de l'ammoniac dans l'eau
- Analyse documentaire avec questions sur La synthèse industrielle de l'ammoniac, académie de Paris
- Un cours lorrain sur l'ammoniac et l'acide nitrique
- Robert Nardone,La chimie de la guerre, épisode de la sérieSavants et Militaires,Universcience, France Télévisions, Enfin Bref production, 2012: un aperçu de la vie de Carl Bosch en 3min22s.
- Fiche toxicologique de l'INRS
- Fiche internationale de sécurité
- Fiche Aria retour d'expérience,no31821 Incendie et explosion de gaz de synthèse d’ammoniac,,Billingham,Grande-Bretagne
- Développement en cours chez un constructeur de moteurs marins(en anglais)
- L'ammoniac un carburant fabriqué à partir du soleil
Bibliographie
[modifier|modifier le code]- Iñaki de Aguirre et Marie-Anne Van de Wiel,Introduction à la chimie générale,édition De Boeck Supérieur, 1995,vol.2, 518p.,p.298-310sur l'ammoniac(ISBN9782804107208).
- Gérard Emptoz,Les chimistes, leurs institutions et leurs sociétés savantes entre les deux guerres. II - La nouvelle chimie de l’azote dans l’entre-deux-guerres,L'Actualité chimique, Journal de la Société chimique de France,no381, janvier 2014, 60p.,p.40-47.
- Victor Kaiser, Ermanno Filippi, Henri Dominique Léger et Pierre Lesur,Calcul des réacteurs catalytiques - Synthèse d’ammoniac - Aspects fondamentaux de la réaction de synthèse,Techniques de l'ingénieur,J 4040,10 juin 1999.
- Paul Pascal,Nouveau traité de chimie minérale,vol.10,t.10:Azote et phoshore,Paris, Masson,(réimpr.1966), 32 vol.
- Arkan Simaan,Grandeur et décadence de Fritz Haber,dansBulletin de l'Union des professeurs de physique-chimie,vol.99,no874, mai 2005,p.613-626.
- H. Ebert (trad.Francis Pichon),Chimie technique,Auckland, Bogota, Paris, McGraw-Hill,coll.« Formulaire de poche »,(ISBN978-2-7042-1108-1,OCLC25322022,BNF34839286).
- Produit chimique corrosif
- Composé de l'azote
- Composé de l'hydrogène
- Amine inorganique
- Réfrigérant
- Produit chimique domestique
- Métabolisme de l'azote
- Engrais azoté
- Gaz à l'état de traces
- Chimie clinique
- Espèce chimique détectée dans le milieu interstellaire ou circumstellaire
- Vecteur énergétique
- Combustible
- Molécule odorante