Candida albicans
| Règne | Fungi |
|---|---|
| Division | Ascomycota |
| Classe | Saccharomycetes |
| Ordre | Saccharomycetales |
| Famille | Saccharomycetaceae |
| Genre | Candida |
Candida albicansest l'espècedelevurela plus importante et la plus connue dugenreCandida.
Candida albicansest un organisme vivant à l'état naturel dans les muqueuses de l'être humain. On le retrouve dans le tube digestif de 70% des adultes sains[1],et il n'entraîne habituellement aucune maladie ou symptôme en particulier. C'est un organismecommensalsaprophyte.
Cechampignon pathogèneprovoque desinfections fongiques(candidiaseoucandidose) essentiellement au niveau des muqueuses digestive et gynécologique. Les candidoses sont une cause importante de mortalité chez les patients immunodéprimés comme les patients atteints dusida,les patients cancéreux souschimiothérapieou après transplantation de moelle osseuse. Les candidoses orale et œsophagienne sont fréquentes chez le patient atteint du sida. LorsqueCandidas'infiltre dans le flux sanguin, l'infection devient systémique et on parle alors decandidémie(ou candémie). Les candidémies sont caractérisées par une mortalité de l'ordre de 40 %.C. albicanspeut donner également une multitude d'autres infections car il s'agit d'unpathogèneopportuniste très polyvalent: il peut être responsable d'infection superficielle cutanée, causer unérythème fessierchez les nouveau-nés, une bronchopneumonie et, ou une pneumonie, unevaginite,unebalaniteou être responsable d'infectionsprofondes.
Au laboratoire médical, la culture enboîte de PetridesCandidadonne des colonies qui sont grandes, rondes, de couleur blanche ou crème (albicanssignifie « blanchâtre »).
Cycle de vie
[modifier|modifier le code]
Le fait queC. albicanssoit classé comme étant unchampignonasexué peut paraître surprenant, vu saproximité phylogénétiqueavec deslevuressexuées telles queSaccharomyces cerevisiae.De plus, des gènes impliqués dans lemating(en)et laméiosechezS. cerevisiaeont desorthologueschezC. albicans.LareproductiondeC. albicansest majoritairement clonale, avec des échanges génétiques limités entre individus. Pourtant, la découverte de gènes de mating laisse à penser queC. albicansa gardé la capacité de se reproduire et de se recombiner. Cesgènesde mating, appelésMTL(matingtype-like), possèdent de grandes similitudes avec les gènesMATrencontrés chezS. cerevisiae,avec la différence notable queC. albicanspossède 4 gènesMTLet non 3 comme c'est le cas chezS. cerevisiae.La plupart des souches deC. albicanssonthétérozygotespour ceslocuset seules 3 à 7 % des souches rencontrées dans la nature sonthomozygotes.À l'inverse deS. cerevisiae,pour lesquelles toutes lescellulessont compétentes, seules les souches deC. albicansayant subi un switch phénotypique de blanc à opaque sont compétentes. Il y a 2 connexions majeures entre le système de mating et la conversion blanc-opaque: 1- c'est le locusMTLqui régule la faculté deC. albicansà effectuer le switch et 2- le mating des cellules en phase opaque est environ 10^6 fois plus efficace que celui des cellules en phase blanche. L'intérêt pourC. albicansde lier les 2 systèmes est peut-être de faire en sorte que les individus ne puissent se recombiner que dans des niches spécifiques. En effet, les cellules en phase opaque sont plus fragiles que les cellules en phase blanche et elles sont instables[2].
Le mating de deux cellules deC. albicansa pour résultat final une celluletétraploïde,qui doit perdre certains de seschromosomespour rétablir ladiploïdie.Chez la plupart des champignons, ce processus se fait grâce à une méiose qui complète ainsi un cycle sexuel. Toutefois, chezC. albicans,seul un cycle parasexuel a pu être identifié in vitro, un cycle impliquant une perte coordonnée des chromosomes surnuméraires au fil des divisions cellulaires[3].Il reste toutefois possible queC. albicanspuisse subir uneméiose,puisque l'étude de songénomea permis d'identifier plusieurs orthologues de gènes impliqués dans ce processus chez d'autres levures: le locusMTL,NDT80,etc.[4]D'un autre côté, plusieurs gènes importants pour la méiose semblent manquer dans le génome deC. albicans,ce qui suggère que si la méiose peut avoir lieu dans cette levure, son déroulement doit être différent de celui des autres champignons.
Génome
[modifier|modifier le code]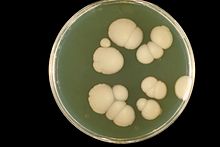
C. albicansest un organismediploïdequi possède huit paires dechromosomes,le plus grand étant appelé R, les suivants étant numérotés de 1 à 7 selon une taille décroissante. Songénomecorrespond approximativement à 16 Mb (haploïde) et code environ 6 400gènes.Lecode génétiquedeC. albicanspossède une particularité. LecodonCUG code unesérineet non pour uneleucine.Une des caractéristiques deC. albicansest sa très grande hétérozygotie naturelle, ce qui lui confère une grande capacité d'adaptation. Cette hétérozygotie accrue repose sur un réarrangement chromosomique (polymorphisme de longueur du chromosome), mais aussi destranslocations réciproques,unpolymorphisme nucléotidiqueou encore des délétions de nucléotides. Ces modifications ducaryotypeentraîne des modifications à l'échellephénotypique,ce qui peut ainsi se traduire par une grande adaptabilité deC. albicans.[5]
Critère d'identification
[modifier|modifier le code]Il existe plusieurs techniques qui permettent d'identifierC. albicansenlaboratoire,par exemple:
- le test de germination positif; en effetC. albicansformera unhyphesansconstrictionune fois placé dans du plasma de lapin à 37degrés Celsius;
- le test dechlamydosporesera positif surmilieu RATdû à la présence detween;
- test de l'uréasenégatif sur milieuChristensen;
- colonie blanc crème, luisant et crémeuse surgélose sangousabouraud.
Facteurs de virulence
[modifier|modifier le code]
Un facteur de virulence permet à unpathogènede se maintenir et de proliférer dans son hôte. Il peut alors créer des lésions pathologiques.
Dimorphisme
[modifier|modifier le code]Ledimorphismecorrespond à la transition de la formelevureellipsoïdale, qui se sépare des cellules filles après lacytokinèse,à la formehyphale,dont les cellules filles restent liées les unes aux autres par des septa et dont la croissance est apicale. Cette transition morphologique réversible de forme levure à forme champignon[6]peut être induite par un grand nombre destimuli:lepH,la température, la composition du milieu... Les voies de signalisation conduisant à la filamentation chezC. albicanssont soitMAP-kinasedépendante, soit pH-dépendante, soitAMPc-dépendante. Ces voies sont redondantes: le blocage de l'une d'elles ne suffit pas à inhiber la filamentation. D'autre part, les gènes régulés par ces voies (HWP1,ALS,SAP) sont connus pour leur rôle dans la virulence. Entre les formes levure et hyphale, on peut encore trouver d'autres formes morphologiques comme lepseudohypheet lachlamydospore,qui sont toutefois plus rares[7].
Adhésines
[modifier|modifier le code]C. albicanspossède un grand nombre de récepteurs à sa surface qui lui permettent de reconnaître les cellules de son hôte et de s'y attacher solidement. Le β-1,2-phosphomannoside se lie ainsi à lagalectinevia une liaison lectinique. Les protéines de lafamilleALS(agglutinin-likesequence) se lient à diverses protéines (laminine,collagène,fibrinogène) ainsi qu'à des cellulesépithélialesetendothélialesvia des liaisons non covalentes[8].Enfin, la protéine Hwp1p (hyphalwallprotein) se lie à son substrat de manière covalente par l'action d'unetransglutaminase.
Enzymes sécrétées
[modifier|modifier le code]C. albicanspossède toute une gamme d'enzymeshydrolytiques qui sont exprimées différentiellement selon l'environnement. On peut citer par exemple les enzymes de la familleSAP(secretedaspartylproteinase), qui compte actuellement 10 membres et dont les rôles sont variés (dégradation deprotéines,dégradation des structures cellulaires et tissulaires de l'hôte, dégradation dusystème immunitaire). Leur expression dépend du pH, de la localisation deC. albicanset de sa forme morphologique[9].C. albicanspossède encore desphospholipases(A, B, C et D) et deslipases(1 à 10).
Traitements utilisés contreC. albicans
[modifier|modifier le code]Lesantifongiquesutilisés actuellement ont de nombreuses cibles: laparoi cellulaire,lamembrane plasmique,la synthèse de l'ergostérol,l'ADN, l'ARN... Ces antifongiques sont soitfongistatiques,soitfongicides.
Polyènes
[modifier|modifier le code]Lespolyènes(ex.:Amphotéricine B[AmB],nystatine) sont des antifongiques naturels à action fongicide. L'AmB se lie à l'ergostérolde la membrane du champignon et crée des pores, augmentant ainsi la perméabilité de la membrane. Des composés essentiels à la vie du champignon diffusent ainsi hors du cytosol (ions K+...) ce qui conduit à la mort de l'organisme.
L'AmB connaît une réactivité croisée avec lecholestérol,lestérolprincipal chez l'homme. L'AmB peut donc être toxique à haute dose.
Analogues de pyrimidine
[modifier|modifier le code]Les analogues de pyrimidine (ex.:5-fluorocytosine[5-FC]) sont des antifongiques à action fongicide. La 5-FC pénètre la cellule fongique et inhibe lasynthèse d'ARNetd'ADN.Les analogues de pyrimidine n'affectent pas l'homme, car la cytosine déaminase n'existe pas dans les cellules ou y est faiblement active.
Azoles
[modifier|modifier le code]Lesazolesforment la classe la plus répandue d'antifongiques à action fongistatique. On les classe en 2 sous-familles: lesimidazoles(kétoconazole, miconazole) et lestriazoles,plus récents (fluconazole, voriconazole, itraconazole). Les azoles inhibent l'action du gèneERG11impliqué dans la biosynthèse de l'ergostérol.La membrane est ainsi fragilisée et le champignon ne peut plus croître. Le gèneERG5est une cible secondaire des azoles.
Allylamines
[modifier|modifier le code]Lesallylamines(ex.:terbinafine,naftinine) sont des antifongiques à action fongistatique qui inhibent la fonction de l'enzyme codée parERG1,unesqualèneepoxidase. L'effet fongistatique est le résultat de la déplétion energostérolet de l'accumulation de stérols toxiques dans la cellule.
Morpholines
[modifier|modifier le code]Lesmorpholines(ex.:amorolfine) ont une activité fongistatique en inhibant la fonction de 2 enzymes impliquées dans la biosynthèse de l'ergostérol: la C-14stérolréductase(codée parERG24) et la C-8 stérolisomérase(codée parERG2).
Echinocandines
[modifier|modifier le code]Laparoi cellulairea une fonction importante chez les champignons. C'est pourquoi de nouveaux antifongiques ont été développés, qui ciblent la synthèse des éléments de ladite paroi. Leséchinocandinesciblent par exemple le produit du gèneFKS1deC. albicans,qui code une β-1,3-glucane synthase. Les échinocandines (ex.:caspofongine, micafongine...) ont une forte activité fongicide et ne présentent pas de réactivité croisée avec d'autres antifongiques[10],[11],[12],[13],[14].
Autres types d'antifongiques chimiques
[modifier|modifier le code]Parmi les autres types d'antifongiques, plus ou moins récents, on retrouve lessordarines,qui ciblent la synthèse deprotéines(inhibiteurs du facteur d'élongation 2), l'auréobasidine A (inhibiteur de la synthèse decéramides), les inhibiteurs de pompes à protons ou destransporteurs ABC,etc.
La Ciclopiroxolamine fait partie de lafamilledes pyridones (dictionnaire Vidal 1996) et les candidoses cutanées font partie de ses indications thérapeutiques.
Antifongique naturel
[modifier|modifier le code]L'Horopito (Pseudowintera colorata), une plante qui pousse en Nouvelle-Zélande, est un antifongique naturel qui a une puissante action contre leC. albicans[10],[11],[12],[13],[14].Cette plante est par ailleurs 32 fois plus efficace lorsqu'elle est associée à l'anis épicé d'Amérique du Sud (Pimpinella anisum)[15].L'huile essentielled'arbre à théest également connue pour son efficacité contreCandida[16].
Les extraits de romarin (Rosmarinus officinalis) et derhizomede gingembre (Zingiber officinale) sont aussi très efficaces contre toutes les souches deCandidacourantes chez l'homme et ont été testés in vitro ainsi qu'in vivo chez la sourisC57BL6.L'extrait éthanolique de gingembre est même plus efficace que lefluconazolesurCandida albicans,sa CMI (concentration minimale inhibitrice) est plus faible que l'antifongique le plus souvent administré pour traiter lescandidosesgynécologiques[17].
Phénomènes de résistance
[modifier|modifier le code]Résistance aux analogues de pyrimidine
[modifier|modifier le code]Certaines souches deC. albicanspeuvent développer une résistance à la 5-FC en exprimant des formes mutées de cytosine perméase ou de cytosine déaminase. Mais la majorité des souches présentent des mutations dans le gèneFUR1qui code une phosphoribosyltransférase, empêchant ainsi à la 5-FC de s'intégrer dans l'ARNmlors de sa synthèse.
Résistance aux azoles
[modifier|modifier le code]La résistance aux azoles est un phénomène courant chezC. albicans.Il intervient généralement lors de traitements prolongés avec le même médicament. La résistance peut intervenir de 4 manières[18]:
- Surexpression de la cible: la cible des azoles, la 14α-lanostérol déméthylase, peut être surexprimée dans la souche de manière que les molécules d'azoles ne soient jamais assez nombreuses pour inhiber toutes les enzymes présentes. La synthèse de l'ergostérol peut ainsi se poursuivre normalement
- Altération de la cible: le gèneERG11peut être muté de manière à ne plus coder qu'une forme modifiée de la 14α-lanostérol déméthylase, dont l'affinité pour les azoles est nettement diminuée. On a actuellement recensé plus de 18 mutations différentes, regroupées dans 3hot spotsdifférents, qui représentent soit le site d'entrée du substrat ou de l'azole, soit le site de liaison du subtrat/azole, soit l'hème.
- Efflux des azoles: les azoles peuvent être expulsés hors de la cellule par la surexpression de transporteurs multidrogues. De cette manière, les azoles ne sont jamais assez concentrés dans la cellule pour réussir l'inhibition d'Erg11p. Deuxfamillesde transporteurs sont impliquées dans ce phénomène: la famille desMajor Facilitators(ex.:CaMDR1) et la famille des ATP-binding cassette transporteurs (transporteurs ABC) (ex.:CDR1etCDR2). La surexpression de cette dernière famille de transporteurs peut intervenir lorsque lefacteur de transcriptionTAC1est muté.
- Absence d'intermédiaire toxique: lorsque la 14α-lanostérol déméthylase est inhibée, il y a accumulation dans la cellule d'un intermédiaire méthylé, le 14α-méthylfécostérol. Ce composé est pris comme substrat par l'enzyme Δ5-6 désaturase codée parERG3pour former le 14α-méthyl-ergosta-8,24(28)-dien-3β, 6α-diol, un composé toxique. Des souches ont été trouvées qui possèdent des allèlesERG3déficients. Ces souches ne transforment donc pas les composés méthylés en composés toxiques, ce qui explique leur résistance aux azoles.
Cette absence d'Erg3p est couplée généralement à une résistance à l'AmB, puisque l'absence de la Δ5-6 désaturase coupe la voie de biosynthèse de l'ergostérol.
Résistance aux échinocandines
[modifier|modifier le code]Les phénomènes de résistance aux échinocandines restent rares. On sait toutefois qu'une mutation dans le gèneFKS1suffit à rendre la souche résistante à l'action des échinocandines.
Notes et références
[modifier|modifier le code]- (en)AskinErdoganet Satish S. C.Rao,«Small Intestinal Fungal Overgrowth»,Current Gastroenterology Reports,vol.17,no4,,p.16(ISSN1522-8037et1534-312X,DOI10.1007/s11894-015-0436-2,lire en ligne,consulté le)
- (en)Bennett, R.J. et A.D. Johnson, «Mating in Candida albicans and the search for a sexual cycle»,Annu rev Microbiol.,no59,,p.233-255
- (en)Bennett, R.J. and A.D. Johnson. 2003. « Completion of a parasexual cycle in Candida albicans by induced chromosome loss in tetraploid strains »Embo J.22: 2505-2515
- (en)Tzung K.W.et al.2001. « Genomic evidence for a complete sexual cycle in Candida albicans »Proc Natl Acad Sci USA98: 3249-3253
- (en)T.Jones,N. A.Federspiel,H.Chibanaet J.Dungan,«The diploid genome sequence of Candida albicans»,Proceedings of the National Academy of Sciences,vol.101,no19,,p.7329–7334(ISSN0027-8424et1091-6490,PMID15123810,PMCIDPMC409918,DOI10.1073/pnas.0401648101,lire en ligne,consulté le)
- (en)DavidKadosh,«Regulatory mechanisms controlling morphology and pathogenesis in Candida albicans»,Current Opinion in Microbiology,vol.52,,p.27–34(PMID31129557,PMCIDPMC6874724,DOI10.1016/j.mib.2019.04.005,lire en ligne,consulté le)
- (en)Sudbery P, N. Gow and J. Berman. 2004.Trends in microbiology
- (en)Sheppard DC.et al.« Functional and structural diversity in the Als protein family ofCandida albicans»J Biol Chem.2004;279: 30480-9.
- (en)Borg-von Zepelin, M., S. Beggah, K. Boggian, D. Sanglard and M. Monod. 1998. « The expression of the secreted aspartyl proteinases Sap4 to Sap6 from Candida albicans in murine macrophages »Mol Microbiol.28: 543-554
- Laverdière, M.et al.2006. « Progressive loss of echinocandin activity following prolonged use for treatment of Candida albicans oesophagitis »J Antimicrob Chemother.57:705-708
- (en)« Antibiotic substances from New Zealand plants II. Polygodial, an anti-Candida agent from Pseudowintera colorata » McCallion, R.F., Cole, A.L.J, Walker, J.R.L., Blunt, J.W. and Munro, H.G., 1982,Planta Medica44,p.34-138.
- (en)« Polygodial, an antifungal potentiator » Kubo, I. & Taniguchi, M., 1988,Journal of Natural Products51 (1),p.22-29.
- (en)« In vitro antifungal susceptibilities of Candida albicans and other fungal pathogens to polygodial, a sesquiterpene dialdehyde » Lee, S.H., Lee, J.R., Lunde, C.S. & Kubo, I., 1999,Planta Medica65,p.204-208.
- (en)« Fungicidal activity of polygodial in combination with anethole and indole against Candida albicans » Himejima, M. & Kubo, I. 1993,J. Agric. Food Chem., 41,p.1776-1779.
- (en)« Anethole, a synergist of polygodial against filamentous microorganisms » Isao Kubo, Masaki Himejima. Université de Californie.
- (en)«In vitro and in vivo activity of melaleuca alternifolia mixed with tissue conditioner on Candida albicans»,Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology and Endodontics,(DOI10.1016/j.tripleo.2007.08.025).
- S.Akroum,«Activité antimicrobienne des extraits de Rosmarinus officinalis et Zingiber officinale sur les espèces du genre Candida et sur Streptococcus pneumoniae»,Annales Pharmaceutiques Françaises,vol.79,no1,,p.62–69(ISSN0003-4509,DOI10.1016/j.pharma.2020.06.003,lire en ligne,consulté le)
- (en)White, T.C., K.A. Marr, and R.A. Bowden. 1998. « Clinical, cellular, and molecular factors that contribute to antifungal drug resistance »Clin Microbiol Rev.11:382-402


