Hydrure de titane(IV)
| Tétrahydrure de titane | |
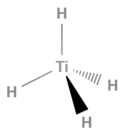
| |
| Structure du tétrahydrure de titane | |
| Identification | |
|---|---|
| Nom systématique | hydrure de titane(IV) |
| Synonymes |
tétrahydrure de titane |
| NoCAS | |
| NoECHA | 100.035.414 |
| NoCE | 238-972-5 |
| PubChem | 187779 |
| Propriétés chimiques | |
| Formule | H4Ti |
| Masse molaire[1] | 51,899 ± 0,001g/mol H 7,77 %, Ti 92,23 %, |
| Unités duSIetCNTP,sauf indication contraire. | |
| modifier |
|
Letétrahydrure de titane,ouhydrure de titane(IV),est uncomposé chimiquedeformuleTiH4.Extrêmement instable, il n'a jamais été isolé en quantité macroscopique à l'état pur et est étudié dans des matrices gazeuses cryogéniques. Ses propriétés macroscopiques ne sont pas bien caractérisées mais il a été modélisé parchimie numérique.Sa forme moléculaire serait ainsi un gaz incolore thermiquement très instable.
Synthèse
[modifier|modifier le code]Le tétrahydrure de titane a été produit pour la première fois en 1963 parphotodissociationde mélanges detétrachlorure de titaneTiCl4et d'hydrogèneH2immédiatement suivie d'unespectrométrie de masse[2].Il fallait réaliser l'analyse rapidement en raison de la grande instabilité de la molécule TiH4.L'analyse numérique a donné uneénergie théorique de dissociation des liaisonsTi−Hde 132kcal/molpar rapport àM+ 4H[3].TiH4se dissocie entitanemétalliqueethydrogène:
Outre TiH4,lesespècesTiH,TiH2,TiH3etpolymèresont été isolées à basse température aprèsablation laserde titane en présence d'hydrogène[4].
Structure
[modifier|modifier le code]On pense que le tétrahydrure de titane solide forme despolymèresdans lesquels les molécules TiH4sont liées par desliaisons covalentes[5].Les modélisations numériques suggèrent que TiH4tende àdimériser[4].Ceci serait dû au déficit du monomère en électrons ainsi qu'à la petite taille desligandshydrure,qui faciliterait la dimérisation en limitant la répulsion inter-ligands et donc l'énergie d'activation.
Les calculs indiquent que le dimère est unemolécule fluxionnelle(en)qui s'interconvertit rapidement entre un certain nombre de formes présentant toutes des hydrogènespontantsdans le cadre deliaisons à trois centres et deux électrons.
Le monomère TiH4est lamoléculedemétal de transitionla plus simple présentant unehybridationsd3[6].
Notes et références
[modifier|modifier le code]- Masse molaire calculée d’après«Atomic weights of the elements 2007», surwww.chem.qmul.ac.uk.
- (en)Peter Breisacher et Bernard Siegel,«Formation of Gaseous Titanium(IV) Hydride and Chlorohydrides of Titanium»,Journal of the American Chemical Society,vol.85,no11,,p.1705-1706(DOI10.1021/ja00894a049,lire en ligne).
- (en)Diane M. Hood, Russell M. Pitzer et Henry F. SchaeferIII,«Electronic structure of homoleptic transition metal hydrides: TiH4,VH4,CrH4,MnH4,FeH4,CoH4,and NiH4»,The Journal of Chemical Physics,vol.71,no2,,p.705-712(DOI10.1063/1.438357,Bibcode1979JChPh..71..705H,lire en ligne).
- (en)George V. Chertihin et Lester Andrews,«Reactions of Laser Ablated Ti Atoms with Hydrogen during Condensation in Excess Argon. Infrared Spectra of the TiH, TiH2,TiH3,and TiH4Molecules»,Journal of the American Chemical Society,vol.116,no18,,p.8322-8327(DOI10.1021/ja00097a045,lire en ligne).
- (en)Simon P. Webb et Mark S. Gordon,«The Dimerization of TiH4»,Journal of the American Chemical Society,vol.117,no25,,p.7195-7201(DOI10.1021/ja00132a020,lire en ligne).
- (en)V. Jonas, C. Boehme et G. Frenking,«Bent's Rule and the Structure of Transition Metal Compounds»,Inorganic Chemistry,vol.35,no7,,p.2097-2099(DOI10.1021/ic951397o,lire en ligne).
