Immunologie des tumeurs

L’immunologie des tumeurs(appelée aussiimmunologie anti-tumoraleouimmuno-oncologie) et son but, l'immunothérapiedes cancers, sont une branche de labiologieet de lamédecinequi consiste à étudier les relations entre unetumeuret lesystème immunitairede l'hôte,afin de concevoir des traitements anticancéreux capables d'exploiter la puissance potentielle d'une réaction immunitaire dirigée contre la tumeur. Ce domaine est au carrefour de divers domaines de la biologie nécessitant une compréhension particulière ainsi qu'une approche intégrée des connaissances: l'étude du micro-environnement tumoral, des différentes sous-populations deleucocytesprésents dans une zone tumorale à unstadedéterminé, des facteurs de transcription activés chez ces diverses cellules, des sous-types tumoraux pouvant influencer la réponse immune… sont autant de paramètres essentiels à décrire. La mise en évidence de nombreux acteurs moléculaires fondamentaux de régulation de la réponse immune durant ces 20 dernières années a révolutionné l'immunothérapie dans la lutte contre le cancer, avec le développement de nouvelles thérapies prometteuses, mais avec des applications dans d'autres domaines de l'immunologie[2].
L'immunothérapie contre le cancer est de plus en plus basée sur le développement de thérapies ciblées en fonction des types tumoraux; lescellules cancéreusesexpriment très souvent des macromolécules membranaires (protéines,dans la majorité des cas) détectables par divers agents du système immunitaire, nommées antigènes tumoraux (tels NY-ESO-1, MAGE-A, etc.). Les antigènes tumoraux permettent une discrimination efficace des cellules tumorales par le système immunitaire et laissent ainsi l'espoir d'une thérapie ciblée et n'occasionnant que très peu de dégâts dans les tissus sains alentour, consistant en une "forme active" de l'immunothérapie. L'immunothérapie dite "passive" a davantage pour objectif de stimuler une réponse immune antitumorale préexistante par l'utilisation d'anticorps monoclonauxou decytokines.
Historique
[modifier|modifier le code]La première preuve que l'immunothérapie peut être appliquée pour obtenir une régression tumorale a émergé des travaux de William Coley, qui, dans les années 1890, a obtenu une régression tumorale chez certains patients atteints desarcome/lymphomeaprès l'injection intra-tumorale de cultures destreptocoques(fourni parRobert Koch)[3],[4].Au cours des 43 années suivantes, Coley a injecté à près de 900 patients (principalement des sarcomes) sa préparation bactérienne (obtenant un taux de guérison de plus de 10 %), connue plus tard sous le nom de toxine de Coley[3],[4].Cependant, la toxine de Coley a fait l’objet d’un examen minutieux en raison d’une toxicité élevée et de certaines difficultés à reproduire les taux de rémission. Finalement, la première preuve expérimentale que les tumeurs non liées au virus peuvent effectivement être reconnues par lesystème immunitairede l'hôte est apparue dans les années 1940, et dans les années 1960, couplées à la découverte descellules T,il a été proposé que le système immunitaire humain puisse également réagir contre tumeurs[5].La capacité des thérapies anticancéreuses à améliorer le potentiel immunogène des cellules malignes a été quelque peu appréciée dans les années 1970. Il a été reconnu que si des traitements spécifiques sont appliqués (par exemple,radiothérapie,bacille de Calmette-Guérinou certaineschimiothérapies), l’immunogénicité des cellules malignes augmente suffisamment pour induire une immunité antitumorale durable[6],[7],[8].
Hétérogénéité des tumeurs
[modifier|modifier le code]Pendant longtemps, les tumeurs ont été considérées comme des entités très homogènes résultant de l’expansionclonaled’une seule cellule présentant des défautsgénétiquesouépigénétiquesspécifiques[9].Il est désormais clair que les cancershématopoïétiquesetsolidessont très hétérogènes, non seulement parce que des cellules malignes présentant des caractéristiques phénotypiques et comportementales distinctes coexistent généralement, mais également parce que de multiples cellules non transformées sont récupérées par les cancers en croissance pour répondre à leurs besoins. Cela est particulièrement vrai pour les tumeurs solides, qui contiennent un compartiment cellulaire non malin abondant comprenant des composantsstromaux,endothéliauxetimmunitaires[10],[11].Le compartiment immunitaire de la masse tumorale est en soi très hétérogène, variant non seulement en fonction du type de tumeur, du stade et du schéma thérapeutique, mais également sur une base interindividuelle[12].Les preuves accumulées au cours de la dernière décennie indiquent en effet que les tumeurs humaines se forment, progressent et répondent au traitement dans le contexte d'une interaction intime et bidirectionnelle avec le système immunitaire[13],[14].Ainsi, les néoplasmes ne peuvent se développer que lorsqu’ils sont capables d’échapper à l’immunosurveillance[15],[16],et ce en évoluant sous la pression sélective imposée par le système immunitaire. De plus, la composition, la densité et la localisation intratumorale de l’infiltrat immunitaire ont été attribuées à une valeur pronostique ou prédictive solide dans plusieurs cohortes de patients atteints de cancer[17],[18],[19].Enfin, l’efficacité de la plupart, sinon de la totalité, des schémas thérapeutiques couramment utilisés chez les patients atteints de cancer a été étiologiquement liée à la réorientation d’une réponse immunitaire adaptative ciblant les cellules malignes[20].
Action immunologique des traitements du cancer
[modifier|modifier le code]La plupart des traitements anti-cancéreux par rayonnement ionisant ou chimiothérapie sont considérés commeaplasiantset immunosuppresseurs. Cependant, certains médicaments comme lecyclophosphamide[21]et la gemcitabine[22]sont capables d'éliminer préférentiellement des cellules immunitaires inhibitrices, respectivement leslymphocytes T régulateurset lescellules myéloïdes suppressives.Par ailleurs, d'autres traitements chimiothérapeutiques, tels les anthracyclines[23]ou le bortezomib[24]sont quant à eux capables d'induire une mort tumorale immunogène, c'est-à-dire que les cellules tumorales tuées par ces médicaments sont pris en charge par lescellules présentatrices d'antigèneet induisent une réponse immunitaire.
Il convient de résoudre ces problématiques liées aux effets des traitements sur le système immunitaire, qui est actuellement considéré comme un facteur clé dans la lutte contre le cancer[25].Par ailleurs, l'étude des traitements anti-cancéreux et de leurs effets sur le système immunitaire soulève diverses interrogations essentielles quant à leur perfectionnement[26].De nombreuses études considèrent que l'avenir du traitement du cancer réside dans une synergie totale et maîtrisée entre deux types de traitements tels que la chimiothérapie (pour affaiblir les cellules tumorales) puis l'immunothérapie (qui détruira les cellules tumorales précédemment affaiblies).
Immunologie des tumeurs
[modifier|modifier le code]En 2013, deux chercheurs ont décrit une série d’événements progressifs auto-entretenus, appelés cycle cancer-immunité, par lesquels les réponses immunitaires anticancéreuses conduisent à une élimination efficace des cellules cancéreuses[1].L’existence de mécanismes de rétroaction négative développés par les tumeurs entrave ce cycle d’immunité contre le cancer et peut constituer un obstacle au développement de réponses cliniques efficaces.
Les sept étapes du cycle sont (1) libération d' antigènes par la cellule cancéreuse (2) Capture des antigènes par unecellule dendritque(3) Dans unganglion lymphatique,présentation de l'antigène à unlymphocyte T CD8+qui s'active et devient un lymphocyte T cytotoxique (4) Création d'une réserve de lymphocyte T cytotoxique dans lazone germinative(5) Migration des lymphocytes T cytotoxiques dans la tumeur (6) Reconnaissance de la cellule cancéreuse par le lymphocyte T (7) Destruction de la cellule cancéreuse par le lymphocyte T entrainant la libération d'antigène et le cycle recommence.
Déclenchement de la réponse immunitaire
[modifier|modifier le code]
Production des antigènes tumoraux
[modifier|modifier le code]Les antigènes spécifiques à la tumeur
[modifier|modifier le code]Les antigènes tumoraux qui s'expriment anormalement avec le développement et la progression des tumeurs sont le résultat d'anomalies au niveau des gènes, mais également en raison d'anomalies dans le processus de synthèse des antigènes[27].Ces anomalies prennent du temps pour que les mutations s’accumulent dans les cellules somatiques normales jusqu’à ce qu’elles affectent les gènes cruciaux pour la prolifération et la mort cellulaire, conduisant finalement à la tumorigenèse. Pendant ce temps, les cellules somatiques normales peuvent également produire des antigènes tumoraux en raison de mutations dans les gènes liés à la tumeur, et même induire une immunité anti-tumorale (semblable à l'auto-immunité) dans des situations non tumorales[28]car l'équilibre entre les gènes pro oncogénique et suppresseur de tumeur est respecté[29].Lorsque cet équilibre est rompu, la cellule produit des antigènes spécifiques à la tumeur (tumor-specific antigenou TSA) ou néoantigène qui sont très immunogènes et spécifiques à la tumeur d'un individu[30].
Les mutations génétiques à l’origine de la cancérogenèse peuvent être divisées en mutation clés et un grand nombre de mutations transitoires. Théoriquement, plus le nombre de mutations est élevé, c'est-à-dire plus la charge de mutation tumorale est élevée, plus de gènes spécifiques à la tumeur seront produites, bien que toutes les mutations n'amélioreront pas la réponse immunitaire antitumorale[31].De plus, la qualité de la mutation a également affecté la production de gènes spécifiques à la tumeur. Seules les mutations clés ont un effet sur la tumeur[32].Les mutations du génome contribuent à la croissance tumorale chez 5 à 10 % des patients[33].
Les antigènes spécifiques à la tumeur jouent un rôle clé dans le déclenchement de l’immunité antitumorale et dans l’activation des lymphocytes T[34].
Les antigènes associées à la tumeur
[modifier|modifier le code]Une expression anormale des gènes normaux peut survenir dans les cellules tumorales[35].Puisqu’il n’y a pas de changement de séquence génétique, les cellules tumorales produiront des antigènes que les cellules normales peuvent également exprimer, c’est-à-dire des antigènes associés aux tumeurs, qui ont une faible immunogénicité en raison de la formation d’une tolérance immunitaire. Les antigènes associés aux tumeurs comprennent l’antigène testiculaire cancéreux (Cancer/testis antigens), l’antigène différencié, l’antigène surexprimé et l’antigène carcinoembryonnaire[36].Notamment, certains antigènes associés aux tumeurs peuvent également être dérivés de voies génétiques classiques, telles que la recombinaison de gènes qui réactive des promoteurs inhibés. Contrairement à d’autres antigènes associés aux tumeurs, certains antigènes carcinoembryonnaires réexprimés ultérieurement présentent encore une immunogénicité élevée car l’expression de protéines embryonnaires normales précède la formation d’une tolérance immunitaire[37].
Certains antigènes tumoraux favorisent l'apparition et le développement de tumeurs. Par exemple, certaines cellules cancéreuses du sein surexpriment lerécepteur 2 du facteur de croissance épidermiqueaméliorant la prolifération et la différenciation cellulaire[38].L’équilibre entre la survie par les antigènes tumoraux et l’immunité antitumorale qu’ils provoquent détermine l’immunophénotypede la tumeur, y compris la sensibilité et la résistance à l’immunothérapie. Dans l’ensemble, les tumeurs ont tendance à cacher les antigènes spécifiques de la tumeur et à se faire passer pour des cellules normales en exprimant les antigènes associées aux tumeurs pour échapper au système immunitaire[39].
Production d'antigène microbien
[modifier|modifier le code]En plus des antigènes spécifiques de la tumeur et des antigènes associées aux tumeurs, des antigènes microbiens étrangers tels que des virus et des bactéries, peuvent également être utilisés comme antigènes tumoraux. Les antigènes microbiens activent l'immunité antimicrobienne tout en détruisant les cellules tumorales de l'hôte[40].
Le premier type d'antigènes provient du processus par lequel des cellules normales sont infectées et se transforment en cellules tumorales. L'autre type d'antigènes est exprimé après une infection spécifique de cellules tumorales, qui sont principalement exprimées par des bactéries génétiquement modifiées[41].Dans des études récentes, lesrétrovirus endogènes humainsse sont révélés être plus actifs. Ils peuvent être réactivés par plusieurs facteurs, tels que des facteurs cancérigènes environnementaux, qui peuvent piloter l’expression d’oncogènes et activer l’immunité innée anti-tumorale en induisant des voies de défense virales[42].
Production d'antigène cellulaire interne: motif moléculaire associé aux dommages
[modifier|modifier le code]Les cellules immunitaires du système adaptatif doivent être capables de reconnaître les antigènes tumoraux afin d’initier l’immunité tumorale car le système immunitaire n’est pas capable de reconnaitre une cellule cancéreuse. Les cellules immunitaires qui patrouillent dans le système sanguin et lymphatique pour augmenter les risques de contact avec les antigènes tumoraux sont principalement deslymphocytes Tetlymphocytes B à mémoire,dont le rôle premier est de maintenir l’immunité à long terme plutôt que d’initier l’immunité initiale[43].Les cellules tumorales peuvent cacher les antigènes tumoraux en réduisant et en modifiant l’expression du complexe majeur d’histocompatibilité, et en se différenciant progressivement en phénotypes moins immunogènes[44].
Cependant, la prolifération tumorale incontrôlée exige des ressources importantes rarement fournis par l'environnement tumoral et l’approvisionnement local en ressources entraînant l’accumulation de déchets métaboliques, tels que l’hypoxie,la carence en glucose, l’accumulation d’acide lactique et lestress oxydatif.Cette situation aboutit inévitablement à des dommages, tels que le stress du réticulum endoplasmique, à lasénescence cellulaireet à lamort cellulaire régulatrice non apoptotique,en particulier lamort cellulaire immunogène[45].La mort des cellules tumorales libère des antigènes internes à la tumeur, de l'adénosine triphosphateet de laprotéine du groupe 1 à haute mobilitéainsi que d'autres stimulateurs immunitaires. De même, les cellules tumorales mourantes peuvent également exprimer desmotifs moléculaires associés aux dommages,tels que lacalréticulineet laprotéine de choc thermique,qui attirent et activent les cellules immunitaires innées en se liant auxrécepteurs de reconnaissance de formes[46].Les cellules tumorales sénescentes sécrètent également un cocktail de cytokines pro-inflammatoires pour former le phénotype sécrétoire associé à la sénescence, qui à son tour régule le microenvironnement tumoral.Les modifications de la proportion de cellules sénescentes dans les tumeurs avant et après le traitement ont été reconnues comme l'un des marqueurs du cancer[47].
La mort des cellules tumorales constitue un marqueur important pour la libération d’antigènes internes de la tumeur et le déclenchement de la réaction immunitaire. Il est souvent utilisé comme cible clinique pour développer diverses stratégies thérapeutiques pour induire unemort cellulaire réguléenon apoptotique dans les tumeurs, telles que les inducteurs de mort cellulaire immunogène[48].Cependant, cela n'explique pas pourquoi les cellules tumorales saines au début du microenvironnement tumoral peuvent être reconnues par le système immunitaire lorsque les ressources sont suffisantes[49].Cependant, la mort ou la lésion des cellules tumorales ne déclenche pas toujours une réponse immunitaire antitumorale et peut même supprimer l’immunité tumorale. Étant donné que la mort cellulaire se produit souvent à l’intérieur du tissu tumoral, il est possible que les débris cellulaires soient enfouis dans le microenvironnement tumoral et ne puisse pas être détecté par les cellules immunitaires[50].Même si l’infiltration immunitaire est activée, la plupart des cellules tumorales peuvent cacher leurs propres antigènes et un grand nombre de cellules immunitaires infiltrées peuventphagocyterentrainant une élimination rapide des motifs moléculaires associés aux dégâts et des débris tumoraux. Cette élimination, rapide peut entraver le processus de présentation de l’antigène induisant une tolérance immunitaire[51].
Les débris tumoraux peuvent également influencer lemicroenvironnement tumoral.Par exemple, lesions potassiumlibérés après la mort des cellules tumorales peuvent inhiber l’effet antitumoral des lymphocytes T effectrices[52].Laprostaglandine E2libérée peut également inhiber l'activation desmotifs moléculaires associés aux dégâtssur lesmacrophageset lescellules dendritiques[53].De même, laprotéine du groupe 1 à haute mobilitélibérée après la mort parferroptoseinduit lapolarisation des macrophagesdetype M2en se liant aurécepteur RAGE[54].En outre, la forte expression de CD39 etCD73dans le microenvironnement tumoral peut convertirl'adénosine triphosphateimmuno-activé en adénosine immunosuppressive, formant ainsi un mécanisme de rétroaction négative de l'axe énergétique de l'adénosine propice au développement de la tumeur[55].La mort d'une cellule tumorale alerte les autres cellules tumorales.. Semblables aux cellules immunitaires innées, les cellules tumorales peuvent également exprimer desrRécepteur de reconnaissance de motifs moléculairestels que lesrécepteurs de type Tollet les récepteurs purinergiques pour reconnaître lesmotifs moléculaires associés aux dommagestelles quel'adénosine triphosphate.Ils peuvent ensuite activer des voies de signalisation telles queNF-κBet lavoie de signalisation MAPK/ERK,qui favorisent la prolifération des cellules tumorales et résistent à la mort. De plus, il induit la production de divers facteurs inflammatoires et dechimiokinespour réguler la différenciation et le recrutement des cellules immunitaires[56].
Mise en route de l'immunité innée
[modifier|modifier le code]
Le premier rôle l'immunité innée consiste à attaquer les cellules tumorales directement notamment les cellules tueuses naturelles et les macrophages. Le second rôle est d' activer l’immunité adaptative, impliquant principalement les cellules dendritiques via la présentation d’antigènes[57].Afin de contrer la réponse immunitaire innée, les cellules tumorales peuvent perturber directement la formation des cellules immunitaires innées dans la moelle osseuse, en inhibant la maturation des cellules dendritiques, des granulocytes et des macrophages et recruter des cellules myéloïdes suppressives[58].
Lymphocyte NK
[modifier|modifier le code]Leslymphocytes NKsont des cellules avec des marqueurs de surfaceCD3-CD19-CD56 + et CD16+ (CD3 est un marqueur deslymphocytes Tet CD19 est un marqueur deslymphocytes B) et lefacteur de transcription nucléaireE4BP4+. Selon la différence d'expression de CD56, les cellules NK peuvent être divisées en CD56dim,qui joue principalement un rôle cytotoxique, et CD56bright,qui joue principalement un rôle immunomodulateur[59].Compte tenu de l’hétérogénéité significative de l’infiltration des cellules NK dans les tumeurs, la fréquence des cellules NK prédit l’efficacité des immunothérapies telles que lerécepteur de mort anti-programmé-1[60].Contrairement aux lymphocytes T, les cellules NK n'expriment pas decomplexe majeur d'histocompatibilité,mais régulent leur activité cytotoxique principalement par l'équilibre d'une série de récepteurs activateurs (AKR) et de récepteurs inhibiteurs (IKR)). Les cellules NK ne nécessitant pas de présentation d’antigène, elles ont nt un effet antitumoral à spectre plus large, rapide et sûr[61].Par conséquent, les récepteurs activateurs et inhibiteurs peuvent être utilisés comme points de contrôle immunitaires associés aux cellules NK.
En général, les molécules noncomplexe majeur d'histocompatibilité de type Ià la surface de la tumeur activent les cellules NK après liaison avec les récepteurs activateurs, tandis que les complexes majeurs d'histocompatibilité de type I inhibent les cellules NK après liaison avec les récepteurs inhibiteurs, mais les complexes majeurs d'histocompatibilité de type I peuvent également activer les récepteurs activateurs[62].
Afin d'éviter la reconnaissance par les lymphocytes T, les cellules tumorales régulent généralement à la baisse l'expression du complexe majeur d'histocompatibilité de type I ou présentent des mutations génétiques de l'antigène leucocytaire humainresponsable de la synthèse des complexes majeurs d'histocompatibilité et de lamicroglobuline β2.La perte du complexe majeur d'histocompatibilité de type I entrainera la destruction par les cellules NK, c’est-à-dire l’effet « manque de soi », mais ce processus peut être perturbé. En raison de l'influence dumicroenvironnement tumoral,le nombre de cellules NK infiltrées dans la tumeur est moindre, en particulier les sous-groupes présentant des effets cytotoxiques[63].De plus, les cellules tumorales peuvent réguler l’équilibre des récepteurs activateurs et des récepteurs inhibiteurs pour maintenir les cellules NK dans un état inhibé[64].
Macrophage
[modifier|modifier le code]Lesmacrophagesdans les tumeurs dérivent principalement demonocytescirculants et demacrophages résidant dans les tissus,qui forment tous deux desmacrophages associés aux tumeurssous l'influence du microenvironnement tumoral[65].Au stade précoce de la réponse immunitaire, le macrophage associé aux tumeurs a unprofil de type M1 pro-inflammatoirejoue principalement un rôle tueur, avec une expression élevée de CD80, CD86, le complexe majeur d'histocompatibilité de type II, de lOxyde nitrique synthase inductible,deCD68et dépend de laglycolyse.Au stade ultérieur de la réponse immunitaire, le macrophage associé aux tumeurs aun profil de type M2et joue principalement un rôle immunosuppresseur, exprimant fortement CD206, CD204, lefacteur de croissance endothélial vasculaire,CD163et l'arginase,et s'appuye sur la lipolyse pour la fourniture d'énergie[66].La proportion desmacrophages associés aux tumeursest liée à la réponse à l'immunothérapie tumorale[67].Semblable aux cellules NK, lemacrophages associés aux tumeursrégule l’état d’activation principalement par l’équilibre d’une série de signaux « mange-moi » et « ne me mange pas » qui agissent comme des inhibiteurs de point de contrôle. Par exemple, lesmotifs moléculaires associés aux dommagesexprimés par les cellules tumorales transmettent un signal « mange-moi » aux macrophages, tandis que les le complexe majeur d'histocompatibilité de type I exprimés par les cellules tumorales transmettent un signal « ne me mange pas »[68].
Mise en route de l'immunité adaptative
[modifier|modifier le code]Seules lescellules dendritiquespeuvent activer les lymphocytes T dans lesganglions lymphatiquesdrainant la tumeur pour initier uneréponse immunitaire adaptative[69].Les cellules dendritiques immatures ont une expression élevée desrécepteurs de reconnaissance de motif moléculairemais une faible expression descomplexes majeurs d'histocompatibilité,des molécules de co-stimulation et d'adhésion, de sorte qu'elles ont une forte capacité d'absorption et de traitement de l'antigène mais une faible capacité à présenter l'antigène. Au cours du processus de migration vers le ganglion lymphatique, les cellules dendritiques mûrissent progressivement avec une augmentation de l'expression descomplexes majeurs d'histocompatibilité[70].Les tumeurs freinent la maturation des cellules dendritiques par le biais du microenvironnement tumorale immunosuppresseurs, en particulier de composants liés à la matrice extracellulaire tumorale. La présentation des antigènes tumoraux peut être inhibée par des mécanismes tels que la mort cellulaire induite par l’activation des lymphocytes T dépendants des cellules dendritiques[71].
Influence du microenvironnement tumoral sur l'immunité
[modifier|modifier le code]Lemicroenvironnement tumoral,du fait de son hétérogénéité, possède des capacités immunosuppressives relativement étudiées. Ainsi, divers phénomènes relatifs à la progression tumorale, à savoir l'angiogenèse tumoraleou encore latransition épithélio-mésenchymateuse,ont été décrits pour leurs liens avec les capacités immunosuppressives de la tumeur.
Ainsi, il a par exemple été montré chez la souris que le sunitinib, un agent anti-angiogénique permettant d'inhiber la signalisation des récepteurs du
VEGF, PDGF, SCF et FLT-3L (facteurs de croissance nécessaires à l'angiogenèse mais aussi au développement tumoral de façon plus globale), avait également comme effet de diminuer la concentration en lymphocytes T CD4+ régulateurs au sein du site tumoral[72],suggérant une influence importante des voies de l'angiogenèse sur la modulation de la réponse immune anti-tumorale[73].
D'autres champs de recherche sont également explorés: si la contribution desfibroblastes associés aux tumeurs(CAF:Cancer Associated Fibroblasts) dans le développement tumoral semble ne faire aucun doute[74],le rôle immunosuppresseur de ces fibroblastes au sein même du micro-environnement tumoral reste moins connu. L'identification des acteurs moléculaires spécifiques de ces fibroblastes pourrait à terme mener à l'identification de nouvelles cibles thérapeutiques.

En parallèle, de nombreux projets de recherche se concentrent sur l'étude de la biologie des cellules immunitaires infiltrant les tumeurs. Parmi elles, on retrouve notamment:
- Lesmacrophages associés aux tumeurs:les monocytes sanguins sont capables d'infiltrer les tumeurs et d'évoluer en macrophages pouvant phagocyter des cellules tumorales et réaliser ensuite une présentation antigénique afin d'activer ou stimuler la réponse immunitaire adaptative. Il a été montré que les macrophages infiltrant les tumeurs (TIM:Tumor Infiltrating Macrophages) pouvaient évoluer en fonction du stade tumoral, du lieu de présence et en fonction de nombreux autres paramètres encore débattus. Ainsi, il existe plusieurs phénotypes de macrophages tumoraux nommés M1 et M2 (dont M2a, b, c) qui ont des fonctions pro-inflammatoires ou anti-inflammatoires, et ainsi, dans un contexte tumoral, pro ou anti-tumoral. Ainsi, une tumeur peut utiliser les macrophages par divers moyens pour créer un environnement favorable à son développement[75].
- Leslymphocytes T CD4+ régulateurs:ce type cellulaire est actuellement tout aussi exploré. Ces cellules ont la capacité d'inhiber ou au moins de participer à une régulation négative puissante du système immunitaire, à travers la sécrétion deTGF-β,d'IL-10et deFgl2.Les tumeurs, à travers divers moyens, peuvent activer les lymphocytes T régulateurs afin d'inhiber l'immunité innée et adaptative anti-tumorale.
Immunosurveillance
[modifier|modifier le code]
L'immunosurveillance énonce que tout au long de la vie, des cellules tumorales sont éliminées par le système immunitaire. l'interaction entre immunité et tumeur suivrait trois phases[76],[77]:
- élimination: les tumeurs sont détruites;
- équilibre: un équilibre dynamique permet que des cellules tumorales sont gardées sous contrôle sans être détruites: c'est ladormance tumorale;
- échappement: Les cellules tumorales échappent au contrôle par le système immunitaire.
Il existe cependant des indices expérimentaux chez la souris. Ainsi, en injectant du méthylcholanthrène, un puissantcarcinogènedans des souris, il est possible d'induire des cancers. Mais si on utilise une dose faible, la plupart des souris ne développeront pas de cancer. Cependant, si on élimine les cellules T de ces souris avec unanticorps monoclonal,on constate que des tumeurs se révèlent cliniquement. Ceci est donc un argument en faveur de l'existence de tumeur cryptiques, tenues sous contrôle du système immunitaire, et qui prolifèrent brusquement lorsque la pression immunitaire se relâche[78].
Immunothérapie des tumeurs
[modifier|modifier le code]
On dénombre 4 grandes stratégies d'immunothérapie des cancers;toutes ont fait leurs preuves en matière d'efficacité dans la réduction du volume tumoral, à travers de très nombreux essais cliniques, mais il convient désormais de cibler les patients en fonction des types d'immunothérapie les plus appropriés selon leur cancer ainsi que d'autres paramètres (médecine personnalisée):
- Immunothérapie non spécifique:c'est une des méthodes d'immunothérapies les plus simples, mais aux résultats modérés. Il s'agit d'injecter des cytokines permettant d'améliorer la réponse immune anti-tumorale, voire de permettre la régression tumorale (Interleukine 2etIFN-γ).
- Immunothérapie par anticorps monoclonaux:c'est actuellement l'une des stratégies aux résultats des plus encourageants: des anticorps monoclonaux, ciblant des points de contrôle et de régulation du système immunitaire, permettent de bloquer l'inhibition (par la tumeur) de l'immunité anti-tumorale. L'utilisation d'anticorps comme le Nivolumab ou le Pembrolizumab, dans le ciblage de la molécule PD-1 sont les molécules rencontrant le plus de succès.
- Immunothérapie spécifique « adoptive »:cette stratégie repose sur le prélèvement descellules Tautologues, donc issus du sang (ou du site tumoral) du patient cancéreux, afin de les reprogrammer génétiquement en laboratoire pour les rendre plus efficaces dans leurs fonctions effectrices anti-tumorales.
- Vaccination thérapeutique:cette méthode correspond à une stimulation du système immunitaire grâce à l'utilisation delymphocytes T CD8+programmés pour cibler directement des cellules porteuses d'antigènes tumoraux puissamment immunogéniques[79],[80].
Classification de l'immunothérapie des tumeurs
[modifier|modifier le code]Les immunothérapies anticancéreuses sont généralement classées comme « passives » ou « actives » en fonction de leur capacité à (ré)activer le système immunitaire de l'hôte contre les cellules malignes[81].
| Immunothérapie | Type |
|---|---|
| Anticorps monoclonaux ciblant les cellules tumorales | Passive |
| Transfert de cellules | Passive |
| Virus oncolytique | |
| Traitement par cellules dendritiques | |
| Vaccin basé sur l'ADN | Active |
| Vaccin basé sur des peptides. | Active |
| Stimulation cytokiniques. | Active |
| Modulation par les anticorps monoclonaux | |
| Inhibiteurs du métabolisme immunitaire de la suppresion de la réponse immunitaire | Active |
| Inducteurs de la mort cellulaire immunologique | Active |
| Stimulateur des récepteur de reconnaissance de motifs moléculaires | Active |
| Autres |
Immunothérapie passive
[modifier|modifier le code]Immunothérapie par anticorps monoclonaux
[modifier|modifier le code]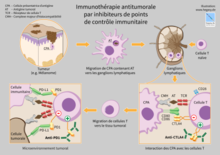
L'immunothérapie se concentre notamment autour de protéines de régulations du système immunitaire, nommées checkpoints du système immunitaire (immune checkpointsou "points de contrôle du système immunitaire" ). Parmi ces protéines, leCTLA-4,PD-1,ou encoreTIGIT,qualifiées de rhéostats de la réponse immune[82]:ces molécules permettent entre autres le contrôle de la réponse immune adaptative du fait de leur expression par plusieurs sous-catégories de lymphocytes T (ainsi que d'autres cellules immunocompétentes). Ces molécules permettent une inactivation du système immunitaire et il a été montré que les tumeurs pouvaient, dans le cadre de leur stratégie de résistance et d'échappement tumoral face aux réactions immunes, inactiver la réponse immune anti-tumorale en « épuisant » les lymphocytes par une activation de leurs protéines d'inhibition que sont PD-1, CTLA-4 ou TIGIT (entre autres). Ces molécules sont la source d'un intérêt thérapeutique considérable dans l'espoir de développer des vaccins curatifs à partir d'anticorpsmonoclonaux inactivant ces protéines.
L'étude de ces divers facteurs de régulation puissante du système immunitaire reste malgré tout un vaste sujet de débat, quant à leur valeur pronostique et diagnostique dans un cadre clinique et de suivi des patients cancéreux. En effet, il a longtemps été considéré que la surexpression de la molécule PD-L1 dans les tumeurs n'était liée qu'à une mauvaise évolution du cancer, du fait de l'expression de cette protéine par les tumeurs. Seulement, l'expression de cette même protéine par diverses sous-populations de cellules du système immunitaire pourrait être un témoin d'une régulation correcte de la réponse immune anti-tumorale exacerbée et témoigner d'un parfait contrôle du système immunitaire sur le développement tumoral. De telles hypothèses restent en suspens et doivent être discutées et vérifiées afin d'adapter les futurs traitements et améliorer la réponse des patients aux divers médicaments en développement.
Il existe de nombreux essais d'immunothérapie des cancers, dont de nombreux traitements anti-cancéreux utilisant l'immunité chez la souris, et il n'est pas rare qu'ils soient couronnés de succès[83].Mais en clinique humaine, à l'opposé, peu de stratégies sont effectivement des réussites. En effet, même si certaines études sur l'humain montrent des résultats encourageants[84],il reste à déterminer quels types de patients peuvent bénéficier du traitement et avec quelles doses (tous les patients traités ne répondent pas de la même manière au traitement, certains n'y répondent pas du tout). Par ailleurs, il convient également de travailler sur les effets secondaires: la sur-activation du système immunitaire par des traitements d'immunothérapie peut avoir de lourdes conséquences, notamment des récations auto-immunes ou inflammatoires puissantes. Dernièrement, on a obtenu des résultats assez bons pour un traitement dumélanome[85],et des cancers digestifs[86]ciblant les liaisonsPD-L1des tumeurs[87].
Desanticorps monoclonauxdirigés contre des antigènes de tumeur sont également de plus en plus expérimentés. C'est le cas par exemple pour le bevacizumab[88].
Influence du microbiote intestinal
[modifier|modifier le code]Une étude[89]de 2018, montre l'influence dumicrobioteintestinal sur l'efficacité de l'immunothérapie. En particulier, l'équipe a mis en évidence chez la souris que la bactérieBacteroides fragiliscontribuait à l’efficacité de l'anti-CLTA-4. De même, chez des patients traités avec dunivolumab(un anticorps dirigé contre le récepteur PD-1), l'efficacité du traitement est corrélée avec le taux d'une bactérie:Akkermansia muciniphila.En transférant à des sourisaxéniquesune même tumeur et le microbiote de patients ayant répondu favorablement ou défavorablement au traitement, l'étude montre une amélioration de l'état des premières contrairement à celles dotées du mauvais microbiote[90].
Immunothérapie active
[modifier|modifier le code]Vaccination
[modifier|modifier le code]Transfert adoptif
[modifier|modifier le code]Il existe aussi des stratégies detransfert adoptif de cellulesimmunitaires manipuléesex vivo[91].
Virus oncolytique
[modifier|modifier le code]Cytokines dans l'immunothérapie des cancers
[modifier|modifier le code]Sources
[modifier|modifier le code]- Yang, K., Lu, R., Mei, J. et al. The war between the immune system and the tumor - using immune biomarkers as tracers. Biomark Res 12, 51 (2024).https://doi.org/10.1186/s40364-024-00599-5publié sous license Creative Commons Attribution 4.0 International
Annexes
[modifier|modifier le code]Articles connexes
[modifier|modifier le code]- Paradoxe de Peto
- William Coley(en)(1862-1936), cancérologue connu pour sestoxines de Coley,médecin duMemorial Sloan-Kettering Cancer Center(avant cette dénomination) connu pour son traitement de certains types de cancer (sarcome)[92],considéré hors de France comme un des pères de l'immunothérapie.
- Facteur de nécrose tumorale(1975)
Liens externes
[modifier|modifier le code]Notes et références
[modifier|modifier le code]Références
[modifier|modifier le code]- Daniel S.Chenet IraMellman,«Oncology Meets Immunology: The Cancer-Immunity Cycle»,Immunity,vol.39,no1,,p.1–10(ISSN1074-7613,DOI10.1016/j.immuni.2013.07.012,lire en ligne,consulté le)
- Jin, Ahmed, Okazaki. 2011. Role of PD-1 in regulating T-cell immunity. Curr. Top. Microbiol. Immunol. 350: 17-37
- (en)Christopher RParish,«Cancer immunotherapy: The past, the present and the future»,Immunology & Cell Biology,vol.81,no2,,p.106–113(ISSN0818-9641et1440-1711,DOI10.1046/j.0818-9641.2003.01151.x,lire en ligne,consulté le)
- (en)KanglaTsunget Jeffrey A.Norton,«Lessons from Coley's Toxin»,Surgical Oncology,vol.15,no1,,p.25–28(DOI10.1016/j.suronc.2006.05.002,lire en ligne,consulté le)
- (en)Pierre G.Coulie,Benoît J.Van den Eynde,Pierrevan der Bruggenet ThierryBoon,«Tumour antigens recognized by T lymphocytes: at the core of cancer immunotherapy»,Nature Reviews Cancer,vol.14,no2,,p.135–146(ISSN1474-175Xet1474-1768,DOI10.1038/nrc3670,lire en ligne,consulté le)
- Liao SK, Carr DH. Comparative immunogenicity of irradiated, neuraminidase treated, and fused cells of a strain-restricted sarcoma.Z Krebsforsch klin Onkol Cancer Res Clin Oncol(1974)82(2):133–42.
- Milas L, Withers HR. Nonspecific immunotherapy of malignant tumors.Radiology(1976)118(1):211–8
- Bogden AE, Esber HJ. Influence of surgery, irradiation, chemotherapy, and immunotherapy on growth of a metastasizing rat mammary adenocarcinoma.Natl Cancer Inst Monogr(1978) (49):97–100.
- (en)DouglasHanahanet Robert AWeinberg,«The Hallmarks of Cancer»,Cell,vol.100,no1,,p.57–70(DOI10.1016/S0092-8674(00)81683-9,lire en ligne,consulté le)
- (en)T LWhiteside,«The tumor microenvironment and its role in promoting tumor growth»,Oncogene,vol.27,no45,,p.5904–5912(ISSN0950-9232et1476-5594,PMID18836471,PMCIDPMC3689267,DOI10.1038/onc.2008.271,lire en ligne,consulté le)
- (en)Corbin E.Meachamet Sean J.Morrison,«Tumour heterogeneity and cancer cell plasticity»,Nature,vol.501,no7467,,p.328–337(ISSN0028-0836et1476-4687,PMID24048065,PMCIDPMC4521623,DOI10.1038/nature12624,lire en ligne,consulté le)
- (en)CatherineSautès-Fridman,JulienCherfils-Vicini,DianeDamotteet SylvainFisson,«Tumor microenvironment is multifaceted»,Cancer and Metastasis Reviews,vol.30,no1,,p.13–25(ISSN0167-7659et1573-7233,DOI10.1007/s10555-011-9279-y,lire en ligne,consulté le)
- (en)Robert D.Schreiber,Lloyd J.Oldet Mark J.Smyth,«Cancer Immunoediting: Integrating Immunity’s Roles in Cancer Suppression and Promotion»,Science,vol.331,no6024,,p.1565–1570(ISSN0036-8075et1095-9203,DOI10.1126/science.1203486,lire en ligne,consulté le)
- (en)DeepakMittal,Matthew MGubin,Robert DSchreiberet Mark JSmyth,«New insights into cancer immunoediting and its three component phases—elimination, equilibrium and escape»,Current Opinion in Immunology,vol.27,,p.16–25(PMID24531241,PMCIDPMC4388310,DOI10.1016/j.coi.2014.01.004,lire en ligne,consulté le)
- (en)LaurenceZitvogel,AntoineTesniereet GuidoKroemer,«Cancer despite immunosurveillance: immunoselection and immunosubversion»,Nature Reviews Immunology,vol.6,no10,,p.715–727(ISSN1474-1733et1474-1741,DOI10.1038/nri1936,lire en ligne,consulté le)
- (en)LauraSenovilla,LorenzoGalluzzi,LaurenceZitvogelet GuidoKroemer,«Immunosurveillance as a regulator of tissue homeostasis»,Trends in Immunology,vol.34,no10,,p.471–481(DOI10.1016/j.it.2013.06.005,lire en ligne,consulté le)
- (en)Wolf HermanFridman,FranckPagès,CatherineSautès-Fridmanet JérômeGalon,«The immune contexture in human tumours: impact on clinical outcome»,Nature Reviews Cancer,vol.12,no4,,p.298–306(ISSN1474-175Xet1474-1768,DOI10.1038/nrc3245,lire en ligne,consulté le)
- (en)LauraSenovilla,ErikaVacchelli,JeromeGalonet SandyAdjemian,«Trial watch: Prognostic and predictive value of the immune infiltrate in cancer»,OncoImmunology,vol.1,no8,,p.1323–1343(ISSN2162-402X,PMID23243596,PMCIDPMC3518505,DOI10.4161/onci.22009,lire en ligne,consulté le)
- (en)LauraSenovilla,FernandoAranda,LorenzoGalluzziet GuidoKroemer,«Impact of myeloid cells on the efficacy of anticancer chemotherapy»,Current Opinion in Immunology,vol.30,,p.24–31(DOI10.1016/j.coi.2014.05.009,lire en ligne,consulté le)
- (en)LorenzoGalluzzi,LauraSenovilla,LaurenceZitvogelet GuidoKroemer,«The secret ally: immunostimulation by anticancer drugs»,Nature Reviews Drug Discovery,vol.11,no3,,p.215–233(ISSN1474-1776et1474-1784,DOI10.1038/nrd3626,lire en ligne,consulté le)
- Ghiringhelliet al.,European Jouranl of Immunology,vol. 34, pages 336-344, 2004.
- Suzukiet al.,Clinical Cancer Research,vol. 11, pages 6713-6721, 2005.
- Apetohet al.,Trends in Molecular Medicine,vol. 14, pages 141-151, 2008.
- Spiseket al.,Blood,vol. 109, pages 4839-4845, 2007.
- http://www.ipubli.inserm.fr/handle/10608/5849- Salem Chouaib, Faten El Hage, Houssem Benlalam et Fathia Mami-Chouaib (Institut Gustave Roussy, Villejuif): "Immunothérapie du cancer: espoirs et réalités" (2006)
- https://www.ncbi.nlm.nih.gov/pubmed/27030078- "Immunological off-target effects of imatinib",Laurence Zitvogel,Sylvie Rusakiewicz, Bertrand Routy, Maha Ayyoub & Guido Kroemer, Nature, 2016.
- (en)Robert K.Bradleyet OlgaAnczuków,«RNA splicing dysregulation and the hallmarks of cancer»,Nature Reviews Cancer,vol.23,no3,,p.135–155(ISSN1474-1768,PMID36627445,PMCIDPMC10132032,DOI10.1038/s41568-022-00541-7,lire en ligne,consulté le)
- (en)RuoyanLi,LinDi,JieLiet WenyiFan,«A body map of somatic mutagenesis in morphologically normal human tissues»,Nature,vol.597,no7876,,p.398–403(ISSN1476-4687,DOI10.1038/s41586-021-03836-1,lire en ligne,consulté le)
- JingLiu,YunhuaPenget WenyiWei,«Cell cycle on the crossroad of tumorigenesis and cancer therapy»,Trends in Cell Biology,vol.32,no1,,p.30–44(ISSN0962-8924,PMID34304958,PMCIDPMC8688170,DOI10.1016/j.tcb.2021.07.001,lire en ligne,consulté le)
- (en)ZheyingZhang,ManmanLu,YuQinet WujiGao,«Neoantigen: A New Breakthrough in Tumor Immunotherapy»,Frontiers in Immunology,vol.12,(ISSN1664-3224,PMID33936118,PMCIDPMC8085349,DOI10.3389/fimmu.2021.672356,lire en ligne,consulté le)
- JingyuanWang,JoanneXiu,AlexFarrellet YasmineBaca,«Mutational analysis of microsatellite-stable gastrointestinal cancer with high tumour mutational burden: a retrospective cohort study»,The Lancet Oncology,vol.24,no2,,p.151–161(ISSN1470-2045,DOI10.1016/s1470-2045(22)00783-5,lire en ligne,consulté le)
- SushantKumar,JonathanWarrell,ShantaoLiet Patrick D.McGillivray,«Passenger Mutations in More Than 2,500 Cancer Genomes: Overall Molecular Functional Impact and Consequences»,Cell,vol.180,no5,,p.915–927.e16(ISSN0092-8674,PMID32084333,PMCIDPMC7210002,DOI10.1016/j.cell.2020.01.032,lire en ligne,consulté le)
- (en)Maxwell A.Sherman,Adam U.Yaari,OliverPriebeet FelixDietlein,«Genome-wide mapping of somatic mutation rates uncovers drivers of cancer»,Nature Biotechnology,vol.40,no11,,p.1634–1643(ISSN1546-1696,PMID35726091,PMCIDPMC9646522,DOI10.1038/s41587-022-01353-8,lire en ligne,consulté le)
- (en)JingjingHe,XinxinXiong,HanYanget DandanLi,«Defined tumor antigen-specific T cells potentiate personalized TCR-T cell therapy and prediction of immunotherapy response»,Cell Research,vol.32,no6,,p.530–542(ISSN1748-7838,PMID35165422,PMCIDPMC9160085,DOI10.1038/s41422-022-00627-9,lire en ligne,consulté le)
- (en)MarianneBurbage,AresRocañín-Arjó,BlandineBaudonet Yago A.Arribas,«Epigenetically controlled tumor antigens derived from splice junctions between exons and transposable elements»,Science Immunology,vol.8,no80,(ISSN2470-9468,DOI10.1126/sciimmunol.abm6360,lire en ligne,consulté le)
- (en)FangjunChen,ZhengyunZou,JuanDuet ShuSu,«Neoantigen identification strategies enable personalized immunotherapy in refractory solid tumors»,The Journal of Clinical Investigation,vol.129,no5,,p.2056–2070(ISSN0021-9738,PMID30835255,PMCIDPMC6486339,DOI10.1172/JCI99538,lire en ligne,consulté le)
- (en)TaoJiang,TaoShi,HenghuiZhanget JieHu,«Tumor neoantigens: from basic research to clinical applications»,Journal of Hematology & Oncology,vol.12,no1,,p.93(ISSN1756-8722,PMID31492199,PMCIDPMC6731555,DOI10.1186/s13045-019-0787-5,lire en ligne,consulté le)
- (en)AvisekMajumder,ManbirSandhu,DebarkoBanerjiet VeronicaSteri,«The role of HER2 and HER3 in HER2-amplified cancers beyond breast cancers»,Scientific Reports,vol.11,no1,,p.9091(ISSN2045-2322,PMID33907275,PMCIDPMC8079373,DOI10.1038/s41598-021-88683-w,lire en ligne,consulté le)
- (en)Frank J.Lowery,SriKrishna,RamiYossefet Neilesh B.Parikh,«Molecular signatures of antitumor neoantigen-reactive T cells from metastatic human cancers»,Science,vol.375,no6583,,p.877–884(ISSN0036-8075et1095-9203,PMID35113651,PMCIDPMC8996692,DOI10.1126/science.abl5447,lire en ligne,consulté le)
- (en)RezaNaghavian,WolfgangFaigle,PietroOldratiet JianWang,«Microbial peptides activate tumour-infiltrating lymphocytes in glioblastoma»,Nature,vol.617,no7962,,p.807–817(ISSN1476-4687,PMID37198490,PMCIDPMC10208956,DOI10.1038/s41586-023-06081-w,lire en ligne,consulté le)
- (en)Fernando P.Canale,CamillaBasso,GaiaAntoniniet MichelaPerotti,«Metabolic modulation of tumours with engineered bacteria for immunotherapy»,Nature,vol.598,no7882,,p.662–666(ISSN1476-4687,DOI10.1038/s41586-021-04003-2,lire en ligne,consulté le)
- JohanJakobssonet MichelleVincendeau,«SnapShot: Human endogenous retroviruses»,Cell,vol.185,no2,,p.400–400.e1(ISSN0092-8674,DOI10.1016/j.cell.2021.12.028,lire en ligne,consulté le)
- (en)UteKochet FreddyRadtke,«Mechanisms of T Cell Development and Transformation»,Annual Review of Cell and Developmental Biology,vol.27,no1,,p.539–562(ISSN1081-0706et1530-8995,DOI10.1146/annurev-cellbio-092910-154008,lire en ligne,consulté le)
- (en)DomenicoRibatti,«The concept of immune surveillance against tumors: The first theories»,Oncotarget,vol.8,no4,,p.7175–7180(ISSN1949-2553,PMID27764780,PMCIDPMC5351698,DOI10.18632/oncotarget.12739,lire en ligne,consulté le)
- (en)GuidoKroemer,ClaudiaGalassi,LaurenceZitvogelet LorenzoGalluzzi,«Immunogenic cell stress and death»,Nature Immunology,vol.23,no4,,p.487–500(ISSN1529-2916,DOI10.1038/s41590-022-01132-2,lire en ligne,consulté le)
- (en)Dmitri V.Krysko,Abhishek D.Garg,AgnieszkaKaczmareket OlgaKrysko,«Immunogenic cell death and DAMPs in cancer therapy»,Nature Reviews Cancer,vol.12,no12,,p.860–875(ISSN1474-1768,DOI10.1038/nrc3380,lire en ligne,consulté le)
- (en)InesMarin,OlgaBoix,AndreaGarcia-Garijoet IsabelleSirois,«Cellular Senescence Is Immunogenic and Promotes Antitumor Immunity»,Cancer Discovery,vol.13,no2,,p.410–431(ISSN2159-8274et2159-8290,PMID36302218,PMCIDPMC7614152,DOI10.1158/2159-8290.CD-22-0523,lire en ligne,consulté le)
- (en)GuidoKroemer,LorenzoGalluzzi,OliverKeppet LaurenceZitvogel,«Immunogenic Cell Death in Cancer Therapy»,Annual Review of Immunology,vol.31,no1,,p.51–72(ISSN0732-0582et1545-3278,DOI10.1146/annurev-immunol-032712-100008,lire en ligne,consulté le)
- (en)JiadiLv,YaboZhou,NannanZhouet ZhenfengWang,«Epigenetic modification of CSDE1 locus dictates immune recognition of nascent tumorigenic cells»,Science Translational Medicine,vol.15,no681,(ISSN1946-6234et1946-6242,DOI10.1126/scitranslmed.abq6024,lire en ligne,consulté le)
- (en)FuPeng,MinruLiao,RuiQinet ShiouZhu,«Regulated cell death (RCD) in cancer: key pathways and targeted therapies»,Signal Transduction and Targeted Therapy,vol.7,no1,,p.1–66(ISSN2059-3635,PMID35963853,PMCIDPMC9376115,DOI10.1038/s41392-022-01110-y,lire en ligne,consulté le)
- JinHuang,YangchunXie,XiaofangSunet Herbert J.Zeh,«DAMPs, ageing, and cancer: The ‘DAMP Hypothesis’»,Ageing Research Reviews,vol.24,,p.3–16(ISSN1568-1637,PMID25446804,PMCIDPMC4416066,DOI10.1016/j.arr.2014.10.004,lire en ligne,consulté le)
- (en)RobertEil,Suman K.Vodnala,DavidCleveret Christopher A.Klebanoff,«Ionic immune suppression within the tumour microenvironment limits T cell effector function»,Nature,vol.537,no7621,,p.539–543(ISSN1476-4687,PMID27626381,PMCIDPMC5204372,DOI10.1038/nature19364,lire en ligne,consulté le)
- FrancescoCilenti,GiuliaBarbiera,NicolettaCaronniet DarioIodice,«A PGE2-MEF2A axis enables context-dependent control of inflammatory gene expression»,Immunity,vol.54,no8,,p.1665–1682.e14(ISSN1074-7613,PMID34129840,PMCIDPMC8362890,DOI10.1016/j.immuni.2021.05.016,lire en ligne,consulté le)
- (en)XinChen,RuiKang,GuidoKroemeret DaolinTang,«Broadening horizons: the role of ferroptosis in cancer»,Nature Reviews Clinical Oncology,vol.18,no5,,p.280–296(ISSN1759-4782,DOI10.1038/s41571-020-00462-0,lire en ligne,consulté le)
- (en)Gennady G.Yegutkinet DetlevBoison,«ATP and Adenosine Metabolism in Cancer: Exploitation for Therapeutic Gain»,Pharmacological Reviews,vol.74,no3,,p.799–824(ISSN0031-6997et1521-0081,PMID35738682,PMCIDPMC9553103,DOI10.1124/pharmrev.121.000528,lire en ligne,consulté le)
- (en)Si MingManet Brendan J.Jenkins,«Context-dependent functions of pattern recognition receptors in cancer»,Nature Reviews Cancer,vol.22,no7,,p.397–413(ISSN1474-1768,DOI10.1038/s41568-022-00462-5,lire en ligne,consulté le)
- (en)LauraMaiorino,JulianeDaßler-Plenker,LijuanSunet MikalaEgeblad,«Innate Immunity and Cancer Pathophysiology»,Annual Review of Pathology: Mechanisms of Disease,vol.17,no1,,p.425–457(ISSN1553-4006et1553-4014,PMID34788549,PMCIDPMC9012188,DOI10.1146/annurev-pathmechdis-032221-115501,lire en ligne,consulté le)
- HaixiaLong,QingzhuJia,LiuyangWanget WenfengFang,«Tumor-induced erythroid precursor-differentiated myeloid cells mediate immunosuppression and curtail anti-PD-1/PD-L1 treatment efficacy»,Cancer Cell,vol.40,no6,,p.674–693.e7(ISSN1535-6108,DOI10.1016/j.ccell.2022.04.018,lire en ligne,consulté le)
- Justin TGunesch,Amera LDixon,Tasneem AMEbrahimet Melissa MBerrien-Elliott,«CD56 regulates human NK cell cytotoxicity through Pyk2»,eLife,vol.9,,e57346(ISSN2050-084X,PMID32510326,PMCIDPMC7358009,DOI10.7554/eLife.57346,lire en ligne,consulté le)
- (en)TobiasBald,Matthew F.Krummel,Mark J.Smythet Kevin C.Barry,«The NK cell–cancer cycle: advances and new challenges in NK cell–based immunotherapies»,Nature Immunology,vol.21,no8,,p.835–847(ISSN1529-2916,PMID32690952,PMCIDPMC8406687,DOI10.1038/s41590-020-0728-z,lire en ligne,consulté le)
- (en)MubinTarannum,RizwanRomeeet Roman M.Shapiro,«Innovative Strategies to Improve the Clinical Application of NK Cell-Based Immunotherapy»,Frontiers in Immunology,vol.13,(ISSN1664-3224,PMID35401529,PMCIDPMC8990319,DOI10.3389/fimmu.2022.859177,lire en ligne,consulté le)
- (en)Jacob A.Myerset Jeffrey S.Miller,«Exploring the NK cell platform for cancer immunotherapy»,Nature Reviews Clinical Oncology,vol.18,no2,,p.85–100(ISSN1759-4782,PMID32934330,PMCIDPMC8316981,DOI10.1038/s41571-020-0426-7,lire en ligne,consulté le)
- (en)CélineBossard,StéphaneBézieau,TamaraMatysiak‐Budniket ChristelleVolteau,«HLA‐E/β2 microglobulin overexpression in colorectal cancer is associated with recruitment of inhibitory immune cells and tumor progression»,International Journal of Cancer,vol.131,no4,,p.855–863(ISSN0020-7136et1097-0215,DOI10.1002/ijc.26453,lire en ligne,consulté le)
- (en)Branca I.Pereira,Oliver P.Devine,MilicaVukmanovic-Stejicet Emma S.Chambers,«Senescent cells evade immune clearance via HLA-E-mediated NK and CD8+ T cell inhibition»,Nature Communications,vol.10,no1,,p.2387(ISSN2041-1723,PMID31160572,PMCIDPMC6547655,DOI10.1038/s41467-019-10335-5,lire en ligne,consulté le)
- (en)YuanyuanAnet QingYang,«Tumor‐associated macrophage‐targeted therapeutics in ovarian cancer»,International Journal of Cancer,vol.149,no1,,p.21–30(ISSN0020-7136et1097-0215,DOI10.1002/ijc.33408,lire en ligne,consulté le)
- (en)HuiWang,TianTianet JinhuaZhang,«Tumor-Associated Macrophages (TAMs) in Colorectal Cancer (CRC): From Mechanism to Therapy and Prognosis»,International Journal of Molecular Sciences,vol.22,no16,,p.8470(ISSN1422-0067,PMID34445193,PMCIDPMC8395168,DOI10.3390/ijms22168470,lire en ligne,consulté le)
- (en)MassimoLocati,GraziellaCurtaleet AlbertoMantovani,«Diversity, Mechanisms, and Significance of Macrophage Plasticity»,Annual Review of Pathology: Mechanisms of Disease,vol.15,no1,,p.123–147(ISSN1553-4006et1553-4014,PMID31530089,PMCIDPMC7176483,DOI10.1146/annurev-pathmechdis-012418-012718,lire en ligne,consulté le)
- (en)David G.DeNardoet BrianRuffell,«Macrophages as regulators of tumour immunity and immunotherapy»,Nature Reviews Immunology,vol.19,no6,,p.369–382(ISSN1474-1741,PMID30718830,PMCIDPMC7339861,DOI10.1038/s41577-019-0127-6,lire en ligne,consulté le)
- (en)Stefanie K.Wculek,Francisco J.Cueto,Adriana M.Mujalet IgnacioMelero,«Dendritic cells in cancer immunology and immunotherapy»,Nature Reviews Immunology,vol.20,no1,,p.7–24(ISSN1474-1741,DOI10.1038/s41577-019-0210-z,lire en ligne,consulté le)
- (en)SuchitJhunjhunwala,ChristianHammeret LéliaDelamarre,«Antigen presentation in cancer: insights into tumour immunogenicity and immune evasion»,Nature Reviews Cancer,vol.21,no5,,p.298–312(ISSN1474-1768,DOI10.1038/s41568-021-00339-z,lire en ligne,consulté le)
- (en)Douglas R.Green,NathalieDroinet MichaelPinkoski,«Activation‐induced cell death in T cells»,Immunological Reviews,vol.193,no1,,p.70–81(ISSN0105-2896et1600-065X,DOI10.1034/j.1600-065X.2003.00051.x,lire en ligne,consulté le)
- Hipp MM, et al. Blood 2008; 111: 5610-20.
- http://www.jle.com/fr/VEGF/VEGF.SOM.29/13-16.pdf"Influence de l’angiogenèse et des traitements anti-angiogéniques sur la réponse immunitaire anti-tumorale et l’immunosuppression" - Pr. Eric Tartour, Paris, 2012
- http://curie.fr/actualites/comprendre-comment-cellule-tumorale-detourne-son-environnement-006647Les différents types de fibroblastes associés aux tumeurs et leurs effets protumoraux; Equipe du Pr. Fatima Mechta, Institut Curie - Paris
- http://www.cell.com/immunity/abstract/S1074-7613(14)00230-1
- Dunnet al.,Immunity,vol. 21, pages 137-148, 2004.
- Dunnet al.,Annual Reviews in Immunology,vol. 22, pages 329-360, 2004.
- Koebelet al.,Nature,vol. 450, pages 930-937, 2008.
- «Faculté de Médecine Montpellier - Nîmes - Université de Montpellier», surFaculté de Médecine Montpellier - Nîmes(consulté le).
- (en)«Types of Cancer Immunotherapy», surfightcancerwithimmunotherapy.com viaWikiwix(consulté le).
- Lesterhuis WJ, Haanen JB, Punt CJ. Cancer immunotherapy--revisited. Nat Rev Drug Discov. 2011; 10:591-60
- (en)Oncology meets immunology: the cancer-immunity cycle.https://www.ncbi.nlm.nih.gov/pubmed/23890059
- Par exemple Berraondoet al.,Cancer Research,vol. 67, pages 8847-8855, 2007.
- (en)Safety and activity of anti-PD-L1 antibody in patients with advanced cancer.https://www.ncbi.nlm.nih.gov/pubmed/22658128
- "Congrès de l'ASCO 2015, Mélanomes: de meilleurs résultats avec les immunothérapies"-
- "Juillet 2015, GastroScoop: L’immunothérapie des cancers digestifs avance!".
- (en)"Anti–PD-1/PD-L1 therapy of human cancer, 37 s/1 min 23 s.
- H. Hurwitz H,et al.,New England Journal of Medicine,vol. 350, pages 2335–2342, 2004.
- (en)Bertrand Routyet al.,Gut microbiote influences efficacy ofPD-1-based immunotherapy against epithelial tumors,Science, 359, 91, 2018.
- La Recherchen° 535, mai 2018.
- Hunder,New England Journal of Medicine,vol. 358, pages 2698-2703, 2008.
- «Ces cancers qui régressent spontanément», surRéalités Biomédicales,(consulté le).
