Macrophage
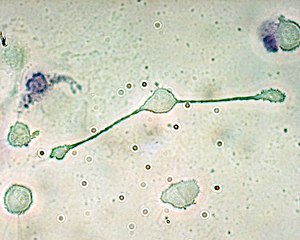
Lesmacrophages(du grecmacro-, gros et -phagein,manger) sont descellulesappartenant ausystème immunitaire,qui sont définis historiquement par leur capacité de phagocytose. Ce sont des grosses cellules arrondies avec un noyau excentré et des vacuoles dans leur cytoplasme. Ils ont deux origines: certains macrophages ont une origine embryonnaire et résident dans les tissus tout au long de la vie de l'individu, d'autres proviennent de ladifférenciationde leucocytes sanguins circulants, lesmonocytes.Les macrophages ne se trouvent pas dans le sang. La prise de sang de routine appelée numération formule sanguine ne les compte pas.
Les macrophages sont desphagocyteset sont donc capables dephagocytosepour éliminer les cellulesapoptiqueset lesagents pathogènes.Elles sont des cellules douées d'une grande plasticité fonctionnelle, s'adaptant à leur environnement tissulaire comme le démontre la diversité des macrophages résidents (tableau 1). Les macrophages ont aussi la capacité de fusionner entre eux ou avec d'autres types cellulaires aboutissant à la formation de cellules géantes multinuclées comme l'ostéoclaste,lescellules géantes de Langhanset les cellules géantes des corps étranger[1],[2].
La reconnaissance de motifs microbiens par les récepteurs situés à la surface des macrophages conduit à la phagocytose et à la destruction des agents infectieux, par le processus d'explosion oxydative (oxidative bursten anglais) et la production deradicaux libresde l'oxygène. Les macrophages produisent également des chimiokines, permettant le recrutement d'autres cellules sur le site de l'infection.
Comme lescellules dendritiques,ils sont capables de se comporter comme descellules présentatrices d'antigène.Ils participent à l’immunité innéeen tant que défense non spécifique, mais sont capables de participer à l’immunité adaptative.
Ils ont été découverts par le biologiste russeÉlie Metchnikoffen 1883. Leur nom provient dugrecμάκρος/mákros,« grand », etφαγεῖν/phageîn,« manger » = « gros mangeur ».
Origine des macrophages
[modifier|modifier le code]
Depuis 1968, à la suite des recherches duchercheurRalph van Furth[3]la croyance était que tous les macrophages tissulaires venaient d'un apport constant de monocytes sanguins. Les avancées technologiques récentes ont permis le rejet définitif du système phagocytaire mononucléaire affirmant que les macrophages résidents dérivés des monocytes et la reconnaissance des macrophages résidant dans les tissus en tant que populations uniques indépendantes de la différenciation monocytaire[4],[5],[6].La plupart des macrophages tissulaires sont présents à la naissance et se régénèrent durant toute la vie. Par contre, à l'âge adulte des macrophages peuvent venir de la différenciation des monocytes particulièrement les macrophages de la peau et les macrophages intestinaux et remplacer les macrophages d'origine fœtal. Les états inflammatoires d'origine infectieuses ou non provoquent l'apparition de macrophage d'origine moncytaire.
Macrophage d'origine fœtale
[modifier|modifier le code]La plupart des macrophages résidents des tissus sont des macrophages embryonnaires. Ils dérivent directement de cellules de lavésicule vitellineet sont capables d'auto-renouvellement et de maintenance indépendamment des monocytes[7]. La première vague, appelée vague primitive, commence au septième jour de la vie embryonnaire 6,5 dans lesac vitellin[8].Cette vague établit une population de progéniteurs exclusifs aux macrophages qui se différencient ensuite en progéniteurs érythroïdes et myéloïdes entre le neuvième et le onzième jour au cours de la vague pro-définitive[9].Une population intermédiaire de pré-macrophages (p-Mac) est dérivée des progéniteurs myéloïdes sans devenir au préalable des monocytes[10].La population de progéniteurs (érythroïdes et myéloïdes) et de p-Mac se développe pendant plusieurs jours dans le sac vitellin et migre vers le foie fœtal avent le quinzième jour. Entre le treizième et le dix-huitième jour, les p-Mac du foie fœtal migrent et ensemencent d'autres tissus pour établir des populations à vie de macrophages résidant dans les tissus. La troisième vague d'hématopoïèse, la vague définitive, débute vers le dix-huitième jour et implique l'établissement de cellules souches hématopoïétiques dans la moelle osseuse. Bien que tous les macrophages résidant dans les tissus proviennent des p-Mac du foie fœtal, les macrophages dérivés de la moelle osseuse remplacent la population fœtale dans les intestins, la rate, la peau et le cœur[11].Cependant, il convient de noter que ces populations de macrophages dérivées de cellules souches hématopoïétiques sont maintenues par auto-renouvellement avec une contribution minimale des monocytes en circulation à la suite de leur colonisation des tissus[12].
Macrophage d'origine médullaire
[modifier|modifier le code]Les macrophages d'origine médullaire sont essentiellement recrutés au cours d'un processus inflammatoire. Ils peuvent remplacer les macrophages résidents d'origine fœtale dans des circonstances très spécifiques.
Les monocytes sont un groupe de cellules circulant dans le sang, la moelle osseuse et la rate et constituant environ 10 % du total des leucocytes chez les êtres humains. Ils présentent des caractéristiques morphologiques typiques, telles qu'une forme cellulaire irrégulière, un noyau en forme d'ovale ou de rein, des vésicules cytoplasmiques et un rapport cytoplasme/noyau élevé. Les monocytes peuvent rester dans la circulation jusqu'à 1 à 2 jours, après quoi, s'ils n'ont pas été recrutés par un processus inflammatoire, ils meurent et sont éliminés.
Les monocytes proviennent de la moelle osseuse à partir decellules souches hématopoïétiqueset se développent à travers une série d'étapes de différenciation séquentielles: le progéniteur myéloïde commun[13],le progéniteur granulocytes-macrophages )[13],le progéniteur macrophages/cellules dendritiques (MDP)[14],et enfin le progéniteur monocytaire engagé (cMoP), un précurseur de la moelle osseuse récemment identifié qui diffère du progéniteur macrophages/cellules dendritiques car il manque d'expression de CD135[15].Les macrophages/cellules dendritiques n'ont pas la capacité de se différencier en cellulesgranulocytaires,mégacaryocytairesetlymphoïdeset sont considérés comme le précurseur direct des monocytes dans la moelle osseuse et par conséquent des monocytes sanguins[16].
La différenciation desmonocytesen macrophages nécessite des signaux déclenchés par des cytokines et des chimiokines sécrétées à la fois par le tissu lésé et par les cellules endothéliales des vaisseaux sanguins situés à proximité de la lésion. Les principales cytokines etchimiokinesqui permettent le recrutement des monocytes sont leCCL2et le CCL7, qui reconnaissent toutes deux le récepteurCCR2exprimé à la surface des monocytes. Lors de la liaison des chimiokines avec le récepteur, les interactions entre les monocytes et les cellulesendothélialesconduisent à ladiapédèsedes monocytes, un processus au cours duquel les monocytes se différencient en macrophages[17].
Macrophages résidents
[modifier|modifier le code]La majorité des macrophages (en situation non inflammatoire) résident à des endroits stratégiques du corps. Ils sont ainsi présents aux endroits les plus susceptibles d’invasion microbienne ou d’accumulation de débris de toutes sortes. Les macrophages résidant dans les tissus de la plupart des organes humains sont établies au cours de l'embryogenèse et maintenues par auto-renouvellement[18].Les macrophages résidant dans les tissus sont uniques dans leur capacité à réintégrer le cycle cellulaire en tant que cellules entièrement différenciées[18].
| Tissue | Sous-ensemble | Origine | Fonction |
|---|---|---|---|
| Peau | Cellule de Langerhans | Fœtale | Immunosurveillance
Présentation de l'antigène aux lymphocytes T Aide à la régénération du follicule pileux |
| Macrophage dermique | Adulte | Immunosurveillance
Aide à la régénération des fibres nerveuses terminales | |
| Système nerveux central | Microglie | Fœtale | Développement néonatal
Formation des synapses |
| Poumon | Macrophage alvéolaire | Fœtale | Nettoyage du surfactant
Destruction des pathogènes inhalés |
| Macrophage interstitielle | Adulte | Immunorégulation | |
| Rate | Macrophage pulpaire | Fœtale | Immunosurveillance
Destruction des hématies et métabolisme du fer |
| Macrophage de la zone marginale | Inconnue | Immunorégulation
Destruction des pathogènes et des cellulesapoptiques | |
| Foie | Cellule de Kupffer | Fœtale | Immunosurveillance
Métabolisme du fer,ducholestérolet de labilirubine Destruction des pathogènes venant de l'intestin et des hématies |
| Macrophage capsulaire | Adulte | Immunosurveillance
Destruction des pathogènes et des cellulesapoptiques | |
| Os | Ostéoclaste | Fœtale/Adulte | Résorption osseuse |
| Intestin | Macrophage intestinal | Fœtale/Adulte | Immunosurveillance
Régulation de la contraction des fibres musculaires lisses intestinales |
| Péritoine | Macrophage péritonéal | Fœtale | Immunosurveillance |
| Cœur | Macrophage cardiaque | Fœtale | Immunosurveillance
Aide à la conduction électrique Stimule l'angiogenèse |
| Tissu adipeux | Macrophage du tissu adipeux | Fœtale | Contrôle la sensibilité à l'insuline
Régulationthermogenèse Stimule l'angiogenèse |
Phénotypes
[modifier|modifier le code]L'existence de deux catégories de macrophages nommées M1 et M2 a été proposée depuis les années 2000[20].Les M1 sont impliqués dans la destruction des agents pathogènes. Les M2 sont impliqués dans la réparation et cicatrisation cellulaire. Cette différenciation se fait par une dégradation différente de l'arginineenoxyde nitriquedans le cas de M1 et enornithinedans le cas de M2[20].Les macrophages forment une population "plastique": ils peuvent passer d'un phénotype à l'autrein vivo.On parle de polarisation des macrophages pour désigner le processus par lequel les macrophages exhibent un phénotype spécifique et une réponse fonctionnelle aux stimuli du microenvironnement et aux signaux rencontrés par les macrophages dans des tissus spécifiques[21].
D'autres phénotypes de macrophages ont été individualisés comme le macrophage CD169+ ouSiglec-1, le macrophage TCR+ porteur durécepteur des lymphocytes Tet le macrophage associé aux tumeurs dont le phénotype est proche du phénotype M2[22].

Macrophage M1
[modifier|modifier le code]Les macrophages M1 sont définis comme des macrophages qui produisent des cytokines pro-inflammatoires, assurent la résistance aux agents pathogènes et présentent de fortes propriétés microbicides, mais ceux-ci contribuent également à la destruction des tissus. L'activation classique des macrophages se produit lorsque la cellule reçoit des stimuli comme l'interféron gammaγ, principalement sécrété par (cellules TH1,cellules T cytotoxiqueset lecellules NK); leslipopolysaccharidesmembranaires desbactéries Gram-négatives;lefacteur stimulant les colonies de granulocytes et de macrophages(GM-CSF) stimulant la production decytokinespro-inflammatoires[23],[24],[25].
Les macrophages M1 sont caractérisés par une capacité élevée à sécréter des cytokines telles que l'interleukine-1β,lefacteur de nécrose tumorale,l'interleukine-12 et l'interleukine-18;phénotypiquement, ils expriment des niveaux élevés decomplexe majeure d'histocompatibilité de classe II,de marqueurCD68et de molécules costimulatrices CD80 et CD86. Les macrophages M1 régulent positivement l'expression du suppresseur de la signalisation des cytokines 3 (Suppressor of cytokine signaling 3 SOCS3), activent l'oxyde nitrique synthaseinductible (NOS2 ou iNOS) générant dumonoxyde d'azote.Ainsi, les macrophages M1, dans des conditions spécifiques, exacerbent les processus inflammatoires pouvant endommager les tissus environnants[26],[27],[28].
Macrophage M2
[modifier|modifier le code]Les macrophages activés par une voie opposée à la voie classique sont appelés M2 ou voie alternative. Plusieurs marqueurs ont été proposés. Les stimulisCSF-1,l'interleukine-4,l'interleukine-10,leTGF-βet l'interleukine-13,ainsi que les infectionsfongiquesethelminthiques,favorisent la polarisation de la sous-population M2, délivrant de l'l'interleukine-10à des concentrations élevées, et de l'IL- 12en petites quantités. Les macrophages M2 jouent un rôle central dans les réponses aux parasites, au remodelage tissulaire, à l'angiogenèse et aux maladies allergiques[29],[30].
Il n’existe pas actuellement de récepteur caractéristique du macrophage M2. Phénotypiquement, cette population est caractérisée par l’expression du récepteur du mannose (MMR), également appelé CD206. Mais il ne semble pas que l'expression de CD206 entre les macrophages M1 et M2 soit la caractéristique spécifique des macrophages M2 mais plutôt la régulation positive de la glycoprotéine membranaire CD200R[31].CD163 a été suggéré comme marqueur M2 uniquement en combinaison avec lefacteur de transcriptionde fibrosarcome c-MAF(musculoaponeurotic fibrosarcoma).CD163 ne peut pas être considéré comme un marqueur M2 lorsqu'il est utilisé comme marqueur unique[32].MGL1 (Macrophage galactose-type lectin 1) et MGL2, deux membres de la famille deslectines de type Cde typegalactose,sont également exprimés dans les macrophages stimulés dans des conditions d'activation alternative[33].Le gène de réponse au complément 32 (RGC-32) est un régulateur du cycle cellulaire exprimé dans de nombreuses cellules, notamment les macrophages mais pas les monocytes[34].L'absence de RGC-32 n'affecte pas la différenciation monocytes-macrophages. Cependant, des stimulations par M-CSF(Macrophage colony-stimulating factor)ou l'interleukine-4,RGC-32 joue un rôle important dans la promotion de la polarisation M2 et son niveau d'expression augmente la polarisation en macrophages M2, proposant d'inclure cette protéine comme marqueur de la polarisation M2[35].
Récepteurs des macrophages
[modifier|modifier le code]Ils interagissent grâce à la présence de plusieurs types de récepteurs qui sont les mêmes que lesgranulocytes neutrophiles:
- les récepteursPAMPetDAMP,
- les récepteursopsioniques,
- les récepteurscytokinétiquesetchimiokinétique,
- les récepteurs de signalisation,
- les récepteursd'adhésivitécellulaire et des récepteurs modulant leur activé par un rétrocontrôle
Mais à la différence desgranulocytes neutrophiles,ils sont particulièrement riches enrécepteurs éboueurscomme lerécepteur RAGE.
Molècules protéiques libérées par les macrophages
[modifier|modifier le code]Cytokines
[modifier|modifier le code]Cytokines pro-inflammatoires
[modifier|modifier le code]Lorsque les macrophages sont exposés à des stimuli inflammatoires, ils sécrètent des cytokines telles que lefacteur de nécrose tumorale(TNF), l'interleukine 1,l'interleukine 6,l'interleukine 8et l'interleukine 12.Bien que les monocytes et les macrophages soient les principales sources de ces cytokines, elles sont également produites par les lymphocytes activés, les cellules endothéliales et les fibroblastes. De plus, les macrophages libèrent des chimiokines, des leucotriènes, des prostaglandines et du complément[36].Toutes ces molécules, de concert, peuvent induire une augmentation de la perméabilité vasculaire et un recrutement de cellules inflammatoires. Outre les effets locaux, ces médiateurs produisent également des effets systémiques tels que lafièvreet la production de protéines de la phase aiguë. La réponse inflammatoire est bénéfique pour l’hôte lorsque les cytokines susmentionnées sont produites en quantités appropriées, mais toxique lorsqu’elle est produite de manière dérégulée. Par exemple, une production excessive d’IL-1β et de TNF déclenche une réponse inflammatoire généralisée aiguë caractéristique duchoc septiqueet de ladéfaillance multiviscérale[37].
Facteur de nécrose tumorale
[modifier|modifier le code]Lefacteur de nécrose tumoraleinitialement décrite pour sa capacité à induire la nécrose de certaines tumeurs[38].Il stimule la phase aiguë de la réponse immunitaire. Cette puissante cytokine pyrogène est l’une des premières à être libérée en réponse à un agent pathogène et est capable d’exercer ses effets dans de nombreux organes[37].À ce titre, lefacteur de nécrose tumoraleest l’une des principales cytokines responsables duchoc septique.Dans l'hypothalamus,lefacteur de nécrose tumoraleF stimule la libération de l'hormone de libération corticotrope,supprime l'appétit et induit de lafièvre.Dans lefoie,il stimule la réponse inflammatoire aiguë en augmentant la synthèse de laprotéine C-réactiveet les autresprotéines de la phase aiguë.Lefacteur de nécrose tumoraleinduit unevasodilatationet augmente la perméabilité vasculaire, ce qui est propice à l'infiltration deslymphocytes,desneutrophileset desmonocytes.Il aide à recruter ces cellules vers le site d’inflammation en régulant la libération dechimiokines.Lefacteur de nécrose tumorale,de concert avec l'interféron 17, déclenche l'expression dechimiokinesCXCL1, CXCL2 et CXCL5 attirant lesneutrophiles[39]et peut également augmenter l'expression demolécules d'adhésion cellulairequi facilitent ladiapédèse[40].
Interleukine 1
[modifier|modifier le code]Trois formes de l'interleukine 1sont connues:interleukine 1α,interleukine 1β etinterleukine 1Ra.interleukine 1Ra réprime les actions pro inflammatoires deinterleukine 1α et de l'interleukine 1β en entrant en compétition avec le récepteur des autres interleukine 1. Comme le facteur de nécrose tumorale, l’interleukine 1β est également un pyrogène endogène produit et libéré dès les premiers stades de la réponse immunitaire aux infections, aux lésions et au stress. Lesmonocyteset les macrophages sont les principales sources de l’interleukine 1β, celle-ci est également libérée par lescellules NK,leslymphocytes B,lescellules dendritiques,lesfibroblasteset les cellulesépithéliales.Lors d'une inflammation, l'interleukine 1β stimule la production deprotéines de phase aiguëpar le foie et agit sur le système nerveux central pour induire de la fièvre et la sécrétion deprostaglandines.Dans lesmastocytes,l’interleukine 1β induit la libération d’histamine,qui à son tour provoque unevasodilatationet une inflammation localisée. C'est également un molécule attractive pour lesgranulocytes,améliore l'expansion et la différenciation descellules T CD4[41]et augmente l'expression des molécules d'adhésion cellulaire sur les leucocytes et les cellules endothéliales. L'interleukine 1β augmente l'expression des gènes qui la produisent[42].
Dans les macrophages stimulés, l'interleukine 1α est synthétisée de novo et peut être activement sécrétée[43]ou libérée passivement par les cellulesapoptotiques[44].Il peut également exercer ses effets de manière intracrine et agir comme facteur de transcription[41],[42].
Interleukine 6
[modifier|modifier le code]L'interleukine 6est une cytokine pléiotrope qui possède à la fois des fonctions pro-inflammatoires et anti-inflammatoires qui affectent des processus allant de l'immunité à la réparation des tissus et au métabolisme. Il favorise la différenciation descellules Benplasmocytes,active lescellules T cytotoxiqueset régule l'homéostasieosseuse.Semblable aufacteur de nécrose tumoraleet à l’interleukine 1,l’interleukine 6 est unpyrogèneendogène qui favorise la fièvre et la production de protéines hépatique de la phase aiguë.
Interleukine 12
[modifier|modifier le code]L'interleukine 12 est produite principalement par lesmonocytes,les macrophages et d'autrescellules présentatrices d'antigènes;il est essentiel pour lutter contre les maladies infectieuses et le cancer. L'IL-12 favorise l'immunité à médiation cellulaire via la stimulation deslymphocytes T auxiliaire.Il entre en synergie avec lefacteur de nécrose tumoraleet d’autres cytokines pro-inflammatoires pour stimuler la production d’interféron gamma,ainsi que la cytotoxicité deslymphocytes NKetCD8[45].L'IL-12 peut également inhiber l'angiogenèsegrâce à la régulation positive médiée par l'interféron gammade la chimiokine anti-angiogénique CXCL10.
Interleukine 18
[modifier|modifier le code]L'interleukine 18 fait partie de la famille de l'interleukine 1et est également un inducteur de la production d'interfèron-γ.Il entre en synergie avec l'interleukine 12pour activer lescellules Tet lescellules NK.L'interleukine 18 n'est pas un pyrogène et peut même atténuer la fièvre induite par l'interleukine 1β[46].
Interleukine 23
[modifier|modifier le code]L'interleukine 23 est également un inducteur d'interféron gammaet un activateur delymphocytes Timpliqué dans diverses maladies allant dupsoriasisà laschizophrénie[47].Contrairement à l' interleukine 12, l'interleukine 23augmente la libération d'interleukine 10et induit la synthèse d'interleukine 17par leslymphocytes Tnaïves activées[48].
Interleukine 27
[modifier|modifier le code]L'interleukine 27 fait partie de la famille IL-12. Elle est produite précocement dans les monocytes et les macrophages stimulés par leslipopolysaccharideset l'interféron gamma.Elle favorise la différenciation descellules Tnaïves en celluleslymphocyte T auxiliairevia l’induction de l’interféron gamma,l’interleukine 27 peut inhiber la différenciation deslymphocytes Th17[49].L'IL-27 possède également des propriétés anti-inflammatoires, en corrélation avec une augmentation des taux de cellules Th17[48].Le fait que cette cytokine possède des propriétés inflammatoires et anti-inflammatoires sélectives conforte l’idée selon laquelle la réponse inflammatoire est rapide, mais également soigneusement calibrée pour éviter tout dommage à l’hôte.
Cytokines anti-inflammatoires
[modifier|modifier le code]Interleukine 10
[modifier|modifier le code]L'interleukine 10agit en supprimant l'activation des macrophages et la production du facteur de nécrose tumorale, deinterleukine 1β, de l'interleukine 6,de l'interleukine 8,de l'interleukine 12et dufacteur stimulant les colonies de granulocytes et de macrophages[50].L'interleukine 10supprime l'expression ducomplexe majeur d'histocompatibilité de classe IIdans les macrophages activés et constitue donc un puissant inhibiteur de laprésentation de l'antigène[51].Il est particulièrement intéressant de noter que l’interleukine 10inhibe la production d’interfèron-γ par leslymphocytes T auxiliaireset lescellules NKet induit la croissance, la différenciation et la sécrétion d’immunoglobuline Gpar lescellules B[52],[53].Les macrophages eux-mêmes sont affectés par l'interleukine 10dans la mesure où l'exposition à cette cytokine diminue leur activité microbicide et diminue leur capacité à répondre à l'interfèron-γ[54],[55].
TGF bêta
[modifier|modifier le code]Lefacteur de croissance transformantbêta ou TGFB(Transforming growth factor-beta)a les mêmes actions anti-inflammatoires que l'interleukine 10.
Chimiokines
[modifier|modifier le code]Leschimiokinessont une famille spéciale de cytokines liant l'héparine,capables de guider la migration cellulaire dans un processus appeléchimiotaxie.Les cellules attirées par les chimiokines migrent vers la source de cette chimiokine. Lors de la surveillance immunitaire, les chimiokines jouent un rôle crucial en guidant les cellules du système immunitaire là où elles sont nécessaires[56].Certaines chimiokines jouent également un rôle au cours du développement en favorisant l’angiogenèse ou en guidant les cellules vers des tissus qui fournissent des signaux critiques pour leur différenciation. Dans la réponse inflammatoire, les chimiokines sont libérées par une grande variété de cellules impliquées dans l’immunité innéeetadaptative[56].La libération de chimiokines est induite principalement par les cytokines pro-inflammatoires telles que lefacteur de nécrose tumorale,l'interleukine 6et l'interleukine 1β.
CXCL1 et CXCL2
[modifier|modifier le code]CCL5
[modifier|modifier le code]CXCL8
[modifier|modifier le code]CXCL9
[modifier|modifier le code]CXCL9, également connue sous l'acronyme MIG(Monokine induced by gamma interferon),est un puissant chimioattractif deslymphocytes Tsur le site de l'inflammation[56],[57].Il assure le recrutement cellulaire nécessaire à l’inflammation et à la réparation des lésions tissulaires. CXCL9 inhibe également lanéovascularisation[58]et a des effetsantitumorauxetanti-métastatiques[59].
CXCL10
[modifier|modifier le code]CXCL11
[modifier|modifier le code]Molécules non protéiques libérées par les macrophages
[modifier|modifier le code]Dérivé réactif de l'oxygène
[modifier|modifier le code]
Lesdérivés réactifs de l'oxygènesont connus depuis de nombreuses années comme une arme essentielle des macrophages pour tuer les micro-organismes invasifs grâce à l'explosion oxydativemédiée par laNADPH oxydase[60].Récemment, les études montrant que lesdérivés réactifs de l'oxygènemitochondrialesjouent un rôle essentiel dans plusieurs fonctions immunitaires innées[61].
Sources des dérivés réactifs de l'oxygène chez le macrophage
[modifier|modifier le code]Cibles des dérivés réactifs de l'oxygène
[modifier|modifier le code]Fonctions
[modifier|modifier le code]
La fonction des macrophages est spécifique des tissus considérés: il est délicat de leur attribuer une fonction générale. Si on doit catégoriser les fonctions des macrophages, elles peuvent être considérées comme étant des fonctions immunitaires ou des fonctions homéostatiques.
Les macrophages sont attirés vers le lieu d’uneinflammationparchimiotactisme.Les signaux d’appel sont constitués de différents stimuli, dérivés de cellules endommagées (parnécroseouapoptose), de pathogènes, et de produits libérés par les cellules présentes au site: l’histaminerelarguée par lesmastocyteset lesgranulocytes basophiles,et deschimiokinesetcytokineslibérées par des macrophages.
Contrairement auxgranulocytes neutrophiles,qui sont les cellules phagocytaires présentes le plus vite au lieu de l’inflammation et qui ne vivent que quelques jours, la durée de vie d’un macrophage va de plusieurs mois à des années. Au cours du temps, on a un remplacement de la plupart des macrophages embryonnaires par des macrophages d'origine monocytaire. Ce remplacement n'est pas observable pour la microglie, une population de macrophage embryonnaire qui peuple le système nerveux central.
Fonctions immunitaires
[modifier|modifier le code]Phagocytose
[modifier|modifier le code]-
Macrophage phagocytant desconidies.
Un des rôles principaux des macrophages est le nettoyage decorps nécrotiqueset decorps apoptotiques,de débris et de poussières dans le cas despoumons.L’élimination des cellules mortes est importante dans le cadre des phases précoces de l’inflammation chronique. Cette élimination est dominée par l’action desgranulocytes neutrophiles,qui seront eux-mêmes phagocytés par les macrophages une fois vieillis (voirCD31pour plus de détails).
L’élimination de la poussière et des tissus nécrotiques est prise en charge à une plus grande échelle (hors inflammation), par des macrophages résidents qui restent à des endroits stratégiques comme les poumons, le foie, les tissus nerveux, les os, la rate et les tissus conjonctifs, et qui digèrent les particules étrangères comme la poussière et les débris, mais aussi les pathogènes, recrutant en cas de besoin des monocytes circulants pour leur différenciation locale en macrophages tissulaires.
Lorsqu’un macrophage ingère un pathogène, la vésicule intracellulaire formée est nomméephagosome.Elle va fusionner avec unlysosome.Lesenzymeslysosomiales et lesradicaux libresde l’oxygène(notamment l’hypochlorite) vont tuer et digérer l’intrus. Cependant, certains organismes peuvent résister à ce processus et survivre dans le macrophage, commeMycobacterium tuberculosisou lesLeishmania.Un macrophage peut digérer une centaine de bactéries avant de succomber lui-même à ses propres enzymes de digestion.
Présentation de l'antigène
[modifier|modifier le code]Après avoir digéré un pathogène, un macrophage peut se comporter encellule présentatrice d'antigène,c’est-à-dire présenter unantigènede manière à stimuler unlymphocyte Tspécifique. La stimulation lymphocytaire par un macrophage est moindre que celle induite par unecellule dendritique,mais les macrophages sont capables de présenter des antigènes associés aux molécules ducomplexe majeur d'histocompatibilitéde classe deux, et donc de stimuler des lymphocytesCD4+.
Une immunisation se traduit également par la production d'anticorpsdirigés contre les antigènes immunisants. Ces anticorps vont se lier aux antigènes de surface des pathogènes. Certainsisotypessontopsonisants,c'est-à-dire qu’il existe sur les phagocytes des récepteurs spécifiques des fragments constants des chaînes lourdes des anticorps. (Dans le cas des IgG (immunoglobuline d'isotype G), ce sont lesCD16,CD32 et CD64.) Les macrophages possèdent ce type de récepteurs et la liaison d’un complexe immun à ces récepteurs déclenche la phagocytose. Ainsi, un pathogène qui sera invisible aux yeux d’un macrophage deviendra visible une fois opsonisé.
Production et libération de cytokines
[modifier|modifier le code]Les macrophages sont capables de sécréter un grand nombre de cytokines comme l'interleukine 1 (IL-1), l'interleukine 6 (IL-6), le facteur nécrosant des tumeurs (TNF-α). Ils participent de façon active au recrutement des autres cellules de l'immunité innée.
In vitro,les macrophages M1 activés libèrent des cytokines pro-inflammatoires dont le TNF-α, l'IL-1α, l'IL-1β, l'IL-6, l'IL-12, l'IL-18 et l'IL-23. Ils produisent de l'oxyde nitreux (NO), des espèces réactives de l'oxygène (ROS) et des espèces réactives de l'azote (RNS). Ils expriment également des récepteurs aux chimiokines (CCR1 et CCR5).
In vitro,les macrophages M2 activés libère plutôt des cytokines de résolution de l'inflammation comme l'IL-10 ou le TGF-β.
Fonctions homéostatiques
[modifier|modifier le code]Les macrophages jouent un rôle important au niveau de lapeauqui est un organe important pour l'immunité[62].Ils[63]stimulent également les cellules impliquées dans la cicatrisation ou la régénération duderme[64](et un défaut de cette fonction de réparation peut conduire à des phénomènes inflammatoires et au cancer[65]). Les macrophages peuvent aussi stimuler lescellules souchesdes follicules pileux qui produisentpoilsetcheveux[66]via des signaux moléculaires émis par les macrophages et reçus par les cellules souches dufollicule pileuxau repos (HF-SCs).
Un type particulier de macrophages, les ostéoclastes, sont responsables de l'homéostasie tissulaire dans l'os. Ils jouent un rôle de contrôle de la quantité d'os fabriqué.
Certains macrophages résidents des poumons libèrent le surfactant pulmonaire.
Fonctions dans le cancer
[modifier|modifier le code]Dans le cancer, la plupart des cellules immunitaires trouvées dans une tumeurcancéreusesont des macrophages, appelésmacrophages associés aux tumeurs[67].Alors que certains macrophages associés aux tumeurs peuvent présenter des propriétés antitumorales telles que la phagocytose des cellules tumorales et l'orchestration d'uneréponse immunitaire,la plupart des macrophages dumicroenvironnement tumoralsont pro-tumorigènes[68].Les macrophages sont impliqués dans tous les stades du cancer. Ils contribuent à l’initiation du cancer par uneinflammationlatente, conduisant à un environnementmutagène[69].Ils soutiennent la progression du cancer en induisant l’angiogenèse,en favorisant la migration et l’invasion des cellules cancéreuses et en renforçant l’immunité antitumorale. Ils stimulent également lesmétastasesen préparant la niche métastatique et en améliorant l'extravasation et la survie des cellules tumorales[67],[69],[70].Par conséquent, l’utilisation des macrophages contre le cancer s’est développée dès lesannées 1970[71],[72].
Implication en pathologie humaine
[modifier|modifier le code]Les macrophages contribuent de façon importante dans la progression de maladies inflammatoires comme le diabète, le cancer, et l'athérosclérose. Parmi leur rôles en pathologie humaine:
- lesmacrophages associés aux tumeursqui sont présents dans lemicro-environnement tumoralsemblent jouer un rôle ambigu dans la progression tumorale et l'immunosuppression;
- les macrophages sont capables de stocker les lipides anormaux. Ils constituent les plaques d'athéroscléroseet portent alors le nom decellules spumeuses;
- les macrophages expriment les moléculesCD4etCCR5,ce qui les rend infectables par les souches macrotropes duVIH.En pratique, l'infection au VIH lors d'une contamination sexuelle passe par les macrophages;
- la formation dugranulomeinflammatoire dépend des macrophages.
Notes et références
[modifier|modifier le code]- (en)MariePereira,EnricoPetretto,SiamonGordonet J. H. DuncanBassett,«Common signalling pathways in macrophage and osteoclast multinucleation»,Journal of Cell Science,vol.131,no11,(ISSN1477-9137et0021-9533,DOI10.1242/jcs.216267,lire en ligne,consulté le)
- KouroshAhmadzadeh,MargotVanoppen,Carlos D.Roseet PatrickMatthys,«Multinucleated Giant Cells: Current Insights in Phenotype, Biological Activities, and Mechanism of Formation»,Frontiers in Cell and Developmental Biology,vol.10,(ISSN2296-634X,PMID35478968,PMCIDPMC9035892,DOI10.3389/fcell.2022.873226,lire en ligne,consulté le)
- (en)Ralphvan Furthet Zanvil A.Cohn,«THE ORIGIN AND KINETICS OF MONONUCLEAR PHAGOCYTES»,The Journal of Experimental Medicine,vol.128,no3,,p.415–435(ISSN1540-9538et0022-1007,PMID5666958,PMCIDPMC2138527,DOI10.1084/jem.128.3.415,lire en ligne,consulté le)
- (en)ChristianSchulz,Elisa GomezPerdiguero,LaurentChorroet HeatherSzabo-Rogers,«A Lineage of Myeloid Cells Independent of Myb and Hematopoietic Stem Cells»,Science,vol.336,no6077,,p.86–90(ISSN0036-8075et1095-9203,DOI10.1126/science.1219179,lire en ligne,consulté le)
- (en)DaigoHashimoto,AndrewChow,ClaraNoizatet PearlineTeo,«Tissue-Resident Macrophages Self-Maintain Locally throughout Adult Life with Minimal Contribution from Circulating Monocytes»,Immunity,vol.38,no4,,p.792–804(PMID23601688,PMCIDPMC3853406,DOI10.1016/j.immuni.2013.04.004,lire en ligne,consulté le)
- (en)Michael H.Siewekeet Judith E.Allen,«Beyond Stem Cells: Self-Renewal of Differentiated Macrophages»,Science,vol.342,no6161,(ISSN0036-8075et1095-9203,DOI10.1126/science.1242974,lire en ligne,consulté le)
- (en)Luke CDavies,Stephen JJenkins,Judith EAllenet Philip RTaylor,«Tissue-resident macrophages»,Nature Immunology,vol.14,no10,,p.986–995(ISSN1529-2908et1529-2916,PMID24048120,PMCIDPMC4045180,DOI10.1038/ni.2705,lire en ligne,consulté le)
- (en)Igor M.Samokhvalov,«Deconvoluting the ontogeny of hematopoietic stem cells»,Cellular and Molecular Life Sciences,vol.71,no6,,p.957–978(ISSN1420-682Xet1420-9071,DOI10.1007/s00018-013-1364-7,lire en ligne,consulté le)
- (en)ElisaGomez Perdiguero,KayKlapproth,ChristianSchulzet KatrinBusch,«Tissue-resident macrophages originate from yolk-sac-derived erythro-myeloid progenitors»,Nature,vol.518,no7540,,p.547–551(ISSN0028-0836et1476-4687,PMID25470051,PMCIDPMC5997177,DOI10.1038/nature13989,lire en ligne,consulté le)
- (en)ElviraMass,IvanBallesteros,MatthiasFarliket FlorianHalbritter,«Specification of tissue-resident macrophages during organogenesis»,Science,vol.353,no6304,(ISSN0036-8075et1095-9203,PMID27492475,PMCIDPMC5066309,DOI10.1126/science.aaf4238,lire en ligne,consulté le)
- YinyuWuet Karen K.Hirschi,«Tissue-Resident Macrophage Development and Function»,Frontiers in Cell and Developmental Biology,vol.8,(ISSN2296-634X,PMID33490082,PMCIDPMC7820365,DOI10.3389/fcell.2020.617879,lire en ligne,consulté le)
- (en)MalayHaldaret Kenneth M.Murphy,«Origin, development, and homeostasis of tissue‐resident macrophages»,Immunological Reviews,vol.262,no1,,p.25–35(ISSN0105-2896et1600-065X,PMID25319325,PMCIDPMC4203404,DOI10.1111/imr.12215,lire en ligne,consulté le)
- (en)KoichiAkashi,DavidTraver,ToshihiroMiyamotoet Irving L.Weissman,«A clonogenic common myeloid progenitor that gives rise to all myeloid lineages»,Nature,vol.404,no6774,,p.193–197(ISSN0028-0836et1476-4687,DOI10.1038/35004599,lire en ligne,consulté le)
- (en)Darin K.Fogg,ClaireSibon,ChaoukiMiledet SteffenJung,«A Clonogenic Bone Marrow Progenitor Specific for Macrophages and Dendritic Cells»,Science,vol.311,no5757,,p.83–87(ISSN0036-8075et1095-9203,DOI10.1126/science.1117729,lire en ligne,consulté le)
- (en)JanHettinger,David MRichards,JennyHanssonet Melanie MBarra,«Origin of monocytes and macrophages in a committed progenitor»,Nature Immunology,vol.14,no8,,p.821–830(ISSN1529-2908et1529-2916,DOI10.1038/ni.2638,lire en ligne,consulté le)
- Fogg DK, Sibon C, Miled C, Jung S, Aucouturier P, Littman DR, et al. A clonogenic bone marrow progenitor specific for macrophages and dendritic cells.Science(2006)311(5757):83–7. doi:10.1126/science.1117729
- (en)SussanNoursharghet RonenAlon,«Leukocyte Migration into Inflamed Tissues»,Immunity,vol.41,no5,,p.694–707(DOI10.1016/j.immuni.2014.10.008,lire en ligne,consulté le)
- (en)AtharAziz,ErinnSoucie,SandrineSarrazinet Michael H.Sieweke,«MafB/c-Maf Deficiency Enables Self-Renewal of Differentiated Functional Macrophages»,Science,vol.326,no5954,,p.867–871(ISSN0036-8075et1095-9203,DOI10.1126/science.1176056,lire en ligne,consulté le)
- AmeliaKulle,AjithaThanabalasuriar,Taylor S.Cohenet MartaSzydlowska,«Resident macrophages of the lung and liver: The guardians of our tissues»,Frontiers in Immunology,vol.13,(ISSN1664-3224,PMID36532044,PMCIDPMC9750759,DOI10.3389/fimmu.2022.1029085,lire en ligne,consulté le)
- (en)Charles D.Mills,KristiKincaid,Jennifer M.Altet Michelle J.Heilman,«M-1/M-2 Macrophages and the Th1/Th2 Paradigm»,The Journal of Immunology,vol.164,no12,,p.6166–6173(ISSN0022-1767et1550-6606,PMID10843666,DOI10.4049/jimmunol.164.12.6166,lire en ligne,consulté le)
- (en)AbbasShapouri‐Moghaddam,SaeedMohammadian,HosseinVaziniet MahdiTaghadosi,«Macrophage plasticity, polarization, and function in health and disease»,Journal of Cellular Physiology,vol.233,no9,,p.6425–6440(ISSN0021-9541et1097-4652,DOI10.1002/jcp.26429,lire en ligne,consulté le)
- LeslieChávez-Galánet Maria L.Olleros,«Much More than M1 and M2 Macrophages, There are also CD169+ and TCR+ Macrophages»,Frontiers in Immunology,vol.6,(ISSN1664-3224,PMID26074923,PMCIDPMC4443739,DOI10.3389/fimmu.2015.00263,lire en ligne,consulté le)
- (en)AlfonsBilliauet PatrickMatthys,«Interferon-γ: A historical perspective»,Cytokine & Growth Factor Reviews,vol.20,no2,,p.97–113(DOI10.1016/j.cytogfr.2009.02.004,lire en ligne,consulté le)
- (en)MausumeeGuhaet NigelMackman,«LPS induction of gene expression in human monocytes»,Cellular Signalling,vol.13,no2,,p.85–94(DOI10.1016/S0898-6568(00)00149-2,lire en ligne,consulté le)
- (en)Andrew J.Fleetwood,TobyLawrence,John A.Hamiltonet Andrew D.Cook,«Granulocyte-Macrophage Colony-Stimulating Factor (CSF) and Macrophage CSF-Dependent Macrophage Phenotypes Display Differences in Cytokine Profiles and Transcription Factor Activities: Implications for CSF Blockade in Inflammation»,The Journal of Immunology,vol.178,no8,,p.5245–5252(ISSN0022-1767et1550-6606,DOI10.4049/jimmunol.178.8.5245,lire en ligne,consulté le)
- (en)TatsuyaOkamoto,KishorchandraGohil,Erik I.Finkelsteinet PeterBove,«Multiple contributing roles for NOS2 in LPS-induced acute airway inflammation in mice»,American Journal of Physiology-Lung Cellular and Molecular Physiology,vol.286,no1,,L198–L209(ISSN1040-0605et1522-1504,DOI10.1152/ajplung.00136.2003,lire en ligne,consulté le)
- (en)Patti C.Zeidler,Lyndell M.Millecchiaet VincentCastranova,«Role of inducible nitric oxide synthase-derived nitric oxide in lipopolysaccharide plus interferon-γ-induced pulmonary inflammation»,Toxicology and Applied Pharmacology,vol.195,no1,,p.45–54(DOI10.1016/j.taap.2003.10.005,lire en ligne,consulté le)
- (en)Christina E.Arnold,Claire S.Whyte,PeterGordonet Robert N.Barker,«A critical role for suppressor of cytokine signalling 3 in promoting M 1 macrophage activation and function in vitro and in vivo»,Immunology,vol.141,no1,,p.96–110(ISSN0019-2805et1365-2567,PMID24088176,PMCIDPMC3893853,DOI10.1111/imm.12173,lire en ligne,consulté le)
- (en)Stephen J.Jenkins,DominikRuckerl,Graham D.Thomaset James P.Hewitson,«IL-4 directly signals tissue-resident macrophages to proliferate beyond homeostatic levels controlled by CSF-1»,Journal of Experimental Medicine,vol.210,no11,,p.2477–2491(ISSN1540-9538et0022-1007,PMID24101381,PMCIDPMC3804948,DOI10.1084/jem.20121999,lire en ligne,consulté le)
- Martinez FO, Sica A, Mantovani A, Locati M. Macrophage activation and polarization.Front Biosci(2008)13:453–61. doi:10.2741/2692
- (en)MarieJaguin,NoémieHoulbert,OlivierFardelet ValérieLecureur,«Polarization profiles of human M-CSF-generated macrophages and comparison of M1-markers in classically activated macrophages from GM-CSF and M-CSF origin»,Cellular Immunology,vol.281,no1,,p.51–61(DOI10.1016/j.cellimm.2013.01.010,lire en ligne,consulté le)
- (en)Mário Henrique M.Barros,FranziskaHauck,Johannes H.Dreyeret BettinaKempkes,«Macrophage Polarisation: an Immunohistochemical Approach for Identifying M1 and M2 Macrophages»,PLoS ONE,vol.8,no11,,e80908(ISSN1932-6203,PMID24260507,PMCIDPMC3829941,DOI10.1371/journal.pone.0080908,lire en ligne,consulté le)
- (en)GeertRaes,LeaBrys,Bhola KDahalet JefBrandt,«Macrophage galactose-type C-type lectins as novel markers for alternatively activated macrophages elicited by parasitic infections and allergic airway inflammation»,Journal of Leukocyte Biology,vol.77,no3,,p.321–327(ISSN0741-5400et1938-3673,DOI10.1189/jlb.0304212,lire en ligne,consulté le)
- (en)RuiTang,GuiZhanget Shi-YouChen,«Response Gene to Complement 32 Protein Promotes Macrophage Phagocytosis via Activation of Protein Kinase C Pathway»,Journal of Biological Chemistry,vol.289,no33,,p.22715–22722(PMID24973210,PMCIDPMC4132778,DOI10.1074/jbc.M114.566653,lire en ligne,consulté le)
- (en)PengZhao,DaiqingGao,QingjieWanget BingfengSong,«Response gene to complement 32 (RGC-32) expression on M2-polarized and tumor-associated macrophages is M-CSF-dependent and enhanced by tumor-derived IL-4»,Cellular & Molecular Immunology,vol.12,no6,,p.692–699(ISSN1672-7681et2042-0226,PMID25418473,PMCIDPMC4716617,DOI10.1038/cmi.2014.108,lire en ligne,consulté le)
- GuillermoArango Duqueet AlbertDescoteaux,«Macrophage Cytokines: Involvement in Immunity and Infectious Diseases»,Frontiers in Immunology,vol.5,(ISSN1664-3224,PMID25339958,PMCIDPMC4188125,DOI10.3389/fimmu.2014.00491,lire en ligne,consulté le)
- Beutler BA. The role of tumor necrosis factor in health and disease.J Rheumatol Suppl(1999)57:16–21.
- Carswell EA, Old LJ, Kassel RL, Green S, Fiore N, Williamson B. An endotoxin-induced serum factor that causes necrosis of tumors.Proc Natl Acad Sci U S A(1975)72(9):3666–70. doi:10.1073/pnas.72.9.3666
- Griffin GK, Newton G, Tarrio ML, Bu D-X, Maganto-Garcia E, Azcutia V, et al. IL-17 and TNF-α sustain neutrophil recruitment during inflammation through synergistic effects on endothelial activation.J Immunol(2012)188(12):6287–99. doi:10.4049/jimmunol.1200385
- Vieira SM, Lemos HP, Grespan R, Napimoga MH, Dal-Secco D, Freitas A, et al. A crucial role for TNF-α in mediating neutrophil influx induced by endogenously generated or exogenous chemokines, KC/CXCL1 and LIX/CXCL5.Br J Pharmacol(2009)158(3):779–89. doi:10.1111/j.1476-5381.2009.0036
- Ben-Sasson SZ, Hu-Li J, Quiel J, Cauchetaux S, Ratner M, Shapira I, et al. IL-1 acts directly on CD4 T cells to enhance their antigen-driven expansion and differentiation.Proc Natl Acad Sci U S A(2009)106(17):7119–24. doi:10.1073/pnas.0902745106
- Carmi Y, Voronov E, Dotan S, Lahat N, Rahat MA, Fogel M, et al. The role of macrophage-derived IL-1 in induction and maintenance of angiogenesis.J Immunol(2009)183(7):4705–14. doi:10.4049/jimmunol.0901511
- Yazdi AS, Guarda G, Riteau N, Drexler SK, Tardivel A, Couillin I, et al. Nanoparticles activate the NLR pyrin domain containing 3 (Nlrp3) inflammasome and cause pulmonary inflammation through release of IL-1alpha and IL-1beta.Proc Natl Acad Sci U S A(2010)107(45):19449–54. doi:10.1073/pnas.1008155107
- Chen CJ, Kono H, Golenbock D, Reed G, Akira S, Rock KL. Identification of a key pathway required for the sterile inflammatory response triggered by dying cells.Nat Med(2007)13(7):851–6. doi:10.1038/nm1603
- Wang KS, Frank DA, Ritz J. Interleukin-2 enhances the response of natural killer cells to interleukin-12 through up-regulation of the interleukin-12 receptor and STAT4.Blood(2000)95(10):3183–90.
- (en)SilviaGatti,JenniferBeck,GiamilaFantuzziet TamasBartfai,«Effect of interleukin-18 on mouse core body temperature»,American Journal of Physiology-Regulatory, Integrative and Comparative Physiology,vol.282,no3,,R702–R709(ISSN0363-6119et1522-1490,DOI10.1152/ajpregu.00393.2001,lire en ligne,consulté le)
- (en)Andrew L.Croxford,PaulinaKuliget BurkhardBecher,«IL-12-and IL-23 in health and disease»,Cytokine & Growth Factor Reviews,vol.25,no4,,p.415–421(DOI10.1016/j.cytogfr.2014.07.017,lire en ligne,consulté le)
- (en)SergeVanden Eijnden,StanislasGoriely,DominiqueDe Witet FabienneWillems,«IL‐23 up‐regulates IL‐10 and induces IL‐17 synthesis by polyclonally activated naive T cells in human»,European Journal of Immunology,vol.35,no2,,p.469–475(ISSN0014-2980et1521-4141,DOI10.1002/eji.200425677,lire en ligne,consulté le)
- (en)Jason SStumhofer,ArianLaurence,Emma HWilsonet ElaineHuang,«Interleukin 27 negatively regulates the development of interleukin 17–producing T helper cells during chronic inflammation of the central nervous system»,Nature Immunology,vol.7,no9,,p.937–945(ISSN1529-2908et1529-2916,DOI10.1038/ni1376,lire en ligne,consulté le)
- Fiorentino DF, Zlotnik A, Mosmann TR, Howard M, O’Garra A. IL-10 inhibits cytokine production by activated macrophages.J Immunol(1991)147(11):3815–22.
- Chadban SJ, Tesch GH, Foti R, Lan HY, Atkins RC, Nikolic-Paterson DJ. Interleukin-10 differentially modulates MHC class II expression by mesangial cells and macrophagesin vitroandin vivo.Immunology(1998)94(1):72–8. doi:10.1046/j.1365-2567.1998.00487.x
- Defrance T, Vanbervliet B, Briere F, Durand I, Rousset F, Banchereau J. Interleukin 10 and transforming growth factor beta cooperate to induce anti-CD40-activated naive human B cells to secrete immunoglobulin A.J Exp Med(1992)175(3):671–82. doi:10.1084/jem.175.3.671
- Rousset F, Garcia E, Defrance T, Peronne C, Vezzio N, Hsu DH, et al. Interleukin 10 is a potent growth and differentiation factor for activated human B lymphocytes.Proc Natl Acad Sci U S A(1992)89(5):1890–3. doi:10.1073/pnas.89.5.1890
- Oswald IP, Wynn TA, Sher A, James SL. Interleukin 10 inhibits macrophage microbicidal activity by blocking the endogenous production of tumor necrosis factor alpha required as a costimulatory factor for interferon gamma-induced activation.Proc Natl Acad Sci U S A(1992)89(18):8676–80. doi:10.1073/pnas.89.18.8676
- Cunha FQ, Moncada S, Liew FY. Interleukin-10 (IL-10) inhibits the induction of nitric oxide synthase by interferon-gamma in murine macrophages.Biochem Biophys Res Commun(1992)182(3):1155–9. doi:10.1016/0006-291X(92)91852-H
- Comerford I, McColl SR. Mini-review series: focus on chemokines.Immunol Cell Biol(2011)89(2):183–4. doi:10.1038/icb.2010.164
- Rosenblum JM, Shimoda N, Schenk AD, Zhang H, Kish DD, Keslar K, et al. CXC chemokine ligand (CXCL) 9 and CXCL10 are antagonistic costimulation molecules during the priming of alloreactive T cell effectors.J Immunol(2010)184(7):3450–60. doi:10.4049/jimmunol.0903831
- Keeley EC, Mehrad B, Strieter RM. Chemokines as mediators of neovascularization.Arterioscler Thromb Vasc Biol(2008)28(11):1928–36. doi:10.1161/ATVBAHA.108.162925
- Dufour JH, Dziejman M, Liu MT, Leung JH, Lane TE, Luster AD. IFN-gamma-inducible protein 10 (IP-10; CXCL10)-deficient mice reveal a role for IP-10 in effector T cell generation and trafficking.J Immunol(2002)168(7):3195–204. doi:10.4049/jimmunol.168.7.3195
- Nathan C, Cunningham-Bussel A. Beyond Oxidative Stress: An Immunologist’s Guide to Reactive Oxygen Species.Nat Rev Immunol(2013) 13:349–61. doi: 10.1038/nri3423
- Sies H, Jones DP. Reactive Oxygen Species (ROS) as Pleiotropic Physiological Signalling Agents.Nat Rev Mol Cell Biol(2020) 21:363–83. doi: 10.1038/s41580-020-0230-3
- Di Meglio P, Perera GK, Nestle FO (2011) The multitasking organ: recent insights into skin immune function.Immunity35: 857–869. doi: 10.1016/j.immuni.2011.12.003.
- Castellana D, Paus R, Perez-Moreno M (2014),Macrophages Contribute to the Cyclic Activation of Adult Hair Follicle Stem Cells;PLoS Biol 12(12): e1002002. doi:10.1371/journal.pbio.1002002 (article publiée souslicence ouverte CC BY 4.0.
- Gurtner GC, Werner S, Barrandon Y, Longaker MT (2008) Wound repair and regeneration.Nature453: 314–321. doi: 10.1038/nature07039.
- Coussens LM, Werb Z (2002) Inflammation and cancer.Nature420: 860–867. doi: 10.1038/nature01322.
- Gay D, Kwon O, Zhang Z, Spata M, Plikus MV, et al. (2013) Fgf9 from dermal gammadelta T cells induces hair follicle neogenesis after wounding.Nat Med19: 916–923. doi: 10.1038/nm.3181.
- (en)SivaDallavalasa,Narasimha M.Beeraka,Chaithanya G.Basavarajuet SubbaRao V.Tulimilli,«The Role of Tumor Associated Macrophages (TAMs) in Cancer Progression, Chemoresistance, Angiogenesis and Metastasis - Current Status»,Current Medicinal Chemistry,vol.28,no39,,p.8203–8236(DOI10.2174/0929867328666210720143721,lire en ligne,consulté le)
- Kerneur C, Cano CE, Olive D. Major pathways involved in macrophage polarization in cancer.Front Immunol(2022) 13:1026954/BIBTEX. doi: 10.3389/FIMMU.2022.1026954/BIBTEX
- (en)Bin-ZhiQianet Jeffrey W.Pollard,«Macrophage Diversity Enhances Tumor Progression and Metastasis»,Cell,vol.141,no1,,p.39–51(PMID20371344,PMCIDPMC4994190,DOI10.1016/j.cell.2010.03.014,lire en ligne,consulté le)
- (en)FrancesBalkwill,Kellie A.Charleset AlbertoMantovani,«Smoldering and polarized inflammation in the initiation and promotion of malignant disease»,Cancer Cell,vol.7,no3,,p.211–217(DOI10.1016/j.ccr.2005.02.013,lire en ligne,consulté le)
- Fidler IJ. Inhibition of pulmonary metastasis by intravenous injection of specifically activated macrophages.Cancer Res(1974) 34:1074–8.
- Alexander P, Evans R. Endotoxin and double stranded RNA render macrophages cytotoxic.Nat New Biol(1971) 232:76–8. doi: 10.1038/NEWBIO232076A0
