Maladie de Parkinson
| Symptômes | Tremblement,spasticité,hypokinésieetanomalie de la démarche |
|---|
| Traitement | Médicament,chirurgieet Hyperbaric oxygen therapy(d) |
|---|---|
| Médicament | Cabergoline,DOPA,pramipexole,entacapone,bipéridène,(S)-(−)-carbidopa monohydrate(d),pergolide(en),(±)-sélégiline(d),Tolcapone,bromocriptine,trihexyphénidyle,ropinirole,amantadine,pimavansérine,apomorphine,rasagiline,safinamide(en),droxidopa(en),zonisamide,rotigotine,co-careldopa(en),rivastigmine,clozapine,rivastigmine,pimavansérine,budipine,rotigotine,piribédil(en),DOPA,amantadine,entacaponeettrihexyphénidyle |
| Spécialité | Neurologie |
| CISP-2 | N87 |
|---|---|
| CIM-11 | 8A00.0 |
| CIM-10 | G20,F02.3 |
| CIM-9 | 332 |
| OMIM | 168600556500 |
| DiseasesDB | 9651 |
| MedlinePlus | 000755 |
| eMedicine | 1831191 |
| MeSH | D010300 |
| GeneReviews | Parkinson Disease Overview |
Lamaladie de Parkinson(abrégée « Parkinson », ou MP) porte le nom deJames Parkinson,un médecin anglais ayant publié la première description détaillée de celle-ci dansAn Essay on the Shaking Palsyen 1817. C'est unemaladie neurodégénérativeirréversible d'évolution lente. Caractérisée par une perte progressive deneurones dopaminergiques,cettemaladie chroniqueaffecte lesystème nerveux central(SNC) et provoque des troubles progressifs d'ordremoteurs,cognitifsetcomportementaux.La « Triade parkinsonienne » regroupe les trois principaux symptômes moteurs de la maladie:akinésie,rigidité plastiqueettremblementsde repos[1].C'est le second trouble neurodégénératif le plus fréquent après lamaladie d'Alzheimer[2],[3].Ladémenceassociée à la maladie de Parkinson est plus courante dans les stades avancés de la maladie.
Ses causes sont encore mal connues, mais on estime qu'une combinaison entre facteursgénétiquesetenvironnementauxjoue un rôle[4].Letableau cliniqueest majoritairement la conséquence de la perte deneuronesdulocus niger(ou « substance noire ») et d'une atteinte desfaisceaux nigrostriés(en).La maladie débute habituellement entre 45 et 70 ans et 1 % des personnes de plus de 60 ans en sont atteintes[5],[6].La maladie de Parkinson se distingue dessyndromes parkinsoniensqui sont généralement d'origines diverses, plus sévères et répondent peu aux traitements.
Aucun remède à la maladie de Parkinson n'est connu, son traitement estsymptomatique[7],[5].Les traitements de première intention sont l'administration de levodopa (L-DOPA), les inhibiteurs demonoamine oxydaseB (MAO-B) et lesagonistes dopaminergiques[8].Ces traitements médicamenteux perdent en efficacité avec la progression de la pathologie et produisent deseffets secondairesdont des mouvements involontaires[9]et des désordres comportementaux[10].D'autres formes de prises en charge (kinésithérapie,orthophonie,etc.) ont montré leur efficacité. En France, les agriculteurs ayant manipulé despesticidespendant au moins 10 ans sont susceptibles d'être pris en charge à 100 % et d'être indemnisés[11].
Physiopathologie et anatomopathologie
[modifier|modifier le code]

Laphysiopathologiede la maladie a été récemment éclairée par la découverte de nombreuxgènesimpliqués dans des formes rares de la maladie. La maladie de Parkinson n'est pas liée à lamaladie d'Alzheimer[12].Dans la maladie de Parkinson, un déficit dedopamineapparaît dans certaines structures du cerveau et notamment de lasubstance noire.La substance noire est un noyau dumésencéphaleémettant une grande partie de ladopaminevers le reste du cerveau. La dopamine est unneurotransmetteurappartenant auxmonoamineset plus précisément auxcatécholamines[13].Elle sert de messager chimique entre deux neurones, synthétisée dans une terminaisonaxonalepuis libérée dans lafente synaptiqueen réponse à uninflux nerveux.Elle effectue son action de manièremétabotropiqueau sein dusystème dopaminergiquevia lesrécepteurs dopaminergiques,ces derniers pouvant appartenir à deux grandes familles dites « famille D1» ou bien « famille D2».
Les altérations cérébrales dues à la maladie de Parkinson ne se limitent pas seulement à la sphèredopaminergique;de nombreux systèmes deneurotransmetteurs(sérotoninergiques,cholinergiques,glutamatergiques,adénosinergiques,noradrénergiques[12]ou encoreadrénergiques) sont également atteints. Le dérèglement dusystème dopaminergiquepar dégénérescence desneurones dopaminergiquesdans lapars compactadulocus nigerest néanmoins caractéristique de cette maladie; c'est elle qui induit les principaux symptômes de la maladie de Parkinson[2].
Les processus biologiques suspectés d'entraîner la perte neuronale sont multiples: dysfonctionnementmitochondrial,apoptose,accumulation deprotéinesneurotoxiquesetstress oxydantaffectant la réparation de l'ADNneuronal lors de stressphysicochimiquesdu neurone; l'hyperactivation inappropriée de laprotéine Cdk5(kinase cycline-dépendante 5(en)) normalement présente dans les neurones, supprime l'enzymeAPE1 (voirEndonucléase) nécessaire à la réparation de l'ADN, ce qui peut conduire à la destruction de neurones. En 2003, il a été montré que la voie Cdk5-APE1 était perturbée chez des patients victimes de la maladie de Parkinson ou d'Alzheimer[14],[15],[16].De même, une protéine mal conformée, l'α-synucléine,s'accumule anormalement dans lescorps de Lewyet lesneurites[2].Selon certains auteurs cette protéine aurait un comportement infectieux de typeprion[17].
Stades de Braak pour la maladie de Parkinson sporadique
[modifier|modifier le code]
En 2003, Braak et collègues ont publié un modèle portant sur l'évolution de l'anatomopathologieet de la symptomatologie de la maladie de Parkinson sporadique[18].Ce modèle est issu de l'étude rétrospective de cas diagnostiqués (de manière incidente ou clinique) de la maladie de Parkinson et au travers de l'observation d'épaisses sections provenant de nombreuses régions cérébrales. Ce fût le premier modèle à inclure lebulbe olfactifau sein d'un modèle de l'évolution de la maladie de Parkinson. Ce modèle influent pour laneurologiea permis d'ouvrir des pistes de recherche sur la maladie de Parkinson prodromale, sur l'identification des personnes à risque de la développer, ainsi que sur sesbiomarqueurspotentiels utilisable au cours des phases précoces[19].
Une hypothèse de ce modèle est que la forme sporadique démarre par l'intrusion d'un agent extérieur au sein du corps humain, son entrée se faisant soit par lesystème respiratoire(le nez) soit par letractus digestif.Cetagent pathogènearriverait ensuite ausystème nerveux centralet serait à la base de la formation descorps de Lewy.La présence de ces inclusions au sein dusystème nerveux périphériqueet notammententériqueest utilisé comme argument pour supporter cette hypothèse. Les auteurs supposent également que la maladie démarre au sein dusystème nerveux entériqueet n'atteint lesystème nerveux centralqu'au travers dunerf vague[20].De plus, la pathologie cérébrale démarrerait au sein des noyaux moteurs dorsaux IX/X desnerfs vagueetglossopharyngien.Le découpage de l'évolution de la maladie se fait ici en six grandes périodes appelées stades, chacun se rapportant à des structures neuronales ainsi que des symptômes spécifiques qui n'étaient respectivement pas atteintes ni présents au cours des stades précédents. Dans cette étude, lecortex cérébralne comporte jamais d'inclusions de Lewy à moins qu'il n'y ait de lésions de lamoelle spinale.En termes de symptomatologie, le type et la sévérité des symptômes sont liés à la progression au travers de ces différents stades[21].Les stades les plus précoces se caractérisent par des symptômes non moteurs tels que laconstipationet la perte progressive de l'odorat.Les symptômes moteurs ne prennent part qu'à partir de la moitié de l'évolution (c'est-à-dire au cours des stades 3 et 4)[22].Enfin, Braak et collaborateurs notent que les corps de Lewy sont typiquement localisés au sein de dépôts delipofuscineou de granules deneuromélanine.
Stade 1
[modifier|modifier le code]
Le stade 1 se caractérise par une implication plus ou moins limitée à lamoelle allongée(medulla oblongata). La maladie démarre au sein des structures inférieures de lamoelle spinaleet dusystème olfactif.En particulier, le noyau moteur dorsal dunerf vaguede la moelle allongée et dunoyau olfactif antérieursont affectés[22].Les «neuritesde Lewy », qui sont des agrégats d'α-synucléine filiformes, sont plusprévalentsque les corps de Lewy globulaires à ce stade[18].
Stade 2
[modifier|modifier le code]
Tout comme le stade 1, le stade 2 se caractérise par une implication plus ou moins confinée aux territoires de lamoelle allongée.En plus des atteintes observées au cours du premier stade, le stade 2 se caractérise par des lésions des noyaux duraphédu noyau réticulaire gigantocellulaire de la moelle allongée[22],[18].La maladie évolue alors jusqu'à lamoelle spinale,traversant des structures médullaires aulocus coerelusdans letegmentumpontique. De la même manière qu'au premier stade, les neurites de Lewy surpassent en nombre les inclusions à corps de Lewy[18].Ces premières lésions des stades 1 et 2 sont dites non répondantes auxagonistes dopaminergiquescar elles n'ont pas encore trait à lasubstance noire[19].Une caractéristique clé de ce stade est l'apparition d'inclusions de Lewy dans les neurones de projection chargés enlipofuscinedesnoyaux caudauxduraphéet de la formation réticulaire. Les neurones de projection du complexe coerelus/sous-coerelus sont les premiers neurones chargés enneuromélaninedu cerveau à développer des inclusions de Lewy[18].
Stade 3
[modifier|modifier le code]Le stade 3 se définit par une atteinte principalement limitée autronc cérébralinférieur et supérieur en l'absence de lésions corticales. Au commencement du stade 3, la maladie a commencé à émerger au sein de mélanoneurones de lasubstance noireet des inclusions decorps de Lewycommencent à se former dans lapars compactade la substance noire[22],[18].Les neurones chargés en neuromélanine développent typiquement des corps de Lewy à l'intérieur de leurs accumulations de neuromélanine, et on observe souvent l'apparition d'un groupe de petits corps de Lewy dans un seulpérikaryon.Au cours de la deuxième moitié de ce stade, il y a progression des lésions dans lenoyau de Meynertqui est un noyau duprosencéphalebasal riche en neuronescholinergiques[22].Plus généralement, les neurones chargés enlipofuscinede noyaux magnocellulaires duprosencéphale basalcommencent à être impliqués. Les structures affectées au cours des stades 1 et 2 commencent à développer plus decorps de Lewy[18].
Stade 4
[modifier|modifier le code]Le stade 4 se définit toujours par une atteinte principalement limitée autronc cérébralinférieur et supérieur. Toutefois, à la différence du stade 3, on y observe les premières affections ducortexviale mésocortex temporal antéromédial. Le stade 4 se caractérise par une destruction sévère desneurones dopaminergiquesde lapars compacta.Les neurones chargés enneuromélaninedes noyaux vulnérables de la substance noire sont alors considérablement atteints. Il existe également une implication de l'allocortex,mais lenéocortexn'est pas affecté au cours de ce stade. En particulier, on peut observer la pathologie au sein de l'amygdaleet des noyaux duthalamus.Des dommages significatifs sont causés auxnoyaux olfactifs antérieurset on observe une très nette implication des noyaux magnocellulaires duprosencéphale basal[22],[18].
Stade 5
[modifier|modifier le code]Le stade 5 est caractérisé par une implication sévère du cerveau, y compris des airesnéocorticales.En effet, au cours du cinquième stade, la maladie a commencé à envahir le néocortex et s'étend dans les structures temporales, pariétales ainsi que dans leslobes frontaux[22].Le point de départ de l'atteinte néocorticale est lemésocortex temporal antéromédial[Quoi?].De là, les inclusions atteignent les aires d'association sensorielles dunéocortex,les champs insulaires granulaires et agranulaires, lecortex cingulaireantérieur et les aires préfrontales. Lamort cellulairepeut être observée dans la substance noire, le noyau dorsal dunerf vague,le noyau réticulaire gigantocellulaire et dans lelocus coerelus[18].Les parties vulnérables de la substance noire deviennent pratiquement dénuées de neurones chargés enneuromélanine,elles deviennent donc pâles en microscopie optique. Le nombre d'inclusions de Lewy décroît tandis que les agrégations extracellulaires en neuromélanine augmentent. Les aires d'association sensorielles de premier ordre, les aires prémotrices ainsi que les motrices et sensorielles de premier ordre sont encore dépourvues d'inclusions de Lewy à ce stade.
Stade 6
[modifier|modifier le code]Tout comme le stade 5, le stade 6 est caractérisé par une implication sévère du cerveau, y compris des aires néocorticales. Le stade 6 est le dernier stade décrit par Braaket al.La maladie a alors totalement envahi lenéocortexaffectant les aires sensorielles et motrices corticales. La sévérité de la maladie est à son paroxysme[22],[18].
Physiopathologie des ganglions de la base
[modifier|modifier le code]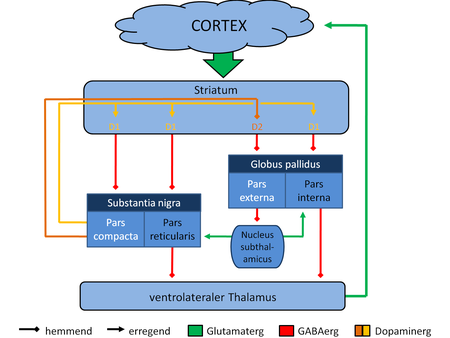
Le modèle de Delong (1990)[23]vise à expliquer les désordres moteurs prenant leur origine dans lesganglions de la base(GB). Il constitue une première approche pour expliquer les symptômes d'akinésieet dedyskinésiedes syndromes parkinsoniens, ces derniers apparaissant alors par une rupture d'équilibre entre les informations en provenance de la voie directe et celles en provenance de la voie indirecte desganglions de la base.En situation physiologique, les neuronesdopaminergiquesde lasubstance noireont un effet excitateur sur la voie directe des GB et inhibiteur sur leur voie indirecte. En situation de maladie de Parkinson, il y aurait en revanche affaiblissement de la voie directe et renforcement de la voie indirecte.
Pour ce modèle, il existe un circuit fermé composé de plusieurs aires motrices corticales (dont l'aire motrice supplémentaire et certaines parties ducortex prémoteuret ducortex moteur), duputamen(entrée des GB recevant des projections depuis les aires motrices), de la part motrice duglobus pallidusinterne (GPi) et de lapars reticulatade lasubstance noire(ces deux dernières recevant des projections duputamenet sont considérées comme sortie des GB), de parties duglobus pallidusexterne (GPe) et des noyaux subthalamiques (STN), et des parties duthalamusventrolatéral (qui reçoit des projections des parts motrices du GPi et de la SNr et se projette en retour sur les champs moteurs précentraux).
Cette boucle motrice serait notamment constituée d'une voie directe, comprenant le putamen et ses projectionsGABAergiquessur les parties motrices du GPi et de la SNr; ainsi que d'une voie indirecte comprenant le putamen et ses projections GABAergiques médiées par les sorties desganglions de la basede manière indirecte, c'est-à-dire au travers d'une séquence de connexions impliquant le GPe et le STN. Dans ce cadre, une augmentation de l'activité de la voie indirecte est susceptible de mener à unehypokinésie,voire à uneakinésietotale, par augmentation de l'inhibition pallidothalamique. Des études menées sur le singe lésés par injection deMPTP(uneneurotoxinedétruisant spécifiquement lesneurones dopaminergiquesde la SN[24]) affichent que ceux-ci ont une activité neuronale tonique troublées dans les deux sections duglobus pallidus[25].On observe chez eux une augmentation de l'activité neurale tonique au sein du GPi, tandis que dans le GPe les décharges toniques diminuent. Cette fluctuation de l'activité tonique représenterait une baisse de la sélectivité des informations au sein du circuit[24].De plus, après injection, on observe également qu'au sein du GPi plus de neurones ont une activité neuronale phasique pour les mouvements volontaires ainsi que pour les stimulationsproprioceptives[26].
Pessiglione et collègues ont mis en place une expérience d'apprentissage procédural chez le singe au cours de laquelle les singes non pathologiques entraînés montrent être capables d'initier un programme moteur dès la vision d'un obstacle. En revanche, les singesMPTP(ici caractérisés de préparkinsoniens) sont incapables de sélectionner des actions adaptées à ce contexte d'obstacle: leurs mouvements sont ralentis et guidés en-ligne par contrôle oculaire de l'action. De plus, ils auraient une difficulté à effectuer plusieurs actions en parallèle, avec séquençage des activités, ce qui se décrit aussi sous le terme defreezing.Ce phénomène defreezinget d'hésitations est amplifié lors de l'intervention des processus cognitifs, signifiant de ce fait que ces symptômes ne sont pas uniquement moteurs[27].À l'inverse, lefreezingest diminué lorsque la motivation à effectuer l'action dirigée vers le but augmente, en faveur d'une préservation des processus motivationnels, ceux-ci étant dès lors capable de compenser, au moins en partie, les troubles exécutifs[28].Chez le patient parkinsonien, des résultats similaires ont été obtenus et lastimulation cérébrale profondedu STN seule (donc sans association à lalevodopa) ne corrige pas l'exécution motrice en situation de prise de décision sous incertitude tandis que l'administration de L-DOPA corrige ces symptômes[29].
Ainsi, le syndrome parkinsonien ne se caractériserait pas par une perte de correction en-ligne des mouvements, mais bien plus par une perte de la capacité à sélectionner des schémas moteurs pertinents et adaptés au contexte[27],[30],[31].Les neurones des GB recevraient et transmettraient ainsi plus d'informations au cours d'un syndrome parkinsonien, mais ces informations seraient moins spécifiques et cette perte de la spécificité engendrerait un défaut dans la détection corticale des priorités motrices, laissant le patient parkinsonien dans un état de confusion. Ce dernier aurait, par ce mécanisme, du mal à sélectionner, initier et exécuter les mouvements, tandis que sarigiditéproviendrait en partie de la sélection concomitante de schémas moteurs antagonistes[24].
Selon le modèle d'Alexander, DeLong et Strick (1986)[32],les GB sont découpés en territoires fonctionnels distincts et notamment sensorimoteurs (circuits moteur etoculomoteur), associatif (circuits préfrontal dorsolatéral et orbitofrontal latéral) etlimbique(circuit cingulaire antérieur). Ce deuxième modèle est couramment utilisé pour expliquer l'apparition de symptômes moins spécifiques à la maladie de Parkinson tels que ladépression,l'apathie,lestroubles anxieuxainsi que l'anticipation aversive. En effet, chez les patients parkinsoniens, on observe que les patients souffrant de dépression ont moins de projections dopaminergiques et noradrénergiques au sein duloecus coerelusainsi que dans plusieurs régions dusystème limbique(cortex cingulaire antérieur,thalamus,amygdaleetstriatumventral)[33].De même, le niveau d'apathie des patients parkinsoniens semble corréler à ladénervationsérotoninergique du striatum ventral[34]et dunoyau caudé,intervenant dans les circuits motivationnels[35].
Causes et facteurs de risque
[modifier|modifier le code]La maladie est caractérisée par l'agrégation enstructures amyloïdesde protéines du SNC, lesα-synucléines,à la suite demauvais repliements.Ces α-synucléines s'associent enfibrillespuis forment descorps de Lewydéplaçant lesorganitesintracellulaires au sein des neurones. L'α-synucléine forme desprotéinespouvant se comporter comme unprionet dont on soupçonne un rôle dans l'origine de la maladie de Parkinson[36].Toutefois, les causes originelles, processus ou facteurs de risque de cette maladie sont encore mal connus[37].La maladie de Parkinson est une maladieidiopathiqueaux causes multiples qui entraînent la mort des neurones. Ils pourraient être la conséquence de l'interaction entre uneprédisposition génétique(surtout chez des sujets de moins de 50 ans[38]) et des cofacteurs environnementaux. Depuis de nombreuses années, des facteurs causaux tels que les agents toxiques environnementaux, lesmétaux lourdset lespesticidessont suspectés[12].Le premier facteur de risque reste avant tout l'âgemême s'il y a des patients jeunes pour les formes génétiques de la maladie, ce qui fait de la maladie de Parkinson une maladie duvieillissement[39].En France, depuis 2012, la maladie de Parkinson est reconnuemaladie professionnellepar lamutualité sociale agricole[40],[41].Lesagriculteursayant manipulé despesticidespendant au moins10 anssont susceptibles d'être pris en charge à 100 % et d'être indemnisés[11].
Facteurs de risque génétiques
[modifier|modifier le code]Une petite partie des malades de Parkinson, environ 15 %, ont des formes génétiques de la maladie[12].De plus, environ 15 % des personnes ayant la maladie de Parkinson ont un proche atteint[7].Au moins 5 % des patients sont reconnus comme ayant une forme de la maladie liée à unemutation de gènesspécifiques[42].Plusieursgènesactifs ont été identifiés dans des familles de parkinsoniens:
- des mutations du gèneLRRK-2(leucine-rich repeatkinase2): la découverte du gène LRRK2 qui code la dardarine, a révolutionné la génétique de la maladie de Parkinson puisqu’une seule mutation, G2019S, explique à elle seule une proportion importante des formesautosomiquesdominantes et des formes communesidiopathiquesde la maladie de Parkinson, dans certains sous-groupes de patients parkinsoniens. La fréquence de la mutation G2019S varie considérablement selon l’origine géographique et ethnique des populations étudiées. Très rare enAsie(<0,1 %) et enAfrique sub-saharienne,elle peut atteindre 40 % enAfrique du Norddans les formes familiales et sporadiques de la maladie de Parkinson. La mutation G2019S joue aussi un rôle important chez les patients d’originejuiveashkénazeetsépharade(10-15 % des cas isolés), et dans une moindre mesure chez les patients originaires de lapéninsule Ibérique(3-6 % des cas isolés). Elle est très rare enEurope du Nord.La plupart des patients d'Afrique du Nord,Juifs et Européens partagent le mêmehaplotypeindiquant l’existence d’un effet fondateur unique[43],[44];
- l'atteinte d'autresgènesa été décrite mais est sensiblement plus rare (c'est le cas, en particulier, des mutations sur le gènePINK1,PRKN,SNCA...);
- le gènePyridoxal kinasepourrait être concerné[45],[46].
Inflammation intestinale
[modifier|modifier le code]Les protéines d'α-synucléine,présentes dans lesystème nerveux central(SNC) et notamment lebulbe olfactif,se retrouvent aussi dans lesystème nerveux entérique.En 2003, se basant sur les mécanismes de transmission duprion,Braaket al.posent comme hypothèse que lamaladie à corps de Lewy(qui est une maladie proche mettant en jeu les mêmes agrégationsamyloïdesd'α-synucléines) serait due à un pathogèneneurotoxiqueà l'origine d'une atteinte initiale des structures nerveuses entériques déclenchantin situune agrégation de l’α-synucléine. Ils postulent que la diffusion se ferait ensuite partransport axonalrétrograde et par voie trans-synaptiquejusqu'auSNCvia lenerf vague[37].
En 2018, certaines preuves solides suggèrent qu'une inflammation intestinale pourrait être responsable de la maladie de Parkinson pour au moins une partie des patients. Les patients atteints de lamaladie de Crohnet derectocolite hémorragiqueont 28 % plus de risques de développer la maladie de Parkinson, suggérant des liens génétiques entre ces affections[28].Les protéines d'α-synucléine s'agglutinent et forment desfibrillesqui endommagent lesneurones.Les patients présentent ces fibrilles dans leur cerveau mais aussi dans leurintestin[47].Les α-synucléines pourraient transiter vers le cerveau au travers dunerf vague[28],[48].Les personnes ayant le nerf vague sectionné auraient ainsi moins de chances de développer la maladie de Parkinson[28].Lavagotomiesemble donc protectrice et pourrait diminuer l'incidence de la maladie par rapport à la population générale[49].Certains avancent l'hypothèse que la déconnexion de l'intestin du cerveau bloque le point d'entrée de l'α-synucléine[50].
La plupart des patients atteints de la maladie de Parkinson se plaignent deconstipationjusqu'à une dizaine d'années avant que d'autres symptômes n'apparaissent[51].Il est démontré que certains composants dumicrobiote intestinal,via la formation d'acides gras volatils,favorisent l'apparition de déficits moteurs médiés par l'α-synucléineet augmentent l'activité pro-inflammatoire de lamicroglie[52].Des chercheurs duCalifornia Institute of Technologyont mis en évidence un lien biologique entre lemicrobiote intestinalet la maladie de Parkinson chez la souris[53].
Facteurs de risque environnementaux
[modifier|modifier le code]LaMPTPest uneneurotoxinesynthétique utilisée pour étudier la maladie chez le singe[54].Elle provoque les symptômes permanents de la maladie de Parkinson en détruisant certainsneurones dopaminergiquesdans lasubstantia nigradu cerveau. Ce mode d'action a permis l'émergence de théories considérant que l'exposition à certaines toxines environnementales pourrait augmenter le risque de survenue d'une MP[3].

Exposition aux pesticides
[modifier|modifier le code]
L'exposition à certainspesticides,notammentorganophosphorésou à base de cuivre[56],augmenterait le risque de développer une maladie de Parkinson de près de 70 %: 5 % des personnes exposées aux pesticides risqueraient de développer la maladie contre 3 % pour la population générale[57].Cette maladie est effectivement plus fréquente enmilieu ruralqu'urbain. Un modèle animal confirme la responsabilité d'un pesticide, leroténone(agissant comme inhibiteur de l'activitémitochondriale), dans la constitution d'un syndrome parkinsonien incluant bradykinésie, instabilité posturale, démarche chancelante et tremblements[58].Lesorganochlorés— interdits dans les pays développés, mais persistants dans l'environnement — seraient les premiers responsables (risque jusqu'à 2,4 fois plus élevé que la normale). Le risque est multiplié par trois si certains pesticides sont associés[59].Le risque pourrait doubler en cas d'exposition à certainspesticides,tels que laroténone(un pesticide utilisé même enAgriculture biologiquejusqu'en 2011) ou leparaquat(interdit dans l'UE), etherbicides,tel que l'agent orange[3],[60],[55].Les pesticides augmentant le risque de maladie de Parkinson comportent le roténone, leparaquat,lecarbamate,l'organochlorine(composant duDDT), lepyréthroideou encore l'heptachlore[27].Une étude sur l'agent orange a mis en évidence que certains facteurs d'exposition indirecte aux pesticides, par exemple la vie en milieu rural, augmentaient également le risque[55].
En France, laSécurité socialea reconnu en 2006 un cas de maladie de Parkinson commemaladie professionnellepour un ancien salarié agricole[61].Depuis le,le lien entre la maladie de Parkinson et les pesticides est officiellement reconnu par l'État français avec l'entrée en vigueur du décretno2012-665[62],[63],[64].Elle est également reconnue comme telle en cas d’exposition aubioxyde de manganèse[65].
Exposition aux solvants
[modifier|modifier le code]L'exposition à certainssolvantsconstitue un facteur de risque de développer une maladie de Parkinson[66].La sévérité de la maladie est directement corrélée au degré d'exposition auxsolvants organiques[67].Un lien significatif entre l’exposition autrichloréthylèneet autétrachlorométhaneavec le risque de survenue de la maladie de Parkinson est établi[68].En 2023, une étude portant sur unecohortede 340 489 vétérans ducorps américain des Marines,dont une moitié avait consommé de l'eau contaminée par dutrichloréthylèneet d'autrescomposés organiquesvolatils et l'autre non, montre que laprévalencede la maladie de Parkinson est chez les premiers supérieure de 70 % à celle des seconds[69],[70].
Autres produits chimiques
[modifier|modifier le code]L’Autorité européenne de sécurité alimentaire (EFSA) a identifié différents produits chimiques associés très probablement à l’apparition de la maladie de Parkinson[27]:
- Méthyl-4-phényl-1,2,3,6-tétrahydropyridine (MPTP);
- 6-hydroxydopamine(6-OHDA);
- Manganèse(voir aussiManganèse (maladie professionnelle));
- Amphétamine;
- Isoquinoline;
- Organophosphate;
- 1-trichloromethyl-1,2,3,4-tétrahydrobétacarboline;
- Carbolinium;
- Particules de lapollution atmosphérique;
- Polychlorobiphényle(PCB);
- Fungal;
- Halopéridol(antipsychotique).
Autres facteurs environnementaux
[modifier|modifier le code]L'exposition auxradiations ionisantesest suspectée d'être un facteur de risque[71].L'exposition à des métaux (éléments-traces métalliquestels que l'aluminiumou lesmétaux lourds), via une accumulation de ces métaux dans lasubstantia nigra,a été fortement suspectée dans lesannées 1970,mais les études n'ont pas pu confirmer de lien de cause à effet[3]et sont actuellement remises en cause; et la maladie est dans ce cadre perçue comme sporadique sauf pour une proportion minoritaire[72].Lestraumatismes crâniensont été associés à la maladie de Parkinson mais ne constituent pas unfacteur de risqueprouvé, l'augmentation des admissions de malades parkinsoniens en hôpital pour traumatismes crâniens semblant une conséquence de l'évolution des troubles moteurs liés à la maladie, et non une cause[73].L'utilisation dans l'alimentation et la médecine traditionnelle, notamment dans lesAntilles françaises,d'annonacineextraite ducorossolest responsable de l'apparition de syndromes parkinsoniens atypiques (notamment deparalysie supranucléaireprogressive) à des fréquences anormalement élevées[74].
H. pyloripourrait contribuer à la survenue de la maladie de Parkinson[75];l'éradication d'Helicobacter pyloriaméliorerait les résultats du traitement parlévodopa[76].Deux bactéries dumicrobiote intestinal(Enterococcus faecalisetEggerthella lenta) dégradent l’essentiel de laLévodopa(L-dopa):E faecalistransforme le médicament en dopamine dans l’intestin, même en présence duCarbidopa(composé censé inhiber la réaction de transformation dans l’intestin); jusqu'à 56% de la L-dopa ne parvient jamais au cerveau, avec des variations selon les patients[77].Le gène et les enzymes bactériens responsables de cettebiodégradationdu médicament sont identifiés[77].Ainsi, une nouvelle molécule (AFMT) 1 000 fois plus efficace (in vitro) que le carbidopa a aussi pu être conçue. Après queE. faecalisa converti le médicament endopamine,l'autre bactérie (E lenta) transforme cette dopamine en méta-tyraminequi semble responsable d'effets toxiques (troubles gastro-intestinaux graves etarythmiescardiaques) observés chez les patients traités[77].
Facteurs environnementaux protecteurs
[modifier|modifier le code]La pratique régulière dusportpermet de diminuer significativement le risque de développer la maladie de Parkinson[17].Letabagisme,lui, entraînerait également une réduction du risque de développer une maladie de Parkinson[78],dans ce cas, le risque des fumeurs pourrait être réduit d'un tiers par rapport aux non-fumeurs[3].Le mécanisme de cette protection reste inconnu, mais pourrait être dû à l'effet stimulant de lanicotinesur la dopamine[3].La fumée dutabaccontient des composés qui agissent commeinhibiteurs de la monoamine oxydaseet qui pourraient également contribuer à cet effet[79].Des essais d'utilisation denicotineen patch ont été débutés en 2012[80],[81].L'étude NIC-PD affichait des résultats plutôt mitigés quant au ralentissement de la progression de la maladie, voire que la nicotine par patch transdermaux pouvait accélérer la progression évaluée par l'échelle UPDRS relativement au groupeplacebo[82].Un possible rôle protecteur desœstrogèneset desanti-inflammatoires non stéroïdiensa été suspecté mais reste à démontrer[3].Le rôle protecteur des œstrogènes expliquerait le plus grand nombre d'hommes touchés par la MP[12](45 % de femmes contre 55 % d'hommes)[83].
Alimentation
[modifier|modifier le code]La consommation decafé,et notamment decaféine,pourrait avoir un rôle protecteur[84],[85].De plus, les preuves accumulées jusqu'à présent démontrent un lien entre les habitudes alimentaires et l'incidence de la maladie. En effet, une étude prospective basée sur un questionnaire de l'alimentation auquel ont répondu 131 368 participants démontre que lerégime méditerranéendiminue l'incidence de la maladie de Parkinson. Cette étude n'identifie pas de facteur protecteur en particulier. Cependant, la consommation depoissonà la base de ce régime est riche enacides grasde typeomégas-3à chaînes longues qui pourraient être en lien avec la diminution du risque. De plus, une autre étude de 5 000 sujets suivis sur une période de 6 ans démontre qu'une forte consommation d'omégas-3 est associée à une diminution du risque de la maladie de Parkinson. Des études supplémentaires sont nécessaires pour déterminer si les omégas-3 peuvent exercer un effetneuroprotecteuret par quel mécanisme ceux-ci agissent[86].
Dans uneétude transversale,une adhésion plus élevée au régimemediterranean-DASH intervention for neurodegenerative delay(MIND) était significativement associée à un âge plus élevé au début de la maladie, en particulier chez les femmes, qui présentaient une différence allant jusqu'à 17,4 ans entre les tertiles les plus élevés et les plus bas d'adhésion au régime[87].Le régime MIND, conçu par Martha Clara Morris, consiste à promouvoir l'apport d'acides gras polyinsaturésrelativement auxgraisses saturées,du fait de leurs bénéfices sur la biologie cellulaire neuronale[88].Des études observationnelles montrent que ce type de régime aurait en effet des répercussions positives sur l'évolution des fonctions mentales avec l'âge avec notamment une réduction de l'incidence de la maladie d'Alzheimer[89]et une apparition retardée de la maladie de Parkinson[90].Des études interventionelles sont toutefois nécessaires pour s'assurer de la robustesse de ces résultats.
Une consommation importante depoivronset d'aubergineset des légumes de la famille dessolanacéespourrait en raison de leur teneur naturelle ennicotineprévenir en partie la maladie[91].D'après une revue de la littérature, l'ingestion devitamine Ela plus élevée par rapport à la plus basse diminue le risque de 25 %[92].Une consommation plus élevée d'antioxydantsalimentaires, en particulier de vitamine E, devitamine Cet depolyphénolstels que lesanthocyanes,est associée à un risque plus faible de maladie de Parkinson[93].
Diagnostic
[modifier|modifier le code]L'âge moyen au moment du diagnostic est de 58 ans[94].Une étude[95]suggère que les personnes enphase prodromiquepeuvent présenter une plus grande déficience en termes de mobilité et de force par rapport à la population générale, et ce jusqu'à3 ansavant le diagnostic de la maladie. D’où l'intérêt de rechercher des signes précurseurs, afin de mettre en place un traitement plus précoce, capable de stopper ou de ralentir l’évolution de la maladie[96].
Clinique
[modifier|modifier le code]
La1religne contient les mots “Catherine Metzger” et la seconde “13 octobre 1869”.

Le diagnostic est basé sur le constat de symptômes spécifiques du syndrome parkinsonien[98]:
- hypertonie musculaireextrapyramidaleappelée « plastique » par opposition à l'hypertoniespastique, c’est-à-dire qu'elle cède à l'appui, qu'on a la sensation de « tuyau de plomb » lors de la mobilisation passive du membre (symptôme chez 85 % des parkinsoniens). Cette rigidité peut céder par à-coups (aspect de roue dentée). L'attitude générale est enflexion(cyphosedorsale, membres semi-fléchis) et donne un aspect penché en avant. Elle est augmentée par lamanœuvre de Froment,persiste endécubitus(signe de l'oreiller);
- tremblementde repos des extrémités, notamment dupouce(symptôme chez 64 % des parkinsoniens): le patient semble compter sa monnaie, ou rouler de la mie de pain. Il est lent et régulier, pouvant plus rarement persister dans l'attitude. Classiquement, il disparaît lors des mouvements volontaires et dusommeil,est augmenté par les efforts de concentration tels que le calcul mental, et respecte le cou et le chef (la tête) mais peut toucher le menton;
- akinésie:elle consiste en une rareté et une lenteur des mouvements (bradykinésie). Elle se manifeste aussi par une perturbation de lamimiqueet des mouvements automatiques comme ceux de lamarche.La bradykinésie peut s'associer à une réduction de l'amplitude des mouvements[1].L'akinésie est le signe le plus important de la maladie (symptôme chez 88 % des parkinsoniens). Le patient a un visage impassible, la bouche entrouverte, clignant rarement des yeux. La marche est lente à petits pas, parfois entrecoupée d'arrêts avecpiétinement.Elle est parfois rapide (festination). Le malade penché en avant paraît courir après son centre de gravité. Il y a toujours une perte du ballant des bras. Les mouvements alternatifs rapides des membres (épreuve des marionnettes) sont mal réalisés.
À ces symptômes constituants le syndrome parkinsonien peuvent également s'ajouter d'autres symptômes moteurs tels qu'une instabilité posturale et unedysarthrie,tandis que la rigidité est susceptible d'engendrer des douleurs[99],[100].Au cours d'une maladie de Parkinson évoluée, il est possible de voir apparaître un syndrome de Pise[101],cette dernière pouvant également survenir de manièreiatrogèneà la suite d'une stimulation cérébrale profonde trop forte du STN[102].
Symptomatologie cognitive
[modifier|modifier le code]Au cours de l'évolution de la maladie de Parkinson, plusieurs symptômes d'ordre non moteur et notamment cognitifs peuvent survenir. Ce déclincognitifest alors généralement lent et insidieux[103].On y compte notamment des signes desyndrome dysexécutif[1].Ce syndrome dysexécutif évoluera chez certains patients en unedémence,dite démence associée à la maladie de Parkinson, tandis que les majorité des patients n'auront que des troubles neurocognitifs mineurs[103].Le risque de démence est majoré par l'avancée en âge[104],[103].Sur le plan cognitif, ce profil dysexécutif se caractérise par des troubles de l'inhibition et de la flexibilité mentale, de lafluence verbale(sémantiqueetphonémique) ainsi que de la déduction de règles et de leur maintien enmémoire de travail,ou encore en abstraction de concepts[105],[106],[107],[108],[109].Les tâches d'empan envers (répétition d'une liste de chiffres dans le sens inverse par exemple) peuvent aussi mettre en avant un déficit de mémoire de travail[12]relativement aux capacités demémoire à court termeen tâche d'empan endroit. En cas de démence associée à la maladie de Parkinson, l'évolution de la maladie pourra faire apparaître des troubles des fonctions instrumentales (langage, visuoconstruction, visuospatial et visuoperceptif)[103].Enfin, lastimulation cérébrale profonde,tout particulièrement lorsqu'elle est appliquée au sein du STN postéro-supérieur[110],pourrait contribuer aux troubles de la fluence verbale et au ralentissement entâche de Stroop[111],[112],[113],[17],[114].
Les premiers changements cognitifs dus à la maladie de Parkinson semblent être, en moyenne, exécutifs, visuospatiaux, puis parfoismnésiques(trouble de la récupération sans déficit du stockage), compliquant dès lors le diagnostic différentiel avec unedémence à corps de Lewy[103].De manière générale, il semblerait que les patients parkinsoniens ayant un trouble neurocognitif mineur, en comparaison aux patients parkinsoniens n'ayant pas de troubles cognitifs significatifs, affichent une connectivité fonctionnelle moindre duthalamusmédiodorsal avec lecortexparacingulaire; tandis qu'en comparaison aux patients ayant une démence associée à la maladie de Parkinson ils ont une connectivité accrue entre le thalamus médiodorsal et le cortex cingulaire postérieur. De plus, certaines structures impliquées par les boucles desganglions de la baseseraient impliquées dans ces troubles cognitifs[115].
Symptomatologie neuropsychiatrique
[modifier|modifier le code]La maladie de Parkinson est susceptible de s'associer à des troublesneuropsychiatriques[116]tenant d'un syndrome dysexécutif comportemental. Parmi ceux-ci, on peut trouver une hypoactivité, uneapathie(avec un intérêt réduit pour les actions dirigées vers un but), uneasthénie,destroubles anxieux,une anticipation aversive et desattaques de paniques,destroubles du comportement alimentaire,ainsi que des méconduites sexuelles et urinaires, destroubles de l'humeuretde la personnalité,deshallucinationsainsi qu'unesomnolencediurne accrue[12],[106],[107],[17],[103].Ladépression[117]fait partie des symptômes inauguraux de la maladie de Parkinson[37]de même que les troubles du comportement en phase desommeil paradoxal.Certains symptômes, dits productifs, sont également susceptibles d'apparaître tels que des hallucinations visuelles et/ou auditives et desillusions[118].
Une « personnalité parkinsonienne » a été décrite: elle serait caractérisée par une forme de rigidité psychologique qui annoncerait la rigidité motrice, un souci de contrôle et unperfectionnismequi correspondent, en outre, à la description de l'état hypodopaminergique, qui est caractérisé principalement par un déficit dans la recherche de nouveauté (novelty seeking)[119].
Autres symptômes
[modifier|modifier le code]Les symptômes inauguraux les plus fréquents sont ladépression,l'altération de l'odorat(symptôme difficile à évaluer[120]), lestroubles du comportementen phase desommeil paradoxal,destroubles de la parole(voix monotone, débit saccadé)[121]puis letremblement,la difficulté de marcher (maladie asymétrique, elle touche plus sévèrement un côté du corps), signes généralement associés à desdouleurs.Après cette phase, on enregistre souvent des symptômes autres que moteurs. D'autres symptômes peuvent être rencontrés plus ou moins tardivement: chutes,hypersalivation,réflexe oculopalpébralinépuisable, une micrographie (lacalligraphiediminue en amplitude), des troubles de l'élocution(difficulté à articuler, voix rauque et de faible intensité), des troubles de ladéglutition,de l'hypotension orthostatique,des troubles urinaires,etc.En effet, la maladie de Parkinson est susceptible d'engendrer un syndrome dysautonomique (constipation,hypotension orthostatique,etc.)[1].
Imagerie
[modifier|modifier le code]

Le diagnostic de maladie de Parkinson est habituellement clinique. En théorie, la certitude du diagnostic n'est obtenue que par l'étudehistologiqueducerveaumais les critères diagnostiques actuellement définis permettent de faire le diagnostic sans trop de difficultés. Lescannercérébral partomodensitométriedes personnes atteintes de la maladie de Parkinson est habituellement normal[123].L'imagerie par résonance magnétiquesensible au fer (IRM T2*) peut être utilisée dans un cadre diagnostique. En effet, leferpeut être témoin de la mort cellulaire et le signal T2* diminue en présence de fer tandis que son inverse (R2*) augmente[124].Dans la maladie de Parkinson, il existe une concentration en fer trop importante par rapport à la moyenne pour le même groupe d'âge au sein de lasubstance noiredu fait de la perte deneurones dopaminergiques[125].De plus, l'imagerie pondérée en fonction de la susceptibilité est elle aussi un marqueur fiable de la présence de fer intracérébral en étant à la fois sensible et spécifique à la maladie[126].L'IRM T2* et l'imagerie pondérée en fonction de la susceptibilité sont toutes deux capables d'afficher le signe d'effacement de la queue d'hirondelle (swallow tail) dans la substance noire dorsolatérale. La tomodensitométrie et l'IRM sont également utilisées, en pratique clinique, pour écarter d'autres maladies pouvant engendrer un syndrome parkinsonien telles que l'encéphalite,lesAVCchroniques, lestumeursdesganglions de la baseet l'hydrocéphalie[123].
LeDat-scanest un type descintigraphiecérébrale qui consiste à tracer les transporteurs de la dopamine de manière à pouvoir observer son parcours dans le cerveau. En effet, latomographie par émission de positons(TEP) permet d'afficher l'activité métabolique des transporteurs dopaminergiques dans les ganglions de la base. Or, dans la maladie de Parkinson, on sait qu'il existe une mort pré-synaptique et les transporteurs de ladopaminedisparaissent donc, le DaTSCAN est donc indiqué pour détecter la perte fonctionnelle des neurones dopaminergiques. Cette scintigraphie cérébrale (DaTSCAN) permettrait de montrer l'atteinte dustriatum[127].Un DaTSCAN est considéré comme normal si l'on peut observer une activité dopaminergique symétrique au sein des deuxputamensdes striatums, mais en cas d'asymétrie l'hypofixation dopaminergique est susceptible de dénoter une maladie de Parkinson. Le DaTSCAN corrèle bien avec le diagnostic clinique de la maladie de Parkinson[128].De plus, une activité liée à la dopamine dans les ganglions de la base peut permettre d'exclure le syndrome parkinsonieniatrogène[123].Une des premières indications du DaTSCAN fut de permettre la différenciation entre les tremblements essentiels des tremblements non essentiels (« parkinsoniens »)[129]et il dispose également également d'une AMM pour faire la distinction entre une démence due à la maladie d'Alzheimer ou une due à la démence à corps de Lewy. Toutefois, il faut noter que le DaTSCAN est incapble de différencier une démence associée à la maladie de Parkinson et une démence à corps de Lewy.
L'IRM de diffusionpeut permettre de différencier la maladie de Parkinson des syndromes parkinsoniens atypiques ainsi que de différencier entre les sous-types moteurs de la maladie de Parkinson[130],mais sa valeur diagnostique reste sujette à débat[123].
Diagnostic différentiel
[modifier|modifier le code]Plusieurs maladies sont susceptibles de ressembler à une maladie de Parkinson. Ce faisant, il est nécessaire, lors du diagnostic, de distinguer cette dernière des pathologies similaires. On doit notamment distinguer la maladie de Parkinson du tremblement essentiel. En effet, il existe plus d'une vingtaine d'autres causes de tremblements, notamment la plus fréquente, letremblement essentiel,qui est un tremblement lors des mouvements (ou dans le maintien d'attitude: tremblement postural), et non de repos, comme l'est le tremblement parkinsonien. Seul un diagnostic posé par unneurologuepermet de confirmer l'existence d'une pathologie précise. De plus, il faut distinguer la MP de l'apparition de symptômes non spécifiques pouvant donner l'aspect d'une dépression ou avoir une allurerhumatismale;ou encore de la chorée dechorée de Huntingtonet de laneuroacanthocytose,et de l'Hydrocéphalieà pression normale qui ne présente typiquement pas de syndrome parkinsonien mais destroubles de la marcheen sont évocateurs[131].
Syndromes parkinsoniens
[modifier|modifier le code]Parmi les syndromes parkinsoniens semblables à une maladie de Parkinson on retrouve:
- les syndromes parkinsoniens de cause iatrogène[132](liée aux médicaments); ils peuvent être causés à la suite de l'administration de neuroleptiques (par exemple, lesbutyrophénonesetphénothiazines) et notamment deneuroleptiquesde deuxième génération (« atypiques ») ou de neuroleptiques « cachés » (ex.:le Primpéran,métoclopramidevendu commeantiémétique). Le syndrome parkinsonien a également été décrit après l'emploi de certaines herbes, dont lekava[133];
- lamaladie de Wilson:cette hypothèse diagnostique est à évoquer chez un sujet jeune avec des antécédents familiaux et une atteinte dufoie;
- Laparalysie supranucléaire progressive(PSP) ou maladie de Steele-Richardson-Olszewski[131].La PSP comporte un syndrome parkinsonien axial et symétrique, avec selon l'évolution de la maladie une paralysie des mouvements oculaires de verticalité, des troubles de l'équilibre avec chutes précoces et des troubles cognitifs précoces (apathie, syndrome dysexécutif, démence)[134];
- l'atrophie multisystématiséede forme parkinsonienne[135]:elle présente dessignes extrapyramidauxplus ou moins associés à des signes pyramidaux, dysautonomiques (hypotension orthostatique,impuissance,etc.) oucérébelleux(troubles de l'équilibre);
- ladégénérescence corticobasale:c'est une affection rare se traduisant par uneapraxie,des signes extrapyramidaux unilatéraux;
- ladémence à corps de Lewy:elle comporte un syndrome parkinsonien débutant chez le sujet âgé, rapidement associé à des troubles cognitifs, des troubles attentionnels, des troubles du sommeil et deshallucinationsvisuelles;
- ls syndromes parkinsoniens vasculaires: ceux-ci sont causés par desaccidents vasculaires cérébrauxmultiples touchant lesnoyaux gris centraux.Concernant la distinction entre un syndrome parkinsonien d'origine vasculaire et une maladie de Parkinson, des tests olfactifs peuvent montrer de meilleures réponses lorsque la cause est vasculaire[136].En cas d'apparition brutale de symptomes moteurs, cette hypothèse doit être évoquée et la réalisation d'une imagerie cérébrale anatomique est indiquée. Ce syndrome parkinsonien a pour caractéristiques cliniques d'être plutôt symétrique et peu sensible au traitement dopaminergique, il prédomine aux membres inférieurs s'associant à une marche avec frezzing précoce et peut s'associer à un syndrome pseudobulbaire[134];
- les intoxications: notamment l'exposition aux pesticides (fréquent), auMPTP(toxicomanie), ou lemanganisme.Ce dernier est une intoxication chronique aumanganèsepar inhalation (certaines professions comme celle de soudeur y sont plus susceptibles) ou ingestion (teneur de manganèse trop importante de l'eau) pouvant provoquer un syndrome parkinsonien[137].
Évolution
[modifier|modifier le code]
Depuis 1998, la maladie de Parkinson est classée, comme certainesmaladies dégénérativesplus rares, dans le groupe dessynucléinopathies:dans ces pathologies, la protéineα-synucléines'accumule et « empoisonne » les cellules. Il s'agit du principal composant descorps de Lewy,les indicateurs pathophysiologiques de la MP et du second composant en importance dans lesplaques sénilesdistinctives de la maladie d'Alzheimer[139].
Premiers troubles
[modifier|modifier le code]Les premiers symptômes de la maladies peuvent inclure des troubles du sommeil, de la digestion, de l'olfactionet de lavision des couleurset descontrastes[17].
Lestroublesdusommeil paradoxalentraînant des mouvements violents et, dans certains cas, des blessures chez le conjoint, apparaissent en moyenne treize ans avant les premiers symptômes moteurs. L'anosmie(perte de l'olfaction) étant présente, selon certaines études, chez 100 % des patients atteints de MP, son apparition, fréquemment considérée comme un aspect normal du vieillissement, pourrait être un symptôme avant-coureur plus alarmant. Selon une étude hollandaise, l'anosmie prédirait cinq ans à l'avance la maladie dans 12,5 % des cas — une performance cependant trop modeste pour appliquer le test d'anosmie isolément à toute la population[140].La fatigue, un autre symptôme omniprésent chez les patients parkinsoniens, pourrait découler d'un processus ayant pour origine une dégénérescence de l'innervationducœur.La présence decorps de Lewydans cet organe et dans lesnerfs sympathiquesqui l'excitent, chez des patients atteints de MP, appuient cette hypothèse. Les nerfs du cœur pourraient bien être atteints avant le système sympathique.
La constipation, un symptôme encore non élucidé observé par James Parkinson, pourrait résulter d'une dégénérescence semblable, puisque des corps de Lewy tapissent diverses régions dutube digestifchez plusieurs, sinon tous les parkinsoniens. Une vaste étude prospective a montré que les personnes souffrant de constipation à l'âge adulte avaient quatre fois plus de risque que les autres d'être atteintes de MP plus tard. Les corps de Lewy dans le tube digestif et la constipation qui en résulte, selon l'hypothèse, pourraient être les premiers signes avant-coureurs de maladie, puisqu'ils apparaîtraient plus de quinze ans avant le diagnostic[141].
Symptômes moteurs
[modifier|modifier le code]Les symptômes moteurs n'apparaissent que lorsque 50[12]à 70 % des neurones de lasubstance noireont été détruits[142].Lestubercules olfactifset lelocus cœruleussont affectés précocement, ce qui entraîne des troubles de l'olfaction et du sommeil (agitation nocturne et cauchemars) initiaux[141],[143].Ultérieurement, des structures impliquées dans la régulation motrice (substance noire) situées dans la partie haute dutronc cérébralvont être atteintes et entraîner les signes moteurs caractéristiques de la maladie. Enfin, après plusieurs décennies d'évolution, des structures corticales peuvent être touchées.
Impact sur l'entourage de la personne malade
[modifier|modifier le code]En France, le conjoint d'une personne atteinte de la maladie de Parkinson lui consacre en moyenne huit heures par jour. 52 % des conjoints de personnes souffrant de la maladie de Parkinson limitent les sorties du domicile sans le patient. 47 % des conjoints parkinsoniens font chambre à part ou utilisent des lits jumeaux, 46 % ont recours à une aide à domicile[144].AuQuébec,Chloé Sainte-MarieetGilles Carleont fondé leRéseau des aidantspour« sortir de l’isolement, être reconnus et pouvoir compter sur de l’aide[145],[146]».
Épidémiologie
[modifier|modifier le code]
- Aucune donnée
- < 5
- 5–12.5
- 12.5–20
- 20–27.5
- 27.5–35
- 35–42.5
- 42.5–50
- 50–57.5
- 57.5–65
- 65–72.5
- 72.5–80
- > 80
La maladie de Parkinson est la seconde maladie neurodégénérative la plus fréquente après lamaladie d'Alzheimer[3].Saprévalence(proportion dans une population à un instant donné) dans les pays occidentaux est d'environ 0,3 % dans la population générale. Elle augmente avec l’âge, atteignant 1 % chez les plus de 60 ans, et jusqu'à 4 % chez les plus de 80 ans[3].Cependant, les études épidémiologiques dans cette tranche d'âge ne distinguent pas la maladie de Parkinson des syndromes parkinsoniens. L'incidencede la maladie de Parkinson est comprise entre 8 et 18 pour 100 000 années-personnes[3](nombre de nouveaux cas pour 100 000 personnes par an). L'âge moyen d'apparition de la maladie est d'environ 60 ans, même si 5 à 10 % des cas, classés comme précoces, commencent entre 20 et 50 ans[7].La maladie de Parkinson pourrait être moins fréquente chez les personnes d'ascendanceafricaineetasiatique,ce qui reste contesté[3].Les hommes seraient plus souvent atteints que les femmes mais les études ne sont pas unanimes sur ce point[147].En France, en 2015, 160 000 personnes sont traitées pour la maladie de Parkinson et 26 000 nouveaux cas apparaissent par an[98].C'est la deuxième cause de handicap moteur majeur chez les sujets âgés après les accidents vasculaires cérébraux[148].Le nombre de patients en France a été multiplié par 2 entre 1993 et 2018 et une augmentation de 50 % d'ici à 2030 est attendue. Cette augmentation est due principalement à l'augmentation de l’espérance de vie, à un meilleur dépistage de la maladie ainsi qu'à d'autres facteurs environnementaux non clairement définis[17].La maladie touche particulièrement lesagriculteurset les riverains des exploitations en particulierviticolesen raison de l'exposition auxpesticides[17].
En dehors des formes rares clairement d'origine purement génétique qui touchent des patients parfois dès 20 - 30 ans, la répartition de l'incidence de la maladie au sein des groupes de populations semble relativement homogène. Cette répartition semblait plus prévalente chez les populations noires d'origine africaine mais finalement de nouvelles études semblent indiquer qu'il n'y a pas de prévalence plus importante selon les ethnies. Les données ne sont cependant pas complètement fiables suivant les pays[17].
Pronostic
[modifier|modifier le code]Il s'agit d'une maladie chronique, avec aggravation progressive, d'évolution, en règle, très longue. L'espérance de vie est diminuée[149].Le risque de mortalité est à peu près doublé par rapport à une population non parkinsonienne, la cause la plus fréquente étant probablement les infections pulmonaires[150].Les chutes sont une complication fréquente de la maladie[150].Une méthode d'évaluation de la sévérité de la MP est l'échelleunified parkinson's disease rating scale(UPDRS), ainsi que sa version modifiée la MDS-UPDRS. Ces échelles sont couramment utilisées en pratique clinique[151].
Si les symptômes moteurs de cette maladie ne sont pas traités, ceux-ci évoluent rapidement au cours des premiers stades de la maladie et plus lentement ensuite. Sans traitements, le patient perd, en moyenne en huit ans, ses capacités de déplacement autonome et peut devenir alité après 10 ans d'évolution. Toutefois, les traitements ont significativement amélioré le pronostic relatif à ces symptômes moteurs, mais ils sont également une nouvelle source de handicap pour les patients du fait des effets iatrogènes de la levodopa se développant au cours de son utilisation[152].Parmi les patients utilisateurs de levodopa, le temps nécessaire à la progression des symptômes pour atteindre le stade de haute dépendance envers les aidants est d'environ 15 ans[153].Il est difficile de prédire l'évolution de la maladie chez un individu donné[153].L'âge est le meilleur indicateur de la progression de la maladie[154].Le taux de déclin moteur est plus élevé chez les personnes moins atteintes au moment du diagnostic, tandis que les troubles cognitifs sont plus fréquents chez les personnes âgées de plus de 70 ans au moment de l'apparition des symptômes[154].
Étant donné que les thérapies actuelles améliorent les symptômes moteurs, le handicap est actuellement principalement lié aux caractéristiques non motrices de la maladie[154],mais la relation entre la progression de la maladie et le handicap n'est pas linéaire. Au fur et à mesure que la maladie progresse, l'incapacité est davantage liée aux symptômes moteurs qui ne répondent pas de manière adéquate aux médicaments, tels que les difficultés de déglutition et d'élocution et les problèmes de marche et d'équilibre, ainsi qu'aux complications induites par la lévodopa, qui apparaissent chez 50 % des personnes après 5 ans d'utilisation de la lévodopa[153].Enfin, après dix ans, la plupart des personnes atteintes de la maladie présentent des troubles autonomes, des problèmes de sommeil, des altérations de l'humeur et un déclin cognitif[153].Tous ces symptômes, en particulier le déclin cognitif, augmentent considérablement l'incapacité[154],[153].
L'espérance de vie des personnes atteintes de la MP est réduite[153].Les taux de mortalité sont environ deux fois plus élevés que ceux des personnes non atteintes[153].Le déclin cognitif et la démence, l'âge avancé au moment de l'apparition de la maladie, un stade plus avancé de la maladie et la présence de problèmes de déglutition sont tous des facteurs de risque de mortalité. Un modèle de maladie principalement caractérisé par des tremblements, par opposition à la rigidité, prédit toutefois une meilleure survie[153].Les décès par pneumonie d'aspiration sont deux fois plus fréquents chez les personnes atteintes de la MP que dans la population en bonne santé[153].En 2016, la maladie de Parkinson a entraîné environ 211 000 décès dans le monde, soit une augmentation de 161 % depuis 1990[155].Le taux de mortalité global a augmenté de 19 % pour atteindre 1,81 pour 100 000 personnes au cours de cette période[155].
Traitements
[modifier|modifier le code]
Médicaments
[modifier|modifier le code]Il n'existe pas à l'heure actuelle de traitement curatif de la maladie chez l'humain. Les traitements médicamenteux restent donc aujourd'hui encore purement symptomatiques (agissant sur les symptômes). Les traitements sont, en 2024, suffisamment efficaces pour améliorer les symptômes principaux mais ne permettent pas de stopper la progression de la maladie[156].
Les symptômes sont rangés en deux catégories: moteurs et non moteurs[116].Sous l'influence des traitements et la progression de la maladie, les symptômes vont se modifier. Des mouvements anormaux (dyskinésies) apparaissent pouvant être parfois très impressionnants. Ce sont des mouvements parasites très variés des mouvements volontaires (ouverture-fermeture des yeux, grimace, mouvements de langue, de rotation de la tête, d'ascension d'une épaule, d'enroulement du bras ou de la jambe…)
Symptômes moteurs
[modifier|modifier le code]L-DOPA
[modifier|modifier le code]La levodopa, ouL-DOPA,est le traitement le plus utilisé. Ce médicament doit être transformé endopaminedans le cerveau pour combler le déficit induit par la maladie. La transformation devrait idéalement se passer dans le système nerveux central, mais elle se produit aussi dans l'intestin puis dans tout l’organisme par la DOPA décarboxylase au niveau sanguin. Pour cette raison, ce traitement est couplé à un inhibiteur de ladécarboxylasepériphérique ou de la catéchol-O-méthyl transférase (COMT), afin de diminuer la transformation périphérique et ainsi de diminuer les effets secondaires tout en multipliant par 10 la disponibilité au niveau du système nerveux central (les effets secondaires tels quenauséesouvomissementsdeviennent rares si les doses sont progressivement augmentées). La réponse est variable d'un individu à l'autre[149].
Forme orale
[modifier|modifier le code]La L-DOPA a unedemi-vie(temps au bout duquel la molécule est à moitié éliminée de l'organisme) comprise entre1h30et3h.Les prises du médicament seront donc répétées et régulières dans la journée pour maintenir un taux sanguin stable, et un effet clinique permanent, idéalement à distance d'un repas protéiné[149].L'effet de la L-DOPA va se modifier au cours du temps en raison d'une augmentation de la sensibilité des récepteurs cérébraux à la L-DOPA et de la diminution de la durée d'action de chaque prise de médicaments. Ces deux particularités vont respectivement entraîner des fluctuations d'effet et des dyskinésies (mouvements involontaires). Les fluctuations motrices peuvent être précoces. Le malade présente des états de blocage au cours de la journée imposant des modifications d'horaires et l'utilisation de formes à libération prolongée. Les dyskinésies surviennent le plus souvent au moment où les taux de L-DOPA sont le plus importants dans le sang. Elles peuvent être retardées par la prise d'agonistesdopaminergiques. Lorsque celles-ci surviennent, il est recommandé de diminuer la dose de la prise unitaire de L-DOPA.
L'utilisation d'agonistes des récepteurs A2A (Istradefylline)[157],molécule analogue de la caféine, en combinaison avec le traitement de L-DOPA permettrait d'améliorer le phénomène on/off relié à la L-DOPA. Celui-ci est disponible au Japon depuis[158].Son efficaité tend à s'amoindrir avec le temps[156].
Autres voies
[modifier|modifier le code]En raison de la courte demi-vie de la L-DOPA et afin de limiter ses fluctuations d'effet, il est également possible d'administrer la L-DOPA sous forme de gel en flux continu directement dans leduodénumou dans la partie haute dujéjunum.Cela est rendu possible par une sonde à demeure mise en place lors d'unegastrostomie endoscopique percutanéecomprenant la mise en place d'une sonde transabdominale externe reliée à une pompe portable et d'une sonde intestinale interne[159].Une forme inhalée a également été développée, permettant deshunterle tube digestif[160].
Agonistes de la dopamine
[modifier|modifier le code]La deuxième grande catégorie de traitement médicamenteux est la classe des agonistes dopaminergiques: bromocriptine, cabergoline,pramipexole,ropinirole,pirebidil, lisurdide, apomorphine. Ces substances agissent directement sur lesrécepteurs postsynaptiquesde lavoie nigrostriée.Elles sont moins efficaces sur les symptômes moteurs que la L-DOPA. Elles sont néanmoins utilisées en première intention chez le sujet jeune car elles retardent l'utilisation de la L-DOPA, qui favorise l'apparition de dyskinésies. Ces médicaments peuvent entraîner des effets indésirables de type nausées, vomissements, œdèmes, hallucinations et troubles du contrôle des pulsions. La dernière classe thérapeutique agit en inhibant la monoamine oxidase, enzyme qui catabolise la dopamine. Les deux molécules utilisées dans ce but sont lasélégilineet larasagiline.Celles-ci peuvent remplacer pendant une courte durée la L-DOPA au début de la maladie. Elles sont parfois utilisées en première intention surtout chez les patients les plus jeunes afin d'économiser la L-DOPA.
Autres
[modifier|modifier le code]D'autres traitements médicamenteux existent en particulier pour optimiser l'efficacité de la L-DOPA: letolcaponepeut être proposé[150],entacapone. L'importance de l'effet placeboest à noter dans cette maladie, avec une amélioration de près de 15 % des cas[161].À la fin des années 1990, un hasardcirconstanciel[Laquelle?]a conduit à explorer, dans un cadre médical contrôlé, la piste potentiellement prometteuse de laMDMA,connue sous le nom d'Ecstasy[162]comme drogue récréative. Son utilisation en complément des traitements usuels, notamment par laL-Dopa,permettrait de réduire sensiblement les effetsiatrogènes.Un reportage de laBBC— repris en français par l’émission36.9°— décrit les modalités de cette découverte, sous l’égide de l’université de Manchester[162].Des injections de toxine botulique peuvent être prescrites dans le cadre de la dystonie des orteils[163].
L'amantadineet l'istradefylline sont également utilisés[156].
Symptômes non moteurs
[modifier|modifier le code]Voie sérotoninergique
[modifier|modifier le code]La maladie de Parkinson implique la dégénérescence de lavoie dopaminergiqueainsi que de multiples voies non dopaminergiques telles que la voiesérotoninergique[164].Les inhibiteurs de la monoamine-oxydase B (indiqués dans le cadre du traitement antiparkinsonien) agissent sur ces voies en inhibitant la dégradation de la sérotonine une fois relarguée dans la fente synaptique, ces médicaments ont donc une action sur les symptômes dépressifs associés à la maladie de Parkinson. Toutefois, d'autres antidépresseurs peuvent être prescrits en plus selon les besoins du patient[163].
Voie cholinergique
[modifier|modifier le code]La plupart des systèmescholinergiques,muscariniquesetnicotiniquessont affectés par la maladie de Parkinson[165].Les médicaments anticholinergiques ont été les premiers utilisés en maladie de Parkinson, mais avec une efficacité limitée. La haute autorité de santé les recommande toujours dans le cadre du traitement antiparkinsonien en fonction de l'âge et du rententissement moteur de la maladie. De plus, ils sont également indiqués pour le traitement de la constipation[163].Des études ont aussi démontré un effet protecteur de la nicotine sur la dégénérescence liée à la maladie. En effet, une corrélation inverse existe entre la consommation de cigarette et l'apparition de la maladie[166].
Larivastigminesemble utile dans les troubles cognitifs et l'apathie[167].
Traitements non médicamenteux
[modifier|modifier le code]Stimulation cérébrale profonde
[modifier|modifier le code]
Lastimulation cérébrale profonde(SCP) est un traitement chirurgical efficace sur les trois symptômes moteurs de la maladie de Parkinson: tremblements, raideur et akinésie. Elle a été pratiquée pour la première fois chez l'être humain en 1993 par l'équipe deAlim Louis BenabidetPierre PollakàGrenoble,après des études menées chez le primate non humain par Abdelhamid Benazzouz à Bordeaux[168].La SCP est aujourd'hui réalisée sur des patients dans plusieurs hôpitaux français, et à travers le monde. Le centreClinatecen réalise à l'aide de dispositifs nanométriques élaborés sur place.
L'opération consiste à implanter parstéréotaxiedeux électrodes dans une région cérébrale précise. Généralement, il s'agit du noyau sous-thalamique. Ces régions d'implantation sont déterminées grâce à uneIRMpréopératoire. Les électrodes sont ensuite reliées à unneurostimulateur.Ce dernier est implanté sous la peau au niveau de la région sous-claviculaire ou abdominale. Le neurostimulateur générera par la suite de faibles impulsions électriques. Ces impulsions vont interrompre le signal émis par le cerveau responsables des symptômes moteurs de la maladie. Les mécanismes qui atténuent ainsi ces signaux sont encore mal connus. Cette information devrait demander une certaine prudence dans l'utilisation de la SCP. Ainsi, il est possible dans la plupart des cas d'alléger le traitement médicamenteux des patients, jusqu'à une diminution des doses de 50 %. Cependant, les deux options thérapeutiques sont complémentaires. Le traitement chirurgical n'est, en aucun cas, une alternative au traitement médicamenteux.
La SCP nécessitant des opérations chirurgicales, elle présente les mêmes risques que toute autre chirurgie. Ces risques sont principalement de nature hémorragique et infectieuse. De plus, le fait que le dispositif implanté traverse des parties du cerveau peut potentiellement engendrer des complications neurologiques. Cependant, la mortalité chirurgicale, difficile à évaluer, est très faible. La SCP nécessite une intervention lourde, c'est pourquoi les candidats à l'opération doivent répondre à des critères bien précis. Le patient doit développer la maladie depuis au moins 5 ans et ne présenter ni trouble cognitif sévère, ni troubles psychiatriques. Une bonne sensibilité à la L-DOPA est un critère essentiel de sélection, car elle est prédictive de l'efficacité de la SCP. Enfin, l'âge en soi n'est pas un critère discriminant, mais certaines maladies dont la fréquence augmente avec l'âge le sont. Les patients aptes à subir l'opération ne représentent que 10 % de la population malade. En France, les critères pour être éligible à une stimulation cérébrale profonde sont de ne pas présenter de troubles cognitifs, avoir de moins de 70 ans et présenter les signes caractéristiques susceptibles d'être amélioré par la stimulation cérébrale profonde[12].Selon les recommandations de bonne pratique de la haute autorité de santé, elle se prescrit pour des patients dont la qualité de vie est altérée du fait du mauvais contrôle médicamenteux de l'état moteur (dyskinésies invalidantes liées au traitement médicamenteux et fluctuations d'effet thérapeutique)[163].
Destruction du thalamus
[modifier|modifier le code]La destruction d'une partie du thalamus (noyau intermédiaire ventral) est efficace sur les tremblements réfractaires. Elle est pratiquée par l'application d'ultrasons focalisés de haute intensitéguidée par une IRM cérébrale[169].Leglobus palliduspourrait être également une cible[170].
Kinésithérapie
[modifier|modifier le code]Plusieurs revues systématiques[171]et méta-analyses[172]existent sur l'effet de la kinésithérapie sur les symptômes de la maladie de Parkinson. Elles montrent que la kinésithérapie:
- améliore la vitesse et l'endurance à la marche;
- diminue la fréquence des blocages lors de la marche;
- améliore l'équilibre et les capacités fonctionnelles;
- améliore certains paramètres ventilatoires[173];
- améliore certaines fonctions cognitives[174].
Elle peut être aidée par des systèmes deréalité virtuelle[175].
Mesures diététiques
[modifier|modifier le code]Une alimentation riche en protéines pourrait réduire l'efficacité de la levodopa par compétition au niveau de son absorption intestinale. Mais les études n'ont pas confirmé l'intérêt d'une diète en protéines. La prise du médicament en début de repas est parfois conseillée[réf. nécessaire].
Exercices physiques
[modifier|modifier le code]La pratique régulière d'exercices (éventuellement dans le cadre d'activités physiques adaptées) est essentielle pour maintenir mobilité, flexibilité, équilibre et pour combattre les effets et symptômes secondaires. De plus, la pratique régulière d'un sport permet d'augmenter la sécrétion naturelle de dopamine[176].Les résultats concrets des effets de la réadaptation physique sur la maladie de Parkinson montrent une amélioration fonctionnelle notable[177],[178].
La pratique d'exercices physiques intenses permettrait également de ralentir la progression de la maladie et ainsi retarder la prise de médicaments selon une étude menée à l'Université Northwestern[179],[180].Il existe des preuves expérimentales chez l'animal qu'un effort intense et une alimentation pauvre ralentissent la progression de la maladie[12].Une étude de 2023 confirme que l'exercice intensif améliore les symptômes moteurs et cognitifs de la maladie de Parkinson en restaurant laplasticité synaptique[181].
Thérapie cognitive
[modifier|modifier le code]Lathérapie cognitivo-comportementaleest utile dans les symptômes psychiatrique de la maladie[182].
Stimulation rythmique auditive
[modifier|modifier le code]Lastimulation rythmique auditive(SRA) est une technique de rééducation neurologique consistant à compenser une perte de régulation motrice, survenant dans le cadre d’atteintes neurologiques à conséquence sur le plan moteur, par une stimulation sensorielle externe, médiée par le son. Le patient va synchroniser ses pas sur la stimulation perçue et pourra développer une marche plus fluide et rythmée. Cette technique est utilisée en rééducation par les kinésithérapeutes afin de soutenir des exercices impliquant un travail du rythme. Cette méthode est également efficace pour réduire la durée et le nombre d'épisode defreezing(ou blocages à la marche)[183].Des dispositifs comme le WALK-DTX ou beatMove[184],[185]mettant en œuvre cette technique sont aujourd’hui proposés, dans une optique de rendre accessible l’auto-rééducation à domicile et de permettre aux patients de conserver une activité physique régulière[186] . De nombreuses études démontrent une amélioration de la longueur de foulée et de la vitesse de marche lors de l’utilisation de la SRA dans le cadre de la maladie de Parkinson[187].Il existe une réduction des chutes et de leur gravité après 24 semaines d'entrainement à base de SRA[188].
Prise en charge orthophonique
[modifier|modifier le code]La prise en charge orthophonique est indiquée dans le cadre des symptômes de troubles de la parole, tenant de problèmes de déglutition ou encore de la micrographie. La rééducation du langage vise à lutter contre laparésiedes muscles de la face. Elle est souvent trop tardivement prescrite par les médecins. Sous l'impulsion de Joseph Sohet, patient, et de Claude Frémont, orthophoniste, un recueil de textes auxphonèmesspécialisés est édité[189].Il existe une méta-analyse sur l'efficacité de l'orthophonie dans la maladie de Parkinson. Elle conclut que son efficacité n'est pas prouvée[190].
Recherche de nouveaux traitements
[modifier|modifier le code]Thérapie génique
[modifier|modifier le code]Cette technique consiste à injecter dans certains zones du système nerveux central desvecteurs virauxporteurs de certains gènes. Ces gènes vont être intégrés dans le génome des cellules hôtes et sécréter des substances neuroprotectrices ou des enzymes intervenant dans la synthèse de neuromédiateurs. Des études préliminaires ont montré des premiers résultats positifs en ce qui concerne la tolérance chez l'être humain, mais l'efficacité clinique reste à démontrer[191].En 2020, des chercheurs révèlent avoir réussi à guérir définitivement des souris de la maladie de Parkinson en induisant la conversion d'astrocytesin situenneurones dopaminergiques[192],[193],[194].
Cellules souches
[modifier|modifier le code]Il s'agit d'une piste thérapeutique majeure qui consiste à transplanter descellules souchesdans lestriatum.Ces cellules sonttotipotenteset peuvent en théorie se transformer encellules neurales.Il existe encore de nombreux obstacles, en particulier liés au risque de cancérisation, avant d'envisager une utilisation thérapeutique chez l'être humain. Les résultats restent inconstants, avec une amélioration plus visible chez les jeunes patients[195]et qui persiste à très long terme[196].La difficulté d'obtention des cellules, la lourdeur de la méthode et la nécessité d'immunosuppression limitent le développement de cette technique. Du fait de la contagion allant de neurone à neurone des corps de Lewy, il est peu susceptible que ces thérapies soient efficaces à moyen comme à long terme avant qu'une façon d'enrayer la progression de la pathologie de Lewy, voire d'en nettoyer les inclusions, ne soit découvert[197],[198],[199].
Facteurs neurotrophes
[modifier|modifier le code]Lesfacteurs neurotrophesforment une famille disparate de messagers cellulaires ayant pour rôle ou pour effet de stimuler le développement des neurones et leur survie une fois qu'ils sont à maturité. Ils sont également impliqués dans le processus de plasticité cérébrale qui est mis en mouvement à la suite d'une atteinte au cerveau. Parmi ceux-ci, lefacteur neurotrophe dérivé de la glie(GDNF) s'avère particulièrement prometteur dans la maladie de Parkinson. Un dispositif d'injection est installé chirurgicalement à la base du cerveau pour que le GDNF soit administré directement dans leputamen.Le facteur neurotrophe est injecté quotidiennement et des améliorations sont observées variant autour de 40 % sur les échelles de gravité de la maladie (échelle UPDRS). La procédure comporte des risques d'infections, comme toute intervention nécessitant un port permanent; le port doit alors être enlevé.
LaFondation Michael J. Foxsubventionne la recherche sur une voie d'administration moins coûteuse et risquée, lavoie intranasale,qui permet d'outrepasser labarrière hématoencéphalique
Stimulation magnétique transcrânienne
[modifier|modifier le code]Lastimulation magnétique transcrânienne(SMT) est, comme la stimulation cérébrale profonde, un traitement par stimulation électrique du cerveau. Cette technique est à l'étude depuis 2004 et continue d'être évaluée, notamment par leDrDavid Benninger au sein duCHUV,enSuisse[200].Des patients volontaires reçoivent actuellement[Quand?]de brèves impulsions magnétiques délivrées par unebobineplacée sur leur cuir chevelu. Ces impulsions ne provoquent aucune douleur. Elles sont censées moduler l'activité desneuronesducortex moteur.Cette région du cerveau est en effet à l'origine des mouvements des muscles.
Cette technique non invasive est bien moins lourde que la SCP. Elle pourrait donc concerner un plus grand nombre de patients et constitue ainsi un espoir pour les chercheurs.
Stimulation par lumière infrarouge
[modifier|modifier le code]Cette technique dénommée Near InfraRed (NIR) est lancée par le centreClinatecduCEA Grenobleen 2013[201]et a pour objectif de démontrer l'efficacité de la lumière proche de l'infrarouge dans laneuroprotectionface à la maladie de Parkinson. Un premier essai clinique démarre lelorsqu'un patient est opéré afin de lui poser une sonde dans le cerveau permettant d'illuminer les neurones et ainsi d'en limiter leur dégénérescence[202].Cet essai clinique est prévu pour 14 patients atteints de cette maladie depuis moins de deux ans et âgés de moins de 65 ans[203].
Stimulation électrique de la moelle spinale
[modifier|modifier le code]Un traitement par stimulation électrique de lamoelle spinaleest également à l'étude et donne endes résultats très prometteurs lors des premiers tests sur des souris et des rats[204],[205].
Immunothérapie
[modifier|modifier le code]Un traitement prometteur à base d’anticorps monoclonauxciblant les dépôts de protéinesα-synucléinespour les détruire[206]est enentré dans la phase II de l’étude clinique avec de 300 patients[83].Le but du traitement est de ralentir le processus dégénératif, voire de le stopper[206].Les patients reçoivent une perfusion par mois.
Antioxydants
[modifier|modifier le code]L'acide urique,mieux connu pour son rôle dans lagoutte,est aussi unantioxydantprésent chez l'homme et les grands singes dont les concentrations sont inversement proportionnelles à la gravité des symptômes dans la maladie de Parkinson[207].La susceptibilité de la substance noire à l'oxydationest due à sa teneur en fer, qui accélère le taux de production de « rouille » cellulaire. Même la DOPA et la dopamine peuvent devenir toxiques au contact demétaux de transitioncomme le fer et le cuivre. L'acide urique est particulièrement intéressant dans la MP en raison de sa capacité à lier ces métaux, en plus de ses capacités antioxydantes intrinsèques[207].L'acide urique et les autres antioxydants peuvent être mesurés dans des laboratoires spécialisés par l'entremise des hôpitaux et des spécialistes prenant en charge le patient[208].
Injection de venin d'abeille
[modifier|modifier le code]En 2013, à la suite d'une observation clinique à San Francisco[209],des chercheurs ont découvert que l'apamine,un des composants actifs duvenind'abeille,semblait capable de freiner la dégénérescence des neurones dopaminergiques. Ils ont ensuite réalisé des tests sur des souris et ont constaté l'efficacité de cette technique. Chez certaines souris, des effets secondaires ont toutefois également été observés à la suite de l'administration du venin d'abeille. Les chercheurs restent donc prudents, conscients du risque de réactions allergiques potentiellement fatales, mais ont tout de même formulé l'hypothèse que les allergènes contribuaient peut-être à l’effet protecteur des neurones dopaminergiques[210].
Chélateur de fer
[modifier|modifier le code]En 2014, en se basant sur l'hypothèse que dans les maladies neurodégénératives, notamment la maladie de Parkinson, il existe une accumulation du taux deferdans certaines régions du cerveau[211],un essai a été réalisé avec unchélateurde fer, une molécule capable de capturer le fer pour en permettre l'élimination. Ladéfériprone,déjà commercialisée dans le traitement de labêta-thalassémie,a montré à 12 mois de traitement une amélioration des symptômes[212],[213].Cette étude a été infirmée par une autre, menée à plus grande échelle et utilisant ladéfériprone,montrant au contraire, une aggravation des symptômes sous ce traitement[214].
Inhibiteur de neurotoxicité de l'α-synucléine
[modifier|modifier le code]LeCLR01,un inhibiteur de la neurotoxicité de l'α-synucléine, a aboli l'agrégation et la toxicité de cette molécule,in vitro,et a amélioré significativement le phénotype et la survie d'un nouveau modèle animal d'α-synucléinopathie (unpoisson zèbremutant; dans le groupe contrôle, tous les mutants sont morts après deux à trois jours)[215].Selon un documentaire, lemannitolpourrait être efficace pour soigner la maladie de Parkinson. Desessais cliniquesde phase 2 sont en cours en 2020[216].Elles se basent sur une recherche de 2003 montrant que le mannitol agitin vitrocomme un puissant inhibiteur de l'agrégation de la α-synucléine (α-syn) qui suspectée d'être à l'origine de la maladie[217].
Histoire et société
[modifier|modifier le code]Historique
[modifier|modifier le code]
Plusieurs sources anciennes, incluant un papyrus de l'ancienne Égypte, un traité demédecine ayurvédique,laBibleou des textes deGalien,décrivent dessymptômessemblables à ceux observés dans la maladie de Parkinson[218].
AprèsGalien(IIesiècle), on ne retrouve pas de descriptions décrivant un tableau de Parkinson jusqu'auXVIIesiècle[218].AuxXVIIeetXVIIIesiècles, plusieurs auteurs écrivent sur le sujet, notammentSylvius,Gaubius,HunteretChomel[218],[219],[220].
En 1817, un médecin anglais,James Parkinson,publie une description claire et détaillée de six patients présentant les symptômes de la maladie qui porte maintenant son nom, et qu'il dénomme alorsparalysisagitans[221].An Essay on the Shaking Palsydécrit le tremblement de repos caractéristique, la posture et la démarche anormales, la paralysie et la diminution de la force musculaire, ainsi que l'évolution de la maladie au fil du temps[221],[222].Les premiers neurologues à avoir étudié la maladie sontArmand Trousseau,Gowers,Kinnier WilsonetWilhelm Erb.Et particulièrementJean-Martin Charcot,dont les études effectuées entre 1868 et 1881 constituent une étape majeure dans la compréhension de la maladie[221].Il fit entre autres la distinction entre la rigidité, la faiblesse et la bradykinésie et défendit le renommage de la maladie en l'honneur de James Parkinson[221].
En 1911,Frederic Lewydécrit les particules microscopiques présentes dans les cerveaux atteints, plus tard appelées «corps de Lewy[221]». En 1919,Konstantin Tretiakoffrapporte que lasubstantia nigraest la principale structure cérébrale touchée, fait qui ne sera reconnu que tardivement, après d'autres études publiées parRolf Hassleren 1938[221].Les modifications biochimiques au niveau cérébral furent identifiées dans les années 1950, surtout grâce aux travaux deArvid Carlssonsur ladopamine,un neurotransmetteur sécrétée par lelocus nigeret dont la diminution joue un rôle majeur dans la maladie de Parkinson[223].La démonstration d'une diminution cérébrale en dopamine dans la maladie de Parkinson a été publié en 1960 par Ehringer et Hornykiewicz[224].En 1990, Delong publie un modèle du fonctionnement des boucles des ganglions de la base permettant d'expliquer la cause de la triade parkinsonienne[23].En 1997, il est découvert que l'α-synucléine est le composant principal des corps de Lewy[225].En 2003, Braak et collaborateurs publient un modèle de l'évolution anatomopathologique de la maladie de Parkinson sporadique[18].En France, laSécurité socialea reconnu en 2006 un cas de maladie de Parkinson commemaladie professionnellepour un ancien salarié agricole[61].En 2008, pour la première fois, le transfert pathogène de neurone à neurone de l'α-synucléine est démontré chez l'humain: des greffes de neurones issus de fœtus développent les inclusions de Lewy plus d'une décennie après la chirurgie de leur implantation[197],[198],[199].Depuis le,le lien entre la maladie de Parkinson et les pesticides est officiellement reconnu par l'État français avec l'entrée en vigueur du décretno2012-665[62],[63],[64].
Les anticholinergiques et la chirurgie (par lésion dufaisceau pyramidalou desganglions de la base) étaient les seuls traitements disponibles jusqu'à l'arrivée de lalevodopa,qui réduisit considérablement leur utilisation[219],[226].LaLevodopafut synthétisée pour la première fois en 1911 parCasimir Funk,mais on[Qui?]s'y intéressa peu jusqu'au milieu duXXesiècle[223].Elle est entrée dans la pratique clinique en 1967 et a apporté une véritable révolution dans la prise en charge thérapeutique de la maladie de Parkinson[223],[227].À la fin des années 1980, lastimulation cérébrale profondedevint un nouveau traitement possible[228].
Société et médias
[modifier|modifier le code]Personnalités
[modifier|modifier le code]Personnes célèbres atteintes d'unemaladie de Parkinson:
- lechef cuisinierPaul Bocuse[229];
- lepapeJean-Paul II[230];
- lecardinalfrançais à lacurie romaineJean-Louis Tauran[231];
- le prédicateurévangélisteBilly Graham[232];
- l'acteur américano-canadienMichael J. Fox[233];
- le romancier, poète et illustrateur anglais,Mervyn Peake[234];
- potentiellement le boxeur américainMohamed Ali[235],[236];
- le basketteur américainBrian Grant[237];
- le metteur en scène québécoisGilles Carle[238];
- les pilotes automobile françaisPatrick Tambay[239],[240]etJacques Laffite[241];
- le chanteur américainMaurice White[242],membre du groupeEarth, Wind and Fire;
- legénéral Franco[243];
- probablementAdolf Hitler[244];
- l'actrice et humoriste françaiseSylvie Joly[245];
- le chanteur et musicien françaisPierre Vassiliu[246];
- l'acteurBob Hoskins[247];
- lasopranofrançaiseMady Mesplé[248],qui a écritLa voix du corps,un livre sur le sujet;
- l'écrivain et dessinateur humoristique françaisFrançois Cavanna[249];
- la couturièreSonia Rykiel;
- l'actrice britanniqueDeborah Kerr[250];
Notes et références
[modifier|modifier le code]- «Maladie de Parkinson», surCollège des Enseignants de Neurologie,(consulté le)
- (en)X. Mao, M. Tianhao Ou, S.S. Karuppagounder et al., «Pathological α-synuclein transmission initiated by binding lymphocyte-activation gene 3»,Science,vol.353,no6307,(DOI10.1126/science.aah3374,résumé)
- (en)de Lau LM, Breteler MM, «Epidemiology of Parkinson's disease»,Lancet Neurol.,vol.5,no6,,p.525–35(PMID16713924,DOI10.1016/S1474-4422(06)70471-9).
- (en)Lorraine VKaliaet Anthony ELang,«Parkinson's disease»,The Lancet,vol.386,no9996,,p.896–912(DOI10.1016/S0140-6736(14)61393-3,lire en ligne,consulté le)
- (en)«Parkinson's Disease», surNational Institute of Neurological Disorders and Stroke(consulté le)
- Robert P.Lisak,DanielTruong,William M.Carrollet RoongrojBhidayasiri,International neurology,(ISBN978-1-118-77734-3)
- (en)Samii A, Nutt JG, Ransom BR, «Parkinson's disease»,Lancet,vol.363,no9423,,p.1783–93(PMID15172778,DOI10.1016/S0140-6736(04)16305-8).
- (en)Melissa J.Armstronget Michael S.Okun,«Diagnosis and Treatment of Parkinson Disease: A Review»,JAMA,vol.323,no6,,p.548(ISSN0098-7484,DOI10.1001/jama.2019.22360,lire en ligne,consulté le)
- (en)SigurlaugSveinbjornsdottir,«The clinical symptoms of Parkinson's disease»,Journal of Neurochemistry,vol.139,,p.318–324(DOI10.1111/jnc.13691,lire en ligne,consulté le)
- «L-dopa», surpharmacomedicale.org(consulté le)
- «Certains pesticides et solvants augmentent le risque de Parkinson - Neuromedia»,Neuromedia,(lire en ligne,consulté le)
- «Parkinson: où en est la recherche?»,France Inter,(lire en ligne,consulté le)
- DanielEugène,MoniqueGauthier,YvesGioanniet DanielRichard,Neurosciences: tout le cours en fiches: licence, master, médecine,(ISBN978-2-10-058504-5)
- (en)P.D. Smith, S.J. Crocker, V. Jackson-Lewis et al., «Cyclin-dependent kinase 5 is a mediator of dopaminergic neuron loss in a mouse model of Parkinson's disease»,PNAS,vol.100,no23,,p.13650-13655(DOI10.1073/pnas.2232515100,lire en ligne[PDF])
- (en)Dianbo Quet al.,«Role of Cdk5-Mediated Phosphorylation of Prx2 in MPTP Toxicity and Parkinson's Disease»,Neuron,vol.55,no1,,p.37-52(DOI10.1016/j.neuron.2007.05.033,lire en ligne[PDF])
- (en)Serge Przedborski, «Peroxiredoxin-2 links Cdk5 to neurodegeneration»,Nat. Med.,vol.13,,p.907-909(DOI10.1038/nm0807-907)
- Marie Vidailhet,Etienne Hirsch,«Maladie de Parkinson: fera-t-elle toujours trembler la recherche?»,La méthode scientifique,(lire en ligne)
- (en)HeikoBraak,Kelly DelTredici,UdoRübet Rob A.Ide Vos,«Staging of brain pathology related to sporadic Parkinson’s disease»,Neurobiology of Aging,vol.24,no2,,p.197–211(DOI10.1016/S0197-4580(02)00065-9,lire en ligne,consulté le)
- HeikoBraaket KellyDel Tredici,«Neuropathological Staging of Brain Pathology in Sporadic Parkinson’s disease: Separating the Wheat from the Chaff»,Journal of Parkinson's Disease,vol.7,nos1,,S71–S85(PMID28282810,PMCIDPMC5345633,DOI10.3233/JPD-179001,lire en ligne,consulté le)
- Carmen D.Rietdijk,PaulaPerez-Pardo,JohanGarssenet Richard J. A.van Wezel,«Exploring Braak’s Hypothesis of Parkinson’s Disease»,Frontiers in Neurology,vol.8,(ISSN1664-2295,PMID28243222,PMCIDPMC5304413,DOI10.3389/fneur.2017.00037,lire en ligne,consulté le)
- Naomi P.Visanji,Patricia L.Brooks,Lili-NazHazratiet Anthony E.Lang,«The prion hypothesis in Parkinson's disease: Braak to the future»,Acta Neuropathologica Communications,vol.1,no1,,p.2(ISSN2051-5960,PMID24252164,PMCIDPMC3776210,DOI10.1186/2051-5960-1-2,lire en ligne,consulté le)
- (en)Kurt A.Jellinger,«A critical evaluation of current staging of α-synuclein pathology in Lewy body disorders»,Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease,parkinson's Disease,vol.1792,no7,,p.730–740(ISSN0925-4439,DOI10.1016/j.bbadis.2008.07.006,lire en ligne,consulté le)
- (en)Mahlon R.DeLong,«Primate models of movement disorders of basal ganglia origin»,Trends in Neurosciences,vol.13,no7,,p.281–285(ISSN0166-2236,DOI10.1016/0166-2236(90)90110-V,lire en ligne,consulté le)
- Léon Tremblay, «Où en sommes-nous sur la physiopathologie de la maladie de Parkinson?», surAcadémie de médecine,(consulté le)
- William C.Milleret Mahlon R.DeLong,« Altered Tonic Activity of Neurons in the Globus Pallidus and Subthalamic Nucleus in the Primate MPTP Model of Parkinsonism »,dansThe Basal Ganglia II,vol.32, Springer US,(ISBN978-1-4684-5349-2,DOI10.1007/978-1-4684-5347-8_29,lire en ligne),p.415–427
- (en)MichelFilion,LéonTremblayet Paul J.Bédard,«Abnormal influences of passive limb movement on the activity of globus pallidus neurons in parkinsonian monkeys»,Brain Research,vol.444,no1,,p.165–176(DOI10.1016/0006-8993(88)90924-9,lire en ligne,consulté le)
- (en)MathiasPessiglione,DominiqueGuehl,Etienne C.Hirschet JeanFéger,«Disruption of self-organized actions in monkeys with progressive MPTP-induced parkinsonism. I. Effects of task complexity: Task complexity and primate PD-like disorders»,European Journal of Neuroscience,vol.19,no2,,p.426–436(DOI10.1111/j.0953-816X.2003.03088.x,lire en ligne,consulté le)
- (en)DianaKwon,«Does Parkinson's Begin in the Gut?»,Scientific American,(lire en ligne,consulté le).
- (en)MathiasPessiglione,VirginieCzernecki,BernardPillonet BrunoDubois,«An Effect of Dopamine Depletion on Decision-making: The Temporal Coupling of Deliberation and Execution»,Journal of Cognitive Neuroscience,vol.17,no12,,p.1886–1896(ISSN0898-929Xet1530-8898,DOI10.1162/089892905775008661,lire en ligne,consulté le).
- (en)MathiasPessiglione,DominiqueGuehl,CarolineJanet ChantalFrançois,«Disruption of self-organized actions in monkeys with progressive MPTP-induced parkinsonism: II. Effects of reward preference: Reward preference and primate PD-like disorders»,European Journal of Neuroscience,vol.19,no2,,p.437–446(DOI10.1111/j.0953-816X.2003.03089.x,lire en ligne,consulté le)
- (en)Mathias Pessiglione, Dominique Guehl, Yves Agid, Etienne C. Hirsch, Jean Féger et Léon Tremblay, «Impairment of context‐adapted movement selection in a primate model of presymptomatic Parkinson’s disease»,Brain,,p.1392-1408(lire en ligne)
- (en)G EAlexander,M RDeLonget P LStrick,«Parallel Organization of Functionally Segregated Circuits Linking Basal Ganglia and Cortex»,Annual Review of Neuroscience,vol.9,no1,,p.357–381(ISSN0147-006Xet1545-4126,DOI10.1146/annurev.ne.09.030186.002041,lire en ligne,consulté le)
- (en)PhilippeRemy,MiroslavaDoder,AndrewLeeset NoraTurjanski,«Depression in Parkinson's disease: loss of dopamine and noradrenaline innervation in the limbic system»,Brain,vol.128,no6,,p.1314–1322(ISSN1460-2156et0006-8950,DOI10.1093/brain/awh445,lire en ligne,consulté le)
- (en)Richard Levy et Bruno Dubois, «Apathy and the functional anatomy of the prefrontal cortex-basal ganglia circuits»,Cerebral Cortex,,p.916-28(lire en ligne)
- (en)AudreyMaillet,PaulKrack,EugénieLhomméeet EliseMétéreau,«The prominent role of serotonergic degeneration in apathy, anxiety and depression in de novo Parkinson’s disease»,Brain,vol.139,no9,,p.2486–2502(ISSN0006-8950et1460-2156,DOI10.1093/brain/aww162,lire en ligne,consulté le)
- TingWanget Jesse C.Hay,«Alpha-synuclein Toxicity in the Early Secretory Pathway: How It Drives Neurodegeneration in Parkinsons Disease»,Frontiers in Neuroscience,vol.9,(ISSN1662-4548,PMID26617485,PMCID4641903,DOI10.3389/fnins.2015.00433,lire en ligne,consulté le)
- J.-P.Brandel,A.-G.Corbillé,P.Derkinderenet S.Haïk,«La maladie de Parkinson est-elle une maladie à prion?»,Revue Neurologique,vol.171,no12,,p.812–824(ISSN0035-3787,PMID26563663,PMCID7111738,DOI10.1016/j.neurol.2015.10.005,lire en ligne,consulté le)
- (en)C.M. Tanner, R. Ottman, S.M. Goldman, J. Ellenberg, P. Chan, R. Mayeux et J.W. Langston, «Parkinson Disease in Twins: An Etiologic Study»,JAMA,vol.281,(lire en ligne)
- (en)«Ageing and Parkinson's disease: Why is advancing age the biggest risk factor?»,Ageing Research Reviews,vol.14,,p.19–30(ISSN1568-1637,DOI10.1016/j.arr.2014.01.004,lire en ligne,consulté le)
- «Le lien entre la maladie de Parkinson et les pesticides officiellement reconnu»,Le Monde.fr,(lire en ligne,consulté le)
- bệnh parkinson có chữa được không
- (en)Lesage S, Brice A, «Parkinson's disease: from monogenic forms to genetic susceptibility factors»,Hum Mol Genet.,vol.18,noR1,,R48–59(PMID19297401,DOI10.1093/hmg/ddp012)
- (en)Healy DG, Falchi M, O-Sullivan SSet al.« Phenotype, genotype, and worldwide genetic penetrance of LRRK2-associated Parkinson's disease: a case-control study »Lancet Neurol.2008;7: 583-590
- Suzanne Lesage,« LRRK2, gène majeur de la maladie de Parkinson dans les pays du Maghreb »Med Sci. (Paris)2006;22(5):470-471.
- MatthiasElstner,Christopher M.Morris,KatharinaHeimet PeterLichtner,«Single-cell expression profiling of dopaminergic neurons combined with association analysis identifies pyridoxal kinase as Parkinson's disease gene»,Annals of Neurology,vol.66,no6,,p.792–798(ISSN1531-8249,PMID20035503,PMCID4034432,DOI10.1002/ana.21780,lire en ligne,consulté le)
- P. GithureM'Angaleet Brian E.Staveley,«A loss of Pdxk model of Parkinson disease in Drosophila can be suppressed by Buffy»,BMC research notes,vol.10,no1,,p.205(ISSN1756-0500,PMID28606139,PMCID5468966,DOI10.1186/s13104-017-2526-8,lire en ligne,consulté le)
- (en)«Gastric α-synuclein immunoreactive inclusions in Meissner's and Auerbach's plexuses in cases staged for Parkinson's disease-related brain pathology»,Neuroscience Letters,vol.396,no1,,p.67–72(ISSN0304-3940,DOI10.1016/j.neulet.2005.11.012,lire en ligne,consulté le)
- (en)StaffanHolmqvist,OldriskaChutna,LucBoussetet PatrickAldrin-Kirk,«Direct evidence of Parkinson pathology spread from the gastrointestinal tract to the brain in rats»,Acta Neuropathologica,vol.128,no6,,p.805–820(ISSN0001-6322et1432-0533,DOI10.1007/s00401-014-1343-6,lire en ligne,consulté le)
- ElisabethSvensson,ErzsébetHorváth-Puhó,Reimar W.Thomsenet Jens ChristianDjurhuus,«Vagotomy and subsequent risk of Parkinson's disease»,Annals of Neurology,vol.78,,p.522-529(ISSN1531-8249,PMID26031848,DOI10.1002/ana.24448,lire en ligne,consulté le)
- HoracioKaufmann,«Cutting the vagal highway blocks one point of entry for prion-like alpha-synuclein»,Annals of Neurology,vol.78,,p.520-521(ISSN1531-8249,PMID26224086,DOI10.1002/ana.24492,lire en ligne,consulté le)
- (en-GB)FionaMacDonald,«New Evidence Suggests Parkinson's Might Start in The Gut, Not The Brain»,ScienceAlert,(lire en ligne,consulté le)
- (en)Timothy R.Sampson,Justine W.Debelius,TarenThronet StefanJanssen,«Gut Microbiota Regulate Motor Deficits and Neuroinflammation in a Model of Parkinson’s Disease»,Cell,vol.167,no6,,p.1469–1480.e12(ISSN0092-8674,DOI10.1016/j.cell.2016.11.018,lire en ligne,consulté le)
- (en)«Gut microbes promote motor deficits in a mouse model of Parkinson's disease»,ScienceDaily,(lire en ligne,consulté le)
- (en)Blanchet PJ, Calon F, Morisette M, Tahar AH, Bélanger N, Samadi Pershia, Grondin R, Grégoire L, Meltzer L et & al, «Relevance of the MPTP primate model in the study of dyskinesia priming mechanisms»,Parkinsonism & Rekated Disorders,vol.10,,p.297-304(ISSN1353-8020,lire en ligne)
- (en)Veterans and Agent Orange: Update 2008,Washington, The National Academies press,(ISBN0-309-13884-1,lire en ligne),« Neurologic disorders »,p.510–45
- Nicolas GutierrezC,«Parkinson: un lien de cause à effet avec plusieurs pesticides?», surSciences et Avenir,(consulté le)
- (en)A Ascherio, H Chen, M Weisskopf, E O'Reilly, M McCullough, E Calle, M Schwarzschild, M Thun,Pesticide exposure and risk for Parkinson's disease,Annals of Neurology, 2006;60;197-203
- (en)Giasson BI, Lee VMY,A new link between pesticides and Parkinson's disease,Nature Neuroscience, 2000;3:1227-1228
- (en)Wang A, Costello S, Cockburn Met al.Parkinson’s disease risk from ambient exposure to pesticides,Europ J Epidemiol, 2011DOI10.1007/s10654-011-9574-5
- (en)Tanner CM, Kamel F, Ross GW,et al.,«Rotenone, Paraquat and Parkinson's Disease»,Environ Health Perspect.,(PMID21269927,DOI10.1289/ehp.1002839)
- avec AFP, «Parkinson: les pesticides doublent le risque chez les agriculteurs»,Le Monde.fr,(lire en ligne)
- Angela Bolis, «Le lien entre la maladie de Parkinson et les pesticides officiellement reconnu»,Le Monde.fr,(lire en ligne)
- «Le lien entre la maladie de Parkinson et les pesticides enfin reconnu»,L'Humanité.fr,(lire en ligne)
- Décret n° 2012-665 du 4 mai 2012 révisant et complétant les tableaux des maladies professionnelles en agriculture annexés au livre VII du code rural et de la pêche maritime,(lire en ligne)
- «Parkinson et emploi», surFrance Parkinson(consulté le)
- (en)G.Pezzoliet E.Cereda,«Exposure to pesticides or solvents and risk of Parkinson disease»,Neurology,vol.80,no22,,p.2035–2041(ISSN0028-3878et1526-632X,DOI10.1212/WNL.0b013e318294b3c8,lire en ligne,consulté le)
- «Maladie de Parkinson: les solvants organiques sont liés à des symptômes plus sévères»,Caducee.net,(lire en ligne,consulté le)
- (en)Samuel M.Goldman,Patricia J.Quinlan,G. WebsterRosset ConnieMarras,«Solvent exposures and parkinson disease risk in twins»,Annals of Neurology,vol.71,no6,,p.776–784(ISSN0364-5134,PMID22083847,PMCIDPMC3366287,DOI10.1002/ana.22629,lire en ligne,consulté le)
- (en)Meredith Wadman, «Widely used chemical strongly linked to Parkinson’s disease»,Science,(DOI10.1126/science.adi7403
 ).
).
- (en)Samuel M. Goldman, Frances M. Weaver, Kevin T. Stroupe, Lishan Cao, Beverly Gonzalezet al.,«Risk of Parkinson Disease Among Service Members at Marine Corps Base Camp Lejeune»,JAMA Neurology,(DOI10.1001/jamaneurol.2023.1168
 ).
).
- Azizova TV, Bannikova MV, Grigoryeva ES, Rybkina VL, Hamada N,Occupational exposure to chronic ionizing radiation increases risk of Parkinson's disease incidence in Russian Mayak workers,Int J Epidemiol, 2020;49:435-447
- Collège des enseignants de neurologie,référentiel national,(lire en ligne)
- (en)Rugbjerg K, Ritz B, Korbo L, Martinussen N, Olsen JH,Risk of Parkinson’s disease after hospital contact for head injury: population based case-control study,BMJ, 2008;337:a2494
- Agence française de sécurité sanitaire des aliments,«Avis de l’Agence française de sécurité sanitaire des aliments relatif aux risques liés à la consommation de corossol et de ses préparations»,saisine n° 2008-SA-0171,,p.2(lire en ligne)
- (en)DrTesterman Traci,«Bacteria 'linked' to Parkinson's disease»,BBC Online,consulté le 23 mai 2011.
- (en)Hashim H, Azmin S, Razlan H, Yahya NW, Tan HJ, Manaf MR, Ibrahim NM, «Eradication ofHelicobacter pyloriinfection improves levodopa action, clinical symptoms and quality of life in patients with Parkinson's disease»,PLoS One,vol.9,no11,,e112330.(PMID25411976,PMCIDPMC4239049,DOI10.1371/journal.pone.0112330,lire en ligne[html])
- Vayu Maini Rekdal & al. (2019) « Discovery and inhibition of an interspecies gut bacterial pathway for Levodopa metabolism »; science 14 Jun 2019:Vol. 364, Issue 6445, eaau6323; DOI: 10.1126/science.aau6323https://science.sciencemag.org/content/364/6445/eaau6323
- (en)Allam MF, Campbell MJ, Hofman A, Del Castillo AS, Navajas R Fernández-Crehuet,Smoking and Parkinson's disease: systematic review of prospective studies,Mov Disord, 2004;19:614-621
- (en)Castagnoli K, Murugesan T, «Tobacco leaf, smoke and smoking, MAO inhibitors, Parkinson's disease and neuroprotection; are there links?»,Neurotoxicology,vol.25,nos1–2,,p.279–91(PMID14697903,DOI10.1016/S0161-813X(03)00107-4)
- (en)http://clinicaltrials.gov/ct2/show/NCT00873392?term=nicotine+parkinson&rank=1
- Présentation de l'essai cliniqueNicopark2sur le site de l'OMS.
- (en-US)«The NIC-PD-study –A randomized, placebo-controlled, double-blind, multi-centre trial to assess the disease-modifying potential of transdermal nicotine in early Parkinson‘s disease in Germany and N. America», surMDS Abstracts(consulté le)
- «L’immunothérapie, enfin une avancée pour les malades de Parkinson»,leparisien.fr,(lire en ligne,consulté le)
- (en)Costa J, Lunet N, Santos C, Santos J, Vaz-Carneiro A, «Caffeine exposure and the risk of Parkinson's disease: a systematic review and meta-analysis of observational studies»,J. Alzheimers Dis.,vol.20,noSuppl 1,,S221–38(PMID20182023,DOI10.3233/JAD-2010-091525)
- (en)Hernán MA, Takkouche B, Caamaño-Isoma Fet al.A meta-analysis of coffee drinking, cigarette smoking, and risk of Parkinson’s disease,Ann Neurol, 2002;52:276–84
- (en)Bousquet M, Calon F et Cicchetti F, «Impact of omega-3 fatty acids in Parkinson's disease»,Ageing Research Reviews,,p.453-463(ISSN1568-1637,lire en ligne)
- (en)AvrilMetcalfe‐Roach,Adam C.Yu,EllaGolzet MihaiCirstea,«MIND and Mediterranean Diets Associated with Later Onset of Parkinson's Disease»,Movement Disorders,vol.36,no4,,p.977–984(ISSN0885-3185et1531-8257,PMID33404118,PMCIDPMC8248352,DOI10.1002/mds.28464,lire en ligne,consulté le)
- Martha ClareMorris,Diet for the mind: the latest science on what to eat to prevent Alzheimer's and cognitive decline -- from the creator of the mind diet,(ISBN978-0-316-44115-5)
- (en)Martha ClareMorris,Christy C.Tangney,YaminWanget Frank M.Sacks,«MIND diet associated with reduced incidence of Alzheimer's disease»,Alzheimer's & Dementia,vol.11,no9,,p.1007–1014(ISSN1552-5260et1552-5279,PMID25681666,PMCIDPMC4532650,DOI10.1016/j.jalz.2014.11.009,lire en ligne,consulté le)
- (en)AvrilMetcalfe‐Roach,Adam C.Yu,EllaGolzet MihaiCirstea,«MIND and Mediterranean Diets Associated with Later Onset of Parkinson's Disease»,Movement Disorders,vol.36,no4,,p.977–984(ISSN0885-3185et1531-8257,PMID33404118,PMCIDPMC8248352,DOI10.1002/mds.28464,lire en ligne,consulté le)
- «Prévenir la maladie de Parkinson en mangeant des poivrons?»,CARE STORE / PASOLO.com,(lire en ligne,consulté le)
- SamaRahnemayan,Sasan GhazanfarAhari,RezaRikhtegaret SevdaRiyahifar,«An umbrella review of systematic reviews with meta-analysis on the role of vitamins in Parkinson's disease»,Acta Neurologica Belgica,(ISSN2240-2993,PMID35920987,DOI10.1007/s13760-022-02055-3,lire en ligne,consulté le)
- SepideTalebi,Seyed MojtabaGhoreishy,AhmadJayediet NikolajTravica,«Dietary Antioxidants and Risk of Parkinson's Disease: A Systematic Review and Dose-Response Meta-analysis of Observational Studies»,Advances in Nutrition (Bethesda, Md.),vol.13,no5,,p.1493–1504(ISSN2156-5376,PMID35030236,PMCID9526846,DOI10.1093/advances/nmac001,lire en ligne,consulté le)
- «Parkinson: la gymnastique, un effort salvateur pour freiner la maladie»,Médecine, santé, forme et bien-être - Ma santé,(lire en ligne,consulté le)
- (en)Miller-Patterson C, Hsu JY, Willis AW, Hamedani AG., «Functional Impairment in Individuals With Prodromal or Unrecognized Parkinson Disease»,JAMA Neurology,American Medical Association,(ISSN2168-6149et2168-6157,OCLC828795097,DOI10.1001/JAMANEUROL.2022.4621).
- Magali Régnier, «Parkinson: ces symptômes perceptibles jusqu'à 3 ans avant le diagnostic», surDoctissimo,
- Internet Archive. org:Présentation et accès au livre;Charcot, J. M. (Jean Martin), 1825-1893; Bourneville, b. 1840 Volume: 2 Subject: Nervous system -- Diseases Ed: A. Delahaye, Paris)
- Santé publique France, «Fréquence de la maladie de Parkinson en France en 2015 et évolution jusqu’en 2030»,Bull Epidémiol Hebd,,p.128-40(lire en ligne).
- «Syndrome parkisonien», surCollège des Enseignants de Neurologie,(consulté le)
- (en)Fil A., Cano-de-la-Cuerda R., Muñoz-Hellín E., Vela L, Ramiro-González M. et Fernández-de-las-Peñas C., «Pain in Parkinson disease: A review of the literature»,Parkinsonism & Related Disorders,vol.19,no3,,p.285–294(ISSN1353-8020,DOI10.1016/j.parkreldis.2012.11.009,lire en ligne,consulté le)
- (en)PaoloBarone,GabriellaSantangelo,MariannaAmboniet Maria TeresaPellecchia,«Pisa syndrome in Parkinson's disease and parkinsonism: clinical features, pathophysiology, and treatment»,The Lancet Neurology,vol.15,no10,,p.1063–1074(DOI10.1016/S1474-4422(16)30173-9,lire en ligne,consulté le)
- (en)MohammadEtoom,MohammadAlwardat,Ala’ S.Aburubet FrancescoLena,«Therapeutic interventions for Pisa syndrome in idiopathic Parkinson's disease. A Scoping Systematic Review»,Clinical Neurology and Neurosurgery,vol.198,,p.106242(DOI10.1016/j.clineuro.2020.106242,lire en ligne,consulté le)
- (en)DagAarsland,LuciaBatzu,Glenda M.Hallidayet Gert J.Geurtsen,«Parkinson disease-associated cognitive impairment»,Nature Reviews Disease Primers,vol.7,no1,,p.47(ISSN2056-676X,DOI10.1038/s41572-021-00280-3,lire en ligne,consulté le)
- (en)M.Pandya,C. S.Kubuet M. L.Giroux,«Parkinson disease: Not just a movement disorder»,Cleveland Clinic Journal of Medicine,vol.75,no12,,p.856-864(DOI10.3949/ccjm.75a.07005)
- (en)AleksandraKudlicka,LindaClareet John V.Hindle,«Executive functions in Parkinson's disease: Systematic review and meta-analysis»,Movement Disorders,vol.26,no13,,p.2305–2315(DOI10.1002/mds.23868,lire en ligne,consulté le)
- (en)S. E.Starkstein,H. S.Mayberg,R.Leiguardaet T. J.Preziosi,«A prospective longitudinal study of depression, cognitive decline, and physical impairments in patients with Parkinson's disease.»,Journal of Neurology, Neurosurgery & Psychiatry,vol.55,no5,,p.377–382(ISSN0022-3050et1468-330X,PMID1602311,PMCIDPMC489079,DOI10.1136/jnnp.55.5.377,lire en ligne,consulté le)
- MartineRoussel,EugénieLhommée,PaulineNarmeet VirginieCzernecki,«Dysexecutive syndrome in Parkinson’s disease: the GREFEX study»,Aging, Neuropsychology, and Cognition,vol.24,no5,,p.496–507(ISSN1382-5585,PMID27585478,DOI10.1080/13825585.2016.1226248,lire en ligne,consulté le)
- (en)OlivierGodefroy,OlivierMartinaud,PaulineNarmeet Pierre-AlainJoseph,«Dysexecutive disorders and their diagnosis: A position paper»,Cortex,vol.109,,p.322–335(DOI10.1016/j.cortex.2018.09.026,lire en ligne,consulté le)
- (en)Sarah JGetzet BonnieLevin,«Cognitive and Neuropsychiatric Features of Early Parkinson's Disease»,Archives of Clinical Neuropsychology,vol.32,no7,,p.769–785(ISSN0887-6177et1873-5843,DOI10.1093/arclin/acx091,lire en ligne,consulté le)
- (en)FlorentLalys,ClaireHaegelen,MarouaMehriet SophieDrapier,«Anatomo-clinical atlases correlate clinical data and electrode contact coordinates: Application to subthalamic deep brain stimulation»,Journal of Neuroscience Methods,vol.212,no2,,p.297–307(DOI10.1016/j.jneumeth.2012.11.002,lire en ligne,consulté le)
- (en)Thomas DParsons,Steven ARogers,Alyssa JBraatenet Steven PaulWoods,«Cognitive sequelae of subthalamic nucleus deep brain stimulation in Parkinson's disease: a meta-analysis»,The Lancet Neurology,vol.5,no7,,p.578–588(DOI10.1016/S1474-4422(06)70475-6,lire en ligne,consulté le)
- (en)H.M.M.Smeding,J. D.Speelman,M.Koning-Haanstraet P. R.Schuurman,«Neuropsychological effects of bilateral STN stimulation in Parkinson disease: A controlled study»,Neurology,vol.66,no12,,p.1830–1836(ISSN0028-3878et1526-632X,DOI10.1212/01.wnl.0000234881.77830.66,lire en ligne,consulté le)
- (en)A. M.Martínez-Martínez,O. M.Aguilaret C. A.Acevedo-Triana,«Meta-Analysis of the Relationship between Deep Brain Stimulation in Patients with Parkinson’s Disease and Performance in Evaluation Tests for Executive Brain Functions»,Parkinson's Disease,vol.2017,,p.1–16(ISSN2090-8083et2042-0080,PMID28280646,PMCIDPMC5320384,DOI10.1155/2017/9641392,lire en ligne,consulté le)
- (en)KarstenWitt,OliverGranert,ChristineDanielset JensVolkmann,«Relation of lead trajectory and electrode position to neuropsychological outcomes of subthalamic neurostimulation in Parkinson’s disease: results from a randomized trial»,Brain,vol.136,no7,,p.2109–2119(ISSN1460-2156et0006-8950,DOI10.1093/brain/awt151,lire en ligne,consulté le)
- (en)ConorOwens-Walton,DavidJakabek,Brian D.Poweret MarkWalterfang,«Structural and functional neuroimaging changes associated with cognitive impairment and dementia in Parkinson's disease»,Psychiatry Research: Neuroimaging,vol.312,,p.111273(DOI10.1016/j.pscychresns.2021.111273,lire en ligne,consulté le)
- (en)Tysnes OB, Müller B, Larsen JP, «Are dysautonomic and sensory symptoms present in early Parkinson's disease?»,Acta Neurol Scand., Suppl.,no190,,p.72–7(PMID20586740,DOI10.1111/j.1600-0404.2010.01380.x)
- (en)Anthony H. V.Schapira,K. RayChaudhuriet PeterJenner,«Non-motor features of Parkinson disease»,Nature Reviews Neuroscience,vol.18,no7,,p.435–450(ISSN1471-0048,DOI10.1038/nrn.2017.62,lire en ligne,consulté le)
- (en)D.Aarsland,K.Bronnick,J. P.Larsenet O. B.Tysnes,«Cognitive impairment in incident, untreated Parkinson disease: The Norwegian ParkWest Study»,Neurology,vol.72,no13,,p.1121–1126(ISSN0028-3878et1526-632X,DOI10.1212/01.wnl.0000338632.00552.cb,lire en ligne,consulté le)
- (en)Ronald F. Pfeiffer, Iván Bódis-Wollner.Parkinson's disease and nonmotor dysfunction
- (en)Doty RL, Bromley SM, Stern MB.« Olfactory testing as an aid in the diagnosis of Parkinson's disease: development of optimal discrimination criteria »Neurodegeneration1995;4:93-97
- Jeancolas L.et al.,«Voice characteristics from isolated rapid eye movement sleep behavior disorder to early Parkinson's disease»,Parkinsonism Relat Disord.,vol. 95, jan 2022,DOI10.1016/j.parkreldis.2022.01.003
- (en)Stefan T.Schwarz,MohammedAfzal,Paul S.Morganet NinBajaj,«The ‘Swallow Tail’ Appearance of the Healthy Nigrosome – A New Accurate Test of Parkinson's Disease: A Case-Control and Retrospective Cross-Sectional MRI Study at 3T»,PLoS ONE,vol.9,no4,,e93814(ISSN1932-6203,PMID24710392,PMCIDPMC3977922,DOI10.1371/journal.pone.0093814,lire en ligne,consulté le)
- (en)David J.Brooks,«Imaging Approaches to Parkinson Disease»,Journal of Nuclear Medicine,vol.51,no4,,p.596–609(ISSN0161-5505et2159-662X,DOI10.2967/jnumed.108.059998,lire en ligne,consulté le)
- (en)LailaKhedher,Jean-MarieBonny,AnaMarqueset ElodieDurand,«Intrasubject subcortical quantitative referencing to boost MRI sensitivity to Parkinson's disease»,NeuroImage: Clinical,vol.36,,p.103231(PMID36279753,PMCIDPMC9668635,DOI10.1016/j.nicl.2022.103231,lire en ligne,consulté le)
- NadyaPyatigorskaya,Clara B.Sanz-Morère,RahulGauravet EmmaBiondetti,«Iron Imaging as a Diagnostic Tool for Parkinson's Disease: A Systematic Review and Meta-Analysis»,Frontiers in Neurology,vol.11,,p.366(ISSN1664-2295,PMID32547468,PMCIDPMC7270360,DOI10.3389/fneur.2020.00366,lire en ligne,consulté le)
- PhilippMahlknecht,FlorianKrismer,WernerPoeweet KlausSeppi,«Meta-analysis of dorsolateral nigral hyperintensity on magnetic resonance imaging as a marker for Parkinson's disease»,Movement Disorders,vol.32,no4,,p.619–623(ISSN0885-3185,DOI10.1002/mds.26932,lire en ligne,consulté le)
- (en)Kimberly D.Seifertet Jonathan I.Wiener,«The impact of DaTscan on the diagnosis and management of movement disorders: A retrospective study»,Am J Neurodegener Dis.,vol.2,no1,,p.29–34(PMCIDPMC3601468,lire en ligne[html])
- (en)Sven RSuwijn,Caroline JMvan Boheemen,Rob Jde Haanet GerritTissingh,«The diagnostic accuracy of dopamine transporter SPECT imaging to detect nigrostriatal cell loss in patients with Parkinson’s disease or clinically uncertain parkinsonism: a systematic review»,EJNMMI Research,vol.5,no1,,p.12(ISSN2191-219X,PMID25853018,PMCIDPMC4385258,DOI10.1186/s13550-015-0087-1,lire en ligne,consulté le)
- European Medicines Agency. Science Medicines Health., «Résumé EPAR à l'intention du public: DaTSCAN»[PDF],surwww.ema.europa.eu,(consulté le)
- (en)Jackson TylerBoonstra,StijnMichielse,YasinTemelet GovertHoogland,«Neuroimaging Detectable Differences between Parkinson's Disease Motor Subtypes: A Systematic Review»,Movement Disorders Clinical Practice,vol.8,no2,,p.175–192(ISSN2330-1619et2330-1619,PMID33553487,PMCIDPMC7853198,DOI10.1002/mdc3.13107,lire en ligne,consulté le)
- SamanZafaret Sridhara S.Yaddanapudi,« Parkinson Disease »,dansStatPearls,StatPearls Publishing,(PMID29261972,lire en ligne)
- «Mouvements anormaux», surCollège des Enseignants de Neurologie,(consulté le)
- (en)Meseguer E, Taboara R, Sánchez V, Mena MA, Campos V, De Yébenes J García « Life-threatening Parkinsonism induced by kava kava »Mov Disord.2002;17:193-196
- Collège des enseignants de neurologie,Neurologie,Elsevier-Masson,(ISBN978-2-294-74386-3)
- «Troubles de la marche et de l’équilibre - Troubles de la marche et de l’équilibre chez le sujet âgé», surCollège des Enseignants de Neurologie,(consulté le)
- (en)L'olfaction permet de différencier un syndrome parkinsonien d'origine vasculaire d'une maladie de Parkinson
- Document sur le manganismepublié par l'Institut de recherche Robert-Sauvé en Santé et en Sécurité du Travail[PDF]
- (en)Cookson MR, «alpha-Synuclein and neuronal cell death»,Mol Neurodegener.,vol.4,,p.9(PMID19193223,PMCID2646729,DOI10.1186/1750-1326-4-9,lire en ligne)
- (en)Krüger R, Müller T, Riess O, «Involvement of alpha-synuclein in Parkinson's disease and other neurodegenerative disorders»,J Neural Transm.,vol.107,no1,,p.31–40(PMID10809401)
- (en)Berendse HW, Ponsen MM, «Diagnosing premotor Parkinson's disease using a two-step approach combining olfactory testing and DAT SPECT imaging»,Parkinsonism Relat Disord.,vol.15 Suppl 3,,S26–30(PMID20083001,DOI10.1016/S1353-8020(09)70774-6)
- (en)Langston JW, «The Parkinson's complex: parkinsonism is just the tip of the iceberg»,Ann Neurol.,vol.59,no4,,p.591–6(PMID16566021,DOI10.1002/ana.20834)
- (en)«Parkinson's Progress»
- (en)Siderowf A, Stern MB, «Premotor Parkinson's disease: clinical features, detection, and prospects for treatment»,Ann Neurol.,vol.64 Suppl 2,,S139–47(PMID19127581,DOI10.1002/ana.21462)
- «ÉtudeCompas»(version dusurInternet Archive)
- «Communiqué de presse - lancement du Réseau des aidants»(version dusurInternet Archive)
- reseaudesaidants.org,le site Internet du réseau
- (en)Twelves D, Perkins KS, Counsell C.Systematic review of incidence studies of Parkinson's disease,Mov Disord. 2003;18:19-31.
- « Épidémiologie de la maladie de Parkinson »La lettre du neurologuejanvier 2004;p.13-15.
- Bloem BR, Okun MS, Klein C,Parkinson's disease,Lancet, 2021;397:2284-2303
- (en)Lees AJ, Hardy J, Revesz T,Parkinson's disease,Lancet, 2009;373:2055-2066
- (en)«MDS Unified Parkinson's Disease Rating Scale (MDS-UPDRS)», surParkinson's UK(consulté le)
- (en)Werner Poewe, «The natural history of Parkinson’s disease»,Journal of Neurology,vol.253,no7,,vii2–vii6(ISSN1432-1459,DOI10.1007/s00415-006-7002-7,lire en ligne,consulté le)
- (en)Werner Poewe, «The natural history of Parkinson’s disease»,Journal of Neurology,vol.253,noS7,,vii2–vii6(ISSN0340-5354et1432-1459,DOI10.1007/s00415-006-7002-7,lire en ligne,consulté le)
- (en)Jose A.Obeso,Maria C.Rodriguez-Oroz,Christopher G.Goetzet ConcepcionMarin,«Missing pieces in the Parkinson's disease puzzle»,Nature Medicine,vol.16,no6,,p.653–661(ISSN1546-170X,DOI10.1038/nm.2165,lire en ligne,consulté le)
- (en)Valery L.Feigin,EmmaNichols,TahiyaAlamet Marlena S.Bannick,«Global, regional, and national burden of neurological disorders, 1990–2016: a systematic analysis for the Global Burden of Disease Study 2016»,The Lancet Neurology,vol.18,no5,,p.459–480(ISSN1474-4422et1474-4465,PMID30879893,PMCIDPMC6459001,DOI10.1016/S1474-4422(18)30499-X,lire en ligne,consulté le)
- Tanner CM, Ostrem JL,Parkinson’s disease,N Engl J Med, 2024;391:442-452
- (en)Morelli M, Di Paolo T, Wardas J, Calon F, Xiao D et Schwarzschild M.A, «Role of adenosine A2A receptors in parkinsonian motor impairment and L-DOPA-induced motor complications»,Progress in Neurobiology,vol.83,,p.293-309(ISSN0301-0082,lire en ligne)
- (en)Dungo R et Deeks E.D, «Istradefylline: First Global Approval»,Drugs,vol.73,,p.875-882(ISSN1179-1950,lire en ligne)
- «DUODOPA - Lévodopa - Posologie, Effets secondaires, Grossesse», surDoctissimo(consulté le)
- LeWitt PA, Hauser RA, Pahwa R et al.Safety and efficacy of CVT-301 (levodopa inhalation powder) on motor function during off periods in patients with Parkinson's disease: a randomised, double-blind, placebo-controlled phase 3 trial,Lancet Neurol, 2019;18:145-154
- (en)Goetz CG, Wuu J, McDermott MPet al.Placebo response in Parkinson's disease: comparisons among 11 trials covering medical and surgical interventions,Mov Disord, 2008;23:690-699
- Jemima Harrison, Françoise Ducret (trad.de l'anglais), «Ecstasy: une drogue qui soigne?» [« Extasy »],36.9°,université de Manchester,Carlton Production,BBC,Radio télévision suisse,(résumé,lire en ligne[vidéo])
- Haute autorité de santé, «Recommandations de bonnes pratiques. Maladie de Parkinson: Actes et prestations affections de longue durée.»[PDF],surHaute autorité de santé,(consulté le)
- (en)Politis M. et Niccolini F., «Serotonin in Parkinson's disease»,Behavioural Brain Research,vol.277,,p.136-145(ISSN0166-4328,DOI10.1016/j.bbr.2014.07.037,lire en ligne)
- Claire Delaville, Philippe DeDeurwaerdèreet Abdelhamid Benazzouz, «Noradrenaline and Parkinson's disease»,Frontiers in Systems Neuroscience,vol.5,,p.31(ISSN1662-5137,PMID21647359,PMCID3103977,DOI10.3389/fnsys.2011.00031,lire en ligne,consulté le)
- (en)Schapia AHV, Bezard E, Brotchie J, Calon F, Collingridge GL, Ferger B, Hengerer B, Hirsh E et & all, «Novel pharmacological targets for the treatment of Parkinson's disease»,Nature,vol.5,,p.845-854(ISSN1474-1776,lire en ligne)
- Seppi K, Ray Chaudhuri K, Coelho M et al.Update on treatments for nonmotor symptoms of Parkinson’s disease — an evidence-based medicine review,Mov Disord, 2019;34:180-198
- (en)Benazzouz A, Gross C, Féger J,Boraud T,Bioulac B. «Reversal of rigidity and improvement in motor performance by subthalamic high-frequency stimulation in MPTP-treated monkeys»Eur J Neurosci.1993;5(4):382-9.
- Bond AE, Shah BB, Huss DS et al.Safety and efficacy of focused ultrasound thalamotomy for patients with medication-refractory, tremor-dominant Parkinson disease: a randomized clinical trial,JAMA Neurol, 2017;74:1412-1418
- Krishna V, Fishman PS, Eisenberg HM et al.Trial of globus pallidus focused ultrasound ablation in Parkinson’s disease,N Engl J Med, 2023;388:683-693
- Domingos J, Keus SHJ, Dean J, de Vries NM, Ferreira JJ, Bloem BR,The European Physiotherapy Guideline for Parkinson's disease: implications for neurologists,J Parkinsons Dis, 2018;8:499-502
- Radder DLM, Lígia Silva de Lima A, Domingos J et al.Physiotherapy in Parkinson's disease: a meta-analysis of present treatment modalities,Neurorehabil Neural Repair, 2020;34:871-880
- «Physiothérapie pour le traitement de la maladie de Parkinson», surwww.cochrane.org(consulté le)
- Franciele Cascaesda Silva,Rodrigo da RosaIop,Laiana Cândidode Oliveiraet Alice MatheaBoll,«Effects of physical exercise programs on cognitive function in Parkinson’s disease patients: A systematic review of randomized controlled trials of the last 10 years»,PLoS ONE,vol.13,no2,(ISSN1932-6203,PMID29486000,PMCID5828448,DOI10.1371/journal.pone.0193113,lire en ligne,consulté le)
- Mirelman A, Rochester L, Maidan I et al.Addition of a non-immersive virtual reality component to treadmill training to reduce fall risk in older adults (V-TIME): a randomised controlled trial,Lancet, 2016;388:1170-1182
- Rôle du sport sur le circuit de la récompense
- (en)Keus SH, Bloem BR, Hendriks EJet al.Evidence-based analysis of physical therapy in Parkinson's disease with recommendations for practice and research,Mov Disord. 2007;22:451-460
- (en)MoritzErnst,Ann-KristinFolkerts,RominaGollanet EmmaLieker,«Physical exercise for people with Parkinson’s disease: a systematic review and network meta-analysis»,Cochrane Database of Systematic Reviews,vol.2023,no1,(PMID36602886,PMCIDPMC9815433,DOI10.1002/14651858.CD013856.pub2,lire en ligne,consulté le)
- «L'exercice intensif peut aider les malades de Parkinson - L'actu GDD», surblog.pharma-gdd.com(consulté le)
- (en)MargaretSchenkman,Charity G.Moore,Wendy M.Kohrtet Deborah A.Hall,«Effect of High-Intensity Treadmill Exercise on Motor Symptoms in Patients With De Novo Parkinson Disease»,JAMA Neurology,(DOI10.1001/jamaneurol.2017.3517,lire en ligne,consulté le)
- (en)Universita Cattolica del SacroCuore,«Parkinson's disease: Intense exercise may help to keep the disease at bay», surmedicalxpress.com(consulté le)
- Dobkin RD, Mann SL, Interian A, Gara MA, Menza M.Cognitive behavioral therapy improves diverse profiles of depressive symptoms in Parkinson’s diseaseInt J Geriatr, Psychiatry, 2019;34:722-729
- PabloAriaset JavierCudeiro,«Effect of rhythmic auditory stimulation on gait in Parkinsonian patients with and without freezing of gait»,PloS One,vol.5,no3,,e9675(ISSN1932-6203,PMID20339591,PMCID2842293,DOI10.1371/journal.pone.0009675,lire en ligne,consulté le)
- «BeatMove - La musique pour aider à la marche», surBeatMove(consulté le)
- ValérieCochen De Cock,DobromirDotov,LoicDammet SandyLacombe,«BeatWalk: Personalized Music-Based Gait Rehabilitation in Parkinson’s Disease»,Frontiers in Psychology,vol.12,(ISSN1664-1078,PMID33981279,PMCIDPMC8109247,DOI10.3389/fpsyg.2021.655121,lire en ligne,consulté le)
- «Dispositif médical WALK-DTx», surwww.walkmebyresilient.com(consulté le)
- Sandi J.Spaulding,BrittanyBarber,MorganColbyet BronwynCormack,«Cueing and gait improvement among people with Parkinson's disease: a meta-analysis»,Archives of Physical Medicine and Rehabilitation,vol.94,no3,,p.562–570(ISSN1532-821X,PMID23127307,DOI10.1016/j.apmr.2012.10.026,lire en ligne,consulté le)
- Michael H.Thaut,Ruth R.Rice,ThenilleBraun Janzenet Corene P.Hurt-Thaut,«Rhythmic auditory stimulation for reduction of falls in Parkinson's disease: a randomized controlled study»,Clinical Rehabilitation,vol.33,no1,,p.34–43(ISSN1477-0873,PMID30033755,DOI10.1177/0269215518788615,lire en ligne,consulté le)
- Pot-pourri parkinsonien,ouvrage.Nouméa,éd.C. Frémont, 2007, 69p.(OCLC470728325)
- «Orthophonie pour le traitement des troubles de la parole dans la maladie de Parkinson», surwww.cochrane.org(consulté le)
- (en)Marks WJ, Ostrem JL, Verhagen Let al.« Safety and tolerability of intraputaminal delivery of CERE-120 (adeno-associated virus serotype 2-neurturin) to patients with idiopathic Parkinson's disease: an open-label, phaseItrial »Lancet Neurol.2008;7:400-408
- (en)HaoQian,XinjiangKang,JingHuet DongyangZhang,«Reversing a model of Parkinson’s disease with in situ converted nigral neurons»,Nature,vol.582,no7813,,p.550–556(ISSN1476-4687,DOI10.1038/s41586-020-2388-4,lire en ligne,consulté le)
- Nayanah Siva, «L'histoire des neurones jaillis de nulle part»,Courrier International (traduit depuis Nautil.us),no1563,,p.56-57
- ÉléonoreSolé,«Ce traitement guérit définitivement la maladie de Parkinson chez la souris», surFutura(consulté le)
- (en)Freed CR, Greene PE, Breeze REet al.« Transplantation of embryonic dopamine neurons for severe Parkinson's disease »N Engl J Med.2001;344:710-719
- Bega D, Krainc D,Long-term clinical outcomes after fetal cell transplantation in Parkinson disease, implications for the future of cell therapy,JAMA, 2014;311:617-618
- (en)Jeffrey H.Kordower,YapingChu,Robert A.Hauseret Thomas B.Freeman,«Lewy body–like pathology in long-term embryonic nigral transplants in Parkinson's disease»,Nature Medicine,vol.14,no5,,p.504–506(ISSN1546-170X,DOI10.1038/nm1747,lire en ligne,consulté le)
- (en)Jeffrey H.Kordower,YapingChu,Robert A.Hauseret C.WarrenOlanow,«Transplanted dopaminergic neurons develop PD pathologic changes: A second case report»,Movement Disorders,vol.23,no16,,p.2303–2306(DOI10.1002/mds.22369,lire en ligne,consulté le)
- (en)Jia-YiLi,ElisabetEnglund,Janice L.Holtonet DenisSoulet,«Lewy bodies in grafted neurons in subjects with Parkinson's disease suggest host-to-graft disease propagation»,Nature Medicine,vol.14,no5,,p.501–503(ISSN1546-170X,DOI10.1038/nm1746,lire en ligne,consulté le)
- (en)Benninger DH, Berman BD, Houdayer E, Pal N, Luckenbaugh DA, Schneider L, Miranda S, Hallett M., «Intermittent theta-burst transcranial magnetic stimulation for treatment of Parkinson disease»,Neurology.,vol.76,no7,,p.601-9.(PMID21321333,PMCIDPMC3053339,DOI10.1212/WNL.0b013e31820ce6bb,lire en ligne[html],consulté le)
- «Le projet NIR»(consulté le)
- «Parkinson: à Grenoble, des chercheurs veulent tester la "neuroillumination" pour ralentir la maladie», surfrance3-regions.francetvinfo.fr,(consulté le)
- «Ralentir l’évolution de la maladie de Parkinson par la neuroillumination: opération du premier patient d’un nouvel essai clinique», surwww.cea.fr,(consulté le)
- (en)Fuentes R, Petersson P, Siesser WB, Caron MG, Nicolelis MA,« Spinal cord stimulation restores locomotion in animal models of Parkinson's disease »Science2009;323:1578-1582 sciencemag.org]
- « Un simulateur de la moelle épinière offre un nouvel espoir contre Parkinson »Le Point.
- «L’immunothérapie, «un nouvel espoir pour les malades de Parkinson»»,leparisien.fr,(lire en ligne,consulté le)
- (en)Ascherio A, LeWitt PA, Xu K.et al.,«Urate as a predictor of the rate of clinical decline in Parkinson disease»,Arch Neurol.,vol.66,no12,,p.1460–8(PMID19822770,PMCID2795011,DOI10.1001/archneurol.2009.247)
- (en)Schipper HM, «Redox neurology: visions of an emerging subspecialty»,Ann N. Y. Acad Sci.,vol.1012,,p.342–55(PMID15105277)
- « Bee Venom and Its Component Apamin as Neuroprotective Agents in a Parkinson Disease Mouse Model »MyScienceWork
- « Le venin d'abeille contre la maladie de Parkinson »MyScienceWork
- E. C.Hirsch,J. P.Brandel,P.Galleet F.Javoy-Agid,«Iron and aluminum increase in the substantia nigra of patients with Parkinson's disease: an X-ray microanalysis»,Journal of Neurochemistry,vol.56,,p.446-451(ISSN0022-3042,PMID1988548,lire en ligne,consulté le)
- DavidDevos,CarolineMoreau,Jean ChristopheDevedjianet JéromeKluza,«Targeting Chelatable Iron as a Therapeutic Modality in Parkinson's Disease»,Antioxidants & Redox Signaling,vol.21,,p.195-210(ISSN1523-0864,PMID24251381,PMCID4060813,DOI10.1089/ars.2013.5593,lire en ligne,consulté le)
- «Association France Parkinson», surwww.franceparkinson.fr(consulté le)
- Devos D, Labreuche J, Rascol O et al. [Devos D, Labreuche J, Rascol O, et al. Trial of deferiprone in Parkinson’s disease. N Engl J Med 2022;387:2045-2055Trial of deferiprone in Parkinson’s disease], N Engl J Med, 2022;387:2045-2055
- (en)S.Prabhudesai,S.Sinha,A.Attar,A.Kotagiri,AG.Fitzmaurice,R.Lakshmanan,MI.Ivanova,JA.Looet FG.Klärner,«A Novel Molecular Tweezer Inhibitor of α-Synuclein Neurotoxicity in Vitro and in Vivo»,Neurotherapeutics,(PMID22373667,DOI10.1007/s13311-012-0105-1)
- (en-US)HawkenMiller,«Parkinson's Patient Brings Awareness to Mannitol Supplement in Documentary»(consulté le)
- RonitShaltiel-Karyo,MoranFrenkel-Pinter,EdwardRockensteinet ChristinaPatrick,«A blood-brain barrier (BBB) disrupter is also a potent α-synuclein (α-syn) aggregation inhibitor: a novel dual mechanism of mannitol for the treatment of Parkinson disease (PD)»,The Journal of Biological Chemistry,vol.288,no24,,p.17579–17588(ISSN1083-351X,PMID23637226,PMCID3682557,DOI10.1074/jbc.M112.434787,lire en ligne,consulté le)
- (es)García Ruiz PJ, «Prehistoria de la enfermedad de Parkinson» [« [Prehistory of Parkinson's disease] »],Neurologia,vol.19,no10,,p.735–7(PMID15568171)
- (en)Lanska DJ, «Chapter 33: the history of movement disorders»,Handb Clin Neurol.,vol.95,,p.501–46(PMID19892136,DOI10.1016/S0072-9752(08)02133-7)
- (en)Koehler PJ, Keyser A, «Tremor in Latin texts of Dutch physicians: 16th–18th centuries»,Mov Disord.,vol.12,no5,,p.798–806(PMID9380070,DOI10.1002/mds.870120531)
- (en)Lees AJ, «Unresolved issues relating to the shaking palsy on the celebration of James Parkinson's 250th birthday»,Mov Disord.,vol.22,noSuppl 17,,S327–34(PMID18175393,DOI10.1002/mds.21684)
- (en)Louis ED, «The shaking palsy, the first forty-five years: a journey through the British literature»,Mov Disord.,vol.12,no6,,p.1068–72(PMID9399240,DOI10.1002/mds.870120638)
- (en)Fahn S, «The history of dopamine and levodopa in the treatment of Parkinson's disease»,Mov Disord.,vol.23,noSuppl 3,,S497–508(PMID18781671,DOI10.1002/mds.22028)
- (de)Ehringer, H. & Hornykiewicz, O., «Verteilung von noradrenalin und dopamin (3-hydroxytyramin) in gerhirn des menshenen und ihr verhalten bei erkankungen des extrapyramidalen systems»,Klin Wochenschr.,vol.38,,p.1236-9
- (en)Schulz-Schaeffer WJ, «The synaptic pathology of alpha-synuclein aggregation in dementia with Lewy bodies, Parkinson's disease and Parkinson's disease dementia»,Acta Neuropathol.,vol.120,no2,,p.131–43(PMID20563819,PMCID2892607,DOI10.1007/s00401-010-0711-0)
- (en)Guridi J, Lozano AM, «A brief history of pallidotomy»,Neurosurgery,vol.41,no5,,p.1169–80; discussion 1180–3(PMID9361073,DOI10.1097/00006123-199711000-00029)
- (en)Hornykiewicz O, «L-DOPA: from a biologically inactive amino acid to a successful therapeutic agent»,Amino Acids,vol.23,nos1–3,,p.65–70(PMID12373520,DOI10.1007/s00726-001-0111-9)
- (en)Coffey RJ, «Deep brain stimulation devices: a brief technical history and review»,Artif Organs,vol.33,no3,,p.208–20(PMID18684199,DOI10.1111/j.1525-1594.2008.00620.x)
- «Paul Bocuse souffrait de la maladie de Parkinson, comme 150.000 Français», surLe HuffPost,(consulté le)
- «Vatican - Le pape souffre de la maladie - de Parkinson -», surL'Orient-Le Jour,(consulté le)
- «Cardinal who led opposition to US invasion of Iraq dies at 75», surweb.archive.org,(consulté le)
- (en)«CBC News Indepth: Billy Graham»
- (en-US)«Michael J. Fox reflects 30 years after Parkinson's diagnosis: "I still am Mr. Optimist"», surwww.cbsnews.com(consulté le)
- (en)admin,«Creative and living with Parkinson’s? Showcase your work in the Mervyn Peake Awards», surParkinson's Life,(consulté le)
- (en-US)Robert Mcg ThomasJr,«CHANGE IN DRUG HELPS ALI IMPROVE»,The New York Times,(ISSN0362-4331,lire en ligne,consulté le)
- (en-GB)«Muhammad Ali: Boxer's battle with Parkinson’s»,BBC News,(lire en ligne,consulté le)
- NicolasMeichel,«Brian Grant et son combat contre la maladie de Parkinson: "Même si la maladie veut vous éteindre, il faut rester actif"», surTrashTalk,(consulté le)
- «Gilles Carle, réalisateur québécois»,Le Monde.fr,(lire en ligne,consulté le)
- «Patrick Tambay, ancien pilote de F1, est mort», surL'Équipe(consulté le)
- «L'Équipe - L'actualité du sport en continu.», surL'Équipe(consulté le)
- «Jacques Laffite révèle qu'il est atteint du syndrome de la maladie de Parkinson», surwww.autonewsinfo.com(consulté le)
- «Maurice White, chanteur d’Earth, Wind & Fire, est mort»,Le Monde.fr,(lire en ligne,consulté le)
- Delphine LeFeuvre,«Franco: portrait du dictateur espagnol en 10 dates», surGeo.fr,(consulté le)
- (en)Adolf Hitler's Parkinson's disease and an attempt to analyse his personality structure,Franz Gerstenbrand, Elisabeth Karamat, Ludwig Boltzmann Institut für Restaurafive Neurologie, Neurologisches Krankenhaus Maria Theresien Schlössl, Hofzeile 18–20, A-1190 Wien, Austria b A-2020 Oberfellabrunn 72, Austria
- Sylvie Joly souffre de la maladie de Parkinson,Libération,8 octobre 2010
- Pure People,29 juillet 2011
- Bob Hoskins prend sa retraite à cause de la maladie de Parkinson,Première,8 août 2012
- Mesplé M,J’ai appris que j'avais la maladie de ParkinsonParis-Match, 18 janvier 2011
- « Quand François Cavanna racontait sa lutte contre la maladie de Parkinson »,surfrancetvinfo.fr,(consulté le)
- «L'actrice Deborah Kerr est décédée à l'âge de 86 ans»,Le Monde.fr,(ISSN1950-6244,lire en ligne,consulté le)
Voir aussi
[modifier|modifier le code]Bibliographie
[modifier|modifier le code]- Chantal Hausser-Hauw (préf.Didier Robillard),La maladie de Parkinson,Paris,PUF,coll.«Que sais-je?»,,128p.(ISBN978-2-13-079568-1,ISSN0768-0066)
Articles connexes
[modifier|modifier le code]- Clinatec
- Corossol(neurotoxicitédes fruits de la famille desannonacées)
- Syndrome de dysrégulation dopaminergique
- DJ-1
- Trouble comportemental en sommeil paradoxal
Liens externes
[modifier|modifier le code]
- Ressources relatives à la santé:
- Notices dans des dictionnaires ou encyclopédies généralistes:
- Recommandations de la Haute Autorité de Santé
- Site de l'Association France Parkinson
- Site de l'Association belge Parkinson
- Site de l'Association suisse Parkinson
- Institut du cerveau: Recherche sur la maladie de Parkinson

