Récepteur antigénique chimérique

Unrécepteur antigénique chimérique(de l'anglaischimeric antigen receptorou CAR) est une molécule créée en laboratoire pour permettre auxcellules immunitairesde reconnaître et de cibler desprotéinesprésentes à la surface d'autres cellules, par exemple présentes à la surface de cellules tumorales[1].
Les CAR font partie d'une série d'avancées prometteuses dans la lutte contre le cancer grâce au développement dethérapies adoptives de transfert de cellules[1],[2].Deslymphocytesdu patient sont prélevés puis génétiquement modifiés pour les doter d'un récepteur CAR spécifique d'un antigène exprimé par les cellules tumorales du patient. Les cellules immunitaires, réintroduites dans le patient, peuvent alors reconnaître et tuer les cellules cancéreuses.
La création de lymphocytes allogéniques, pouvant être administrés à un grand nombre de patients, est également explorée et a déjà permis de soigner avec succès[3].Les traitementsYescartaetKymriah,commercialisés aux États-Unis en 2017, utilisent cette approche.
Au sein de l'Union Européenne, ces traitements sont commercialisés sous le statut de "médicaments de thérapie innovante" et plus particulièrement de "médicament dethérapie génique"[4].
Historique
[modifier|modifier le code]Le concept de traitement génétique par lymphocytes T a été développé dans lesannées 1980par un immunologiste israélien au Weizmann Institute of Science et au Tel Aviv Sourasky Medical Center Zelig Eshhar et ses collègues, qui ont créé les premiers lymphocytes T CAR fonctionnels en 1989.
Les premiers traitements avec des lymphocytes T universels ont été mis sur le marché en 2017. Ils sont efficaces sur les cancers dits « liquides », tels lesleucémieset leslymphomes[5].
Dans lesannées 2010,des oncologues comme Katayoun Rezvani travaillent sur deslymphocytes NK-CAR, qui pourraient être mieux tolérés.
Concept
[modifier|modifier le code]
CAR de première génération
[modifier|modifier le code]Lerécepteur des lymphocytes T(TCR) reconnaît l'antigène ciblé sous la forme d'un court peptide présenté par les molécules ducomplexe majeur d'histocompatibilitéalors que lerécepteur des lymphocytes B,comme lesanticorps,reconnaît l'antigène natif. Il est possible de produire un récepteur hybride comprenant la partie extracellulaire du récepteur des lymphocytes B fusionnée génétiquement à la partie intracellulaire du récepteur de lymphocytes T. Plus précisément, on fusionne le module de reconnaissance du lymphocyte B (en général sous la forme d'un sc-FV,single chain variable fragment) avec le domaine activateur du lymphocyte T, c'est-à-dire la chaineCD3ζ. Le récepteur ainsi obtenu (CAR de première génération), une fois exprimé dans un lymphocyte T, redirige ce dernier contre des cellules exprimant l'antigène ciblé par le module de reconnaissance[6],[7],[8].Cependant, la seule reconnaissance de l'antigène par le lymphocyte T ne suffit pas à produire une activation complète, et peut même rendre le lymphocyte T anergique[9].De fait, les premiers essais cliniques avec des CAR de première génération furent plutôt décevants.
CAR de deuxième génération
[modifier|modifier le code]C'est probablement à D. Campana et ses collègues que revient l'idée d'ajouter au CAR de première génération un module de costimulation, par exemple une séquence dérivée des molécules CD28 ou 4-1BB[10].Lorsque les lymphocytes exprimant un CAR de deuxième génération rencontrent l'antigène ciblé par le CAR à la surface d'une cellule tumorale, ils reçoivent simultanément le signal antigénique (signal 1 transmis par la séquence dérivée du CD3ζ) et le signal de costimulation (signal 2). Les premiers succès thérapeutiques furent observés dès 2011 avec les CAR de deuxième génération développés par les équipes de C. June[11],M. Sadelain[12]et S. Rosenberg[13].
Place des CAR dans les immunothérapies adoptives
[modifier|modifier le code]C'est S. Rosenberg et son équipe qui, dès 1988, traita des patients atteints de mélanome avec des lymphocytes T activés[14].Dans la version la plus simple de cettethérapie cellulaire adoptive,les lymphocytes qui infiltrent la tumeur du patient (et qui donc sont enrichis en lymphocytes dirigés contre les antigènes exprimés par les cellules tumorales) sont prélevés puis amplifiésin vitroavant d'être réinjectés au patient. Ce type d'approche a certes donné des résultats cliniques prometteurs et permis de démontrer la faisabilité d'utiliser des lymphocytes pour combattre les cancers. Cependant, seule une fraction des lymphocytes issus de la tumeurs sont réellement dirigés contre les cellules tumorales. De plus, l'étape d'amplificationin vitroest particulièrement longue et difficile car il faut injecter des dizaines de milliards, voire des centaines de milliards de lymphocytes pour obtenir une certaine efficacité clinique[15].Enfin, les lymphocytes injectés ne persistent que très transitoirement chez le patient et de multiples injections sont nécessaires.
C'est pour pallier ces difficultés que les CAR ont été développés. En effet, l'expression par les lymphocytes modifiés génétiquement du CAR (de première ou de deuxième génération) assure la spécificité vis-à-vis de l'antigène tumoral. Surtout, l'addition du module de costimulation sur les CAR de deuxième génération permet une prolifération des lymphocytesin vivo,c'est-à-dire après leur injection au patient. Certaines études ont reporté des amplificationsin vivod'un facteur > 1000[16],[17].Il suffit alors d'injecter au patient quelques dizaines ou centaines de millions de lymphocytes exprimant le CAR, ce qui est parfaitement faisable. Enfin, comme ils prolifèrentin vivo,les lymphocytes modifiés persistent pendant des semaines, voire des mois.
Traitements
[modifier|modifier le code]Dans les cancers du sang
[modifier|modifier le code]Les premiers résultats cliniques positifs ont été obtenus dans le traitement de leucémies ou de lymphomes à cellules B en ciblant l'antigèneCD19exprimé par les lymphocytes B et les cellules tumorales. Depuis de nombreux autres antigènes exprimés par les cellules tumorales ont été testés et sont en développement. Le premier traitement à base de CAR a été approuvé par laFDAaméricaine enpour le traitement de leucémie chez l'enfant et les jeunes adultes[18]et en octobre de la même année pour le traitement de certainslymphomes non hodgkiniensà grandes cellules B[19].Lors des essais cliniques de traitement deleucémies aiguës lymphoblastiques79 % des patients traités avaient survécu douze mois après traitement. Le coût du traitement appelé Kymriah s'élève à 475 000 dollars américains et n'est facturé qu'en cas de réussite du traitement[18].Cette approche est actuellement réservée aux cas où les autres traitements ont échoué. Les deux tableaux ci-dessous citent quelques-uns des antigènes ciblés testés actuellement en clinique et les cancers correspondants[20].
| Dénomination commune internationale | Nom commercial | Structure | Antigène cible | Indication |
|---|---|---|---|---|
| Tisagenlecleucel | Kymriah | Ectodomain: Anti- CD19; Endodomain: CDζ-4-1BB | CD19 | |
| Axicabtagene ciloleucel | Yescarta | Ectodomain: Anti- CD19; Endodomain: CDζ-CD28 | CD19 | |
| Brexucabtagene autoleucel | Tecartus | Ectodomain: Anti- CD19; Endodomain: CDζ-CD28 | CD19 | |
| Lisocabtagene maraleucel | Breyanzi | Ectodomain: Anti- CD19; Endodomain: CDζ-4-1BB | CD19 | |
| Idecabtagene vicleucel | Abecma | Ectodomain: Anti-BCMA; Endodomain: CDζ-4-1BB | BCMA | |
| Ciltacabtagene autoleucel | Carvykti | Ectodomain: Anti-BCMA; Endodomain: CDζ-4-1BB | BCMA |
| Antigène ciblé | Indications |
|---|---|
| CD19 | Hémopathies à cellules B |
| BCMA | Myélome multiple |
| CD123 | Leucémie aiguë myéloblastique
Syndrome myéloïde dysplasique |
| CD20 | Hémopathies à cellules B |
| CD22 | Hémopathies à cellules B |
| CD38 | Myélome multiple |
| LeY | Leucémie aiguë myéloblastique
Syndrome myéloïde dysplasique |
| ROR1 | Leucémies ROR1+ |
Dans les tumeurs solides
[modifier|modifier le code]il n'existe, à ce jour, aucun traitement approuvé par laFood and Drug Administrationpour un traitement des tumeurs solides par les CAR-T[21].
La première différence majeure entre les tumeurs solides et les tumeurs hématologiques est qu’il est plus difficile de trouver un antigène cible idéal. Contrairement aux cancers tels que laleucémie aiguë lymphoblastiqueou laleucémie lymphoïde chroniquedans lesquels les cellules tumorales expriment universellement le marqueur descellules BCD19, les tumeurs solides expriment rarement un antigène spécifique de la tumeur[22].
Le manque de spécificité de l’antigène tumoral augmente le risque potentiel de toxicité significative hors tumeur sur la cible. Ce fut le cas d’un patient atteint d’un cancer du côlon métastatique qui a reçu une perfusion de cellules CAR T ciblées sur l’antigène HER2 (ERBB2) et est décédé 5 jours plus tard[23].La cause du décès a été attribuée aux faibles niveaux de HER2 sur les cellules épithéliales du poumon, qui ont été attaquées par les CAR. Un autre exemple de toxicité ciblée et hors tumeur a été trouvé avec un CAR anti-GD2 à haute affinité pour le neuroblastome, dans lequel de faibles niveaux de GD2 dans le cerveau ont entraîné une encéphalite mortelle[24].
| Antigène ciblé | Indications |
|---|---|
| c-MET | Mélanome, sein |
| CD133 | Foie, pancréas, cerveau |
| CD171 | Neuroblastome |
| CD70 | pancréas, rein, sein |
| CEA | foie, poumon, colo-rectal, estomac, pancréas |
| EGFR-VIII | Glioblastome |
| EpCAM | foie, estomac, nasopharynx, sein, colon, œsophage, pancréas |
| EphA2 | glioblastome |
| FAP | mésothéliome |
| GD2 | neuroblastome[25],glioblastome, sarcomes, ostéosarcome, mélanome |
| GPC3 | foie, poumon |
| HER2 | sein, ovaire, poumon, glioblastome, sarcomes |
| IL-13Ra2 | glioblastome |
| Mésothéline | col de l'utérus, pancréas, ovaire, poumon |
| MUC1 | foie, poumon, pancréas, sein, glioblastome, estomac, colo-rectal |
| PSCA | pancréas |
| PSMA | prostate, vessie |
| ROR1 | cancers ROR1+ |
| VEGFR2 | mélanome, rein |
Effets secondaires
[modifier|modifier le code]Les deux principaux effets secondaires graves associés au traitement CAR-T sont le syndrome de libération des cytokines et le syndrome de neurotoxicité associé aux cellules effectrices immunitaires chez tous les patients. L’efficacité et la sécurité à long terme de cette approche prometteuse ne sont pas encore disponibles et restent un défi[26],[27],[28]. Le traitement par CAR T cell n’est pas sans risque. Les deux principales complications possibles sont le syndrome de relargage cytokinique (SRC) et les troubles neurologiques. Ceux-ci surviennent dans les jours suivant l’injection du traitement. Ainsi, les services de réanimation et de neurologie de l’hôpital où a lieu le traitement par CAR T cell doivent être prévenus dès le premier jour de l’administration du traitement[29].Chez les enfants une insuffisance rénale aiguë et des anomalies électrolytiques sont décrits comme une complication grave après le traitement CAR-T[30].En Novembre 2023, laF.D.Aannonce qu'elle enquêtait sur des cas de leucémie et de lymphome qui pourraient être en rapport avec le traitement. Sur les environ 30 000 cas de traitement par CAR-T, 33 cas de lymphome et/ou leucémie ont été rapporté. Il est toutefois difficile de prouver que leprocessus de fabricationest en cause[31].
Majeures
[modifier|modifier le code]Syndrome de libération des cytokines
[modifier|modifier le code]C'est une conséquence immédiate de l'activation desmacrophagesliée aux cytokines inflammatoires déclenchée par de grandes quantités d'interfèron-γ libérées par les cellules T activées. Il se traduira le plus souvent par une fièvre intense[32]. La fréquence de ce syndrome dépasse 50% dans beaucoup d'essais thérapeutiques. Sa gravité est très variable mais des décès sont rapportés[33].Ce syndrome doit être reconnu et traité rapidement pour préserver les conséquences potentiellement mortelles et ne pas altérer l’efficacité des récepteurs antigéniques chimériques En cas de syndrome de relargage cytokinique sévère, pouvant se manifester par une chute de la tension artérielle importante ou encore une désaturation en oxygène, le patient sera transféré en réanimation afin d’avoir une prise en charge adaptée[29],[34],[35].La cytokine responsable est supposée être l'interleukine 6.En effet, l'immunosuppression utilisant letocilizumab,un anticorps anti-récepteur de l'interleukine 6, avec ou sans corticostéroïdes, peut inverser le syndrome mais pourrait limiter l'efficacité du traitement par récepteur antigénique chimérique[36].
Syndrome neurotoxique associé aux cellules effectrices immunitaires
[modifier|modifier le code]Les troubles neurologiques peuvent se présenter sous différentes formes:céphalées,confusion,convulsions,coma[34].Ainsi, il est nécessaire de réaliser un examen neurologique quotidien pendant toute la durée de l’hospitalisation et de prévenir les neurologues en cas de complications sévères[29].L'origine de ce syndrome neurotoxique est pour le moment inconnu et le traitement par tocilizumab pourrait l'aggraver[33].
Mineures
[modifier|modifier le code]Les effets secondaires les plus fréquents (incidence supérieure à 20 %) étaient l'hypogammaglobulinémie,lafièvre,lesinfections d'origine non précisée,,lesmaux de tête,la diminution de l'appétit, les épisodes hémorragiques, la coagulopathie, l'hypotension, les nausées, la tachycardie, la diarrhée, les vomissements, la fatigue[37],[38],[39],[40],[41],[42],[43],[44],[45].
Fabrication des récepteurs antigéniques chimériques
[modifier|modifier le code]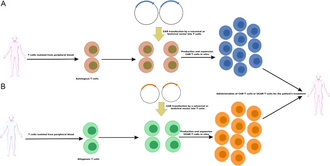
Le processus de fabrication des cellules CAR-T comprend l'isolement des cellules T du donneur, suivi d'une activation efficace, du transfert de gène pour la synthése du récepteur antigénique chimérique, de l'expansion des cellules CAR-T, du phénotypage et d'une analyse de contrôle qualité. Lesleucocytessont prélevés sur des cellules mononucléées du sang périphérique de patients (autologues) ou de donneurs sains (allogéniques). Plusieurs sous-ensembles différents de leucocytes sont utilisés dans les essais cliniques, tels que les cellules T CD3 + , les cellules mémoire centrales, les cellules naïves et les cellules souches mémoire. Les sous-ensembles delymphocytes Tsont séparés à l'aide d'anticorps spécifiques, suivis du processus d'activation par purification decellules présentatrices d'antigènesautologues provenant de patients ou de donneurs, ou de billes recouvertes d'anticorps monoclonaux anti-CD3/anti-CD28, ou d'anticorps anti-CD3 seuls ou en combinaison avec des cellules nourricières et des facteurs de croissance, tels que l'interleukine 2[33],[46].
Les vecteurs viraux utilisés pour transférer le code des récepteurs antigéniques chimériques est suit unlentivirusetrétroviruset ont été largement utilisés dans la recherche fondamentale en raison de leur efficacité de transfert élevée, puis appliqués à la conception et à la construction des récepteurs antigéniques chimériques pour traiter les cancers. En raison de leur profil de site d’intégration plus sûr et de leur capacité à infecter des cellules qui ne se divisent pas et quiescentes, les lentivirus sont plus couramment utilisés que les rétrovirus dans les essais cliniques[33].Les modèles d'intégration des lentivirus se produisent loin des sites de transcription, ce qui entraîne un risque plus faible de mutagenèse[46],[47].À plusieurs étapes du processus de fabrication du vecteur destiné à être utilisé en clinique, le produit est étroitement testé pour détecter la présence de rétrovirus/lentivirus compétents pour la réplication pour éviter la possibilité d'être oncogène, conformément aux directives de laFood and Drug Administrationde 2006. La Food and Drug Administration a également imposé un long suivi jusqu'à 15 ans chez les patients traités pour surveiller tout événement indésirable retardé potentiel à l'aide de vecteurs intégrateurs.
Futures directions
[modifier|modifier le code]CAR universels
[modifier|modifier le code]Si l'on veut que davantage de patients susceptibles de bénéficier de cette approche puissent y avoir accès, il convient d'en simplifier la production et d'en réduire le coût. Deux sociétés françaises,ServieretCellectis,se sont associées pour développer des traitements utilisant comme cellules de départ non plus les lymphocytes du patient lui-même (thérapie autologue) mais des lymphocytes de donneurs sains (thérapie allogénique). Cependant, les lymphocytes de donneurs sains contiennent une sous-population susceptible de reconnaitre les molécules du Complexe Majeur d'Histocompatibilité du patient et donc de provoquer une réaction du greffon contre l'hôte (en quelque sorte, un rejet de greffe à l'envers). Pour prévenir cette réaction, en général mortelle, le récepteur endogène des lymphocytes de donneurs sains est génétiquement inactivé en utilisant la technologie des TALEN. Les lymphocytes, délétés de leur récepteur endogène mais exprimant un récepteur CAR sont ensuite injectés au patient. La même préparation peut être utilisée pour tous les patients dont la tumeur exprime l'antigène ciblé par le CAR. Cela constitue un progrès très significatif puisque, dans le cas d'une thérapie autologue, un lot spécifique de lymphocytes doit être préparé pour chaque patient. Cette approche permet aussi des traiter des patients aplasiques, c'est-à-dire dont le nombre de lymphocytes est trop faible en raison des multiples traitements préalables[48].
D'autres stratégies, comme l'utilisation de cellules NK (dépourvues d'activité alloréactive) ou d'inactivation de l'expression surfacique du TCR endogène par sur-expression d'une chaine CD3 tronquée semblent également prometteuses[49].
Cellules T CAR blindées
[modifier|modifier le code]Les cellules T CAR sont plus efficaces sur lestumeursliquides et ne se sont pas montrées autant prometteuses dans le traitement des tumeurs solides. Lecancer de l'ovaireest l'un des cancer les plus meurtrier chez la femme en raison du diagnostic tardif chez la plupart des cas (environ 70 %) à un stade avancé. Parmi les personnes diagnostiquées, environ 30 % d'entre elles survivent plus de cinq ans. Le cancer de l'ovaire est difficile à traiter parce qu'il s'agit d'une tumeur solide avec un micro-environnement qui supprime les cellules T transférées adoptivement. Le micro-environnement hostile de la tumeur solide est également composé decellules suppressives myéloïdes(MDSC) et demacrophagesassociés à la tumeur (TAM)[50].Les TAM et les MDSC favorisent certains aspects de la croissance et du développement des tumeurs[51].Le micro-environnement tumoral est également composé deleucocytes vasculaires(VLC) qui favorisent la progression de la tumeur solide[52].Tous ces composants du micro-environnement de la tumeur agissent pour supprimer les cellules T.
La cellule T CAR « blindée » est conçue pour sécréter de puissantescytokinestelles que l'interleukine 12(IL-12) ainsi que pour exprimer desligands captifsou solubles sur sa membrane afin d'améliorer l'efficacité de la cellule T CAR. La sécrétion de l'IL-12 est prometteuse car il s'agit d'une cytokine pro-inflammatoire connue pour sa capacité à améliorer les capacités cytotoxiques des cellules CD8+, à engager et recruter des macrophages pour prévenir la fuite des cellules tumorales antigène[53].Les lymphocytes T CD19-CAR sécrétant l'IL-12 pourraient éradiquer leslymphomesétablis chez la souris sans qu'il soit nécessaire de procéder à un pré-conditionnement par induction de l'immunité de l'hôte[54].Un récent essai clinique de phase II a été mené chez des patientes atteintes d'un cancer de l'ovaire où on leur a administré de l'IL-12. Ce traitement a permis de stabiliser la maladie dans 50 % de la cohorte[55].
Vaccins
[modifier|modifier le code]Une approche vise à renforcer la fonction des T CAR en stimulant le système immunitaire à l'aide de l'administration d'un vaccin. Le vaccin stimule la réponse des cellules T modifiées[56].Une étude de 2023 a montré que cette approche aide également le système immunitaire à générer de nouvelles cellules T qui ciblent d'autres antigènes tumoraux. Lors d'études menées sur des souris, les chercheurs ont constaté que cette approche augmentait considérablement les chances d'éradication des tumeurs[57].
Références
[modifier|modifier le code]- «CAR Récepteur antigénique chimérique | cellectis»,surwww.cellectis.com(version dusurInternet Archive).
- M.Pule,H.Finneyet A.Lawson,«Artificial T-cell receptors»,Cytotherapy,vol.5,no3,,p.211–226(ISSN1465-3249,PMID12850789,DOI10.1080/14653240310001488,lire en ligne,consulté le).
- OliviaWilkins,Allison M.Keeleret Terence R.Flotte,«CAR T-Cell Therapy: Progress and Prospects»,Human Gene Therapy Methods,vol.28,no2,,p.61–66(ISSN1946-6536,DOI10.1089/hgtb.2016.153,lire en ligne,consulté le).
- Mathieu Guerriaud, «Fasc. 61-70: MÉDICAMENTS DE THÉRAPIE INNOVANTE. -Statut juridique»,Jurisclasseur Droit pharmaceutique,(SUDOChttp://www.sudoc.fr/192855301,lire en ligne).
- La Rechercheno542, décembre 2018,p.46.
- Y.Kuwana,Y.Asakura,N.Utsunomiyaet M.Nakanishi,«Expression of chimeric receptor composed of immunoglobulin-derived V regions and T-cell receptor-derived C regions»,Biochemical and Biophysical Research Communications,vol.149,no3,,p.960–968(ISSN0006-291X,PMID3122749,lire en ligne,consulté le).
- GGross,TWakset ZEshhar,«Expression of immunoglobulin-T-cell receptor chimeric molecules as functional receptors with antibody-type specificity.»,Proceedings of the National Academy of Sciences of the United States of America,vol.86,no24,,p.10024–10028(ISSN0027-8424,PMID2513569,lire en ligne,consulté le).
- «[Frontiers in Bioscience 4, d386-393, April 1, 1999]», surwww.bioscience.org(consulté le).
- R. H.Schwartz,D. L.Mueller,M. K.Jenkinset H.Quill,«T-cell clonal anergy»,Cold Spring Harbor Symposia on Quantitative Biology,vol.54 Pt 2,,p.605–610(ISSN0091-7451,PMID2534840,lire en ligne,consulté le).
- Michael C.Milone,Jonathan D.Fish,CarmineCarpenitoet Richard G.Carroll,«Chimeric Receptors Containing CD137 Signal Transduction Domains Mediate Enhanced Survival of T Cells and Increased Antileukemic Efficacy In Vivo»,Molecular Therapy: the Journal of the American Society of Gene Therapy,vol.17,no8,,p.1453–1464(ISSN1525-0016,PMID19384291,PMCIDPMC2805264,DOI10.1038/mt.2009.83,lire en ligne,consulté le).
- David L.Porter,Bruce L.Levine,MichaelKaloset AdamBagg,«Chimeric Antigen Receptor–Modified T Cells in Chronic Lymphoid Leukemia»,The New England Journal of Medicine,vol.365,no8,,p.725–733(ISSN0028-4793,PMID21830940,PMCIDPMC3387277,DOI10.1056/NEJMoa1103849,lire en ligne,consulté le).
- RenierBrentjens,Marco LDavila,IsabelleRiviereet JaePark,«CD19-targeted T cells rapidly induce molecular remissions in adults with chemotherapy-refractory acute lymphoblastic leukemia»,Science translational medicine,vol.5,no177,,p.177ra38(ISSN1946-6234,PMID23515080,PMCIDPMC3742551,DOI10.1126/scitranslmed.3005930,lire en ligne,consulté le).
- James N.Kochenderfer,Wyndham H.Wilson,John E.Janiket Mark E.Dudley,«Eradication of B-lineage cells and regression of lymphoma in a patient treated with autologous T cells genetically engineered to recognize CD19»,Blood,vol.116,no20,,p.4099–4102(ISSN0006-4971,PMID20668228,PMCIDPMC2993617,DOI10.1182/blood-2010-04-281931,lire en ligne,consulté le).
- S. A.Rosenberg,B. S.Packard,P. M.Aebersoldet D.Solomon,«Use of tumor-infiltrating lymphocytes and interleukin-2 in the immunotherapy of patients with metastatic melanoma. A preliminary report»,The New England Journal of Medicine,vol.319,no25,,p.1676–1680(ISSN0028-4793,PMID3264384,DOI10.1056/NEJM198812223192527,lire en ligne,consulté le).
- Stephanie L.Goff,Mark E.Dudley,Deborah E.Citrinet Robert P.Somerville,«Randomized, Prospective Evaluation Comparing Intensity of Lymphodepletion Before Adoptive Transfer of Tumor-Infiltrating Lymphocytes for Patients With Metastatic Melanoma»,Journal of Clinical Oncology,vol.34,no20,,p.2389–2397(ISSN0732-183X,PMID27217459,PMCIDPMC4981979,DOI10.1200/JCO.2016.66.7220,lire en ligne,consulté le).
- David L.Porter,Wei-TingHwang,Noelle V.Freyet Simon F.Lacey,«Chimeric antigen receptor T cells persist and induce sustained remissions in relapsed refractory chronic lymphocytic leukemia»,Science translational medicine,vol.7,no303,,p.303ra139(ISSN1946-6234,PMID26333935,PMCIDPMC5909068,DOI10.1126/scitranslmed.aac5415,lire en ligne,consulté le).
- BarbaraSavoldo,Carlos AlmeidaRamos,EnliLiuet Martha P.Mims,«CD28 costimulation improves expansion and persistence of chimeric antigen receptor–modified T cells in lymphoma patients»,The Journal of Clinical Investigation,vol.121,no5,,p.1822–1826(ISSN0021-9738,PMID21540550,PMCIDPMC3083795,DOI10.1172/JCI46110,lire en ligne,consulté le).
- (en)EmilyMullin,«A pioneering gene therapy for leukemia has arrived in the U.S.»,MIT Technology Review,(lire en ligne,consulté le).
- (en)Office of theCommissioner,«Press Announcements - FDA approves CAR-T cell therapy to treat adults with certain types of large B-cell lymphoma», surwww.fda.gov(consulté le)
- «?», surclinicaltrials.gov[pas clair].
- (en)TadesseAsmamaw Dejenie,MarkeshawTiruneh G/Medhin,GashawDessie Terefeet FitalewTadele Admasu,«Current updates on generations, approvals, and clinical trials of CAR T-cell therapy»,Human Vaccines & Immunotherapeutics,vol.18,no6,(ISSN2164-5515et2164-554X,PMID36094837,PMCIDPMC9746433,DOI10.1080/21645515.2022.2114254,lire en ligne,consulté le)
- MarinaMartinezet Edmund KyungMoon,«CAR T Cells for Solid Tumors: New Strategies for Finding, Infiltrating, and Surviving in the Tumor Microenvironment»,Frontiers in Immunology,vol.10,(ISSN1664-3224,PMID30804938,PMCIDPMC6370640,DOI10.3389/fimmu.2019.00128,lire en ligne,consulté le)
- (en)Richard AMorgan,James CYang,MioKitanoet Mark EDudley,«Case Report of a Serious Adverse Event Following the Administration of T Cells Transduced With a Chimeric Antigen Receptor Recognizing ERBB2»,Molecular Therapy,vol.18,no4,,p.843–851(PMID20179677,PMCIDPMC2862534,DOI10.1038/mt.2010.24,lire en ligne,consulté le)
- (en)Sarah A.Richman,SeleneNunez-Cruz,BabakMoghimiet Lucy Z.Li,«High-Affinity GD2-Specific CAR T Cells Induce Fatal Encephalitis in a Preclinical Neuroblastoma Model»,Cancer Immunology Research,vol.6,no1,,p.36–46(ISSN2326-6066et2326-6074,PMID29180536,PMCIDPMC6004321,DOI10.1158/2326-6066.CIR-17-0211,lire en ligne,consulté le)
- Del Bufalo F, De Angelis B, Caruana I et al.GD2-CART01 for relapsed or refractory high-risk neuroblastoma,N Engl J Med, 2023;388:1284-1295
- ZhenguangWanget WeidongHan,«Biomarkers of cytokine release syndrome and neurotoxicity related to CAR-T cell therapy»,Biomarker Research,vol.6,no1,,p.4(ISSN2050-7771,PMID29387417,PMCIDPMC5778792,DOI10.1186/s40364-018-0116-0,lire en ligne,consulté le)
- (en)Kris M.Mahadeo,Sajad J.Khazal,HishamAbdel-Azimet Julie C.Fitzgerald,«Management guidelines for paediatric patients receiving chimeric antigen receptor T cell therapy»,Nature Reviews Clinical Oncology,vol.16,no1,,p.45–63(ISSN1759-4782,PMID30082906,PMCIDPMC7096894,DOI10.1038/s41571-018-0075-2,lire en ligne,consulté le)
- Ping-PinZheng,Johan M.Kroset JinLi,«Approved CAR T cell therapies: ice bucket challenges on glaring safety risks and long-term impacts»,Drug Discovery Today,vol.23,no6,,p.1175–1182(ISSN1359-6446,DOI10.1016/j.drudis.2018.02.012,lire en ligne,consulté le)
- Beauvaiset al.,«Le parcours de soins du patient dans le cadre des CAR T-cell: recommandations de la Société francophone de greffe de moelle et de thérapie cellulaire (SFGM-TC)»[PDF],
- ShrutiGupta,HarishSeethapathy,Ian A.Strohbehnet Matthew J.Frigault,«Acute Kidney Injury and Electrolyte Abnormalities After Chimeric Antigen Receptor T-Cell (CAR-T) Therapy for Diffuse Large B-Cell Lymphoma»,American Journal of Kidney Diseases,vol.76,no1,,p.63–71(ISSN0272-6386,PMID31973908,PMCIDPMC7311244,DOI10.1053/j.ajkd.2019.10.011,lire en ligne,consulté le)
- (en)Cassandra Willyard, «Do cutting-edge CAR-T-cell therapies cause cancer? What the data say», surNature,(consulté le)
- Daniel W. Lee, Rebecca Gardner, David L. Porter, Chrystal U. Louis, Nabil Ahmed, Michael Jensen, Stephan A. Grupp, Crystal L. Mackall; Current concepts in the diagnosis and management of cytokine release syndrome.Blood2014; 124 (2): 188–195. doi: https://doi.org/10.1182/blood-2014-05-552729
- (en)MohsenSheykhhasan,HamedManoochehriet PaolaDama,«Use of CAR T-cell for acute lymphoblastic leukemia (ALL) treatment: a review study»,Cancer Gene Therapy,vol.29,no8,,p.1080–1096(ISSN1476-5500,PMID34987176,PMCIDPMC9395272,DOI10.1038/s41417-021-00418-1,lire en ligne,consulté le)
- Jennifer N.Brudnoet James N.Kochenderfer,«Recent advances in CAR T-cell toxicity: Mechanisms, manifestations and management»,Blood Reviews,vol.34,,p.45–55(ISSN1532-1681,PMID30528964,PMCID6628697,DOI10.1016/j.blre.2018.11.002,lire en ligne,consulté le)
- (en)AlexanderShimabukuro-Vornhagen,PhilippGödel,MarionSubkleweet Hans JoachimStemmler,«Cytokine release syndrome»,Journal for ImmunoTherapy of Cancer,vol.6,no1,,p.56(ISSN2051-1426,PMID29907163,PMCIDPMC6003181,DOI10.1186/s40425-018-0343-9,lire en ligne,consulté le)
- Daniel W.Lee,Bianca D.Santomasso,Frederick L.Lockeet ArminGhobadi,«ASTCT Consensus Grading for Cytokine Release Syndrome and Neurologic Toxicity Associated with Immune Effector Cells»,Biology of Blood and Marrow Transplantation,vol.25,no4,,p.625–638(ISSN1083-8791,DOI10.1016/j.bbmt.2018.12.758,lire en ligne,consulté le)
- (en)Marco L.Davila,IsabelleRiviere,XiuyanWanget ShirleyBartido,«Efficacy and Toxicity Management of 19-28z CAR T Cell Therapy in B Cell Acute Lymphoblastic Leukemia»,Science Translational Medicine,vol.6,no224,(ISSN1946-6234et1946-6242,PMID24553386,PMCIDPMC4684949,DOI10.1126/scitranslmed.3008226,lire en ligne,consulté le)
- (en)Shannon L.Maude,NoelleFrey,Pamela A.Shawet RichardAplenc,«Chimeric Antigen Receptor T Cells for Sustained Remissions in Leukemia»,New England Journal of Medicine,vol.371,no16,,p.1507–1517(ISSN0028-4793et1533-4406,PMID25317870,PMCIDPMC4267531,DOI10.1056/NEJMoa1407222,lire en ligne,consulté le)
- Jian-Ping Zhang, Rui Zhang, Shih-Ting Tsao, Yu-Chen Liu, Xiaochuan Chen, Dao-Pei Lu, Paul Castillo, Lung-Ji Chang; Sequential allogeneic and autologous CAR-T–cell therapy to treat an immune-compromised leukemic patient.Blood Adv2018; 2 (14): 1691–1695. doi: https://doi.org/10.1182/bloodadvances.2018017004
- (en)Shannon L.Maude,Theodore W.Laetsch,JochenBuechneret SusanaRives,«Tisagenlecleucel in Children and Young Adults with B-Cell Lymphoblastic Leukemia»,New England Journal of Medicine,vol.378,no5,,p.439–448(ISSN0028-4793et1533-4406,PMID29385370,PMCIDPMC5996391,DOI10.1056/NEJMoa1709866,lire en ligne,consulté le)
- Persis J Amrolia, Robert Wynn, Rachael Hough, Ajay Vora, Denise Bonney, Paul Veys, Kanchan Rao, Robert Chiesa, Muhammad Al-Hajj, Shaun P Cordoba, Shimobi Onuoha, Ekaterini Kotsopoulou, Nushmia Z Khokhar, Martin Pule, Vijay G R Peddareddigari; Simultaneous Targeting of CD19 and CD22: Phase I Study of AUTO3, a Bicistronic Chimeric Antigen Receptor (CAR) T-Cell Therapy, in Pediatric Patients with Relapsed/Refractory B-Cell Acute Lymphoblastic Leukemia (r/r B-ALL): Amelia Study.Blood2018; 132 (Supplement 1): 279. doi: https://doi.org/10.1182/blood-2018-99-118616
- Renier J. Brentjens, Isabelle Rivière, Jae H. Park, Marco L. Davila, Xiuyan Wang, Jolanta Stefanski, Clare Taylor, Raymond Yeh, Shirley Bartido, Oriana Borquez-Ojeda, Malgorzata Olszewska, Yvette Bernal, Hollie Pegram, Mark Przybylowski, Daniel Hollyman, Yelena Usachenko, Domenick Pirraglia, James Hosey, Elmer Santos, Elizabeth Halton, Peter Maslak, David Scheinberg, Joseph Jurcic, Mark Heaney, Glenn Heller, Mark Frattini, Michel Sadelain; Safety and persistence of adoptively transferred autologous CD19-targeted T cells in patients with relapsed or chemotherapy refractory B-cell leukemias.Blood2011; 118 (18): 4817–4828. doi: https://doi.org/10.1182/blood-2011-04-348540
- (en)Jae H.Park,IsabelleRivière,MithatGonenet XiuyanWang,«Long-Term Follow-up of CD19 CAR Therapy in Acute Lymphoblastic Leukemia»,New England Journal of Medicine,vol.378,no5,,p.449–459(ISSN0028-4793et1533-4406,PMID29385376,PMCIDPMC6637939,DOI10.1056/NEJMoa1709919,lire en ligne,consulté le)
- Junfang Yang, Pengfei Jiang, Xian Zhang, Xiaobin Zhu, Qi Dong, Jiaping He, Nanjing Lin, Zhenguang Wang, Songbai Cai, Xun Ye, Yunchao Su, Wenqian Li, Jingjing Li, Ziyao Yu, Jiujiang He, Li Xu, Dan Song, Wei Cao, Peihua Lu; Anti-CD19/CD22 Dual CAR-T Therapy for Refractory and Relapsed B-Cell Acute Lymphoblastic Leukemia.Blood2019; 134 (Supplement_1): 284. doi: https://doi.org/10.1182/blood-2019-126429
- RunxiaGu,FangLiu,DehuiZouet YingxiXu,«Efficacy and safety of CD19 CAR T constructed with a new anti-CD19 chimeric antigen receptor in relapsed or refractory acute lymphoblastic leukemia»,Journal of Hematology & Oncology,vol.13,no1,,p.122(ISSN1756-8722,PMID32894185,PMCIDPMC7487702,DOI10.1186/s13045-020-00953-8,lire en ligne,consulté le)
- Bruce L.Levine,JamesMiskin,KeithWonnacottet ChristopherKeir,«Global Manufacturing of CAR T Cell Therapy»,Molecular Therapy - Methods & Clinical Development,vol.4,,p.92–101(ISSN2329-0501,PMID28344995,PMCIDPMC5363291,DOI10.1016/j.omtm.2016.12.006,lire en ligne,consulté le)
- (en)JohnScholler,Troy L.Brady,GwendolynBinder-Schollet Wei-TingHwang,«Decade-Long Safety and Function of Retroviral-Modified Chimeric Antigen Receptor T Cells»,Science Translational Medicine,vol.4,no132,(ISSN1946-6234et1946-6242,PMID22553251,PMCIDPMC4368443,DOI10.1126/scitranslmed.3003761,lire en ligne,consulté le)
- (en)WaseemQasim,HongZhan,SujithSamarasingheet StuartAdams,«Molecular remission of infant B-ALL after infusion of universal TALEN gene-edited CAR T cells»,Science Translational Medicine,vol.9,no374,,eaaj2013(ISSN1946-6234et1946-6242,PMID28123068,DOI10.1126/scitranslmed.aaj2013,lire en ligne,consulté le).
- TakahiroKamiya,DesmondWong,Yi TianPnget DarioCampana,«A novel method to generate T-cell receptor–deficient chimeric antigen receptor T cells»,Blood Advances,vol.2,no5,,p.517–528(ISSN2473-9529,PMID29507075,PMCIDPMC5851418,DOI10.1182/bloodadvances.2017012823,lire en ligne,consulté le).
- Jon G.Quatromoniet EvgeniyEruslanov,«Tumor-associated macrophages: function, phenotype, and link to prognosis in human lung cancer»,American Journal of Translational Research,vol.4,no4,,p.376–389(ISSN1943-8141,PMID23145206,PMCIDPMC3493031,lire en ligne,consulté le).
- PratimaSinha,Virginia K.Clements,Stephanie K.Buntet Steven M.Albelda,«Cross-talk between myeloid-derived suppressor cells and macrophages subverts tumor immunity toward a type 2 response»,Journal of Immunology (Baltimore, Md.: 1950),vol.179,no2,,p.977–983(ISSN0022-1767,PMID17617589,lire en ligne,consulté le).
- S. PeterBak,AnselmoAlonso,Mary JoTurket BrentBerwin,«Murine ovarian cancer vascular leukocytes require arginase-1 activity for T cell suppression»,Molecular Immunology,vol.46,no2,,p.258–268(ISSN0161-5890,PMID18824264,PMCIDPMC2613193,DOI10.1016/j.molimm.2008.08.266,lire en ligne,consulté le).
- MarkusChmielewski,CarolineKopecky,Andreas A.Hombachet HinrichAbken,«IL-12 release by engineered T cells expressing chimeric antigen receptors can effectively Muster an antigen-independent macrophage response on tumor cells that have shut down tumor antigen expression»,Cancer Research,vol.71,no17,,p.5697–5706(ISSN1538-7445,PMID21742772,DOI10.1158/0008-5472.CAN-11-0103,lire en ligne,consulté le).
- GrayKueberuwa,MilenaKalaitsidou,EleanorCheadleet Robert EdwardHawkins,«CD19 CAR T Cells Expressing IL-12 Eradicate Lymphoma in Fully Lymphoreplete Mice through Induction of Host Immunity»,Molecular Therapy Oncolytics,vol.8,,p.41–51(ISSN2372-7705,PMID29367945,PMCIDPMC5772011,DOI10.1016/j.omto.2017.12.003,lire en ligne,consulté le).
- (en)Oladapo O.Yeku,Terence J.Purdon,MythiliKoneruet DavidSpriggs,«Armored CAR T cells enhance antitumor efficacy and overcome the tumor microenvironment»,Scientific Reports,vol.7,no1,(ISSN2045-2322,PMID28874817,PMCIDPMC5585170,DOI10.1038/s41598-017-10940-8,lire en ligne,consulté le).
- (en)ThiagoCarvalho,«mRNA vaccines boost BioNTech’s CAR T cell therapy»,Nature Medicine,vol.28,no10,,p.1968–1969(DOI10.1038/d41591-022-00091-3,lire en ligne,consulté le)
- (en)Massachusetts Institute ofTechnology,«Vaccine boosts response of engineered T cells, may help eradicate solid tumors», surmedicalxpress.com(consulté le)
Voir aussi
[modifier|modifier le code]Liens externes
[modifier|modifier le code]- « Michel Sadelain: le dessous des Car-T »,La Science, CQFD,France Culture, 29 mai 2024.
