Raltégravir
| raltégravir | ||

| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | N-(2-(4-(4-fluorobenzylcarbamoyl) -5-hydroxy-1-méthyl-6-oxo-1,6-dihydropyrimidin -2-yl)propan-2-yl)-5-méthyl -1,3,4-oxadiazole-2-carboxamide | |
| NoCAS | ||
| NoECHA | 100.124.631 | |
| Code ATC | J05 | |
| PubChem | 54671008 | |
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule | C20H21FN6O5[Isomères] |
|
| Masse molaire[1] | 444,416 3 ± 0,020 2g/mol C 54,05 %, H 4,76 %, F 4,27 %, N 18,91 %, O 18 %, |
|
| Données pharmacocinétiques | ||
| Biodisponibilité | "bonne" | |
| Considérations thérapeutiques | ||
| Classe thérapeutique | Antirétroviral:Inhibiteur d'intégrase | |
| Voie d’administration | Orale | |
| Grossesse | Contre-indiquée (catégorie C) |
|
| Précautions | surveiller la créatine kinase | |
| Unités duSIetCNTP,sauf indication contraire. | ||
| modifier |
||
Leraltégravirest ladénomination commune internationalede l'Isentress,uninhibiteur de l'intégraseduVIHqui a obtenu sonAMMeuropéenne le[2].Cettemolécule,brevetée par les laboratoiresMerck & Co.,est également connue sous son ancien nom de code, MK-0518[3].Plus précisément, il s'agit d'un inhibiteur de transfert de brins (INtegrase Strand Transfer Inhibitor, INSTI).
Posologie et effets secondaires[modifier|modifier le code]
Laposologiehabituelle est de400mg,deux fois par jour (un essai conduit par Merck a évalué l'efficacité d'une monoprise quotidienne de800mgmais a conclu que cette posologie était moins efficace[4],[5],[6]). En 2018, a été commercialisé une spécialité à 600mg, permettant une monoprise quotidienne de 1200 mg (équivalents aux 800 mg). Les comprimés ne doivent pas nécessairement être ingérés avec des aliments, contrairement à d'autresantirétroviraux.
Leseffets secondairesles plus courants sont: nausées, vertiges, diarrhées,lipodystrophie.Chez certains patients on a pu observer une augmentation du taux decréatine kinase,sans pouvoir établir que ce problème était dû au médicament[7].Chez d'autres, très peu nombreux, une dépression préexistante a empiré temporairement à l'instauration du traitement sous Isentress, nécessitant même une hospitalisation dans un cas[8].Plus de quatre ans après l'approbation dumédicamentpar laFDA,celle-ci a fait rajouter débutun avertissement dans la notice des boîtes d'Isentress, afin de prévenir de la survenue, dans quelques cas très rares, dusyndrome de Stevens-Johnsonchez certains patients[9].
Le raltégravir étant une des seules molécules agissant sur l'intégrasedu virus disponibles à l'heure actuelle; on ne connaît pas de possibles effets secondaires à long terme (éventuel risque de cancer[10]). De plus, on ne sait pas ce qu'il advient de l'ADN proviral,qui n'est plus intégré augénomede la cellule. Les essais sur les animaux ont montré une activité délétère sur lefœtus[11].
Efficacité et accessibilité[modifier|modifier le code]
La molécule semble très puissante, malgré le peu de recul qu'on ait sur son utilisation. Elle permet notamment d'atteindre unecharge viraleindétectable plus rapidement qu'avec unetrithérapiecomprenant de l'éfavirenz[12].
Certaines souches de virus sont cependant résistantes à ce médicament, du fait d'une mutation sur legènede l'intégrase[13].
Le médicament a obtenu l'accord de laFDApour une mise sur le marché aux États-Unis en.Le prix d'une boîte de 60 comprimés (30 jours de traitement) était de 902,31€[14]en France lors de la mise sur le marché, mais Merck a revu le prix à la baisse: le prix pour un mois de traitement est en 2011 de 772,43€[15].
À noter également: le raltégravir se diffuse bien dans lesystème nerveux central[16]et letractus génital[17],ce qui permet de diminuer respectivement le vieillissement du cerveau et la possibilité de contamination en cas de rapport sexuel non protégé. Le raltégravir est efficace contre leVIH-2[18],contrairement auxINNTI.
Le raltégravir a également fait ses preuves en tant que remplaçant de l'enfurvitide[19],[20],[21];l'Isentress remplaçant les injections biquotidiennes de Fuzeon, jugées difficiles à vivre par les patients. L'essai Trio (ANRS 139) a montré que dans le cadre d'une multithérapie, l'Isentress permettait d'obtenir, en association avec d'autres molécules récentes, un résultat «spectaculaire» sur des patients enéchec thérapeutique[22].

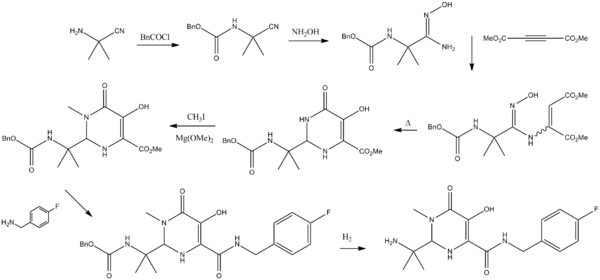
Synthèse de la molécule[modifier|modifier le code]
K. M. Belyk, H. G. Morrison, P. Jones et V. Summa, 2007. Brevet WO 2006060730.
Perspectives[modifier|modifier le code]
Deux essais visant à dispenser un traitement sans analogues nucléosidiques ou nucléotidiques ont été conduits: l'essai Spartan (raltégravir associé à de l'atazanavirnonboosté), dont les résultats sont mitigés, et l'essai Progress (raltégravir associé auKaletra), plus concluant[23].
La molécule, associée aumaraviroc,permettrait de diminuer l'inflammation dusystème nerveux centralcausée par le VIH[24].
Des essais sont conduits afin de déterminer si l'Isentress, en association avec d'autres molécules, antirétrovirales ou non, permettrait de diminuer voire de supprimer les réservoirs viraux.
De récentes recherches ont également démontré que le raltégravir était actif sur certaines souches duHSV;des études pourraient mener à la création d'un médicament efficace contre tous les virus de la famille de l'herpès[25].
L'intestin joue un rôle essentiel dans l'immuno-pathogenèse du virus de l'immunodéficience humaine (VIH)[26],[27],[28].La diminution des niveaux dezonulineest corrélée à une mortalité accrue chez les patients VIH[29].Les traitements parmaraviroc(antagoniste de récepteur deCCR5) et raltegravir (inhibiteur de l'intégrase) augmentent la zonuline[30].Ces données combinées suggèrent que la voie de la zonuline dans sa fonction d'immunité innée peut protéger contre l'infection par le VIH.
Autres inhibiteurs d'intégrase en développement[modifier|modifier le code]
Deux autres molécules de la classe desanti-intégrase:l'elvitégravirdeGilead Sciences/Japan Tobacco,leMK-2048,elle aussi développée parMerck & Co.et ledolutégravirdeViiV Healthcare.
Liens externes[modifier|modifier le code]
- Ressources relatives à la santé:
- «Une fiche à propos du raltégravir»(Archive.org•Wikiwix•Archive.is•Google•Que faire?)(consulté le)surHIV Medication Guide(en français)
- Notice de l'Isentresssur le site de l'AFSSAPS
- (en)Unmementocompletsur aidsmeds.com
- (en)Le site officiel,www.isentress.com
- Du nouveau sur les inhibiteurs d’intégrase,sur le site actions-traitements.org
- Plan de gestion de risquesur le site de l'AFSSAPS
Références[modifier|modifier le code]
- Masse molaire calculée d’après«Atomic weights of the elements 2007», surwww.chem.qmul.ac.uk.
- (en) EPARs for authorised medicinal products for human use: Isentress
- Nouvelles molécules en développement: Mythiques anti-intégrases
- (en) Merck Testing Once-Daily Isentresssur aidsmeds.com
- Raltégravir en une prise par joursur actions-traitements.org
- Isentress Once-Daily Is Less Effective Than Twice-Dailysur aidsmeds.com
- Résumé des caractéristiques du produit,page 8
- (en) Worsening Depression in Four Patients on Isentresssur aidsmeds.com
- (en) FDA Warns of Serious Skin Reactions Among Isentress Userssur aidsmeds.com
- Préoccupations concernant le risque de cancer associé au raltégravir(CATIE TraitementSida 173, juin 09) sur actions-traitements.org
- Résumé des caractéristiques du produit,page 7
- http://www.medscape.com/viewarticle/707219(en)Compared with patients receiving efavirenz, those receiving raltegravir had a shorter time to achieve viral suppressionsur medscape.com
- Malet I, Delelis O, Valantin MA, et als.(en) Mutations associated with failure of raltegravir treatment affect integrase sensitivity to the inhibitor in vitro,Antimicrob Agents Chemother, 2008;52:1351-1358
- Isentress en pharmacies de villesurseronet
- Fiche de l'Isentresssur doctissimo.fr
- http://www.groupesida.ch/filrouge/assets/pdf/remaides-73-suisse.pdfRemaidesno73, page 9
- http://www.edimark.fr/ejournaux/croi2010/19fev/breves.php?PHPSESSID=1gcrpsd52f8ml8kmd16ltn6217#1433"Raltégravir dans le tractus génital: ça passe!" sur edimark.fr
- Feuillet d'information: Raltégravir (Isentress)sur catie.ca
- NathalieDe Castro,JoséphineBraun,IsabelleCharreauet GillesPialoux,«Switch from enfuvirtide to raltegravir in virologically suppressed multidrug-resistant HIV-1-infected patients: a randomized open-label trial»,Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America,vol.49,no8,,p.1259–1267(ISSN1537-6591,PMID19757993,DOI10.1086/605674,lire en ligne,consulté le)
- ConstanceDelaugerre,IsabelleCharreau,JosephineBraunet Marie-LaureNéré,«Time course of total HIV-1 DNA and 2-long-terminal repeat circles in patients with controlled plasma viremia switching to a raltegravir-containing regimen»,AIDS (London, England),vol.24,no15,,p.2391–2395(ISSN1473-5571,PMID20683319,DOI10.1097/QAD.0b013e32833d214c,lire en ligne,consulté le)
- ThomasBoulet,JuliettePavie,IsabelleCharreauet JoséphineBraun,«Impact on health-related quality of life of a switch from enfuvirtide to raltegravir among multidrug-resistant HIV-1-infected patients: a randomized open-label trial (EASIER-ANRS 138)»,HIV clinical trials,vol.11,no5,,p.283–293(ISSN1528-4336,PMID21126958,DOI10.1310/hct1105-283,lire en ligne,consulté le)
- Essai ANRS 139 Trio: des résultats spectaculairessur vih.org
- http://www.vih.org/20100716/vienne-2010-j-2-il-parait-que-15993Vienne 2010, J-2: Il paraît que…], article deGilles Pialouxsur vih.org
- (en)ART Intensification with Maraviroc (Selzentry) or Raltegravir (Isentress) May Improve Immune Activation and Inflammationsur hivandhepatitis.com
- (en)HIV Drug Isentress Could Fight All Herpes Virusessur aidsmeds.com
- Deeks SG, Tracy R, Douek DC.. Systemic effects of inflammation on health during chronic HIV infection. Immunity 2013; 39:633-45;;https://dx.doi.org/10.1016/j.immuni.2013.10.001 [PMC free article] [PubMed] [CrossRef]
- Sandler NG, Wand H, Roque A, Law M, Nason MC, Nixon DE, Pedersen C, Ruxrungtham K, Lewin SR, Emery S, et al. Plasma levels of soluble CD14 independently predict mortality in HIV infection. J Infect Dis 2011; 203:780-90;;https://dx.doi.org/10.1093/infdis/jiq118 [PMC free article][PubMed] [CrossRef]
- Tenorio AR, Zheng Y, Bosch RJ, Krishnan S, Rodriguez B, Hunt PW, Plants J, Seth A, Wilson CC, Deeks SG, et al. Soluble markers of inflammation and coagulation but not T-cell activation predict non-AIDS-defining morbid events during suppressive antiretroviral treatment. J Infect Dis 2014; 210:1248-59;;https://dx.doi.org/10.1093/infdis/jiu254 [PMC free article] [PubMed] [CrossRef]
- Hunt PW, Sinclair E, Rodriguez B, Shive C, Clagett B, Funderburg N, Robinson J, Huang Y, Epling L, Martin JN, et al. Gut epithelial barrier dysfunction and innate immune activation predict mortality in treated HIV infection. J Infect Dis 2014; 210:1228-38;;https://dx.doi.org/10.1093/infdis/jiu238 [PMC free article] [PubMed] [CrossRef]
- Serrano-Villar S, Sainz T, Ma ZM, Utay NS, Chun TW, Mann S, Kashuba AD, Siewe B, Albanese A, Troia-Cancio P, et al. Effects of Combined CCR5/Integrase Inhibitors-Based Regimen on Mucosal Immunity in HIV-Infected Patients Naive to Antiretroviral Therapy: A Pilot Randomized Trial. PLoS Pathog 2016; 12:e1005540;;https://dx.doi.org/10.1371/journal.ppat.1005540 [PMC free article] [PubMed] [CrossRef]