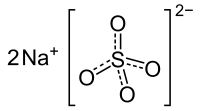
Sulfate de sodium
| Sulfate de sodium | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| NoCAS | ||
| NoECHA | 100.028.928 | |
| NoCE | 231-820-9 | |
| NoRTECS | WE1650000 | |
| Code ATC | A12 | |
| PubChem | 24436 | |
| ChEBI | 32149 | |
| NoE | E514 | |
| InChI | ||
| Apparence | solide blanc | |
| Propriétés chimiques | ||
| Formule | Na2SO4 Heptahydrate: Na2SO4·7H2O Décahydrate: Na2SO4·10H2O |
|
| Masse molaire[1] | 142,042 ± 0,006g/mol Na 32,37 %, O 45,06 %, S 22,58 %, |
|
| Propriétés physiques | ||
| T°fusion | 884°C(anhydre) 32,38°C(décahydrate) |
|
| Solubilité | 47,6g·kg-1(eau,0°C) 427g·kg-1(eau,100°C) pour la maille rhomboédrique |
|
| Masse volumique | 2,68g·cm-3(anhydre) | |
| Thermochimie | ||
| ΔfH0solide | 78,2 kJ/mol | |
| Cristallographie | ||
| Système cristallin | monoclinique,orthorhombiqueouhexagonal | |
| Propriétés optiques | ||
| Indice de réfraction | polyaxe α=1,471, β=1,477, γ=1,484 |
|
| Précautions | ||
| SIMDUT[2] | ||
Produit non contrôlé |
||
| Peau | Irritant | |
| Unités duSIetCNTP,sauf indication contraire. | ||
| modifier |
||
Lesulfate de sodiumest uncomposé chimiquecourant formé d'unionsulfateet de deux ionssodium.Lorsqu'il est à l'état anhydre, il prend l'apparence d'unsolidecristallinblancdeformule chimiqueNa2SO4dont la forme naturelle est lathénarditedes minéralogistes.
Ceselétait autrefois dénommé sel sec ou sel desséché de Glauber, car il provenait d'une lente dessication à l'étuve du sulfate de sodium décahydraté, Na2SO4·10H2O, connu sous le nom desal mirabilis glauberi,simplifié ensel de Glauberpar les anciens chimistes ou adapté plus tard par les minéralogistes enmirabilitepour désigner l'espèce minérale correspondante.
Parmi un grand nombre d'usages différents, les principales utilisations dusulfatedesodiumconcernent la fabrication dedétergentset leprocédé kraftde traitement de lapâte à papier.La moitié de la production mondiale provient de l'extraction de mirabilite ou de thénardite naturelles, et l'autre moitié de productions secondaires, notamment par sa récupération, dans des procédés de l'industrie chimique.
Histoire et description
[modifier|modifier le code]
Le sel naturel décahydraté du sulfate de sodium porte le nom de sel de Glauber, ousal mirabilis.Il est baptisé parJohann Rudolf Glauber,qui le découvrit auXVIIesiècleen laboratoire. Cette matière minérale se présente sous la forme de cristaux blancs outransparents,utilisés originellement commelaxatifs.
Propriétés physiques et chimiques
[modifier|modifier le code]Le sulfate de sodium est très stable chimiquement, alors même qu'il existe sous diverses formespolymorphiquesen général incolores: de maille rhomboédrique à température ambiante, monoclinique lentement à partir de100°Cet surtout après160à185°C,enfin à structure hexagonale à plus haute température à partir de241°Cet surtout au-dessus de500°C[3].Il fond vers884°Csans se décomposer sous l'effet de lachaleur.Il est insensible aux agentsoxydants(le soufre dans l'ion sulfate étant déjà à la valence VI, la plus élevée). Il ne réagit avec desréducteurscomme le carbone qu'à température très élevée (réduction thermochimique des sulfates dans leprocédé kraftde purification de la pulpe à papier). À des températures élevées, au-delà de730°C,il peut néanmoins êtreréduitensulfure de sodium.
Étant dérivé d'unacide fort(acide sulfuriqueH2SO4) et d'unebase forte(hydroxyde de sodiumNaOH oubicarbonate de sodium), c'est un sel neutre dont lasolution aqueuseest depH7.
Le sulfate de sodium peut réagir en solution aqueuse. Il réagit notamment avec une quantité équivalente d'acide sulfurique pour former un sel d'acideselon unéquilibre chimique,comme indiqué ci-dessous:
- Na2SO4(aq) + H2SO4(aq) ⇔ 2 NaHSO4(aq).
Cet équilibre dépend desconcentrations molairesen réactifs et produits ainsi que de la température.
Na2SO4constitue typiquement un sulfate ionique. Une solution saturée précipite en formant le décahydrate de sulfate de sodium, appelé mirabilite ou sel de Glauber. La formation d'heptahydrate de sulfate de sodiumest plus compliquée.
Il peut former des précipités en solution aqueuse lorsqu'il est combiné avec des sels debaryumou deplombqui forment des sulfates insolubles:
L'évolution de lasolubilitédu sulfate de sodium dans l'eau en fonction de la température est assez inhabituelle, comme le montre la courbe ci-dessous (l'augmentation de pression nécessaire pour conserver l'eau à l'état liquide n'est pas indiquée sur le graphique). La solubilité croît de plus d'unfacteur 10entre0°Cet32,4°C,température à laquelle elle atteint un maximum de 49,7g/100 g d'eau(~497g/L). À cette température, l'évolution de la courbe change brusquement et la solubilité devient presque indépendante de la température. La solubilité est nettement plus faible si l'on ajoute duchlorure de sodiumdans la solution (régression de l'équilibre de dissolution vers la gauche pareffet d'ion communavec le cation Na+).
Cette évolution inhabituelle de la solubilité avec la température est à la base de l'utilisation du sulfate de sodium dans des systèmes passifs de chauffage solaire.

Cette caractéristique de la solubilité du sulfate de sodium peut être expliquée par le fait que la valeur de32,4°Ccorrespond à la température à laquelle le composé décahydratée du sulfate de sodium (sel de Glauber oumirabilitenaturelle) se décompose pour former une phasesolideanhydre (thénardite) et un excédent d'eau liquide.
À10°C,la solubilité du sulfate de sodium est quatre fois plus faible que celle du chlorure de sodium. En cas de mélange en saumure sulfatée, l'écart est accru.
Le sulfate de sodium est soluble dans leglycérol.Il est soluble dans l'acide sulfurique dilué. Il est insoluble dans l'alcool.
Extraction
[modifier|modifier le code]La moitié environ de la production mondiale provient de l'extraction de gisements naturels de rochesévaporitesnaturelles, lathénardite,laglaubérite,etc.,mais aussi le sel décahydratée, lamirabiliteautrefoissel de Glauber,qui précipite en saison hivernale dans les lacs salés ou lagunes salées riches en sulfate[4].Ces gisements minéraux d'évaporites sont souvent localisés et surtout formés dans des environnements arides.
En 1990, les principaux producteurs de sulfate de sodium naturel étaient leMexiqueet l'Espagne(avec chacun environ500 000t) suivis par l'URSS,lesÉtats-Uniset leCanada(avec chacun environ350 000t).
Production industrielle
[modifier|modifier le code]La seconde moitié de la production mondiale est issue essentiellement de récupérations diverses ou de synthèse via le chlorure de sodium NaCl. Il s'agit de productions ou d'issues secondaires de procédés de l'industrie chimique.
La plus importante survient lors de la production d'acide chlorhydriqueà partir de chlorure de sodium et d'acide sulfurique selon leprocédé Mannheimentre 800 et900°C.Le sulfate de sodium obtenu par synthèse directe est alors appelé « gâteau de sel ».
Il est produit également à partir dedioxyde de soufre,par une réaction plus lente, mais avec une meilleure efficacité à650°C,selon le procédéHargreaves:
Mais il y a surtout les récupérations de diverses fabrications:
- il précipite facilement sous l'aspect de mirabilite dans les saumures ou solutions concentrées de chlorure de sodium, en particulier vers10°C;
- il représente un coproduit de la synthèse du bichromate de potassium;
- il apparaît nécessairement par rencontre de la base forte et de l'acide fort, les plus communément utilisées en chimie industrielle, soient respectivement la soude caustique et l'acide sulfurique;
- il est unsous-produitde l'obtention defibres synthétiquesrégénérées.
Aux États-Unis et auRoyaume-Uni,l'une des principales sources de sulfate de sodium synthétique provient de la fabrication dedichromate de sodium.Il s'agit surtout d'uncoproduitde l'obtention debichromate de potassium.
- 2 Na2CrO4aq+ 2 H2SO4aq+H2O→ Na2Cr2O7aq.2 H2Oprécipité+ Na2SO4aq
Il y a également un grand nombre de procédés industriels au cours desquels un excès d'acide sulfurique est neutralisé par de lasoude,ce qui conduit à la production de sulfate de sodium. Cette méthode est également la technique de fabrication la plus aisée en laboratoire:
Le sulfate de sodium est généralement purifié via la forme décahydratée, la forme anhydre ayant tendance à réagir avec les composés à base deferet avec lescomposés organiques.La forme anhydre est ensuite produite par chauffage modéré de la forme hydratée.
Utilisation
[modifier|modifier le code]En 1995, le sulfate de sodium se vendait environ 70$la tonne aux États-Unis, ce qui en fait un composé chimique relativement bon marché. La première utilisation du sulfate de sodium à l'heure actuelle est probablement dans le domaine desdétergents.Il s'agit à la fois d'une charge, d'un fluidisant et antimottant. C'est un véritable coproduit detensio-actifsanioniques, une charge avec l'eau qui permet de solubiliser le détergent actif. Ainsi il est présent à hauteur de 25 à 40 % dans les diverses « poudres de machines à laver ».
La consommation totale en Europe était d'environ 1,6 million de tonnes en 2001, dont 80 % dans le domaine des détergents. Cependant, cet usage tend à diminuer avec l'utilisation croissante de détergents sous forme liquide qui ne contiennent pas de sulfate de sodium.
Une des autres applications majeures du sulfate de sodium, tout particulièrement aux États-Unis, est dans l'industrie de lapâte à papier,en particulier leprocédé Kraftde traitement de la pâte à papier et les divers procédés de pâte à papier au sulfate, qui en réclame entre 20 et30kg·t-1de pâte malgré les divers recyclages. En pratique, il permet l'obtention desulfure de sodiumNa2S, un réducteur etdépilatoire[pas clair]efficace. La réaction de réduction au carbone a lieu vers750°C. Na2SO4+ 2 C → Na2S + 2 CO2
Un litre d'une liqueur blanche industrielle, alcaline, possède entre 150 et160gd'alcalis actifs (par exemple 2/3 desoude caustique,moins d'1/3 de sulfure de sodium), 30 à40gdecarbonate de sodium,5 à10gde sulfate de sodium, 3 à5gde Na2S2O3,0,5gde Na2SO3.
Les composés organiques présents dans la « liqueur noire » formée au cours de ce procédé sont brûlés pour produire de la chaleur, avec en parallèle uneréductiondu sulfate de sodium en sulfure de sodium. Cependant, ce procédé a été remplacé dans une certaine mesure par un nouveau procédé, etl'utilisation du sulfate de sodium dans l'industrie papetière américaine a décru de980 000ten 1970 à210 000ten 1990[réf. nécessaire].
L'industrie duverre,en particulier les verres d'oxydes,est également une grande utilisatrice de sulfate de sodium, avec une consommation d'environ30 000ten 1990 aux États-Unis (4 % de la consommation totale). Il est utilisé pour réduire la quantité de petites bulles d'air dans le verre fondu. Il contribue également à fluidifier le verre, et à prévenir la formation de mousse dans le verre fondu durant l'élaboration.
Le sulfate de sodium est utilisé dans l'industrie textile,en particulier auJapon.Il réduit la quantité de charges négatives sur lesfibresce qui facilite la pénétration desteintures.Contrairement au chlorure de sodium, il a l'avantage de ne pas corroder les instruments enacier inoxydableutilisés pour la teinture.
Commechargeblanche ou mate, voire comme fluidifiant et ajusteur de viscosité pratique, il est encore présent dans les encres et les colorants, ou les mélanges réfrigérants.
Enlaboratoire,le sulfate de sodium anhydre est utilisé comme agent de séchage pour les solutions organiques.
Le sel de Glauber, c'est-à-dire la mirabilite ou sulfate de sodium décahydratée, était utilisé dans le passé commelaxatif.Il a également été proposé pour stocker lachaleurdans des systèmes passifs de chauffage solaire. Cette utilisation profite de ses propriétés de solubilité inhabituelle, ainsi que de sa chaleur de cristallisation élevée (78,2kJ·mol-1).
Il entre dans la composition desémulseursanti-incendie AFFF (Agent Formant un Film Flottant), notamment pour les extincteurs à eau pulvérisée avec additif[5].
Précautions à prendre
[modifier|modifier le code]Bien que le sulfate de sodium soit généralement considéré comme non toxique, il convient de le manipuler avec précaution. En effet, étant irritant, il convient de porter des gants et des lunettes de protection lors de sa manipulation.
Bibliographie
[modifier|modifier le code]- Handbook of Chemistry and Physics,71eéd.,CRC Press, Ann Arbor, Michigan, 1990.
- The Merck Index,71eéd.,Merck & Co, Rahway, New Jersey, États-Unis, 1960.
- W. F. Linke, A. Seidell,Solubilities of Inorganic and Metal Organic Compounds,4eéd.,Van Nostrand, 1965.
- D. Butts,inKirk-Othmer Encyclopedia of Chemical Technology,4eéd.,vol.22,p.403-411,1997.
- H. Nechamkin,The Chemistry of the Elements,McGraw-Hill, New York, 1968.
- Maria Telkes,Improvements in or relating to a device and a composition of matter for the storage of heat,British PatentnoGB694553, 1953.
- Robert Perrin, Jean-Pierre Scharff, Chimie industrielle, Masson, Paris, 1993, 1136 p. en deux tomes avec bibliographie et index(ISBN978-2-225-84037-1)et(ISBN978-2-225-84181-1)[6]pour la partie industrielle.
Notes et références
[modifier|modifier le code]- Masse molaire calculée d’après«Atomic weights of the elements 2007», surwww.chem.qmul.ac.uk.
- «Sulfate de sodium» dans la base de données de produits chimiquesReptoxde laCSST(organisme québécois responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
- Ce sont des températures de transition thermochimique, qui attestent des modifications structurales de l'état cristallin.
- La thénardite se transforme rapidement en mirabilite à l'air humide.
- «Fiche de données de sécurité Artic foam»(Archive.org•Wikiwix•Archive.is•Google•Que faire?),surSolbergfoam.com
- Jean-Pierre Scharff, Robert Perrin, Chimie industrielle,2eédition,(ISBN9782100067473)

