Borane
Cet article concerne un composé spécifique. Pour la classe de composés, voirboranes.
| Borane | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | borane | |
| Synonymes |
borine, trihydrure de bore, trihydridobore |
|
| NoCAS | ||
| PubChem | 6331 | |
| ChEBI | 30149 | |
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
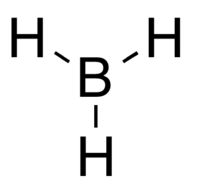
| Formule | BH3 | |
| Masse molaire[1] | 13,835 ± 0,007g/mol H 21,86 %, B 78,14 %, |
|
| Moment dipolaire | 0D[réf.souhaitée] | |
| Thermochimie | ||
| S0gaz, 1 bar | 187,88kJ mol−1K−1[réf.souhaitée] | |
| ΔfH0gaz | 106,69kJ/mol[réf.souhaitée] | |
| Propriétés électroniques | ||
| 1reénergie d'ionisation | 12,026±0,024eV(gaz)[2] | |
| Unités duSIetCNTP,sauf indication contraire. | ||
| modifier |
||
Leborane(trihydridoboreen nomenclature systématique), est une molécule instable et hautement réactive répondant à la formule chimique BH3.
L'espèce moléculaire BH3est unacide de Lewistrès fort. Par conséquent, il est hautement réactif et ne peut être observé directement que sous forme de produit continu, transitoire, dans un système à flux ou lors de la réaction de bore atomique ablaté au laser avec de l’hydrogène.
C'est un gaz incolore impossible à concentrer sous sa forme pure. Le borane est l'élément le plus simple de la famille desboranesainsi que le prototype des monoboranes.
Structure et propriétés
[modifier|modifier le code]BH3est une molécule trigonale plane (AX3E0) présentant une symétrie D3h.La longueur de la liaison B – H déterminée expérimentalement est de 119pm[réf.souhaitée].
En l'absence d'autres espèces chimiques, il réagit avec lui-même pour former du diborane. Il s’agit donc d’un produit intermédiaire dans la préparation du diborane en fonction de la réaction:
- BX3+ BH4−→ HBX3−+ (BH3) (X = F, Cl, Br, I)
- 2 BH3→ B2H6
L'enthalpie standard dedimérisationde BH3est estimée à−170kJ mol−1.L'atome de bore dans BH3a sixélectrons de valence.Par conséquent, il s'agit d'unacide de Lewisfort qui réagit avec toutebase de Lewis,L, pour former un produit d'addition dans lequel la base donne sa paire unique, formant uneliaison covalente dative.
- BH3+ L → L—BH3
De tels composés sont thermodynamiquement stables, mais peuvent être facilement oxydés à l'air libre. Des solutions contenant dudiméthylsulfure de borane(en)et dutétrahydrofuranede borane sont disponibles dans le commerce; dans letétrahydrofurane,un agent stabilisant est ajouté pour empêcher le THF d’oxyder le borane.
Le borane est également utilisé en pratique pour réduire des acides carboxyliques en alcools primaires.
Notes et références
[modifier|modifier le code]- Masse molaire calculée d’après«Atomic weights of the elements 2007», surchem.qmul.ac.uk.
- (en)David R. Lide,Handbook of Chemistry and Physics,Boca Raton, CRC,,89eéd.,2736p.(ISBN978-1-4200-6679-1),p.10-205.
