Bryophyte
Bryobiotina
| Règne | Plantae |
|---|



Lesbryophytessont desplantes terrestresthalloïdesoufeuilléesnon vascularisées.Parmi lesplantesactuelles, les bryophytes terrestres et lesbryophytes aquatiquessont celles qui ont conservé le plus de caractères des premières plantes ayantcolonisé la terre ferme.Les ancêtres de toutes les plantes terrestres, donc des bryophytes, sont desalgues vertes,Charophyceae.
Même si certaines structures anatomiques leur permettent de résister à ladessiccation,les Bryophytes sont encore extrêmement dépendantes de l'eau ou des milieux humides, ou en tout cas d'unehygrométrieminimale au moment de leur reproduction. Cette exigence n'empêche pas une grandeplasticité écologiquequi leur permet de vivre dans toutes les régions du globe, de l'équateur jusqu'aux pôles[4].
Pris au sens large, c'est-à-dire celui des classifications traditionnelles, le terme « bryophyte » s'applique aux troisembranchementsde plantes terrestres qui ne pos sắc dent pas de vrai système vasculaire: lesMarchantiophyta(hépatiques), lesBryophytas.s.(mousses, sphaignes) et lesAnthocerotophyta(anthocérotes), regroupés dans lesous-règnedesBryobiotinadurègnedesChlorobiota[5],[6].Au sens strict de la botanique, l'embranchement desBryophytane concerne donc que lesmousseset lessphaignes(à l'exception donc desMarchantiophytaet desAnthocerotophyta).
Avec près de 25 000 espèces de mousses et sphaignes, 9 000 espèces d'hépatiques (Marchantiophyta) et 300 espèces d'anthocérotes, les bryophytes constituent le second groupe de végétaux terrestres, après lesDicotylédones.
Composants importants desbiotopesforestiers et montagnards, les bryophytes sont une source majeure de labiodiversitéspécifique des environnements frais ou humides et contribuent de façon non négligeable à la structure et au fonctionnement des écosystèmes que ce soit en termes dedynamique écologique,deformation des solset plus largement dans lescycles biogéochimiqueset larégulation des climats[4].
Historique[modifier|modifier le code]

Connues et utilisées depuis la nuit des temps, les bryophytes ne font l'objet d'une attention particulière que depuis la fin duXVIIIesiècle, le seul ouvrage consacré exclusivement aux mousses avant étant l'Historia muscorumdeJohann Jacob Dilleniuspublié en 1741[7].Au cours des siècles précédents, les bryophytes, comme les autrescryptogames(taxon désormais non valide comprenant les algues, les lichens, les fougères), sont en effet peu étudiées compte tenu de leur petitesse, de leur organe reproducteur non visible et du peu d'avantages que l'Homme arrive à en tirer[8].En 1784,Johannes Hedwig,« père de la bryologie », en fait un ensemble véritablement naturel, subdivisé enMusci frondosi(Mousses) etMusci hepatici(Hépatiques)[9].En 1789,Jussieupropose une classification naturelle dans sonGenera plantarumet est le premier à utiliser le terme de mousse pour représenter cet ensemble qu'il classe dans les « plantes sans fleurs » avec les Fungi (champignons), Algae (algues) et Filices (fougères)[8].Le terme Bryophyte est inventé en 1864 par le botaniste allemandAlexander Braunqui accole deux mots grecs,bryo(« mousse ») etphytos(« plante »)[10].
Lesclassifications phylogénétiquesrécentes intègrent les bryophytes dans le taxonmonophylétiquedesEmbryophytes,plantes terrestres comprenant les « cryptogames » (Bryophytes et Ptéridophytes)[8].Lasystématique phylogénétiquesuggère également qu'elles sont un groupeparaphylétique(lamonophylieou lapolyphyliede cetaxona longtemps été discutée[11]), abandonné par lescladistesmais conservé commegrade évolutifpar lessystématiciens évolutionnistes.Il comporte troisphylums:lesMarchantiophytes(hépatiques), les Bryophytess.s.(mousse, sphaigne) et lesAnthocérotophytes(anthocérotes)[12].
Cycle de vie[modifier|modifier le code]
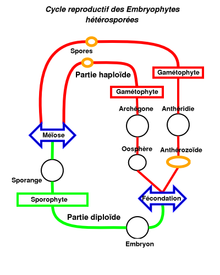






Comme pour lesalgues verteset les plantes vertes, lecycle de vieprésente une alternance desporophytes(ousporogone) et degamétophytes,mais, comme pour toutes lesEmbryophytes,lesanthérozoïdes(ouspermatozoïdes) sont protégés (et formés) par desanthéridieset lesoosphèrespar desarchégones(caractères partagés avec lesplantes vasculaires). Les mousses forment souvent, au sommet de leur axe, une couronne de feuilles plus grandes, appelée soit anthéridiophore soit archégoniophore, qui porte à leur sommet les structures fertiles (anthéridies et archégones) en forme de corbeilles qui renferment ainsi lesgamétanges.Dans ces organes sexuels, les gamétanges sont généralement séparés par des poils stériles (appelésparaphyses) qui jouent un rôle protecteur contre la dessiccation en favorisant la rétention d'eau parcapillarité[13].
La fécondation est unezoïdogamieaquatique (oogamie), lesanthérozoïdes(ouspermatozoïdes) ciliés, libérés de l'anthéridie par gélification et rupture de la paroi, sont entraînés par les gouttes d'eau de pluie ou de rosée, retenue par les feuilles ou les thalles (ou par les éclaboussures de gouttes de pluie lorsque les mousses sontdioïques) dans lesquelles ils se déplacent pour atteindre l'oosphère(la distance maximale de dispersion des spermatozoïdes étant d'une dizaine de centimètres)[14].L'embryon qui en résulte est nourri et protégé par legamétophyte(matrotrophie). Lesporophytenon ramifié fixé sur le gamétophyte ne devient jamais indépendant de celui-ci. Le gamétophyte haploïde est donc le stade dominant sous lequel se rencontre la plante alors que le sporophyte est éphémère. Il peut êtremonoïque(plante bisexuée) oudioïque(plante monosexuée). Lorsqu'il est monoïque, uneprotandrie(maturation de l'anthéridie avancée par rapport à celle de l'archégone) permet généralement d'éviter l'autofécondation[15].
Lessporessont entourées d'une paroi contenant de lasporopolléninequi les protège de ladessiccationau cours de la dissémination[16]. Les botanistes parlent decycle digénétiquehaplodiplophasique (présence de deux générations séparées, le gamétophytehaploïdeet le sporophytediploïde) qui devient de plus en plushétéromorphe,avec prédominance du gamétophyte sur le sporophyte (sporogone)[17].
Généralement, seule uneoosphèreremplie de réserves et fixée dans son réceptacle est fécondée et conduit à la production d'un sporophyte (monosétie). Il arrive que plusieurs oosphères d'un même réceptacle soient fécondées, aboutissant à la production de plusieurs sporophytes. Ce phénomène est appelépolysétie[18].
Dans certains cas, en particulier chez les anthocérotes, les gamétophytes sont bisexués et nourrissent alors de nombreuxsporophytes.
- Après la fécondation, l'embryon matrotrophe est porté par le gamétophyte femelle. Le sporophyte embryonnaire se développe pour donner un sporophyte mature souvent formé d'un pédicelle (plutôt appelésoiechez les mousses etpseudopodechez les sphaignes) portant une capsule. Appelée aussiurneousporogone,la capsule correspond ausporangeoù se forment dans des sporosacs (ou sacs sporifères) lesméïosporesqui seront à l'origine des gamétophytes. Cette capsule est entourée par une coiffe (appelée aussi calyptre) qui provient du développement de l'archégone. Constituée d'une fine membrane qui protège la capsule, cette coiffe se déchire et disparaît à la maturité du sporophyte. Le sporange libère les spores mâles et femelles (sauf dans le cas des gamétophytes bisexués) qui sont dispersés principalement par le vent (parfois par les mouches chez lesSplachnaceae(en)[2]). La plupart des spores tombent au sein de la colonie parentale avant de germiner sous forme deprotonema,lequel donne, après une phase de croissance et de développement, les gamétophytes[19].
- Les stades mobiles (en jaune dans le schéma) sont principalement les spores pour lesquelles les mousses ont développé des mécanismes assurant leur dispersion (capsule explosive dessphaignes,fentes de déhiscence desandréales,péristomedes vraiesmousses) et lesanthérozoïdes(ouspermatozoïdes) avant la fécondation.
Les bryophytes peuvent se multiplier de façon végétative par fragmentation (bouturagenaturel par brisure de feuilles, de rameaux). Certaineshépatiquesont développé des structures de dispersion spécialisées, lespropagules(bourgeon, bulbille). Des structures particulières (gemmules, bulbilles) existent aussi chez certaines mousses[20].Tous ces éléments sont principalement dispersés par le vent, mais il existe des vecteurs animaux, tels que les chauves-souris[21],les fourmis[22],les limaces[23].L'allocation des ressources(correspondant à l'allocation denutriments) reflète l'existence decompromis évolutifsentre deuxtraits biologiques,la reproduction sexuée favorisée pendant les stades de colonisation et lareproduction asexuéefavorisée au sein des colonies matures[24].
Organisation fonctionnelle[modifier|modifier le code]
Pas de système vasculaire ou un système vasculaire rudimentaire[modifier|modifier le code]
Les Bryophytes ne disposent pas dexylèmeni dephloème(faisceaux conducteursde l'eau et des nutriments). Ces deux tissus ne sont apparus que plus tard au cours de l'évolution, chez lesplantes vasculaires.L'irrigation de l'axe feuillé (appelé caulidie) se réalise par un processus de capillarité, possible grâce à l'étroit agencement des « feuilles » sur cet axe. La « tige » et les « feuilles » (lames foliacées de l'axe) absorbent l'eau et les sels minéraux (puisés dans les eaux de ruissellement qui charrient les éléments minéraux issus de la décomposition des matières organiques et des poussières atmosphériques véhiculées) sur toute leur surface, grâce l'épiderme faiblementcutiniséet constitué de cellules àparoimince[25].Cette absorption se fait par imbibition (à travers les surfaces qui peuvent être agrémentées de poilshyalins[Note 4]ou de lamelles parallèles pour augmenter la surface d'échange) puis par diffusion[27].
Certains bryophytes (mousses tropicales, sphaignes) disposent d'ébauches de tissus conducteurs spécialisés permettant le transport de l'eau, des sels minéraux et des produits de laphotosynthèse,mais ces derniers ne sont paslignifiés:les « leptoïdes » (cellules vivantes allongées assurant la distribution des produits de la photosynthèse, l'équivalent de laSắc ve élaborée) et les « hydroïdes » (cellules mortes allongées assurant la distribution de l'eau et des sels minéraux, l'équivalent de laSắc ve brute)[28].Les mousses endohydriques ont un tissu conducteur développé à la périphérie de l'axe feuillé, les mousses ectohydriques ont seulement des jonctionsprotoplasmiquesentre les cellules, ce qui permet une circulation très localisée des nutriments[29].Les « feuilles » sont constituées souvent d'une seule assise de cellules chlorophylliennes, excepté dans la région médiane où plusieurs épaisseurs de cellules simulent une nervure différenciée. Le sporophye présente un épiderme doté destomateset une ébauche de tissu conducteur au niveau dupédicelle.Elle aurait facilité la dessiccation du sporophyte permettant, à maturité, ladéhiscencedes capsules et la dispersion des spores[30].Les stomates, en contrôlant les échanges gazeux (vapeur d'eau, gaz carbonique, oxygène) liés à la photosynthèse et en permettant la régulation des pertes d'eau, sont uneinnovation évolutivedéterminante de la diversification desplantes terrestres.Alors que les ancêtres des plantes terrestres possédaient déjà des stomates, la majorité des mousses auraient perdu ces orifices[31].Elles auraient subi un processus d'évolution réductive(en)en lien avec leur mode de vie[32].
Les mousses pos sắc dent cependant destanninscomplexes proches de la lignine, leslignanes(biopolymèresprésents dans lesvacuoleset lesparois cellulaires). Leur appartenance auxmétabolites secondairesainsi que les caractéristiques toxiques, antifongiques ou antibactériennes de certains lignanes font émettre l'hypothèse de leur implication dans lesdéfenses chimiques des plantes contre les herbivoreset laphotoprotection[33].
Lespseudophyllesou phyllidies n'ont pas l'histologiedes vraies feuilles.
Il n'existe pas d'organes comparables auxracineschez les bryophytes dotés de «rhizoïdes» (mono ou pluricellulaires) qui les fixent ausubstratmais n'absorbent pas la solution du sol. Les bryophytes ont uncormus(« tige » et « feuille », ces deux organes donnant un axe feuillé). En l'absence de photosynthèse, ce cormus se nécrose, se décolore et forme ainsi unhumusprimitif.
Les bryophytes ne pouvant absorber l'eau par leur rhizoïdes ont la faculté de permettre à l'eau de rentrer par toutes les parties de la plante. De plus en cas de forte sécheresse la plante peut entrer en état de vie ralentie (reviviscence) en attendant des conditions de développement mieux adaptées.
-
Coupe transversale de la « feuille » duPolytric commun[Note 6].
-
Coupe transversale d'une feuille dePhilonotis caespitosamontrant la fausse nervure.
Deux grands groupes[modifier|modifier le code]
Les botanistes duXIXesiècle ont traditionnellement subdivisé les mousses en deux sous-groupes, selon la disposition des sporophytes sur la plante et leur aspect général[36]:les mousses acrocarpes (du grecakron,sommet etcarpo,fruit) ont des « tiges » dressées portant à leur extrémité des sporogones. Elles sont très peu ou pas du tout ramifiées, souvent en touffes denses, formant des coussins ou coussinets qui présentent des caractères plutôtxérophilesethéliophiles(en raison de ce port compact en demi-sphère plus apte à lutter contre la forte exposition au soleil et ladessiccation)[Note 7]et une faible longévité. Les mousses pleurocarpes (du grecpleuro,côté etcarpo,fruit) ont des « tiges » très ramifiées latéralement d'où émergent les sporogones. Elles sont étalées sur leur support (tiges rampantes), et forment des tapis « moquettes » qui présentent à l'inverse des caractères plutôthydrophilesetsciaphiles,et une plus grande pérennité du fait des grandes capacités demultiplication végétativedes ramifications des tiges[37].Cette catégorisation pratique souffre de nombreuses exceptions et n'implique pas deux groupes de parenté, même si lamonophyliedu groupe des pleurocarpes est supportée par des analyses génétiques[38].
-
Développement de mousses en coussins.
-
L'évaporation, en lien avec la taille des coussinets, est unfacteur limitantde laphotosynthèse[Note 8].
-
Développement de l'Hypne cyprèsen tapis étendus plus ou moins denses.
Symbioses avec des champignons[modifier|modifier le code]
Comme les plantes vascularisées, les bryophytes peuvent profiter d'unesymbioseavec des champignons. On a encore peu de connaissances sur la diversité fongique associée aux bryophytes. Mais quelques études basées sur labiologie moléculaireont montré qu'elle était importante.
Par exemple, enforêt boréaleles bryophytes se montrent très résistantes au froid et capables de se nourrir sur dessols geléstout ou partie de l'année. Les champignons les y aident. Il existe au nord du Canada« un ensembleécologiquementetphylogénétiquementdiversifié de champignons associés aux parties vivantes de 3 bryophytes abondantes et largement distribuées (…),lesHylocomium splendens(Hedw.) Schimp. in B.S.G.,Pleurozium schreberi(Brid.) Mitt. etPolytrichum communeHedw »[41];Au moins 158 espèces de champignons leur sont associées dans la région étudiée. Ces champignons appartiennent surtout à ladivisiondesAscomycota(62,8 % des cas), et à la sous-division desBasidiomycota(32 % des cas), parfois desChytridiomycota(considérés comme les ancêtres de tous les autres champignons (3,9 % des cas) et rarement auxGlomeromycota(1,3 % seulement des cas, bien que ces champignons soient très fréquemment associés aux plantes supérieures)[41].Les principaux ordres concernés étaient dans cette région lesHelotiales(18,6 %), lesAgaricales(11,5 %), lesChaetothyriales(en)(9,6 %) et lesTremellales[41].L'association la plus souvent repérée était l'agaricEntoloma conferendumavecLophodermium piceae(Fckl.) Hoehn. commeendophyteassocié[41].D'autres taxons avaient des affinités avec desHelotialesdu genreHyphodiscus(en)ou avec plusieursbasidiomycètesmycorhiziens[41].La plupart (72,2 %) des taxons de champignons endophytes n'ont été trouvés qu'une seule fois dans cette étude[41].De plus, très peu de champignons étaient associés avec l'ensemble des trois bryophytes étudiés, ce qui indique une diversité d'associations très large et peut-être certaines spécificités[41],qui restent à explorer.
Autre exemple,Pleurozium schreberi(la Pleurozie dorée) est une mousse qui peut fournir duphosphateet ducarboneaux racines duPin torducolonisées par leBolet des bouviersqui forme desectomycorhizesavec eux[42].
Habitats et répartition[modifier|modifier le code]

Capables de tirer leurs nutriments de l'air et des aérosols, comme les lichens qu'ils accompagnent souvent, les bryophytes sont en tant que groupe taxonomique très ubiquistes. Grâce à de nombreuses adaptations, ils ont colonisé presque toute la planète, jusqu'aux zones subpolaires[47].Ils sont toutefois absents (plus que les lichens) du milieu marin, et des milieux extrêmement arides. Grâce à des spores aéroportées, ils comptent parmi les premières espèces à pouvoir coloniser les nouveaux habitats (ex: terrils, îles volcaniques nouvelles…)
De nombreuses espèces vivent sur le sol (terricoles), dans l'humus (humicole) ou les milieuxtourbeux(turficole), d'autres sontsaxicoles(ou devenuesmuricoles) ouépiphytes,ou encore se développent sur lesbois-mortstombés au sol (corticoles sur l'écorce). Dans lesréserves naturelleset en forêt dans lesîlots de sénescence,après une vingtaine d'années denon-gestion(« restauration passive »[48]), le taux de bois mort au sol ré-augmente au profit des bryophytes notamment[48]mais aussi de nombreuxcortèges saproxylophages,chacun caractéristique de l'un des stades de décomposition du bois, et du type d'essences (bois dur, bois tendres, etc) ou de situation (à l'ombre, au soleil, dans l'eau…)[49].
-
Hypne cyprès,espèceubiquiste.
-
Riccia fluitans,hépatique flottante utilisée enaquariophiliepour l'oxygénation de l'eau.
-
Eurhynchium praelongum(en)[Note 12],l'Eurhynchie allongée, plante vivace à tige rampante, humo-terricole[50].
-
Mousse des jardiniers,espèce humicole.
-
Rhytidiadelphus squarrosus(en)(l'Hypne squarreux), une des mousses les plus communes des jardins[Note 13].
- Cas demimétismeavec les mousses
-
Œufs dupluvier dorétrès mimétiques avec les mousses.
Écologie[modifier|modifier le code]


Turgescentes,les mousses se gorgent d'eau, un kilogramme de bryophyte sắc che pouvant retenir 15 litres d'eau (les capacités d'absorption étant maximisées chez les sphaignes dont un kg peut retenir 70 à 75 litres d'eau)[54].
Les Bryophytes sont généralementautotrophesparphotosynthèsegrâce aux cellules pourvues dechlorophylle.Certaines en sont dépourvues, telle l'hépatiqueCryptothallus mirabilisqui vit sous d'autres mousses en milieu bois.Parasitesur un champignon du genreTulasnella(lequel forme uneectomycorhizeavec des arbres du genreBetulaouPinus), elle est l'unique hépatique non chlorophyllienne d'Europe et reste associée à des milieux naturels de très grande qualité[55].
Dans une certaine mesure, en empêchant physiquement des graines d'accéder au sol ou en limitant l'accès de lalumièreaux graines déjà présentes dans les sols (spectre du rouge notamment, qui déclenche la germination de certaines graines) et/ou parallélopathie,les tapis de mousses peuvent éliminer ou sélectionner certaines espèces[56];par exemple dans une pelouse calcaire néerlandaise (et de même en conditions contrôlées enserre), un tapis dense de mousses sur le sol réduit jusqu'à 30 % le nombre de plantules de certaines espècesphanérogames[56].
Les mousses ont un pouvoir absorbant et isolant mis à profit par lesrongeursqui utilisent ce matériau pour tapisser leursterriersou par lesoiseauxpour leursnids.Lors de relevés bryophytiques, lesbryologuesont distingué 65 espèces de mousses qui garnissaient le nid depassereauxcomme lesmésanges.Plus de la moitié de la masse de leurs nids est composé de mousses[57].
Malgré le pouvoir nutritif des mousses identique aux plantes vasculaires et le fait qu'elles offrent un habitat à de nombreux invertébrés, elles sont très peu consommées par les herbivores, notamment en raison de la synthèse de composés peu digestes voire inappétents (tanins,terpénoïdes) qui interviennent probablement dans des réactions dedéfense contre les herbivores[58].Elles servent de nourriture à quelques espèces de coléoptères, orthoptères, collemboles, chenilles ou pucerons[59]Elles sont plus consommées dans les régions de haute latitude où elles dominent la végétation (zones arctiques ettoundras) où elles font partie du régime alimentaire hivernal des ruminants comme lerenneet lebœuf musqué[60].
Services écosystémiques[modifier|modifier le code]

Les mousses fournissent de nombreuxservices écosystémiques.
Espèces ingénieurs,elles ont la capacité, en s'installant, de créer des micro-habitats qui hébergent une diversité faunistique (un mètre carré de mousses abrite des milliers d'espèces de vers,acariens,rotifères,collemboles,tardigrades,pseudoscorpions,et uneentomofauneriche decoléoptères,fourmis) et floristique (lichen, épiphytes telle que lesHyménophyllacéeset lesorchidées) importantes[62].Une seule mousse peut abriter des dizaines d'espèces d'invertébrés[63].Les mousses servent également de site de reproduction à des insectes et acariens[64].
Lorsque les conditions le permettent, les mousses non ramifiées s'installent en colonies formant des tapis et des coussins. À partir des débris issus de la décomposition des micro-organismes hébergés et de la dégradation naturelle des brins à partir de la base de ces colonies, les mousses créent un micro-humus qui favorise leur développement ainsi que celui d'autres espèces végétales[65].
Elles ont pris une place dans le quotidien des humains (serviettes hygiéniquesensphaignes,couches,papier toilette,carburanten Europe, costumes traditionnels enNouvelle Guinée), en médecine (utilisées en Chine pour leurs vertus médicinales), en agriculture (engrais,phytosanitaire)[66],dans leur foyer (remplissage de matelas ou d'oreiller[Note 14],calfeutrage des habitations en bois,toits végétaliséspour l'isolation, plantes ornementales enaquariophilie) ou dans la construction navale (calfatagedes embarcations)[67],[68].Les chercheurs ont trouvé chez les bryophytes desantibiotiques,desantifongiques,deshormones végétales,desanti-tumoraux[69].
Biosurveillance, environnement et pollution[modifier|modifier le code]

Les bryophytes, et les mousses en particulier tirent l'essentiel de leur nourriture de l'air et des nutriments apportés par l'eau atmosphérique[71],par lapluieou les dépôts de particules etaérosols.En raison notamment de leurs grandes capacités d'absorption d'eau et de minéraux passivement, de leur tissu épidermique faiblementcutiniséet constitué le plus souvent d'une seule couche de cellules à paroi mince (ce qui permet d'accroître la capacité d'échange), et de parois cellulaires contenant de nombreuxsites de fixationchargés négativement qui capturent lescationsmétalliques[Note 16],de nombreux bryophytes sont vulnérables à l'acidification de l'air, à sa pollution[73]et à l'eutrophisationdes milieux[74].
Ils jouent à ce titre un rôle important dans l'épuration de l'air, mais aussi en matière d'accumulation de certains polluants (métaux lourdsetradionucléidesnotamment). Ce sont aussi desorganismes pionniersde succession (capables de croître sur des sols squelettiques et de fournir de l'humus pour les communautés suivantes) importants dans les processus derésilience écologique.
Ils sont moins sensibles à la continuité temporelle de l'état forestier que leslichens[75].
Les espèces les plus sensibles aux polluants acides et aux pesticides véhiculés par l'air ont parfois disparu de tout ou partie de leur habitat naturel. Depuis les années 1960, certaines espèces sensibles ou résistantes sont utilisées comme desbioindicateursou desbiointégrateurs,en matière de qualité thermohygrométrique de l'air notamment ou de contaminations métalliques (cas des bryophytes aquatiques ou urbaines)[76],[77].Parmi lesbioaccumulateursvégétaux et animaux, les mousses sont ceux qui répondent le mieux aux critères exigibles pour l'obtention d'une bonne information sur le degré de contamination métallique des cours d'eau. Elles permettent notamment de cartographier la pollution présente et d'un passé récent. On les a utilisées par exemple[Note 17]pour cartographier des pollutions par leplombou lecadmium[78].
Ils ont aussi été utilisés comme indicateurs dechangement climatiquerécent[79].
Histoire évolutive[modifier|modifier le code]


Le fossile de moussePallavicinites devonicus,daté dudévonien supérieur(environ 350 millions d'années)[81],rappelle que lesembryophytes(i.e. lesplantes terrestres)sorties des eauxil y a environ 450 millions d'années sont probablement issues d'algues vertesdu groupe descharophytes,qui ont évolué eneau douceet sont capables de supporter des émersions temporaires grâce à ces associationssymbiotiques(bactéries, micro-algues et micro-champignons)[82].
Les premiersphylumsà émerger au sein des bryophytes sont respectivement et successivement leshépatiquesàthalle,lesanthocéroteset lesmousses vraies[83].
Laconquête du milieu terrestreexige un certain nombre d'adaptations qui sont toujours présentes chez les mousses actuelles. Faisant partie des premièresplantes terrestrespour qui l'eau et le gaz étaient lesfacteurs limitants,elles avaient certainement peu de possibilités de contrôler leur teneur en eau (absence destomatesau niveau de l'axe feuillé, mincecuticule). Ne possédant ni de vrais vaisseaux conducteurs, ni de véritables racines, ni d'organes de stockage, elles ont développé plusieurs adaptations: grande capacité d'absorption de l'eau (elles fonctionnant pour la plupart comme une éponge), tolérance à ladessiccationet capacité dereviviscencelorsque les conditions extrêmes (sécheresse, climat…) qu'elles ont dû endurer sont terminées[Note 18],ce qui explique que les bryophytes se sont autant affranchies du milieu aquatique que les végétaux vasculaires, beaucoup de mousses survivant dans des milieux secs (par exemple lesespèces pionnièrescapables de coloniser les roches nues, les déserts chauds et froids[Note 19],les toits ensoleillés des maisons)[87].Elles ont toujours besoin d'eau (par exemple de pluie) pour leurreproduction sexuéeaquatique. L'absence detissus conducteurspose des problèmes de soutien en raison de lapoussée d'Archimèderéduite en milieu aérien, d'où leur petite taille qui ne dépasse généralement pas 7cmet leur forme compacte qui permet à leurappareil végétatifd'acquérir un port dressé qui complète les autres ports typiques (rampant, en coussinet, en lames foliacée)[88],[89].Elles disposent derhizoïdesassurant l'ancrage, tandis que l'absorption de l'eau et des minéraux est réalisée par une symbiose fongique avec l'équivalent demycorhizes[90].
Peu de changements morphologiques sont observés depuis les fossiles jusqu'aux formes actuelles, ce qui fait des bryophytes le groupe le plus stable morphologiquement desplantes terrestres[91].
Lesanthocérotesforment un lien important pour l'étude de l'évolution des plantescar il représente ungroupe frèredesvégétaux vasculaires[92].Ils montrent le passage de la phase gamétophytique dominante au profit du sporophyte dominant des plantes vasculaires (réduction de taille mais aussi du temps de vie du gamétophyte), conduisant au succès évolutif desplantes à fleurs.Une hypothèse est que la réduction de cettephase gamétophytique du cycle biologiqueau cours de laconquête des terres(milieu difficile) pourrait être que ladiploïdiedu sporophyte autorise le masquage de l'expression de mutations délétères (provenant d'une exposition auxUV) parcomplémentation génétique[93],[94].
Taxinomie[modifier|modifier le code]
Le sous-règne desBryobiotinaa été nommé par lebotanisteitalienVittore Benedetto Antonio Trevisan de Saint-Léonen 1876, initialement sous le nomBryophytae[95].
Liste desdivisions(ouphylums) du sous-règne desBryobiotina(du règne desChlorobiota) selon J. M. Glime, 2017[5],Novikoff et Barabasz-Krasny, 2015[6]et laWorld Flora Online(WFO)(5 janvier 2024)[96]:
- AnthocerotophytaStotl. et Crand.-Stotl. - les anthocérotes
- BryophytaSchimp. - les mousses
- MarchantiophytaStotler et Crand. - les hépatiques ou marchantiophytes
LeCatalogue of Life(5 janvier 2024)[97]etbryonames.org[98]ajoutent la divisionfossiledes†LangiophytophytaDoweld, 2001.
SelonTropicos(13 juin 2023)[99](attention liste brute contenant dessynonymes):
- AnthocerotophytaStotler & Crand.-Stotl., 1977
- BryophytaSchimp., 1879
- HepaticophytaH.C. Bold ex Stotler & Crand.-Stotl., 1977
- HepatophytaH.C. Bold ex Stotler & Crand.-Stotl., 1977
- HepatophytaH.C. Bold, 1957
- †LangiophytophytaDoweld, 2001
- MarchantiophytaStotler & Crand.-Stotl., 2000
- MonosporangiophytaS. Majumdar, 2020
- MstikhiniaMosseichik, Ignatov & Ignatiev, 2007
- SphagnophytaH.A. Crum, 2001
- TakakiophytaCrand.-Stotl., 1986
Avec près de 25 000 espèces de mousses et sphaignes, 9 000 espèces d'Hépatiques (Marchantiophytes) et 300 espèces d'anthocérotes, les bryophytes constituent le second groupe de végétaux terrestres, après lesDicotylédones[100].En France, près de 1 300 espèces sont connues, le pays comptant de nombreuxtaxonstrès rares[101].
Laphylogénétique moléculaireactuelle remet en cause les caractères morphologiques utilisés pour laclassification classique,en montrant qu'il y a souvent unehomoplasiesubstantielle dans plusieurs de ces caractères employés pour définir desgenres,desfamilleset dessous-ordres[102].
État, pression et menaces sur les populations[modifier|modifier le code]
Certaines espèces ont disparu de régions entières, ou doivent être considérées comme rares, menacées ou en danger (uneliste rougede bryophytes a par exemple été publiée pour leLuxembourg[103]).
D'autres sont devenuesenvahissantes.
-
Buxbaumia viridis,espèce protégée en France.
Notes et références[modifier|modifier le code]
Notes[modifier|modifier le code]
- Tetraplodon angustatus(sv)est par exemple une espècecoprophageinféodée auxexcrémentsdecarnivores(renard,loupetchien) et probablement aussi auxpelotes de réjectiondechouettes[1].
- L'étymologie de cenom scientifiquefait référence aux corbeilles en forme delunule,de croissant, cruciata aux pieds du sporophyte en croix. Ces propagules se forment au fond de la corbeille, puis s'élèvent sur un court pédicule et enfin se détachent.
- Le diagramme représente les « tiges » brunes pour les distinguer des « feuilles » vertes mais ces tiges sont généralement vertes car elles aussi photosynthétiques.
- Ces poils prolongent les « nervures » des « feuilles » et forment des pointes à leur extrémités. Ils réfléchissent la lumière du jour, ce qui permet de lutter contre le des sắc chement. Inversement, ils captent les gouttelettes de rosée ou de brouillard grâce à des papilles en surface qui créent des canaux piégeant l'eau. On peut dire ainsi que les moussesvivent d'air et d'eau fraiche[26].
- Cette coupe permet d'observer, de l'extérieur à l'intérieur, une assise superficielle, à valeur d'épiderme; une zonecorticaleconstituée de cellulesparenchymateuse;un cordon central formé de leptoïdes et d'hydroïdes[34].
- Finement dentée, la feuille ou pseudophylle porte à sa surface supérieure des lamelles chlorophylliennes dressées de 5 à 10 cellules de haut. Le cordon conducteur est normalement composé d'hydroïdes et de leptoïdes. Ces lamelles ont pour effet d'accroître la surface d'échange et de favoriser la diffusion de CO2,facteur limitant chez ces mousses caractérisées par l'absence destomatesau niveau du gamétophyte[35].
- Elles compensent la forte mortalité des gamétophytes (exposition au soleil, dessiccation ou perte d'eau par évapotranspiration) par une production constante, régulière de sporophytes
- Les grands coussinets qui ont unrapport surface/volumeplus bas ont une évapotranspiration plus faible, ce qui leur permet de rester hydratés plus longtemps et donc de photosynthétiser pendant quelques heures de plus[39].ChezGrimmia pulvinata,« en juillet, des coussins hydratés artificiellement et exposés en plein soleil, se des sắc chent en quatre heures pour les plus petits contre neuf heures pour les plus gros[40]».
- La probabilité de dispersion à courte distance est élevée tandis que celle à longue distance est faible
- La dispersion des spores est directement influencée par l'incidence des facteurs extrin sắc ques (facteurs topographiques, position par rapport aux autres plantes, facteurs météorologique tels que vitesse et direction du vent, ensoleillement, turbulence de l'air, humidité et précipitations) et des facteurs intrin sắc ques (hauteur de libération des spores, saison de reproduction, taille (moyenne entre 10 et 15μm) et aérodynamisme des spores, vitesse d'éjection…). Certaines mousses expulsent leurs spores à30m/sjusqu'à une dizaine de cm de hauteur.
- Une étude en Belgique montre que cette moyenne occulte de grandes disparités: 35 % des espèces bryophytes — incluant notamment des espèces rares — sont susceptibles de se déplacer à une vitesse d'environ 25kmen 50 ans[43]
- Du grecrugchosbec d'oiseau, eteu,bien; du latinpraelongustrès long, allusion au rostre très long de l'opercule au sommet de la capsule portée par le sporophyte.
- Du grecrhutis,plis, etdiadelphos,jumelés (en référence aux deux plis des feuilles caulinaires, bien visibles à sec). Espècenitrophileetsynanthrope,elle n'élimine pas ou n'étouffe pas les herbes du jardin. Comme toutes les mousses des pelouses, elle est moins compétitive que les herbes, disparaît dès leur arrivée et s'installe là où les conditions ne sont pas propices à ces dernières[51].
- D'où l'étymologie populaireassociée à l'Hypne cyprès.
- Les feuilles se regroupent enrosettesqui portent des pédicelles dont la couleur varie de vert pâle à jaune orangé, selon leur degré de maturité. Les jeunes capsules portent des coiffes munies d'un long bec.
- Leurs parois ont une teneur élevée enacides polygalacturoniquesetgroupes fonctionnels(amine,phosphodiester) qui forment des sites immobiles extracellulaires chargés négativement, favorisant lesréactions d'échange cationique(remplacement d'un cation lié à ces sites par un autre cation métallique du milieu extérieur). Différentes voies sont généralement décrites pour expliquer la prise en charge des contaminants (métaux, radionucléides) et leurbioaccumulation(adsorption sur la surface des parois cellulaires, transport dans les espaces intercellulaires…)[72].
- Orthotrichum diaphanum(de)est une mousseépiphytequi vit sur les murs et les trottoirs humides des villes et qui résiste à la pollution urbaine.
- Les bryophytes ont développé la capacité de supporter une période de sécheresse encessant toute activité métabolique,vie ralentie qui peut atteindre plusieurs siècles comme pourChorisodontium aciphyllum(en)[84].Pour résister à la dessiccation, elles fonctionnent comme une éponge et certaines développent certaines adaptations en prenant une apparence brune et rabougrie:crispation des feuilles(de),entortillement, application des feuilles contre la tige, retournement du thalle. Cette phase d'anhydrobiosepeut perdurer jusqu'à une trentaine d'années pour certaines espèces[85].
- Cette colonisation de milieuxoligotrophespauvres enazoteest permise grâce à l'association symbiotique avec des cyanobactéries du typeNostocréalisant laphotosynthèseetfixant l'azote[86].
Références[modifier|modifier le code]
- (en)Howard Crum,Structural diversity of bryophytes,University of Michigan Herbarium,,p.214.
- (en)A. Smith,Bryophyte Ecology,Springer Science & Business Media,,p.314.
- Jean-Claude Rameau, Dominique Mansion et Gérard Dumé,Flore forestière française: guide écologique illustré,Forêt privée française,,p.173.
- (en)Tomas Hallingbäck et Nick Hodgetts,Mosses, liverworts, and hornworts: status survey and conservation action plan for bryophytes,IUCN in collaboration with the Swedish Threatened Species Unit,(ISBN978-2-8317-0466-1).
- (en)Janice M.Glime,« Anthocerotophyta Chapt. 2-8 »,dansBryophyte Ecology,vol.1,Université technologique du MichiganetInternational Association of Bryologists(en),(lire en ligne).
- (uk)A.Novikoffet B.Barabasz-Krasny,« Система ембріофітів »,dansModern Plant Systematics[« Système d'embryophytes »],Lviv,Ukraine,Liga-Pres,(lire en ligne[PDF]),p.23-63.
- Jean-Louis De Sloover et Anne-Marie Bogaert-Damin,Les Muscinées duXVIeauXIXesiècle dans les collections de la Bibliothèque universitaire Moretus Plantin,Presses universitaires de Namur,,p.103.
- Jean Vallade,L'œil de lynx des microscopistes. La sexualité végétale: l'apport des micrographes depuis leXVIIesiècle,Éditions universitaires de Dijon,,p.111.
- Johannes Hedwig,Theoria generationis et fructificationis plantarum cryptogamarum Linnæi,Pétersbourg, 1784[lire en ligne],p. 52 et suiv.
- (en)Anupama Krishna,Botany for Degree Students. Bryophyta,S. Chand Publishing,,p.12.
- (en)A. Jonathan Shaw et Bernard Goffinet,Bryophyte Biology,Cambridge University Press,(lire en ligne[PDF]),p.135.
- Karen S.Renzaglia,Juan C.Villarrealet R. JoelDuff,« New insights into morphology, anatomy, and systematics of hornworts »,dansBryophyte Biology,Cambridge University Press,(ISBN978-0-521-69322-6,DOI10.1017/cbo9780511754807.004,lire en ligne),p.139–172.
- Daniel Richard, Martine Hausberger, Patrick Chevalet, Sylvie Fournel, Nathalie Giraud, Frédéric Gros, Patrick Laurenti, Fabienne Pradere, Thierry Soubaya et Frédéric Ysnel,Biologie,Dunod,,p.115.
- (en)R. E. Longton, «Reproductive biology and evolutionary potential in bryophytes»,Journal of the Hattori Botanical Laboratory,vol.41,,p.205-223(lire en ligne[PDF]).
- (en)Kishan Gopal Ramawat, Jean-Michel Mérillon et K. R. Shivanna,Reproductive Biology of Plants,CRC Press,,p.64.
- (en)Roy C.Brownet Betty E.Lemmon,«Spores before sporophytes: hypothesizing the origin of sporogenesis at the algal–plant transition»,New Phytologist,vol.190,no4,,p.875–881(ISSN0028-646Xet1469-8137,DOI10.1111/j.1469-8137.2011.03709.x,lire en ligne,consulté le).
- Yves Tourte, Michel Bordonneau, Max Henry et Catherine Tourte,Le monde des végétaux. Organisation, physiologie et génomique,Dunod,,p.48.
- Amélie Pichonet, « Variabilité et dispersion au sein du genreDicranumHedw. (Dicranaceae,Bryophyta): approches moléculaire et morphologique », Thèse Museum National d'Histoire Naturelle, 2011, p. 6.
- Amélie Pichonet,op. cit.,p. 7.
- Angela E.Newtonet Brent D.Mishler,«The Evolutionary Significance of Asexual Reproduction in Mosses»,The Journal of the Hattori Botanical Laboratory,vol.76,,p.127–145(DOI10.18968/jhbl.76.0_127,lire en ligne[PDF],consulté le).
- J. G.Parsons,A.Cairns,C. N.Johnsonet S. K. A.Robson,«Bryophyte Dispersal by Flying Foxes: A Novel Discovery»,Oecologia,vol.152,no1,,p.112–114(ISSN0029-8549,lire en ligne[PDF],consulté le).
- (en)JörgenRudolphi,«Ant-mediated dispersal of asexual moss propagules»,The Bryologist,vol.112,no1,,p.73–79(ISSN0007-2745et1938-4378,DOI10.1639/0007-2745-112.1.73).
- Robin WallKimmereret Craig C.Young,«The Role of Slugs in Dispersal of the Asexual Propagules of Dicranum flagellare»,The Bryologist,vol.98,no1, 21/1995,p.149(DOI10.2307/3243652).
- (en)Christopher G.Eckert,«The loss of sex in clonal plants»,Evolutionary Ecology,vol.15,no4,,p.501–520(ISSN1573-8477,DOI10.1023/A:1016005519651,lire en ligne[PDF],consulté le).
- (en)J. W. Bates, «Mineral nutrient acquisition and retention by bryophytes»,Journal of Bryology,vol.17,no2,,p.223-240(DOI10.1179/jbr.1992.17.2.223).
- (en)William McLagan Malcolm, Nancy Malcolm,Mosses and other bryophytes: an illustrated glossary,Micro-Optics Press,,p.156
- Franck Massé,Les mousses, les lichens et les fougères,CNPF,,p.24.
- Vincent Chassany, Marie Potage et Maud Ricou,Biologie végétale,Dunod,,p.81.
- (en)David H. S. Richardson,The biology of mosses,John Wiley & Sons Canada,,p.25-26.
- (en)J. G. Duckett, S. Pressel, «The evolution of the stomatal apparatus: intercellular spaces and sporophyte water relations in bryophytes-two ignored dimensions»,Philos. Trans. R. Soc. Lond. B Biol. Sci.,vol.373I,no1739,(DOI10.1098/rstb.2016.0498).
- (en)J. Leon,Cladogramme des plantes terrestres, montrant l'évolution des stomates,Phylogenomic evidence for reductive evolution of stomata,Curr. Biol.,2020.
- (en)Bernard Goffinet, Victoria Catherine Hollowell, Robert E. Magill,Molecular Systematics of Bryophytes,Missouri Botanical Garden Press,,p.55.
- Marc-André Selosse,Les Goûts et les couleurs du monde. Une histoire naturelle des tannins, de l'écologie à la santé,Actes Sud Nature,,p.91
- Valérie Boutin, Jean-François Fogelgesang, Jean-François Beaux et Françoise Ribola,Atlas de biologie végétale,Dunod,,p.17
- (en)Mariann Marschall, Michael CF Proctor, «Are Bryophytes Shade Plants? Photosynthetic Light Responses and Proportions of Chlorophyll a, Chlorophyll b and Total Carotenoids»,Annals of Botany,vol.94,no4,,p.603(DOI10.1093/aob/mch178)
- (en)Matt von Konrat,Bryophytes. The Closest Living Relatives of Early Land Plants,Magnolia Press,,p.176.
- Gérard Guillot, «Pierre qui mousse n’amasse pas d’eau», surzoom-nature.fr,.
- (en)Matt von Konrat,Bryophytes. The Closest Living Relatives of Early Land Plants,Magnolia Press,,p.180.
- (en)Gerhard Zotz, Anja Schweikert, Walter Jetz, Herta Westerman, «Water relations and carbon gain are closely related to cushion size in the mossGrimmia pulvinata»,New Phytologist,vol.148,no1,,p.59-67(DOI10.1046/j.1469-8137.2000.00745.x).
- Gérard Guillot, «La grimmie: une souris grise sur un mur», surzoom-nature.fr(consulté le).
- (en)Håvard Kauserud, Cecilie Mathiesen et Mikael Ohlson, «High diversity of fungi associated with living parts of boreal forest bryophytes»,Botanique,vol.86,no11,,p.1326-1333(DOI10.1139/B08-102,résumé)
- (en)T. J. Carleton & D. J. Read, «Ectomycorrhizas and nutrient transfer in conifer – feather moss ecosystems»,Revue canadienne de botanique,vol.69,no4,,p.778-785(DOI10.1139/b91-101).
- (en)V. Hutsemekers, C. Dopagne, A. Vanderpoorten, «How far and how fast do bryophytes travel at the landscape scale?»,Diversity and Distribution,vol.14,no3,,p.483-492(DOI10.1111/j.1472-4642.2007.00454.x)
- Ainsi, la production annuelle d'1m2de mousse peut aller de 100 millions à 10 milliards de spores. Cf(en)C. J. Miles & R. E. Longton, «Deposition of moss spores in relation to distance from parent gametophytes»,Journal of Bryology,vol.17,no2,,p.355-368(DOI10.1179/jbr.1992.17.2.355).
- (en)Emma J. Pharo, Charles E. Zartman, «Bryophytes in a changing landscape: The hierarchical effects of habitat fragmentation on ecological and evolutionary processes»,Biological Conservation,vol.135,no3,,p.317(DOI10.1016/j.biocon.2006.10.016).
- Hutsemekers et al,op. cit..
- (en)R.E. Longton (1988),Biology of polar bryophytes and lichens.British Bryological Society Cambridge University Press..
- P. Meyer et M. Schmidt, «Accumulation of dead wood in abandoned beech (Fagus sylvaticaL.) forests in northwestern Germany»,Forest Ecology and Management,vol.261,,p.343–352(résumé)
- J. Bardat. 2006. Écologie des bryophytes. In Lamy, D., Decocq, G., Boudier, P., Chavoutier, J., Bardat, J., Hugonnot, V., & Rausch de Trautenberg, C. (eds),Bulletin Mycologique et Botanique Dauphiné-Savoie,p. 47–61
- Jean-Claude Rameau, Dominique Mansion, Gérard Dumé,Flore forestière française. Plaines et collines,Forêt privée française,,p.89
- (en)Andrew Farmer,Jeffrey Batesl,Bryophytes and Lichens in a Changing Environment,Clarendon Press,,p.262
- (en)Scott Hotaling, Timothy C. Bartholomaus, Sophie L. Gilbert, «Rolling Stones Gather Moss: Movement and Longevity of Moss Balls on an Alaskan Glacier»,Polar Biology,vol.43,no6,,p.735–744(DOI10.1007/s00300-020-02675-6).
- Franck Massé,Les mousses, les lichens et les fougères,CNPF,,p.21.
- (en)David H. S. Richardson,The biology of mosses,John Wiley & Sons Canada,,p.37.
- (en)Martin I Bidartondo, Thomas D Bruns, Michael Weiss, Cecília Sérgio & and David J Read, «Specialized cheating of the ectomycorrhizal symbiosis by an epiparasitic liverwort»,Proc Biol Sci.,vol.270,no1517,,p.835–842(DOI10.1098/rspb.2002.2299).
- B.V. Tooren, «Effects of a bryophyte layer on the emergence of seedlings of chalk grassland species»,Acta Oecologica,vol.11,no2,,p.155-163(lire en ligne)
- (en)Jennifer Britt, Charles Deeming, «First-egg date and air temperature affect nest construction in Blue Tits Cyanistes caeruleus, but not in Great Tits Parus major»,Bird Study,vol.58,no1,,p.78-89(DOI10.1080/00063657.2010.524916).
- (en)O. O. Oyesiku & O. R. Ogunkolade, «The relationship between the Nigerian garden snail Limicolaria aurora and the moss Hyophila crenulata»,Journal of Bryology,vol.28,no2,(DOI10.1179/174328206X105380).
- (en)U. Gerson, «Moss-arthropod association»,The Bryologist,vol.72,,p.495-500.
- (en)Claudia Ihl & Perry S. Barboza, «Nutritional Value of Moss for Arctic Ruminants: A Test with Muskoxen»,The Journal of Wildlife Management,vol.71,no3,,p.752-758.
- (en)Longton, R. E. (1992) The role of bryophytes and lichens in terrestrial ecosystems. In, J. W. Bates & A. M. Farmer (eds). Bryophytes in a Changing Environment, 32-76. Clarendon Press, Oxford
- (en)Alain Vanderpoorten et Bernard Goffinet,Introduction to Bryophytes,Cambridge University Press,,p.35.
- (en)Bojana Božanić et al, «Factors Affecting Invertebrate Assemblages in Bryophytes of the Litovelské Luhy National Nature Reserve, Czech Republic»,Acat Zoologica Bulgarica,vol.65,no2,,p.197-206.
- (en)Gerson U. 1982. Bryophytes and Invertebrates. – In: Smith A. J. E. (Ed.): Bryophyte Ecology. London, New York (Chapman & Hall Ltd), p. 291-332.
- Franck Massé,Les mousses, les lichens et les fougères,CNPF,,p.25.
- (en)Jan-Peter Frahm, «Recent Developments of Commercial Products from Bryophytes»,The Bryologist,vol.107,no3,,p.277-283.
- Sébastien Leblond & Anabelle Boucher, «Initiation à la bryologie - Voyage au cœur de la vie secrète des mousses», 2011, p.24
- C. Ah-Peng, P. Staménoff, J. Bardat, T. Hedderson, L. Marline, N. Wilding, D. Strasberg, « Initiation à l'étude des bryophytes des îles du Sud Ouest de l’océan Indien », 2014, Faculté des sciences Université de la Réunion, p. 6
- (en)Ando, H. & A. Matsuo (1984). Applied bryology, In W. Schultze-Motel (ed.), Advances in Bryology, vol 2 Cramer, p. 133- 224.
- (en)Bernard Clément, Jean Touffet, «Plant strategies and secondary succession on Brittany heathlands after severe fire»,Journal of Vegetation Science,vol.1,no2,,p.195-202(DOI10.2307/3235658).
- (en)A.M. Kooijman et C. Bakker, «Species replacement in the bryophyte layer in mires: the role of water type, nutrient supply and interspecific interactions»,Journal of Ecology,vol.83,,p.1–8(résumé)
- (en)Anju Malik, Mohd. Kashif Kidwai, Vinod Kumar Garg,Bioremediation of Toxic Metal(loid)s,CRC Press,,p.65
- (en)A.M. Kooijman et C. Bakker, «The acidification capacity of wetland bryophytes as influenced by clean and polluted rain»,Aquatic Botany,vol.48,,p.133–144(DOI10.1016/0304-3770(94)90080-9,résumé)
- (en)A.M. Kooijman (1993), Changes in the bryophyte layer of rich fens as controlled by acidification and eutrophication. PhD Thesis, Utrecht University, the Netherlands
- (en)Ö. Fritz, L. Gustafsson et K. Larsson, «Does forest continuity matter in conservation? - A study of epiphytic lichens and bryophytes in beech forests of Southern Sweden»,Biological Conservation,vol.141,,p.655–668(résumé)
- (en)P. C. Onianwa, «Monitoring atmospheric metal pollution: A review of the use of mosses as indicators»,Environmental Monitoring and Assessment,vol.71,no1,,p.13–50(DOI10.1023/A:1011660727479).
- (en)Maurizio Aceto, Ornella Abollino, Raffaele Conca, Mery Malandrino, «The Use of Mosses as Environmental Metal Pollution Indicators»,Chemosphere,vol.50,no3,,p.333-342(DOI10.1016/S0045-6535(02)00533-7).
- (en)Theresa Greenaway,Mosses and Liverworts,Steck-Vaughn,,p.20.
- J.P. Frahm et D. Klaus, «Bryophytes as indicators of recent climate fluctuations in Central Europe»,Lindbergia,vol.26,no2,,p.97–104
- R. Wattenhofer,Contribution à l'étude des macrophytes du Léman,Conservatoire Botanique de Genève,,p.115.
- (en)F. M. Hueber, «Hepaticites devonicus, a New Fossil Liverwort from the Devonian of New York»,Annals of the Missouri Botanical Garden,vol.48,no2,,p.125–131(DOI10.2307/2394879).
- (en)Douglas E. Soltis, Pamela Soltis, J.J. Doyle,Molecular Systematics of Plants II: DNA Sequencing,Springer,,p.530
- «Du Silurien au Dévonien: les sorties des eaux», surcnrs.fr(consulté le).
- (en)Esme Roads, Royce E. Longton, Peter Convey, «Millennial timescale regeneration in a moss from Antarctica»,Current biology,vol.24,no6,,p.222-223(DOI10.1016/j.cub.2014.01.053)
- Laurent Burgisser & Ariane Cailliau,« Les mousses »: Liste Rouge, inventaire et initiation aux bryophytes du canton de Genève,Conservatoire et jardin botaniques de la ville de Genève, 2012, p. 32
- (en)Adams, D. G. & Duggan. P. S. (2008) Cyanobacteria-bryophyte symbioses. Conference Information: Annual Meeting of the Society-for-Experimental-Biology, MAR 31-APR 04, 2007 Glasgow, Scotland. Journal of Experimental Botany 59: 1947-1058
- (en)P. Alpert & M. J. Oliver (2002) Drying without dyin, In: Black M, Prichard HW (eds) Desiccation and survival in plants: drying without dying, CABI, Wallingford, p. 3–43
- (en)Hugues Renault, Annette Alber, Nelly A. Horst, Alexandra Basilio Lopes, Eric A. Fich, Lucie Kriegshauser, Gertrud Wiedemann, Pascaline Ullmann, Laurence Herrgott, Mathieu Erhardt, Emmanuelle Pineau, Jürgen Ehlting, Martine Schmitt, Jocelyn K. C. Rose, Ralf Reski & Danièle Werck-Reichhart, «A phenol-enriched cuticle is ancestral to lignin evolution in land plants»,Nature Communications,vol.8,no14713,(DOI10.1038/ncomms14713).
- Peter H Raven, Susan R Singer, Georges B Johnson, Kenneth A Mason, Jonathan B Losos,Biologie,De Boeck Superieur,(lire en ligne),p.591.
- Jean Garbaye,La symbiose mycorhizienne,Quae,,p.121.
- (en)R. Reski, «Development, Genetics and Molecular Biology of Mosses»,Plant biology,vol.111,no1,,p.10(DOI10.1111/j.1438-8677.1998.tb00670.).
- Peter H Raven,op. cit.,p. 593
- (en)H. Bernstein, G.S. Byers et R.E. Michod, «Evolution of sexual reproduction: Importance of DNA repair, complementation, and variation»,The American Naturalist,vol.117,no4,,p.537–549(DOI10.1086/283734).
- (en)R.E. Michod et T.W. Gayley, «Masking of mutations and the evolution of sex»,The American Naturalist,vol.139,no4,,p.706–734(DOI10.1086/285354).
- (it)Trevisan de Saint-Léon,«Carestiaea, nuovo genere di Andreäacee»,Atti Della Società Italiana Di Scienze Naturali,vol.19,,p.468–480
- WFO:World Flora Online.Published on the Internet: http:// worldfloraonline.org., consulté le 5 janvier 2024
- Catalogue of Life Checklist,consulté le 5 janvier 2024
- (en)«The Bryophyte Nomenclator — Bryobiotina», surbryonames.org(consulté le)
- Tropicos.org. Missouri Botanical Garden., consulté le 13 juin 2023
- (en)Buck, W.R. & Goffinet, B. 2000. 3. Morphology and classification of mosses. In A.J. Shaw & B. Goffinet (eds.), Bryophyte Biology. Cambridge University Press, p. 71
- Vincent Hugonnot,Un haut-lieu pour la conservation des bryophytes: les gorges de la Rhue (Cantal),Journée Forêt & Biodiversité du 17 octobre 2013
- (en)B. Crandall-Stotler, R. E. Stotler & D. G. Long, « Morphology and classification of the marchantiophyta », in Goffinet, B., & Shaw, A.J. (eds),Bryophyte Biology,Cambridge University Press, 2008, p. 1–54.
- Werner J (1987)Liste rouge des bryophytes du Grand-Duché de Luxembourg.Musée d'histoire naturelle (PDF, 46 p).
Voir aussi[modifier|modifier le code]
Bibliographie[modifier|modifier le code]
- (en)Frey, W., Frahm, J.P., Fischer, E., & Lobin, W. (2006),The Liverworts, Mosses and Ferns of Europe.Harley Books, Colchester
- (en)Goffinet, B., Buck, W.R., & Shaw, A.J. (2008),Morphology, anatomy and classification of the Bryophyta.Pages 55–138 of: B., Goffinet, & A.J., Shaw (eds),Bryophyte Biology second edition.Cambridge University Press.
- Prune Pellet - Bryoflore des pierriers gréseux du massif du Suquet (Aigoual, Cévennes),Répartition, inventaire, caractérisation bryocénotiques et écologiques et évaluation de l'intérêt patrimonial, Rapport de stage Parc National des Cévennes, MNHN. Mis en ligne par Tela-Botanica.
- Vincent Hugonnot,Mousses et hépatiques de Païolive (Ardèche et Gard, France),Jarnac, Société Botanique du Centre-Ouest,,293p.(ISSN0759-934X)
- Vincent Hugonnot, Jaoua Celle, Florine Pépin,Mousses et hépatiques de France,Biotope Editions, 2015, 320 p.(ISBN9782366621952)
- (en)Alain Vanderpoorten et Bernard Goffinet,Introduction to Bryophytes,Cambridge University Press,,293p.(lire en ligne)
Articles connexes[modifier|modifier le code]
Liens externes[modifier|modifier le code]
- base de données taxinomiquespécialisée sur les bryophytes:(en)«The Bryophyte Nomenclator — Home», surbryonames.org(consulté le)
- (en)RéférenceBioLib:BryobiotinaD.H. Campbell(consulté le)
- (en)RéférenceCatalogue of Life:BryobiotinaTrevis.(consulté le)
- (fr + en)RéférenceEOL:BryobiotinaTrevis.(consulté le)
- (en)RéférencePaleobiology Database:Bryobiotina(consulté le)
- (en)RéférenceTaxonomicon:BryobiotinaCampb. (1890)(consulté le)
- (en)RéférenceTropicos:BryobiotinaTrevis.(+ liste sous-taxons)(consulté le)
- (en)RéférenceWorld Flora Online(WFO):BryobiotinaTrevis.(+descriptions)(consulté le)
- Bryophytes,article en ligne de l'Encyclopædia Universalis
- Les bryophytes,présentation du Centre de ressources pédagogiques en Biologie Végétale de l'Université de Bourgogne
- Bryophytes de France
- (en)Bryophyta. Tree of life
- Bryologia Gallica
- Clés de détermination (chapitre 3)


![Microphotographie d'un coupe transversale de l'axe feuillé de Dawsonia[Note 5].](https://upload.wikimedia.org/wikipedia/commons/thumb/d/d2/Dawsonia_stem.svg/324px-Dawsonia_stem.svg.png)
![Coupe transversale de la « feuille » du Polytric commun[Note 6].](https://upload.wikimedia.org/wikipedia/commons/thumb/d/d9/Polytrichum_commune_querschnitt.jpeg/240px-Polytrichum_commune_querschnitt.jpeg)


![L'évaporation, en lien avec la taille des coussinets, est un facteur limitant de la photosynthèse[Note 8].](https://upload.wikimedia.org/wikipedia/commons/thumb/2/2c/Polsterkissenmoos_2.jpg/240px-Polsterkissenmoos_2.jpg)




![Eurhynchium praelongum (en)[Note 12], l'Eurhynchie allongée, plante vivace à tige rampante, humo-terricole[50].](https://upload.wikimedia.org/wikipedia/commons/thumb/5/5d/Moss_cobroft_rest_area.jpg/240px-Moss_cobroft_rest_area.jpg)

![Rhytidiadelphus squarrosus (en) (l'Hypne squarreux), une des mousses les plus communes des jardins[Note 13].](https://upload.wikimedia.org/wikipedia/commons/thumb/f/f3/Rhytidiadelphus_squarrosus_141600299.jpg/240px-Rhytidiadelphus_squarrosus_141600299.jpg)
![Mousses de glacier (en) dont les boules peuvent se déplacer de 2,5 cm par jour[52].](https://upload.wikimedia.org/wikipedia/commons/thumb/e/e8/Mousses_sur_le_fell_field%2C_Ditrichum_strictumLycopodium_magellanicum_-_panoramio.jpg/240px-Mousses_sur_le_fell_field%2C_Ditrichum_strictumLycopodium_magellanicum_-_panoramio.jpg)



