Enzyme


Uneenzymeest uneprotéinedotée de propriétéscatalytiques.Presque toutes lesbiomoléculescapables de catalyser desréactions chimiquesdans lescellulessont des enzymes; certaines biomolécules catalytiques sont cependant constituées d'ARNet sont donc distinctes des enzymes: ce sont lesribozymes.
Une enzyme agit en abaissant l'énergie d'activationd'une réaction chimique, ce qui accroît lavitesse de réaction.L'enzyme n'est pas modifiée au cours de la réaction. Les molécules initiales sont lessubstratsde l'enzyme, et les molécules formées à partir de ces substrats sont les produits de la réaction. Presque tous lesprocessus métaboliquesde lacelluleont besoin d'enzymes pour se dérouler à une vitesse suffisante pour maintenir la vie. Les enzymes catalysent plus de 5 000 réactions chimiques différentes[2].L'ensemble des enzymes d'une cellule détermine lesvoies métaboliquespossibles dans cette cellule. L'étude des enzymes est appeléeenzymologie.
Les enzymes permettent à des réactions de se produire des millions de fois plus vite qu'en leur absence. Un exemple extrême est l'orotidine-5'-phosphate décarboxylase,qui catalyse en quelquesmillisecondesune réaction qui prendrait, en son absence, plusieurs millions d'années[3],[4].Comme tous les catalyseurs, les enzymes ne sont pas modifiées au cours des réactions qu'elles catalysent, et ne modifient pas l'équilibre chimiqueentre substrats et produits. Les enzymes diffèrent en revanche de la plupart des autres types de catalyseurs par leur très grandespécificité.Cette spécificité découle de leurstructure tridimensionnelle.De plus, l'activité d'une enzyme est modulée par diverses autres molécules: uninhibiteur enzymatiqueest une molécule qui ralentit l'activité d'une enzyme, tandis qu'un activateur de cette enzyme l'accélère; de nombreuxmédicamentsetpoisonssont des inhibiteurs enzymatiques. Par ailleurs, l'activité d'une enzyme décroît rapidement en dehors de sa température et de sonpHoptimums. De plus, une enzyme a la caractéristique d'être réutilisable.
Structure
[modifier|modifier le code]Les enzymes sont généralement desprotéinesglobulairesqui agissent seules, comme lelysozyme,ou en complexes de plusieurs enzymes ousous-unités,à l'instar ducomplexeα-cétoglutaratedéshydrogénase.Comme toutes les protéines, les enzymes sont constituées d'une ou plusieurschaînes polypeptidiquesrepliéespour former une structure tridimensionnelle correspondant à leurétat natif.Laséquenceenacides aminésde l'enzyme détermine la structure de cette dernière, structure qui, à son tour, détermine les propriétéscatalytiquesde l'enzyme[5].Bien que ce soit la structure d'une enzyme qui détermine sa fonction, il n'est pas encore possible à ce jour de prédire l'activité d'une nouvelle enzyme en ne connaissant que sa structure[6].La structure des enzymes est altérée (dénaturée) lorsqu'elles sont chauffées ou mises en contact avec des dénaturants chimiques, ce qui a généralement pour effet de les inactiver.
Les enzymes sont des molécules bien plus grandes que leurssubstrats.Leur taille varie de 62résiduspour lemonomèrede4-oxalocrotonate tautomérase[7]à plus de 2 000 résidus pour l'acide gras synthaseanimale[8].Seule une toute petite partie de l'enzyme — entre deux et quatre résidus le plus souvent — est directement impliquée dans la catalyse, ce qu'on appelle le site catalytique. Ce dernier est situé à proximité d'un ou plusieurs sites de liaison, au niveau desquels les substrats sont liés et orientés afin de permettre la catalyse de la réaction chimique. Le site catalytique et les sites de liaison forment lesite actifde l'enzyme. Le reste de la protéine sert à maintenir la configuration du site actif et à y générer les conditions optimales pour le déroulement de la réaction.
Dans certains cas, la catalyse ne fait intervenir aucun des résidus d'acides aminés de l'enzyme mais plutôt uncofacteurlié à cette enzyme. La structure des enzymes peut également contenir un site de liaison pour uneffecteur allostériquequi provoque unchangement conformationnelactivant ou inhibant l'activité enzymatique.
Mécanisme
[modifier|modifier le code]Liaison au substrat
[modifier|modifier le code]Les enzymes doivent tout d'abord se lier à leurssubstratsavant de pouvoircatalysertouteréaction chimique.Les enzymes sont plus ou moins spécifiques en ce qui concerne à la fois les substrats auxquels elles peuvent se lier et les réactions qu'elles sont susceptibles de catalyser. Cette spécificité résulte de la configuration de leurs sites de liaison, qui sont des poches présentant une complémentarité de forme ainsi que de distribution spatiale des charges électriques et des propriétéshydrophile/hydrophobepar rapport à celles du substrat. Les enzymes peuvent ainsi faire la différence entre des molécules très semblables, ce qui assure leurchimiosélectivité,leurrégiosélectivitéet leurstéréospécificité[9].

Certaines des enzymes parmi les plus spécifiques interviennent dans laréplication de l'ADNet l'expression génétique.Certaines de ces enzymes sont pourvues d'un mécanisme de « correction d'épreuve »: c'est le cas desADN polymérases,qui sont capables de corriger leurs erreurs de réplication —paires de basesincorrectes — avant de passer aunucléotidesuivant[10].Ce processus en deux étapes permet d'atteindre une fidélité particulièrement élevée, avec moins d'une erreur sur 100 millions de réactions chez lesmammifères.Des mécanismes semblables existent également dans lesARN polymérases[11],lesaminoacyl-ARNt synthétases[12]et lesribosomes[13].A contrario,certaines enzymes présentent une ou plusieurs activités dites « depromiscuité», c'est-à-dire qu'elles peuvent catalyser un ensemble de réactions apparentées sur un ensemble de substrats ayant des implications physiologiques diverses. De nombreuses enzymes pos sắc dent des activités catalytiques mineures qui peuvent se manifester fortuitement et être le point de départ pour la sélection de nouvelles fonctionnalités au cours de l'évolution[14],[15].
Modèle de la serrure et de la clef (obsolète)
[modifier|modifier le code]Afin d'expliquer la spécificité des enzymes dans la sélection des réactions chimiques qu'elles sont susceptibles de catalyser, le chimiste allemandEmil Fischerproposa en 1894 que l'enzyme et le substrat d'une réaction pos sắc dent une géométrie complémentaire permettant au substrat de s'emboîter exactement dans l'enzyme[16].Cette représentation est souvent appelée « modèle de la serrure et de la clef ». Ce modèle rend compte de la spécificité des enzymes mais ne permet pas d'expliquer comment les enzymes parviennent à stabiliser l'état de transition au cours des réactions.
Ce modèle est aujourd'hui considéré comme obsolète[17],[18],car il simplifie beaucoup trop la réalité. En effet, il ne serait pas possible que les enzymes aient la même conformation lorsqu'elles sont liées à leur substrat que lorsqu'elles n'y sont pas liées.
Modèle de l'ajustement induit
[modifier|modifier le code]Le biochimiste américainDaniel Koshlandproposa en 1958 le modèle dit de l'ajustement induit (induced fiten anglais) comme adaptation du modèle de la serrure et de la clef pour tenir compte du fait que les enzymes sont des molécules flexibles: plutôt qu'imaginer l'emboîtement d'un substrat dans une enzyme rigide, Koshland considérait que l'interaction entre le substrat et l'enzyme remodelait en permanence le site actif, et ce tout au long de l'établissement de la liaison[19].
Dans certains cas, comme lesglycoside hydrolases,le substrat lui-même change légèrement de forme lorsqu'il se lie au site actif de l'enzyme[20].
Le site actif continue de changer de configuration jusqu'à ce que le substrat soit entièrement lié, et ce n'est qu'alors que la distribution des charges et la géométrie finale peuvent être déterminées.
Catalyse
[modifier|modifier le code]Les enzymes peuvent accélérer des réactions chimiques de plusieurs façons, mais toutes passent par l'abaissement de l'énergie d'activation,notéeEa:
- En stabilisant l'état de transition:
- l'enzyme génère un environnement dans lequel la distribution de charges est complémentaire de celles de l'état de transition afin de le stabiliser, donc d'abaisser sonenthalpie libre[21],notéeG;
- En ouvrant un chemin réactionnel alternatif:
- l'enzyme peut réagir temporairement avec le substrat et former un intermédiaire covalent ayant un état de transition de plus basse énergie,
- l'enzyme peut permettre l'utilisation d'un autre chemin réactionnel, comportant la formation de plus d'états de transitions, mais avec des énergies d'activation plus basses;
- En déstabilisant l'état fondamental du substrat:
- par déformation du substrat lié dans leur état de transition afin de réduire l'énergie nécessaire pour atteindre cet état[22],
- par une orientation du substrat dans une configuration qui réduit la variation d'entropie de la réaction; la contribution de ce mécanisme à la catalyse est assez faible[23].
Une enzyme peut recourir à plusieurs de ces mécanismes simultanément. Ainsi, lespeptidasestelles que latrypsinemettent en œuvre une catalyse covalente partriade catalytique,stabilisent la distribution des charges électriques de l'état de transition à l'aide d'untrou oxyanion,et terminent l'hydrolyseen orientant spécifiquement unemolécule d'eau.
Dynamique
[modifier|modifier le code]Les enzymes ne sont pas des structures rigides et statiques. Elles sont au contraire le siège de tout un ensemble de mouvements internes, qu'il s'agisse du mouvement de résidus d'acides aminés individuels, d'un groupe de résidus formant un élément de la structure secondaire, voire d'un domaine entier de la protéine. Ces mouvements donnent naissance à un ensemble de structures légèrement différentes les unes des autres qui sont à l'équilibre en perpétuelle interconversion les unes avec les autres. Différents états conformationnels de l'enzyme peuvent par exemple être associés à différentes phases de son activité chimique. Ainsi, différentes conformations de ladihydrofolate réductasesont associées au cours ducycle catalytiquerespectivement à la liaison avec le substrat, à la catalyse, à la libération du cofacteur, et enfin à la libération du produit[24].
Régulation allostérique
[modifier|modifier le code]Les sites de régulation allostérique sont des sites de liaison distincts du site actif qui peuvent interagir avec des molécules de l'environnement cellulaire, appelées dans ce cas effecteurs allostériques. La liaison de ces molécules avec ce site induit unchangement conformationnelou une modification de la dynamique interne de l'enzyme, qui altèrent les propriétés du site actif et modifient par conséquent la vitesse de réaction de l'enzyme[25].Ces changements peuvent activer ou inhiber des enzymes. Les interactions allostériques avec desmétabolitesen amont ou en aval d'unevoie métaboliqueà laquelle participe l'enzyme provoquent des boucles de rétrorégulation permettant de moduler l'activité de l'enzyme en fonction de l'intensité du flux de métabolites[26].
Cofacteurs
[modifier|modifier le code]Définitions
[modifier|modifier le code]
Certaines enzymes n'ont besoin d'aucun composant supplémentaire pour être pleinement actives. D'autres ont au contraire besoin d'interagir avec desespèces chimiquesnonprotéiques,appeléescofacteurs,pour être actives. Ces cofacteurs peuvent être inorganiques tels que desionsmétalliquesouclusterfer-soufre,ou bien descomposés organiquestels qu'uneflavineou unhème.Les cofacteurs organiques peuvent être descoenzymes,qui sont libérées dusite actifde l'enzyme au cours de la réaction, ou desgroupes prosthétiques,qui demeurent étroitement liés à l'enzyme. Certains groupes prosthétiques organiques sont liés à leur enzyme parcovalence,comme c'est le cas de labiotinepour des enzymes telles que lapyruvate carboxylase[28].
L'anhydrase carboniqueest un exemple d'enzyme à cofacteur dezinclié à son site actif[29].Ces ions ou molécules étroitement liées à l'enzyme se trouvent généralement dans le site actif et interviennent dans lacatalyse.Ainsi, on trouve fréquemment une flavine ou un hème dans lesréactions d'oxydoréduction
Les enzymes dépourvues du cofacteur qui les rend actives sont appeléesapoenzymes,ouapoprotéines.Une enzyme liée à son ou ses cofacteurs est appeléeholoenzyme.On appelle également holoenzymes les complexes enzymatiques formés de plusieurssous-unitéspour lesquels toutes les sous-unités requises pour l'activité enzymatique sont présentes; on emploie souvent ce terme pour lesADN polymérases.
Coenzymes
[modifier|modifier le code]Les coenzymes sont depetites moléculesorganiquesqui peuvent être liées à l'enzyme de façon assez lâche ou, au contraire, très étroite. Elles transportent desgroupes fonctionnelsou desrésidusd'une enzyme à une autre. LeNAD+,leNADPHet l'ATPsont des coenzymes. Certaines coenzymes telles que lariboflavine,lathiamineet l'acide foliquesont desvitamines,c'est-à-dire des composés qui ne peuvent être synthétisés par l'organisme et doivent être absorbés tels quels par l'alimentation. Parmi les groupes chimiques transportés par des coenzymes, on trouve l'ion hydrureH−transporté par le NADH et le NADPH, le groupephosphate–OPO32−transporté par l'ATP, le groupeacétyle–COCH3transporté par lacoenzyme A,les groupesaldéhyde–CHO, méthényle –CH= ouméthyle–CH3portés par l'acide folique, ou encore le groupe méthyle porté par laS-adénosylméthionine(SAM).
Dans la mesure où les coenzymes sont modifiées au cours des réactions chimiques catalysées par les enzymes, il peut être utile de les considérer comme des substrats particuliers partagés par de nombreux types d'enzymes. Ainsi, on connaît plus de 1 000 enzymes utilisant le NAD+comme coenzyme.
Les coenzymes sont régénérées continuellement et leur concentration est maintenue à un niveau constant dans la cellule. Par exemple, le NADPH est régénéré par lavoie des pentoses phosphateset laS-adénosylméthionineest régénérée par laméthionine adénosyltransférase.Cette régénération permanente signifie que de petites quantités de coenzymes peuvent être utilisées très intensivement. Par exemple, lecorps humainutilise et régénère son propre poids en ATP chaque jour[30].
Thermodynamique
[modifier|modifier le code]
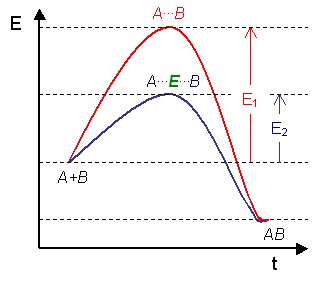
En l'absence de catalyseur(pointillés), les substrats ont besoin d'uneénergie d'activationélevée pour atteindre l'état de transition, qui évolue ensuite vers des produits de plus faible énergie.
En présence d'une enzyme(ligne pleine), les substrats se lient à l'enzyme (ES), qui stabilise l'état de transition (ES‡) en réduisant la quantité d'énergie nécessaire pour le former, et le complexe enzyme-produits (EP) est dissocié.
Comme c'est le cas pour tous lescatalyseurs,les enzymes ne modifient pas la position de l'équilibre chimiqued'une réaction. La présence d'une enzyme a simplement pour conséquence d'accélérer la réaction, qui se déroule dans le même sens. Ainsi, l'anhydrase carbonique,qui catalyse une réaction réversible, agit dans l'un et l'autre sens en fonction de la concentration relative de ses réactifs:
- CO2+H2O→H2CO3dans lestissus,où la concentration du CO2est élevée;
- H2CO3→CO2+H2Odans lespoumons,où la concentration du CO2est faible.
La vitesse de réaction dépend de l'énergie d'activationnécessaire pour atteindre, à partir dessubstrats,l'état de transition, qui évolue ensuite vers la formation des produits de réaction. Les enzymes accélèrent la vitesse de réaction en abaissant l'énergie d'activation de l'état de transition. Elles commencent par établir une liaison enzyme-substrat (ES) de faible énergie, stabilisent par la suite l'état de transition (ES‡) de sorte qu'il requiert moins d'énergie pour se former, et font évoluer cet état de transition vers un complexe enzyme-produit (EP) qui se dissocie spontanément.
De plus, les enzymes peuvent coupler deux ou plusieurs réactions afin de permettre à une réaction thermodynamiquement défavorisée de se produire à l'aide d'une réaction thermodynamiquement favorisée de telle sorte que l'énergie combinée des produits de deux réactions soit inférieur à l'énergie combinée de leurs substrats. C'est très souvent le cas de l'hydrolysede l'ATP,qui est généralement couplée à d'autres réactions chimiques, notamment ducatabolisme(biosynthèses).
Cinétique enzymatique
[modifier|modifier le code]Lacinétique enzymatiqueétudie la façon dont les enzymes se lient à leurssubstratset les convertissent en produits de réaction. Les données quantitifant lacinétiqued'une enzyme sont généralement obtenues à partir dedosages enzymatiques(en).En 1913, l'AllemandLeonor Michaeliset la CanadienneMaud Mentenpropo sắc rent une théorie quantitative de la cinétique enzymatique, appelée depuiséquation de Michaelis-Menten[31].Leur principale contribution a été de concevoir les réactions enzymatiques en deux étapes. Tout d'abord, les substrats se lient réversiblement à l'enzyme, formant un complexe enzyme-substrat. Puis l'enzyme catalyse la réaction chimique et libère les produits de réaction. Ces travaux ont ensuite été poursuivis par les BritanniquesGeorge Edward BriggsetJohn B. S. Haldane,qui en dérivèrent les équations cinétiques encore largement utilisées de nos jours[32].
La vitesse d'une enzyme dépend des conditions de la solution et de laconcentrationen substrats. Lavitesse maximumVmaxd'une réaction enzymatique peut être déterminée en augmentant la concentration [S] en substrats jusqu'à ce que la vitesse de formation des produits de réaction présente un plateau, comme représenté ci-contre. Cette saturation s'explique par le fait que plus la concentration en substrats augmente, plus ce substrat se lie aux enzymes, de sorte que la concentration en complexes enzyme-substrats augmente et la concentration en enzyme libre diminue; la vitesse maximum de réaction correspond à la situation où toutes les enzymes sont liées à leurs substrats de sorte qu'il ne reste plus d'enzyme libre ayant des sites de liaison à occuper.
Outre la vitesse maximumVmaxd'une enzyme, la quantité de substrat nécessaire pour atteindre une vitesse de réaction donnée est une autre grandeur importante caractérisant l'activité d'une enzyme. Cette quantité est mesurée par laconstante de MichaelisKM,qui représente la concentration de substrat nécessaire pour que l'enzyme atteigne la moitié deVmax.Chaque enzyme pos sắc de généralement uneKmdonnée pour chacun de ses substrats. La vitessevde réaction à concentration [S] de substrat, correspondant à l'augmentation de la concentration [P] en produit, est alors donnée par l'équation:
- .
Laconstante catalytique,notéekcat,également appeléeturnover number(TON), représente le nombre de molécules de substrat converties en produits par site actif et par seconde. Elle est liée à la vitesse maximumVmaxet à la concentration [E] de l'enzyme par l'équationVmax=kcat[E].
L'activité enzymatique est mesurée enkatals,unité SIdéfinie par1kat= 1mols−1,ou, plus fréquemment, enunités enzymatiques,définies par1 U =1µmol·min-1:ces grandeurs représentent la quantité d'enzyme nécessaire pour traiter une quantité unitaire desubstratpar unité de temps, dans des conditions opératoires qui doivent être précisées avec la mesure. On peut en déduire l'activité spécifique de l'enzyme, qui représente son activité par unité de masse, exprimée par exemple en U·mg-1.
L'efficacité d'une enzyme peut être exprimée en termes dekcat/KM,qui représente la constante de spécificité. Dans la mesure où elle reflète à la fois l'affinité pour les substrats et l'efficacité de la catalyse, elle est utile pour comparer des enzymes entre elles ou pour comparer la même enzyme par rapport à différents substrats.
- Le maximum de la constante de spécificité est appelée limite de diffusion et se situe aux alentours de 108à 109M−1s−1.À cette valeur, chaque contact entre l'enzyme et ses substrats conduit à une réaction chimique, et la vitesse de formation des produits de réaction n'est plus limitée par la vitesse de réaction mais par la vitesse de diffusion. Les enzymes qui présentent de telles propriétés sont appeléesenzymes parfaites.Ce sont par exemple latriose-phosphate isomérase,l'anhydrase carbonique,l'acétylcholinestérase,lacatalase,lafumarase,lesβ-lactamases,ou encore lessuperoxyde dismutases.Leturnoverde telles enzymes peut atteindre plusieurs millions de réactions par seconde et par site actif.
- Mais la plupart des enzymes ont des performances moindres. Une enzyme« moyenne »a unde l'ordre de 105M−1s−1et≈ 10s−1[33].
La cinétique de Michaelis-Menten repose sur laloi d'action de masse,qui dérive de l'hypothèse que ladiffusion de la matièreest libre et que les collisions entre particules sont aléatoires et décrites par lathermodynamique.Cependant, de nombreux processus biochimiques ou cellulaires s'écartent significativement de ces conditions en raison de la concentration très élevée des espèces chimiques dans lecytosolqui restreignent leur liberté de mouvement[34].La cinétique de Michaelis-Menten a fait l'objet d'extensions récentes qui tentent de tenir compte de ces effets[35].
Inhibition enzymatique
[modifier|modifier le code]Uninhibiteur enzymatiqueest unepetite moléculequi réduit la vitesse de réaction d'une enzyme.
Types d'inhibition enzymatique
[modifier|modifier le code]On range habituellement les types d'inhibition enzymatique dans les catégories suivantes.
Inhibition compétitive
[modifier|modifier le code]

Uninhibiteur compétitifpeut se lier à l'enzyme en empêchant ses substrats de le faire[36].Il s'agit souvent d'une molécule qui ressemble à l'un des substrats et prend sa place sur l'un des sites de liaison mais sans que l'enzyme puisse catalyser la réaction chimique avec cet inhibiteur. Ainsi, leméthotrexate,unanticancéreux,est un inhibiteur compétitif de ladihydrofolate réductase,qui catalyse la réduction dudihydrofolateentétrahydrofolate.Ce type d'inhibition peut être contourné par une concentration élevée en substrat. Il peut également s'agir d'une molécule qui se lie sur un autre site de l'enzyme et induit deschangements conformationnelsqui modifient les propriétés du site de liaison au substrat pareffet allostérique.En conséquence, l'affinité de l'enzyme pour ses substrats diminue et saconstante de MichaelisKMaugmente, tandis que savitesse maximumVmaxdemeure inchangée.

Inhibition non compétitive
[modifier|modifier le code]
Uninhibiteur non compétitifse lie à l'enzyme sur un site indépendant des sites de liaison aux substrats. Ceux-ci se lient donc à l'enzyme avec une affinité inchangée, de sorte que laconstante de MichaelisKMdemeure inchangée. Cependant, l'inhibiteur réduit l'efficacité de l'enzyme, c'est-à-dire saconstante catalytiquekcat,et, par conséquent, savitesse maximumVmax.Contrairement à l'inhibition compétitive, l'inhibition non compétitive n'est pas réduite par l'augmentation de la concentration du substrat.
Inhibition incompétitive
[modifier|modifier le code]Uninhibiteur incompétitifne peut se lier qu'au complexe enzyme-substrat et non à l'enzyme seule. Ce type d'inhibiteurs est par conséquent d'autant plus efficace que la concentration en substrats est élevée. Le complexe enzyme-substrat-inhibiteur est inactif et ne peut catalyser la conversion des substrats en produits. Ce type d'inhibition demeure rare[37].
Inhibition mixte
[modifier|modifier le code]Uninhibiteur mixtese lie à un siteallostériquedistinct du site de liaison des substrats sur l'enzyme, et ces deux liaisons interagissent l'une sur l'autre. La fonctionnalité de l'enzyme est réduite mais pas supprimée lorsqu'elle est liée à l'inhibiteur. Ce type d'inhibiteur ne suit pas l'équation de Michaelis-Menten.
Inhibition irréversible
[modifier|modifier le code]Un inhibiteur irréversible, également appelé inhibiteur suicide, se lie à l'enzyme pour l'inhiber de façon permanente, généralement à travers uneliaison covalente.Lapénicilline[38]et l'aspirine[39]agissent de cette façon respectivement sur lestranspeptidaseset lescyclooxygénases.
Rôle biochimique
[modifier|modifier le code]Chez de nombreux êtres vivants, lesinhibiteurs enzymatiquesinterviennent dans le cadre d'un mécanisme général derétroactionmétabolique.Lorsqu'une molécule est produite en excès, elle peut agir comme inhibiteur de l'enzyme qui engage lavoie métaboliqueproduisant cette molécule, ce qui a pour effet d'en réduire la production et d'en maintenir la concentration physiologique à un niveau convenable. Il s'agit d'une forme de rétraction négative. Des voies métaboliques majeures telles que lecycle de Krebsutilisent des mécanismes de ce type.
Dans la mesure où les inhibiteurs modulent l'activité de certaines enzymes, ils sont fréquemment employés commemédicaments.De nombreux médicaments sont des inhibiteurs compétitifs réversibles qui ressemblent au substrat naturel de ces enzymes. Outre leméthotrexateprésenté plus haut, de tels inhibiteurs compétitifs sont par exemple lesstatinesutilisée pour traiter l'hypercholestérolémie[40]en inhibant l'HMG-CoA réductaseet lesinhibiteurs de protéaseutilisés pour traiter les infections àrétrovirustels que leVIH[41].Un exemple classique d'inhibition irréversible est celui de l'aspirine,qui inhibe lescyclooxygénasesCOX-1etCOX-2produisant lesmessagersde l'inflammationque sont lesprostaglandines[39].
D'autres inhibiteurs enzymatiques sont despoisons.C'est par exemple le cas ducyanureCN−,qui se lie aucuivreet auferdusite actifde lacytochromecoxydase[42]et bloque larespiration cellulaire.
Fonctions biologiques
[modifier|modifier le code]Les enzymes remplissent un grand nombre de fonctions au sein des êtres vivants. Elles sont indispensables aux mécanismes detransduction de signalet de régulation des processus cellulaires, souvent à travers l'activité dekinaseset dephosphatases[43].Elles interviennent également dans la génération de mouvements, comme lamyosinequihydrolysel'ATPlors de lacontraction musculaireet permet le transport de molécules à travers lacelluleen agissant sur lecytosquelette[44].Lespompes à ionsdesmembranes cellulairessont d'autresATPasesqui interviennent dans letransport actiftransmembranaire. Des enzymes interviennent également dans des processus plus exotiques tels que labioluminescenceproduite par exemple par laluciférasechez leslucioles,ou encore par certainesbactéries[45].Lesviruscontiennent quant à eux des enzymes leur permettant d'infecter des cellules, comme l'intégraseet latranscriptase inverseduVIH,ou de sortir des cellules infectées comme laneuraminidaseduvirusde lagrippe[46].
Digestion
[modifier|modifier le code]Les enzymes jouent un rôle important dans l'appareil digestif humain,où des enzymes telles que lesamylaseset lespeptidasesinterviennent endégradantdesbiopolymèrescomme l'amidonet lesprotéinesenpetites moléculessusceptibles d'être absorbées au niveau desintestins— respectivement enmaltose(puis englucose) et enacidesα-aminésdans notre exemple. Lesmacromoléculesbiologiques sont en effet trop grosses pour être absorbées directement, et ce sont leursmonomèresqui sont absorbés. Ladigestionrecouvre précisément ce processus declivagedes macromolécules en petites molécules. Des enzymes différentes sont nécessaires pour digérer des substances différentes. Chez lesruminants,qui sontherbivores,desmicroorganismesde l'intestin produisent une enzyme particulière, lacellulase,capable de cliver lacellulosede laparoi cellulairedes cellules végétales[47].
Métabolisme
[modifier|modifier le code]
Plusieurs enzymes peuvent travailler ensemble dans un ordre défini pour former desvoies métaboliques:dans une telle configuration, un produit d'une enzyme devient unsubstratde l'enzyme suivante. Il est possible que plusieurs enzymes catalysent parallèlement la même réaction; ceci permet des modes de régulation plus complexes avec, par exemple, une faible constante d'activité pour une enzyme mais une seconde enzyme pouvant atteindre un niveau d'activité élevé lorsqu'elle est activée[48].
Les enzymes déterminent les étapes des voies métaboliques. En l'absence d'enzymes, le métabolisme n'emprunterait pas les mêmes chemins et ne pourrait pas être régulé afin d'être en cohérence avec les besoins de la cellule. La plupart des voies métaboliques principales du métabolisme sont régulées au niveau de quelques étapes clés, généralement au niveau d'enzymes qui requièrent l'hydrolysede l'ATP.Cette réaction étant fortementexothermique(c'est-à-dire qu'elle s'accompagne d'unevariation d'enthalpie libreélevée), elle peut être couplée à uneréaction endothermique(c'est-à-dire s'accompagnant d'une variation d'enthalpie libre négative) afin de la rendre thermodynamiquement favorable.
Contrôle de l'activité enzymatique
[modifier|modifier le code]Il existe essentiellement cinq moyens de contrôler l'activité des enzymes dans les cellules.
Régulation
[modifier|modifier le code]Les enzymes peuvent être activées ou inhibées par d'autres molécules. Le ou les produits finaux d'unevoie métaboliquesont souvent desinhibiteursde l'une des premières enzymes de cette voie, généralement la première enzyme qui catalyse une étape irréversible, ce qui régule la quantité de produit final; il s'agit d'un mécanisme de rétroaction, dans la mesure où la quantité de produit final est régulée par la propre concentration de ce produit. La rétroaction permet d'ajuster efficacement le niveau debiosynthèsed'un ensemble demétabolitesintermédiaires en fonction des besoins de la cellule, en évitant de produire un excès de molécules qui serait perdu et réduirait l'efficacité globale du métabolisme cellulaire.
Modification post-traductionnelle
[modifier|modifier le code]Laphosphorylation,lamyristoylationet laglycosylationsont des exemples demodifications post-traductionnelles.Ainsi, la phosphorylation, induite par l'insuline,de nombreuses enzymes, dont laglycogène synthase,permet de contrôler l'anabolismeet lecatabolismeduglycogèneet permet à la cellule de s'adapter aux variations de laglycémie[49].
Le clivage d'unechaîne polypeptidiqueest un autre exemple de modification post-traductionnelle. Lachymotrypsine,unepeptidasedigestive, est produite dans lepancréassous une forme inactive appeléechymotrypsinogèneet transportée sous cette forme jusque dans l'estomac,où elle est activée. Ceci permet d'éviter que la chymotrypsine active ne digère d'autrestissusavant de parvenir dans l'estomac. Ce type de précurseur inactif d'une enzyme est unzymogène.
Quantité
[modifier|modifier le code]Laproduction des enzymespeut être accrue ou réduite par la cellule en réponse à des modifications dans son environnement. Cette forme de régulation de l'expression génétiqueest appelée induction enzymatique. C'est par exemple le cas desbactériesqui deviennentrésistantesà desantibiotiques,par exemple à lapénicillinepar induction d'enzymes appeléesβ-lactamases,lesquelleshydrolysentle noyauβ-lactame[50]qui est précisément lepharmacophorede ce type d'antibiotiques. Lescytochrome P450 oxydasessont un autre exemple d'induction enzymatique. Ces enzymes jouent un rôle important dans lamétabolisationde nombreuxmédicaments,et leur induction ou leur inhibition peuvent conduire à desinteractions médicamenteuses.
La quantité d'enzymes présente dans une cellule peut également être modulée par leurdégradation.
Distribution subcellulaire
[modifier|modifier le code]La distribution intracellulaire des enzymes peut être compartimentée, différentesvoies métaboliquesse déroulant dans différentscompartiments cellulaires.Ainsi, lesacides grassontproduitspar un ensemble d'enzymes distribuées dans lecytosol,leréticulum endoplasmiqueet l'appareil de Golgi,et sontdégradéspour en libérer l'énergie chimique parβ-oxydationsous l'effet d'un autre ensemble d'enzymes situées dans lesmitochondries[51].De plus, les différents compartiments d'une cellule connaissent des niveaux de protonation différents (par exemple, leslysosomessontacidesquand lecytoplasmeest neutre) ou des niveaux d'oxydationdifférents (par exemple, lepériplasmeest plusoxydantque lecytoplasme), ce qui module également le niveau d'activité des enzymes qui s'y trouvent.
Spécialisation par organes
[modifier|modifier le code]Chez lesorganismes multicellulaires,lescellulesde différentsorganesou de différentstissusprésentent différents modes d'expression génétiqueet produisent par conséquent différentes variantes, appelésisoenzymes,d'un même ensemble d'enzymes,catalysantdifférentes réactions métaboliques. Ceci offre un mécanisme de régulation dumétabolismeglobal de l'organisme. Ainsi, l'hexokinase,première enzyme de laglycolyse,pos sắc de une forme spécialisée, laglucokinase,exprimée dans lefoieet dans lepancréas,dont l'affinitépour leglucoseest plus faible mais qui est plus sensible aux variations deconcentrationde glucose[52].Ceci permet à cette enzyme de réguler la production d'insulineen fonction des variations de laglycémie[53].
Pathologies
[modifier|modifier le code]Dans la mesure où un contrôle très étroit de l'activité enzymatique est essentiel pour l'homéostasiede l'organisme, tout dysfonctionnement (mutation,surproduction, sousproduction ou absence) d'une seule enzyme critique peut provoquer unemaladie génétique.Le dysfonctionnement d'un seul type d'enzyme parmi les milliers ducorps humainpeut être mortel: c'est par exemple le cas d'une déficience enhexosaminidase,responsable de lamaladie de Tay-Sachs[54].
La forme la plus courante dephénylcétonurieest un autre exemple de maladie résultant d'une déficience enzymatique. De nombreusesmutationsn'affectant chaque fois qu'un seulrésidud'acide aminéde laphénylalanine hydroxylase,quicatalysela première étape de ladégradationde laphénylalanine,conduit à l'accumulation de cet acide aminé et de produits apparentés. Certaines de ces mutations affectent lesite actif,altérant directement la liaison dessubstratset la catalyse, mais de nombreuses autres mutations touchent des résidus éloignés du site actif et réduisent l'activité enzymatique par altération durepliementde l'enzyme (structure tertiaire) ou affectant sonoligomérisation(structure quaternaire)[55],[56].Ceci peut conduire auhandicap mentalsi la maladie n'est pas prise en charge. L'administration orale d'enzymes peut traiter certaines déficiences enzymatiques fonctionnelles telles que l'insuffisance pancréatique exocrine(en)[57]et l'intolérance au lactose[58].
Des maladies peuvent résulter d'autres types de dysfonctionnements enzymatiques lorsque ces derniers affectent les enzymes assurant laréparation de l'ADN,ce qui provoque des mutations dans lescellules germinales.De tels défauts enzymatiques sont davantage susceptibles de provoquer descancersparce que les cellules deviennent alors plus sensibles aux mutations affectant leurgénome.La lente accumulation de telles mutations peut alors conduire à l'apparition de cancers.Un exemple de tels syndromes cancéreux héréditaires est lexeroderma pigmentosum,qui conduit à l'apparition d'uncancer de la peauà la suite d'une exposition même minime à la lumièreultraviolette[59].
Utilisations industrielles
[modifier|modifier le code]Certaines enzymes sont utilisées dans l'industrie chimiqueet pour d'autres applications industrielles lorsque descatalyseurstrès spécifiques sont nécessaires. Les enzymes naturelles sont cependant assez limitées du point de vue des réactions qu'elles sont capables de catalyser, car il s'agit de réactions spécifiques aumétabolismedes êtres vivants, et non de l'industrie chimique en général; les enzymes sont également actives dans les conditionsphysico-chimiquesphysiologiques des organismes dont elles sont issus, conditions qui diffèrent souvent de celles mises en œuvre dans le cadre de procédés industriels. Par conséquent, legénie protéique(en)est un domaine de recherche actif qui vise à développer de nouvelles enzymes dotées de propriétés innovantes, que ce soit par conception rationnelle ou par évolutionin vitro[60],[61].Depuis le début du siècle, des enzymes ont ainsi pu être conçues de manière entièrement artificielle afin de catalyser des réactions chimiques qui ne se produisent pas naturellement[62].Bien que les procédés industriels catalysés par des enzymes soient très efficaces, certaines enzymes dépendent de cofacteurs nicotinamides (NADH/NAD+, NADP/NAPH). En raison du prix élevé de ces cofacteurs, ces procédés ne seraient pas économiquement compétitifs. Dans un passé récent, certains composés synthétiques ont été identifiés comme des homologues biomimétiques très prometteurs des cofacteurs naturels[63].
Le tableau ci-dessous résume quelques applications industrielles de certaines enzymes courantes.
Histoire et nomenclature
[modifier|modifier le code]Découverte de la diastase
[modifier|modifier le code]
La première enzyme, ladiastase,a été isolée en 1833 parAnselme PayenetJean-François Persoz[78].Après avoir traité un extrait aqueux demaltà l'éthanol,ils précipitèrent une substance sensible à la chaleur et capable d'hydrolyser l'amidon,d'où son nom dediastaseforgé à partir dugrec ancienδιάστασις/diástasisdésignant l'action de cliver. Il s'agissait en réalité d'uneamylase.
Le biologiste et chimisteÉmile Duclaux(1840-1904) préconisa à la fin duXIXesiècle de nommer les substances actives semblables à la diastase à l'aide du suffixe-aseen référence à cette dernière[79].
Notions defermentset dezymases
[modifier|modifier le code]

Quelques décennies plus tard, alors qu'il étudiait lafermentation alcooliquedu sucre par unelevure,Louis Pasteurconclut qu'un principe actif — qu'il appelaferment— contenu dans la levure était responsable de cette fermentation. Il considérait que cette substance n'était active qu'au sein d'une cellule vivante. Pasteur écrivit[80],[81]:
« la fermentation alcoolique est un acte en corrélation avec la vie et l'organisation des cellules de levure, et non avec la mort ou la putréfaction; que ce n'est pas non plus un phénomène de contact, cas dans lequel la transformation du sucre s'accomplirait sans rien lui abandonner ni rien lui prendre. »
En 1877, le physiologiste allemandWilhelm Kühne(1837–1900) introduisit le termeenzymeen référence à ce processus, dugrec ancienἔνζυμον/énzumonforgé à partir de la prépositionἐν/en,« dans » et deζύμη/zúmê,«levain». Le motenzymedésigna par la suite les substances actives non vivantes telles que lapepsine,tandis que le motfermentétait utilisé en référence à l'activité chimique produite par des êtres vivants.
En 1883, le biologiste et chimiste françaisAntoine BéchamppubliaLes microzymas,ouvrage dans lequel il théorisait son concept de «microzymes(en)» comme constituants ultimes de toute matière vivante; il y employait à cette occasion le termezymase.
Le chimiste allemandEduard Buchnerpublia son premier article sur l'étude des extraits de levure en 1897. Au cours d'une série d'expériences à l'université Humboldt de Berlin,il découvrit que le sucre pouvait être fermenté par des extraits de levure même en l'absence de toute cellule de levure dans le mélange, et reçut en 1907 leprix Nobel de chimiepour sa découverte de la fermentation sans cellule vivante[82].Il appelazymasel'enzyme responsable de la fermentation, reprenant la construction du nom des enzymes en se référant au processus qu'elles catalysent auquel est adjoint le suffixe-ase,suivant en cela les recommandations d'Émile Duclaux quelques années plus tôt.
Caractérisation biochimique
[modifier|modifier le code]La nature biochimique des enzymes demeurait cependant encore inconnue au début duXXesiècle. De nombreux scientifiques avaient observé que l'activité enzymatique était associée auxprotéines,tandis que d'autres (dontRichard Willstätter,prix Nobel de chimie 1915 pour ses travaux sur lachlorophylle) considéraient que les protéines étaient de simples véhicules de l'activité enzymatique, étant par elles-mêmes incapables de catalyser des réactions chimiques[83],[84].En 1926,James B. Sumnermontra que l'uréaseétait une enzyme de nature purement protéique et lacristallisa;il fit de même en 1937 avec lacatalase.John Howard NorthropetWendell Meredith Stanleyachevèrent d'établir la nature protéique des enzymes en travaillant sur lapepsine(1930), latrypsineet lachymotrypsine.Ces trois chercheurs partagèrent le prix Nobel de chimie de 1946[85].
Le fait que des enzymes puissent être cristallisées permit d'établir leur structure tridimensionnelle parcristallographie aux rayons X.Ceci fut réalisé pour la première fois avec lelysozyme,une enzyme présente dans leslarmes,lasaliveet leblanc d'œufquidigèrel'enveloppe de certainesbactéries:sa structure fut résolue par une équipe dirigée parDavid Chilton Phillipset publiée en 1965[86].L'établissement à haute résolution de la structure du lysozyme marqua les débuts de labiologie structuraleet de l'étude du fonctionnement des enzymes à l'échelle atomique[87].
Dénomination et classement
[modifier|modifier le code]Le comité desnomenclaturesde l'Union internationale de biochimie et de biologie moléculaire(NC-IUBMB) a développé lanomenclature EC(pourEnzyme Commission), fondée sur le type deréactions chimiquescatalysées[88].Cette nomenclature est constituée de quatre nombres séparés par des points, associés à une dénomination systématique unique; par exemple, l'α-amylasea pour numéroECet pour dénomination systématique 4-α-D-glucane glucanohydrolase. La dénomination systématique est rarement employée: on lui préfère généralement des appellations d'usage, une enzyme pouvant avoir plusieurs appellations, certaines étant parfois ambiguës.
Les enzymes sont classées en six principaux groupes, en fonction du type de réaction qu'elles catalysent:
| Groupe | Code | Type de réaction |
|---|---|---|
| Oxydoréductases | EC 1 | Réaction d'oxydoréduction |
| Transférases | EC 2 | Transfert degroupes fonctionnelsd'unsubstratà un autre |
| Hydrolases | EC 3 | Hydrolyses |
| Lyases | EC 4 | Rupture de différentes liaisons chimiques par des moyens autres que l'hydrolyse ou l'oxydation |
| Isomérases | EC 5 | Isomérisations |
| Ligasesou synthétases | EC 6 | Formations de liaisons covalentes couplées à l'hydrolyse d'unnucléosidetriphosphate (généralement l'ATP) |
Unnuméro ECfait référence à uneréaction chimiquedonnée, mais pas à unemoléculedonnée: un mêmenuméro ECpeut ainsi correspondre à plusieursisoenzymes,c'est-à-dire à plusieursprotéinescatalysantla même réaction chimique mais ayant desséquences peptidiquesdifférentes — c'est par exemple le cas de toutes lesADN polymérases,qui partagent toutes le numéroEC— tandis qu'une même enzyme peut avoir plusieursnuméros EClorsque la protéine qui la constitue porte plusieurssites actifscatalysant des réactions chimiques différentes — on parle par exemple d'enzyme bifonctionnelle lorsqu'une même protéine catalyse deux réactions chimiques, comme l'uridine monophosphate synthétase(UMPS) qui porte unesous-unitéorotate phosphoribosyltransférase(EC)et une sous-unitéorotidine-5'-phosphate décarboxylase(EC).
Le nom des enzymes fait le plus souvent référence à un ou plusieurs de sessubstrats,parfois au type de réaction chimique catalysée, et très souvent avec le suffixe-ase,parfois avec le suffixe-ine.
Lalactase,l'alcool déshydrogénase,l'ADN polymérase,latriose-phosphate isomérase,lapapaïne,lapepsineet latrypsinesont des exemples de noms d'enzymes.
Laglucose oxydaseest ainsi une enzyme catalysant l'oxydationduglucose,tandis que l'amidon synthasecatalyse labiosynthèsede l'amidon.Plusieurs enzymes qui catalysent la même réaction chimique sont appeléesisoenzymes.
Concernant lespeptidases,il existe un classement complémentaire mis au point par leCentre Sanger,fondé sur leséquençage des protéines.Il regroupe par familles les enzymes faisant apparaitre des séquencesacido-aminéssimilaires. La première lettre de la classification correspond au type de peptidase: A pour lesprotéases aspartiques,S pour lesprotéases à cystéine,etc.[89].
Le mot « enzyme »: masculin ou féminin?
[modifier|modifier le code]Les noms d'enzymes sont presque tous du genre féminin; lelysozymeet lesribozymesfont exception, bien que le suffixe-zymeprovienne dugrec ancienζύμη/zúmê,«levain», qui était du genre féminin.
Le motenzymeétait originellement (en1897) lui-même employé au féminin, par exemple dans le Bulletin de la société chimique ou celui de l'Académie des sciences, etc.)[90].Selon le Larousse, il est féminin ou, parfois masculin[91],ainsi que ses composés (par exemplecoenzyme[92],de même pour letrésor de la langue française,mais l'usage fait qu'il est de plus en plus utilisé au masculin. Il l'aurait été par écrit pour la première fois en 1900 par un néerlandais écrivant en français, puis par les chimistes français Bourquelot et Herissey, puis de plus en plus souvent entre 1925 et 1940. En 1957 alors que déjà les articles scientifiques n'utilisent presque plus que le masculin, les académiciens duComité du langage scientifiquese penchent sur le sujet, décidant d'abord du féminin. Mais dans une pétition 257 signataires protestent contre ce choix, plaidant au contraire pour l'emploi du masculin[90].La pétition a fait remettre en cause la décision de l'Académie, qui en 1968 continuait encore à débattre des arguments grammaticaux et de la tendance populaire à utiliser le genre masculin. Selon l'archivisteetpaléographeEugène-Humbert Guitard(en 1968)« sous l'influence de l'anglais, des scientifiques de plus en plus nombreux font et feront d'enzyme un masculin »[90].
Terminologie
[modifier|modifier le code]- Enzyme de la transformation alimentaire:enzyme employé pour contrôler la texture, le goût, l’aspect ou la valeur nutritive des aliments. Les amylases dégradent les complexes polysaccharidiques en sucres plus simples; et les protéases « attendrissent » les protéines de la viande. Un objectif important de la biotechnologie alimentaire est le développement de nouvelles enzymes alimentaires améliorant la qualité de la transformation des aliments.
- Enzyme de restrictionouendonucléase de restriction:classe d’enzymes qui coupent l'ADN après avoir reconnu une séquence spécifique. Les trois types d’endonucléase de restriction sont:
- enzyme répressible:enzyme dont l’activité peut être réduite par la présence d’une molécule régulatrice;
- enzyme limitante:enzyme dont l’activité contrôle le rendement du produit final d’unevoie métaboliquemulti-enzymatique…;
- enzyme constitutive:enzyme dont la concentration dans la cellule est constante et n'est pas influencée par une concentration en substrat.
Notes et références
[modifier|modifier le code]- (en)Jacinta A. Lodge, Timm Maier, Wolfgang Liebl, Volker Hoffmann et Norbert Sträter,«Crystal Structure ofThermotoga maritimaα-Glucosidase AglA Defines a New Clan of NAD+-dependent Glycosidases»,Journal of Biological Chemistry,vol.278,no21,,p.19151-19158(PMID12588867,DOI10.1074/jbc.M211626200,lire en ligne)
- (en)Ida Schomburg, Antje Chang, Sandra Placzek, Carola Söhngen, Michael Rother, Maren Lang, Cornelia Munaretto, Susanne Ulas, Michael Stelzer, Andreas Grote, Maurice Scheer et Dietmar Schomburg,«BRENDA in 2013: integrated reactions, kinetic data, enzyme function data, improved disease classification: new options and contents in BRENDA»,Nucleic Acids Research,vol.41,noD1,,D764-D772(PMID23203881,DOI10.1093/nar/gks1049,lire en ligne)
- (en)A. Radzicka et R. Wolfenden,«A proficient enzyme»,Science,vol.267,no5194,,p.90-93(PMID7809611,DOI10.1126/science.7809611,lire en ligne)
- (en)Brian P. Callahan et Brian G. Miller,«OMP decarboxylase—An Enigma persists»,Bioorganic Chemistry,vol.35,no6,,p.465-469(PMID17889251,DOI10.1016/j.bioorg.2007.07.004,lire en ligne)
- (en)Christian B. Anfinsen,«Principles that govern the folding of protein chains»,Science,vol.181,no4096,,p.223-230(PMID4124164,DOI10.1126/science.181.4096.223,lire en ligne)
- (en)Debra Dunaway-Mariano,«Enzyme Function Discovery»,Structure,vol.16,no11,,p.1599-1600(PMID19000810,DOI10.1016/j.str.2008.10.001,lire en ligne)
- (en)L H Chen, G L Kenyon, F Curtin, S Harayama, M E Bembenek, G Hajipour et C P Whitman,«4-Oxalocrotonate tautomerase, an enzyme composed of 62 amino acid residues per monomer»,Journal of Biological Chemistry,vol.267,no25,,p.17716-17721(PMID1339435,lire en ligne)
- (en)S. Smith,«The animal fatty acid synthase: one gene, one polypeptide, seven enzymes»,The FASEB Journal,vol.8,no15,,p.1248-1259(PMID8001737,lire en ligne)
- (en)Karl-Erich Jaeger et Thorsten Eggert,«Enantioselective biocatalysis optimized by directed evolution»,Current Opinion in Biotechnology,vol.15,no4,,p.305-313(PMID15358000,DOI10.1016/j.copbio.2004.06.007,lire en ligne)
- (en)Igor V. Shevelev et Ulrich Hübscher,«The 3′–5′ exonucleases»,Nature Reviews Molecular Cell Biology,vol.3,no5,,p.364-376(PMID11988770,DOI10.1038/nrm804,lire en ligne)
- (en)Nikolay Zenkin, Yulia Yuzenkova et Konstantin Severinov1,«Transcript-Assisted Transcriptional Proofreading»,Science,vol.313,no5786,,p.518-520(PMID16873663,DOI10.1126/science.1127422,lire en ligne)
- (en)Michael Ibba et Dieter Söll,«Aminoacyl-tRNA synthesis»,Annual Reviews Biochemistry,vol.69,,p.617-650(PMID10966471,DOI10.1146/annurev.biochem.69.1.617,lire en ligne)
- (en)Marina V. Rodnina et Wolfgang Wintermeyer,«Fidelity of aminoacyl-tRNA selection on the ribosome: kinetic and structural mechanisms»,Annual Reviews Biochemistry,vol.70,,p.415-435(PMID11395413,DOI10.1146/annurev.biochem.70.1.415,lire en ligne)
- (en)Olga Khersonsky et Dan S. Tawfik,«Enzyme Promiscuity: A Mechanistic and Evolutionary Perspective»,Annual Reviews Biochemistry,vol.79,,p.471-505(PMID20235827,DOI10.1146/annurev-biochem-030409-143718,lire en ligne)
- (en)Patrick J O'Brien, Daniel Herschlag,«Catalytic promiscuity and the evolution of new enzymatic activities»,Chemistry & Biology,vol.6,no4,,R91-R105(PMID10099128,DOI10.1016/S1074-5521(99)80033-7,lire en ligne)
- (de)Emil Fischer,«Einfluss der Configuration auf die Wirkung der Enzyme»,Berichte der deutschen chemischen Gesellschaft,vol.27,no3,,p.2985-2993(DOI10.1002/cber.18940270364,lire en ligne)
- Valéry Ozenne. Caractérisation des protéines intrin sắc quement désordonnées par résonance magnétique nucléaire. Biologie structurale [q-bio.BM]. Université de Grenoble, 2012. Français.https://tel.archives-ouvertes.fr/tel-00870515- Consulté le 23/05/2019
- MarylineCoquidé,MichèleDell’Angelo,StanislasDoreyet CorinneFortin,«Espace et temps dans les sciences du vivant: nouvelles perspectives pour la recherche en didactique»,RDST. Recherches en didactique des sciences et des technologies,no4,,p.139–160(ISSN2110-6460,DOI10.4000/rdst.512,lire en ligne,consulté le)
- (en)Daniel E. Koshland,«Application of a Theory of Enzyme Specificity to Protein Synthesis»,Proceedings of the National Academy of Sciences of the United States of America,vol.44,no2,,p.98-104(PMID16590179,PMCID335371,lire en ligne)
- (en)Andrea Vasella,, Gideon J Davies et Matthias Böhm,«Glycosidase mechanisms»,Current Opinion in Chemical Biology,vol.6,no5,,p.619-629(DOI10.1016/S1367-5931(02)00380-0,lire en ligne)
- (en)Arieh Warshel, Pankaz K. Sharma, Mitsunori Kato, Yun Xiang, Hanbin Liu et Mats H. M. Olsson,«Electrostatic Basis for Enzyme Catalysis»,Chemical Reviews,vol.106,no8,,p.3210-3235(PMID16895325,DOI10.1021/cr0503106,lire en ligne)
- (en)Stephen J. Benkovic et Sharon Hammes-Schiffer,«A Perspective on Enzyme Catalysis»,Science,vol.301,no5637,,p.1196-1202(PMID12947189,DOI10.1126/science.1085515,lire en ligne)
- (en)J. Villà, M. Štrajbl, T. M. Glennon, Y. Y. Sham, Z. T. Chu et A. Warshel,«How important are entropic contributions to enzyme catalysis?»,Proceedings of the National Academy of Sciences of the United States of America,vol.97,no22,,p.11899-11904(PMID11050223,PMCID17266,DOI10.1073/pnas.97.22.11899,lire en ligne)
- (en)Arvind Ramanathan, Andrej Savol, Virginia Burger, Chakra S. Chennubhotla et Pratul K. Agarwal,«Protein Conformational Populations and Functionally Relevant Substates»,Accounts of Chemical Research,vol.47,no1,,p.149-156(PMID23988159,DOI10.1021/ar400084s,lire en ligne)
- (en)Chung-Jung Tsai, Antonio del Sol et Ruth Nussinov,«Protein allostery, signal transmission and dynamics: a classification scheme of allosteric mechanisms»,Molecular BioSystems,vol.5,no3,,p.207-216(PMID19225609,PMCID2898650,DOI10.1039/B819720B,lire en ligne)
- (en)Jean-Pierre Changeux et Stuart J. Edelstein,«Allosteric Mechanisms of Signal Transduction»,Science,vol.308,no5727,,p.1424-1428(PMID15933191,DOI10.1126/science.1108595,lire en ligne)
- (en)Stefan Lüdtke, Piotr Neumann, Karl M. Erixon, Finian Leeper, Ronald Kluger, Ralf Ficner et Kai Tittmann,«Sub-ångström-resolution crystallography reveals physical distortions that enhance reactivity of a covalent enzymatic intermediate»,Nature Chemistry,vol.5,no9,,p.762-767(PMID23965678,DOI10.1038/nchem.1728,lire en ligne)
- (en)Anne Chapman-Smith et John E. Cronan Jr,«The enzymatic biotinylation of proteins: a post-translational modification of exceptional specificity»,Trends in Biochemical Sciences,vol.24,no9,,p.359-363(PMID10470036,DOI10.1016/S0968-0004(99)01438-3,lire en ligne)
- (en)Zoë Fisher, Jose A. Hernandez Prada, Chingkuang Tu, David Duda, Craig Yoshioka, Haiqian An, Lakshmanan Govindasamy, David N. Silverman et Robert McKenna,«Structural and Kinetic Characterization of Active-Site Histidine as a Proton Shuttle in Catalysis by Human Carbonic Anhydrase II»,Biochemistry,vol.44,no4,,p.1097-1105(PMID15667203,DOI10.1021/bi0480279,lire en ligne)
- (en)Susanna Törnroth-Horsefield et Richard Neutze,«Opening and closing the metabolite gate»,Proceedings of the National Academy of Sciences of the United States of America,vol.105,no50,,p.19565-19566(PMID19073922,PMCID2604989,DOI10.1073/pnas.0810654106,lire en ligne)
- (en)Kenneth A. Johnson et Roger S. Goody,«The original Michaelis constant: translation of the 1913 Michaelis-Menten paper»,Biochemistry,vol.50,no39,,p.8264-8269(PMID21888353,PMCID3381512,DOI10.1021/bi201284u,lire en ligne).
- (en)George E. Briggs et John B. S. Haldane,«A Note on the Kinetics of Enzyme Action»,Biochemical Journal,vol.19,no2,,p.338-339(PMID16743508,PMCID1259181).
- ArrenBar-Even,EladNoor,YonatanSaviret WolframLiebermeister,«The Moderately Efficient Enzyme: Evolutionary and Physicochemical Trends Shaping Enzyme Parameters»,Biochemistry,vol.50,no21,,p.4402–4410(ISSN0006-2960,DOI10.1021/bi2002289,lire en ligne,consulté le).
- (en)R.John Ellis,«Macromolecular crowding: obvious but underappreciated»,Trends in Biochemical Sciences,vol.26,no10, octobre,p.2001(PMID11590012,DOI10.1016/S0968-0004(01)01938-7,lire en ligne).
- (en)Raoul Kopelman,«Fractal Reaction Kinetics»,Science,vol.241,no4873,,p.1620-1626(PMID17820893,DOI10.1126/science.241.4873.1620,lire en ligne).
- (en)Nicholas C. Price,«What is meant by ‘competitive inhibition’?»,Trends in Biochemical Sciences,vol.4,no11,,N272-N273(DOI10.1016/0968-0004(79)90205-6,lire en ligne)
- (en)Athel Cornish-Bowden,«Why is uncompetitive inhibition so rare?»,FEBS Letters,vol.203,no1,,p.3-6(PMID3720956,DOI10.1016/0014-5793(86)81424-7,lire en ligne)
- (en)J. F. Fisher, S. O. Meroueh et S. Mobashery,«Bacterial resistance to beta-lactam antibiotics: compelling opportunism, compelling opportunity»,Chemical Reviews,vol.105,no2,,p.395-424(PMID15700950,DOI10.1021/cr030102i,lire en ligne)
- (en)Douglas S Johnson, Eranthie Weerapana et Benjamin F Cravatt,«Strategies for discovering and derisking covalent, irreversible enzyme inhibitors»,Future Medicinal Chemistry,vol.2,no6,,p.949-964(PMID20640225,DOI10.4155/fmc.10.21,lire en ligne)
- (en)Akira Endo,«The discovery and development of HMG-CoA reductase inhibitors»,Journal of Lipid Research,vol.33,no11,,p.1569-1582(PMID1464741,lire en ligne)
- (en)Alexander Wlodawer et Jiri Vondrasek,«INHIBITORS OF HIV-1 PROTEASE: A Major Success of Structure-Assisted Drug Design1»,Annual Review of Biophysics and Biomolecular Structure,vol.27,,p.249-284(PMID9646869,DOI10.1146/annurev.biophys.27.1.249,lire en ligne)
- (en)S. Yoshikawa et W. S. Caughey,«Infrared evidence of cyanide binding to iron and copper sites in bovine heart cytochrome c oxidase. Implications regarding oxygen reduction»,Journal of Biological Chemistry,vol.265,no14,,p.7945-7958(PMID2159465,lire en ligne)
- (en)Tony Hunter,«Protein kinases and phosphatases: The Yin and Yang of protein phosphorylation and signaling»,Cell,vol.80,no2,,p.225-236(PMID7834742,DOI10.1016/0092-8674(95)90405-0,lire en ligne)
- (en)Jonathan S. Berg, Bradford C. Powell et Richard E. Cheney,«A Millennial Myosin Census»,Molecular Biology of the Cell,vol.12,no4,,p.780-794(PMID11294886,PMCID32266,DOI10.1091/mbc.12.4.780,lire en ligne)
- (en)E. A. Meighen,«Molecular biology of bacterial bioluminescence»,Microbiology and Molecular Biology Reviews,vol.55,no1,,p.123-142(PMID2030669,PMCID372803,lire en ligne)
- (en)E. de Clerq,«Highlights in the Development of New Antiviral Agents»,Mini Reviews in Medicinal Chemistry,vol.2,no2,,p.163-175(PMID12370077,DOI10.2174/1389557024605474)
- (en)Roderick I. Mackie et Bryan A. White,«Recent Advances in Rumen Microbial Ecology and Metabolism: Potential Impact on Nutrient Output»,Journal of Dairy Science,vol.73,no10,,p.2971-2995(PMID2178174,DOI10.3168/jds.S0022-0302(90)78986-2,lire en ligne)
- (en)Carol A. Rouzer et Lawrence J. Marnett,«Cyclooxygenases: structural and functional insights»,Journal of Lipid Research,vol.50,,S29-S34(PMID18952571,PMCID2674713,DOI10.1194/jlr.R800042-JLR200,lire en ligne)
- (en)Bradley W. Doble et James R. Woodgett,«GSK-3: tricks of the trade for a multi-tasking kinase»,Journal of Cell Science,vol.116,noPart 7,,p.1175-1186(PMID12615961,PMCID3006448,DOI10.1242/jcs.00384,lire en ligne)
- (en)Peter M. Bennett et Ian Chopra,«Molecular basis of beta-lactamase induction in bacteria»,Antimicrobial Agents and Chemotherapy,vol.37,no2,,p.153-158(PMID8452343,PMCID187630,DOI10.1128/AAC.37.2.153,lire en ligne)
- (en)Nils Joakim Færgeman et Jens Knudsen,«Role of long-chain fatty acyl-CoA esters in the regulation of metabolism and in cell signalling»,Biochemical Journal,vol.33,noPart 1,,p.1-12(PMID9173866,PMCID1218279)
- (en)Kenji Kamata, Morihiro Mitsuya, Teruyuki Nishimura, Jun-ichi Eiki et Yasufumi Nagata,«Structural Basis for Allosteric Regulation of the Monomeric Allosteric Enzyme Human Glucokinase»,Structure,vol.12,no3,,p.429-438(PMID15016359,DOI10.1016/j.str.2004.02.005,lire en ligne)
- (en)Philippe Froguel, Habib Zouali, Nathalie Vionnet, Gilberto Velho, Martine Vaxillaire, Fang Sun, Suzanne Lesage, Markus Stoffel, Jun Takeda, Philippe Passa, M. Alan Permutt, Jacques S. Beckmann, Graeme I. Bell et Daniel Cohen,«Familial Hyperglycemia Due to Mutations in Glucokinase — Definition of a Subtype of Diabetes Mellitus»,The New England Journal of Medicine,vol.328,no10,,p.697-702(PMID8433729,DOI10.1056/NEJM199303113281005,lire en ligne)
- (en)Shintaro Okada et John S. O'Brien,«Tay-Sachs Disease: Generalized Absence of a Beta-D-N-Acetylhexosaminidase Component»,Science,vol.165,no3894,,p.698-700(PMID5793973,DOI10.1126/science.165.3894.698,lire en ligne)
- (en)Heidi Erlandsen et Raymond C. Stevens,«The Structural Basis of Phenylketonuria»,Molecular Genetics and Metabolism,vol.68,no2,,p.103-125(PMID10527663,DOI10.1006/mgme.1999.2922,lire en ligne)
- (en)T. Flatmark et R. C. Stevens,«Structural Insight into the Aromatic Amino Acid Hydroxylases and Their Disease-Related Mutant Forms»,Chemical Reviews,vol.99,no8,,p.2137-2160(PMID11849022,DOI10.1021/cr980450y,lire en ligne)
- (en)Aaron Fieker, Jessica Philpott et Martine Armand,«Enzyme replacement therapy for pancreatic insufficiency: present and future»,Clinical and Experimental Gastroenterology,vol.4,,p.55-73(PMID21753892,DOI10.2147/CEG.S17634,lire en ligne)
- (en)Benjamin Misselwitz, Daniel Pohl, Heiko Frühauf, Michael Fried, Stephan R. Vavricka et Mark Fox,«Lactose malabsorption and intolerance: pathogenesis, diagnosis and treatment»,United European Gastroenterology Journal,vol.1,no3,,p.151-159(PMID24917953,PMCID4040760,DOI10.1177/2050640613484463,lire en ligne)
- (en)J. E. Cleaver,«Defective Repair Replication of DNA in Xeroderma Pigmentosum»,Nature,vol.218,no5142,,p.652-656(PMID5655953,DOI10.1038/218652a0,lire en ligne)
- (en)V. Renugopalakrishnan, R. Garduño-Juárez, G. Narasimhan, C. S. Verma, X. Wei et Pingzuo Li,«Rational Design of Thermally Stable Proteins: Relevance to Bionanotechnology»,Journal of Nanoscience and Nanotechnology,vol.5,no11,,p.1759-1767(PMID16433409,DOI10.1166/jnn.2005.441,lire en ligne)
- (en)Karl Hult et Per Berglund,«Engineered enzymes for improved organic synthesis»,Current Opinion in Biotechnology,vol.14,no4,,p.395-400(PMID12943848,DOI10.1016/S0958-1669(03)00095-8,lire en ligne)
- (en)Lin Jiang, Eric A. Althoff, Fernando R. Clemente, Lindsey Doyle, Daniela Röthlisberger, Alexandre Zanghellini, Jasmine L. Gallaher, Jamie L. Betker, Fujie Tanaka, Carlos F. Barbas III, Donald Hilvert, Kendall N. Houk, Barry L. Stoddard et David Baker,«De novo computational design of retro-aldol enzymes»,Science,vol.319,no5868,,p.1387-1391(PMID18323453,PMCID3431203,DOI10.1126/science.1152692,lire en ligne)
- (en)ClaudiaNowak,AndréPick,Lénárd‐IstvánCsepeiet VolkerSieber,«Characterization of Biomimetic Cofactors According to Stability, Redox Potentials, and Enzymatic Conversion by NADH Oxidase from Lactobacillus pentosus»,ChemBioChem,vol.18,no19,,p.1944–1949(ISSN1439-4227et1439-7633,DOI10.1002/cbic.201700258,lire en ligne,consulté le)
- (en)Sun Y, Cheng J,«Hydrolysis of lignocellulosic materials for ethanol production: a review»,Bioresource Technology,vol.83,no1,,p.1–11(PMID12058826,DOI10.1016/S0960-8524(01)00212-7)
- (en)Kirk O, Borchert TV, Fuglsang CC,«Industrial enzyme applications»,Current Opinion in Biotechnology,vol.13,no4,,p.345–351(DOI10.1016/S0958-1669(02)00328-2)
- Dennis E.Briggs,Malts and Malting,Londres, Blackie Academic,,1reéd.,796p.(ISBN978-0-412-29800-4,lire en ligne).
- (en)Dulieu C, Moll M, Boudrant J, Poncelet D,«Improved performances and control of beer fermentation using encapsulated Alpha -acetolactate decarboxylase and modeling»,Biotechnology Progress,vol.16,no6,,p.958–65(PMID11101321,DOI10.1021/bp000128k)
- (en)RodrigoTarté,Ingredients in meat products: properties, functionality and applications,New York, Springer,,419p.(ISBN978-0-387-71327-4,lire en ligne),p.177.
- (en)«Chymosin - GMO Database»,GMO Compass,European Union,(consulté le).
- (en)Molimard P, Spinnler HE,«Review: Compounds Involved in the Flavor of Surface Mold-Ripened Cheeses: Origins and Properties»,Journal of Dairy Science,vol.79,no2,,p.169–184(DOI10.3168/jds.S0022-0302(96)76348-8)
- (en)Guzmán-Maldonado H, Paredes-López O,«Amylolytic enzymes and products derived from starch: a review»,Critical Reviews in Food Science and Nutrition,vol.35,no5,,p.373–403(PMID8573280,DOI10.1080/10408399509527706)
- (en)«Protease - GMO Database»,GMO Compass,European Union,(consulté le).
- (en)Alkorta I, Garbisu C, Llama MJ, Serra JL,«Industrial applications of pectic enzymes: a review»,Process Biochemistry,vol.33,no1,,p.21–28(DOI10.1016/S0032-9592(97)00046-0)
- Stryer L, Berg JM, Tymoczko JL,Biochemistry,San Francisco, W.H. Freeman,,5eéd.(ISBN0-7167-4955-6,lire en ligne).
- (en)Bajpai P,«Application of enzymes in the pulp and paper industry»,Biotechnology Progress,vol.15,no2,,p.147–157(PMID10194388,DOI10.1021/bp990013k)
- (en)Begley CG, Paragina S, Sporn A,«An analysis of contact lens enzyme cleaners»,Journal of the American Optometric Association,vol.61,no3,,p.190-4(PMID2186082)
- Paul L.Farris,Roy L.Whistler(dir.) et James N.BeMiller(dir.),Starch Chemistry and Technology,Londres, Academic,,3eéd.,894p.(ISBN978-0-08-092655-1,lire en ligne),« Economic Growth and Organization of the U.S. Starch Industry ».
- Payen et Persoz, « Mémoire sur la diastase, les principaux produits de ses réactions et leurs applications aux arts industriels »,Annales de chimie et de physique,2esérie, t. 53, 1833,p.73-92,consultable surGoogle Books.
- Traité de Microbiologie,vol. 2, éditions Masson, 1899, Paris; chapitre 1, page 9 notamment.
- François Gros, «Biochimie cellulaire: Leçon inaugurale prononcée le mardi 15 janvier 1974», surPublications du Collège de France,OpenEdition,(consulté le),p.4-33.
- (en)Keith L. Manchester,«Louis Pasteur (1822–1895) — chance and the prepared mind»,Trends in Biotechnology,vol.13,no12,,p.511-515(PMID8595136,DOI10.1016/S0167-7799(00)89014-9,lire en ligne)
- (en)«The Nobel Prize in Chemistry 1907: Eduard Buchner - Biographical», surNobel Prizes and Laureates(consulté le).
- (en)Richard Willstätter,«Faraday lecture. Problems and methods in enzyme research»,Journal of the Chemical Society (Resumed),,p.1359-1381(DOI10.1039/JR9270001359,lire en ligne)
- (en)David Blow,«So do we understand how enzymes work?»,Structure,vol.8,no4,,R77-R81(PMID10801479,DOI10.1016/S0969-2126(00)00125-8,lire en ligne)
- (en)«The Nobel Prize in Chemistry 1946», surNobel Prizes and Laureates(consulté le).
- (en)C. C. F. Blake, D. F. Koenig, G. A. Mair, A. C. T. North, D. C. Phillips et V. R. Sarma,«Structure of Hen Egg-White Lysozyme: A Three-dimensional Fourier Synthesis at 2 Å Resolution»,Nature,vol.206,no4986,,p.757-761(PMID5891407,DOI10.1038/206757a0,lire en ligne)
- (en)Louise N. Johnson et Gregory A. Petsko,«David Phillips and the origin of structural enzymology»,Trends in Biochemical Sciences,vol.24,no7,,p.287-289(PMID10390620,DOI10.1016/S0968-0004(99)01423-1,lire en ligne)
- (en)Nomenclature Committee of the International Union of Biochemistry and Molecular Biology (NC-IUBMB), in consultation with the IUPAC-IUBMB Joint Commission on Biochemical Nomenclature (JCBN), «Web Version of Enzyme Nomenclature: Recommendations of the Nomenclature Committee of the International Union of Biochemistry and Molecular Biology on the Nomenclature and Classification of Enzymes by the Reactions they Catalyse», surIUBMB,(consulté le).
- Families of Proteolytic Enzymessur Merops, 4 mars 2016
- «Question de langage: une ou un enzyme?»,Revue d'histoire de la pharmacie,vol.56,no199,,p.195–196(lire en ligne,consulté le).
- «enzyme», surLarousse en ligne(consulté le).
- «coenzyme», surLarousse en ligne(consulté le).
Voir aussi
[modifier|modifier le code]Articles connexes
[modifier|modifier le code]- Exoenzyme
- Endoenzyme
- Isoenzyme
- Enzyme artificielle
- Fermentation
- Œnologie
- Réaction enzymatique
- Enzymes gloutons
Liens externes
[modifier|modifier le code]- (en)BRENDA:base de données sur les enzymes



![{\displaystyle v={\frac {d}{dt}}[P]={\frac {[S]}{K_{\mathrm {M} }+[S]}}V_{\max }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/408cb7c05c65870489878b63ba428c1dabbdf5ec)

