NF-κB

NF-κBpournuclear factor-kappa Boufacteur nucléaire kappa Best uneprotéinede lasuperfamilledesfacteurs de transcriptionimpliquée dans laréponse immunitaireet la réponse au stresscellulaire.Cette dernière est associée aux facteurs anti-apoptotiques. En effet son activation par la libération de sa protéine inhibitrice (IKB) déclenche la transcription de gènes anti-apoptotiques dans le noyau. Elle effectue donc un rétrocontrôle négatif de l'apoptose.C'est un sujet de recherche actuellement très étudié dans la mesure où plusieurs centaines de modulateurs de NF-κB sont connus et plus d'un millier de gènes cibles de ce facteur de transcription ont été identifiés.
Structure
[modifier|modifier le code]NF-κB est un homo- ou hétérodimère formé à partir de cinq sous-unités[1]:p50NF-κB1,p52NF-κB2,p65RelA,RelB et c-Rel. L’hétérodimère p50:p65 constitue la forme classique, la plus étudiée, de NF-κB.
Toutes les sous-unités sont caractérisées par un domaine N-terminal conservé d’environ 300 acides aminés[2],leRel Homology Domain(RHD), contenant undomaine de liaison à l’ADN,un domaine dedimérisation,unsignal de localisation nucléaireet un domaine d'interaction avec la protéine inhibitrice IκB. Les sous-unités RelA, RelB et c-Rel contiennent également un domaine de transactivation, responsable des activités derégulation transcriptionnellede NF-κB.
Mécanisme d'action
[modifier|modifier le code]NF-κB est en partie régulée dans lecytoplasmede la cellule par un complexe protéique (IKK) composé des protéines,IKKα,IKKβet de laprotéine NEMO (IKKg).Elle joue un rôle dans la répression ou l'activation des gènes, et est retenue dans le cytoplasme par la protéine inhibitrice IκB-α. La dégradation de IκB-α par phosphorylation et ubiquitination permet la translocation de NF-κB jusqu'au noyau et l'activation de la transcription des gènes cibles.
Voie de signalisation
[modifier|modifier le code]
NF-κB est le pivot des cellules phagocytaires. Il permet de les activer. Il est activé grâce au complexe membranaire CD14-Toll-like receptor au contact d'un PAMP; par exemple, Toll-like receptor 4 reconnait les LPS bactériens. Le complexe membranaire va en fait permettre la dégradation de IκB qui retient NF-κB dans sa forme inactive. Une fois libéré, il se dirige vers le noyau et permet la transcription de nouveaux gènes.
IκB peut être défini comme étant un séquestreur cytosolique. La séquestration cytosolique de NF-κB par IκB laisse le facteur NF-κB inactif (inhibition). En intra-cytosolique, NF-κB est lié au facteur IκB mais des stimuli externe peuvent permettre la dissociation du complexe NF-κB/IκB. Une autre kinase, IKK, pourra ainsi dans certains cas phosphoryler IκB; NF-κB se retrouve donc libre et peut ainsi rentrer dans le noyau pour atteindre le génome (translocation nucléaire de NF-κB). De son côté, IκB est voué à la dégradation dans leprotéasome26S à la suite de l'accrochage d'une chaine d'ubiquitine.
Divers stimuli peuvent phosphoryler IκB et ainsi dissocier le complexe NF-κB/IκB. Ce qui, par conséquent, pourra activer NF-κB. Ces stimuli peuvent être physiologiques ou non: ce sont des carcinogènes, des facteurs pro-apoptotiques, des réactifs oxygénés, descytokines,des facteurs de stress cellulaires (variés), des lipopolysaccharides bactériens, etc.
L'activation du facteur NF-κB peut se faire de deux façons: canonique et non-canonique.
Activation canonique
[modifier|modifier le code]C'est la voie la plus simple. Un ligand extracellulaire se fixe à un type de récepteur membranaire (par exemple, des récepteurs TLR activés par divers types de ligands), ce qui entraîne un recrutement et une activation du complexe IKK. Pour rappel, IKK comprend IKKa, IKKb et NEMO.
Le complexe IKK activé phosphoryle alors IKB (IKB étant le séquestreur cytosolique de NF-κB) qui sera ensuite envoyé vers le protéasome 26S pour subir une dégradation. NF-κB peut ainsi être transloqué dans le noyau. La voie canonique active le plus souvent les dimères NF-κB comprenant Rel-A, c-Rel, Rel-B et p50.
Activation non canonique
[modifier|modifier le code]Elle inclut l'activation des complexes p100/RelB et s'observe souvent durant le développement de certains organes lymphoïdes (génération et formation des lymphocytes B et T). Actuellement, on ne connaît que très peu de stimuli permettant de l'activer (lymphotoxine B, B cell activating factor, etc).
La caractéristique de la voie non canonique est l'utilisation d'un complexe IKK ayant deux sous-unités IKKa sans NEMO.
Le récepteur activé induira l'activation de la protéine NIK (NF-κB inducing kinase), qui phosphoryle et active le complexe IKKa, qui à son tour phosphoryle p100. Il s'ensuit une libération d'un hétérodimère actif p52/Rel-B. Contrairement au facteur p100, p105 subit un clivage pour donner p50.
Interactions avec les autres voies de signalisation cellulaire
[modifier|modifier le code]
Les molécules transmettent des signaux de manière intracellulaire ou extracellulaire et agissent comme récepteurs,ligands,protéines kinasesoufacteurs de transcriptiondans les voies de signalisation. Les différentes voies de signalisation constituent un réseau de transduction de signal avec une régulation fine grâce à des interactions mutuelles. La signalisation NF-κB n'est pas isolée dans la régulation de nombreux processus physiologiques et pathologiques dans lesquels elle est impliquée, et il peut y avoir une régulation directe ou indirecte avec d'autres molécules, ce qui déclenche par conséquent des interactions avec d'autres voies de signalisation. Les voies de signalisation classiques incluent la signalisation NF-κB, lavoie de signalisation PI3K/AKT,lavoie de signalisation MAPK/ERK,lavoie de signalisation JAK-STAT,lavoie de signalisation TGF beta,lavoie de signalisation Wnt,lavoie de signalisation Notchet lavoie de signalisation Hedgehog.Ces voies de signalisation peuvent interagir avec la signalisation NF-κB dans l'implication de processus biologiques tels que laprolifération cellulaire,ladifférenciation,la survie, lamort,le développement, l'immunité,l'inflammationet lacancérogène.De plus, les membres de la famille desrécepteurs de type Tollparticipent également à la signalisation NF-κB en reconnaissant les composants antigéniques des micro-organismes.
Voie de signalisation PI3K/AKT
[modifier|modifier le code]
Lavoie de signalisation phosphatidylinositol 3-kinase (PIK3) /protéine kinase B (AKT1) ou PI3K/AKTest une voie de signalisation cellulaire crucialet impliquée dans la régulation de plusieurs activités biologiques: le métabolisme cellulaire, la prolifération, la cancérogenèse, l'immunité, l'angiogenèse et de l'homéostasie cardiovasculaire[3],[4].Les signaux provenant desfacteurs de croissance,descytokineset des ligands desrécepteurs membranaires de la tyrosine kinaseaurécepteur couplé aux protéines Gfavorisent la production catalysée par la phosphatidylinositol 3-kinase dephosphatidylinositol trisphosphate,et le phosphatidylinositol trisphosphate est le deuxième messager qui active laprotéine kinase B[4],[5].La sous-unité catalytique Alpha duphosphatidylinositol-4,5-bisphosphate 3-kinasecode pour la sous-unité catalytique p110α de la phosphatidylinositol-4,5-bisphosphate 3-kinase, et sa mutation est l’une des altérations somatiques les plus courantes dans les cancers[6].
L'interaction entre la signalisation NF-κB et la signalisation PI3K/AKT dans lelymphome diffus à grandes cellules Best un phénomène important. La prolifération et la survie des cellules activées du lymphome diffus à grandes cellules B nécessitent une signalisation active du récepteur des cellules B, et l'activation de la signalisation NF-κB est détectée dans environ 10 % des cellules activées. La cascade de signalisation NF-κB a été suggérée comme cible potentielle pour le traitement du lymphome diffus à grandes cellules B[7],[8].Des découvertes récentes ont révélé que laphosphoinositide 3-kinaseactive la signalisation NF-κB et lecopanlisib,un inhibiteur de la phosphoinositide 3-kinase peut bloquer efficacement la double signalisation PI3K/AKT - NF-κB dans les cellules activées du lymphome diffus à grandes cellules B, conduisant à une régression tumorale[9].L'inhibition du phosphoinositide 3-kinase dans le lymphome diffus à grandes cellules B s'est également avérée diminuer l'activité de NF-κB[10].L'inhibition du phosphatidylinositol 3-kinase réduit l'activité de la protéine kinase B dans le myélome multiple de manière dose-dépendante[11].
Un autre cas exemplaire est l'athérosclérose. L'interleukine 7,essentielle au développement et à l'équilibre deslymphocytes T,active la signalisation NF-κB via la voie PI3K/AKT, régule positivement l'expression de laprotéine chimiotactique 1 des monocyteset de laprotéine d'adhésion cellulairedans lesmacrophageset dans les cellules endothélialesaortiqueset joue un rôle actif dans l'athérosclérose[12].La sécrétion accrue du facteur pro-inflammatoiregalectine-3dans l'athérosclérose active la voie PI3K/AKT et inhibe l'autophagielors de la liaison au CD98, alors que l'inhibition de la galectine-3 réduit l’activité de la voie NF-κB, supprime l’inflammation et améliore l’autophagie[13].
La signalisation NF-κB peut également interagir avec la signalisation PI3K/AKT via des voies métaboliques. Dans lecarcinome hépatocellulairelié auvirus de l'hépatite B,la protéine X de l'hépatite B (HBx) induit uneglycolyseaérobie et produit une grande quantité d'acide lactiquevia la signalisation NF-κB/hexokinase 2qui active davantage PI3K-AKT et améliore la capacité de prolifération maligne des cellules[14].Lesous-type 2 du récepteur de la somatostatineinhibe la signalisation PI3K activée par laGTPaseKRASfavorisant la libération du ligand dechimiokineCXC 16 et de l'interleukine 6et conduisant finalement à la progression de l'adénocarcinome canalaire pancréatique[15].Le système de signalisation PI3K/AKT/NF-ΚB facilite également latransition épithélio-mésenchymateuse[16].
Voie de signalisation MAPK/ERK
[modifier|modifier le code]
Laprotéine kinase activée par des agents mitogènes(MAPK) appartient à la famille dessérine/thréonine kinaseet joue un rôle important dans la prolifération, la différenciation, le développement, la transformation, les réponses inflammatoires et l'apoptose en transmettant, en amplifiant et en intégrant les signaux de un large spectre de stimuli. La signalisation MAPK est une cascadeenzymatiqueconservée qui assure latransduction du signalde la surface cellulaire au noyau via des événements dephosphorylation.Cette voie implique trois enzymes clés: la MAPK déjà citée, la MAPK kinase ou MAPKK et la MAPKK kinase ou MAPKKK. La MAPK est responsable de laphosphorylationdes protéines cibles dans lecytoplasmeou lenoyau.Les MAPK dans les cellules de mammifères comprennent principalement laprotéine kinase régulée extracellulaire,laMAPK p38,lac-Jun N-terminal kinases(JNK) et laprotéine kinase 5 régulée extracellulaire.L’interaction de la signalisation NF-κB avec la signalisation MAPK est principalement centrée sur la signalisation JNK. TAK1 sert de kinase en amont pour la signalisation NF-κB et la signalisation JNK[17].La voie JNK régule la progression du cycle cellulaire par le biais de multiples mécanismes. JNK active la voie de transcription Jun et lefacteur de transcription AP-1pour exercer des effets pro-oncogènes,tout en induisant simultanément l'apoptose[18].Les réponses cellulaires présentent une variabilité basée sur la nature du stimulus, l'étendue de l'activation de JNK et la durée de la réponse[18].Des études portant sur l'interaction de la signalisation NF-κB avec la signalisation JNK ont révélé que bien que la signalisation JNK régule lamortou la survie cellulaire, le destin ultime de la cellule est déterminé par NF-κB, et l'activation de la signalisation NF-κB est capable d'inhiber la pro-apoptose induite par lescaspases,la JNK et les[dérivés réactifs de l'oxygène[19].NF-κB a également été observé pour bloquer l'apoptose induite par lefacteur de nécrose tumoralevia la régulation négative de JNK et de c-Jun/AP-1 dans les hépatocytes de rat[20].Au cours d'uneinsuffisance hépatique aiguë,le récepteur de type 1 de l'interleukine 1est stimulé par l'interleukine 1 et active la signalisation NF-kB qui favorise la régulation transcriptionnelle positive des gènes liés à l'inflammation et le recrutement de cellules immunitaires, tandis que le NF-κB inhibe la signalisation JNK activée par le facteur de nécrose tumorale et empêche l'apoptosemédiée par lacaspase 3,qui amplifie encore les réponses inflammatoires et exacerbe les lésions hépatiques[21].
Voie de signalisation JAK-STAT
[modifier|modifier le code]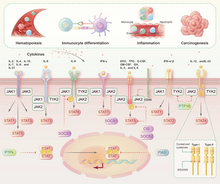
Lajanus kinase 2(JAK) se lie de manière non covalente aux récepteurs decytokines,médie laphosphorylationdu récepteur de la tyrosine et recrute un ou plusieurs transducteurs de signal et activateurs detranscription( protéines STAT). Lors de la phosphorylation, lesprotéines STATtraversent la membrane nucléaire pour moduler l'activité de gènes spécifiques. La famille JAK comprend JAK1, JAK2, JAK3 et la tyrosine kinase 2 (TYK2)[22].L'érythropoïétineintervient dans l'activation de JAK2 dans lesneurones,ce qui active en outre la signalisation NF-κB et initie la transcription de gènes ayant des effets neuroprotecteurs[23].La famille STAT comprend de STAT1, STAT2, STAT3, STAT4, STAT5A, STAT5B et STAT6[24].Chaque protéine STAT exerce des effets biologiques uniques et joue une fonction régulatrice dans la survie cellulaire, la différenciation, le métabolisme et la réponse immunitaire, et joue un rôle clé dans les tumeurs malignes et maladies auto-immunes[25].
STAT1 aide à renforcer l’immunité contre les tumeurs, mais STAT3 et d’autres types de protéines peuvent déclencher une inflammation pro-cancéreuse[26].Une interaction étroite entre STAT3 et la signalisation NF-κB a été observée. L'interleukine 6régulé par la signalisation NF-κB, est un activateur important de STAT3[27].L'interleukine 10et leCpGactivent en synergieSTAT3et NF-κB dans unelignée de cellules Bhumaines induites par leprotooncogène Myc[28].STAT3 a également inhibé l'expression de molécules essentielles à l'immunité antitumorale médiée par NF-κB et STAT1, notamment l'interleukine 12et l'interféron-γ[29],[30].
L'acétylation de la sous-unité RelA du NF-kB médiée par STAT3 favorise l'exercice par NF-κB d'une activité pro-transcriptionnelle dans le noyau, un phénomène observé dans à la fois les cellules tumorales et les cellules hématopoïétiques associées à la tumeur[31].La suppression de l'abl interactor 1(Abi-1) peut entraîner une activité accrue de STAT3 et de NF-κB, ce qui pourrait être un mécanisme potentiel menant à lasplénomégalie myéloïde[32].Dans lecancer colorectal,IKKα induit leleukemia inhibitory factor(LIF) en induisant une activité transcriptionnelle dépendante de NF-κB, activant ainsi le STAT3[32].Dans les cellules dulymphome anaplasique à grandes cellules,STAT3 favorise l'expression de p52 et CD30, induisant ainsi une activation soutenue de la signalisation non canonique NF-κB[33].STAT3 favorise non seulement la prolifération, la survie, la néovascularisation et les métastases des cellules tumorales, mais exerce également un effet inhibiteur sur l'immunité anticancéreuse[26].L'interféron-γet lefacteur de nécrose tumorale-αfavorisent la réponse du promoteur du gène inductible de l'oxyde nitrique synthaseau NF-κB via l'activation de la signalisation JAK-STAT dans le recrutement desfibroblastesmusculaires, activant ainsi l'oxyde nitrique synthétaseet induisant une atrophie musculaire[34].
Voie de signalisation TGF beta
[modifier|modifier le code]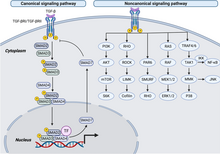
Lavoie de signalisation du facteur de croissance transformant bêta(TGFβ) est impliquée dans de nombreux processus cellulaires à la fois dans l'organisme adulte et dans l'embryonen développement, notamment la croissance cellulaire, ladifférenciation cellulaire,la migration cellulaire, l'apoptose,l'homéostasiecellulaire et d'autres fonctions cellulaires. Les voies de signalisation TGFB sont conservées au cours de l'évolution[35].Malgré le large éventail de processus cellulaires régulés par la voie de signalisation du TGFβ, le processus est relativement simple. Les ligands de la superfamilleTGFβse lient à un récepteur de type II, qui recrute et phosphoryle un récepteur de type I. Le récepteur de type I phosphoryle ensuite les SMAD régulés par le récepteur (R-SMAD) qui peuvent désormais se lier au coSMADSMAD4.Les complexes R-SMAD/coSMAD s'accumulent dans lenoyauoù ils agissent commefacteurs de transcriptionet participent à la régulation de l'expression des gènes cibles[36]. Les membres de la famille des facteurs de croissance transformants comprennent le TGF-β, et les membres de la famille desprotéines morphogénétiques osseuses.Ces cytokines jouent un rôle crucial dans divers processus cellulaires, notamment la prolifération cellulaire, la migration, le métabolisme, la régulation immunitaire et la réponse inflammatoire[37].La famille de récepteurs TGF-β comprend le récepteur de type I, le récepteur TGF-bêta (TβR) I, le récepteur de type II (TβRII) et le récepteur de type III (TβRIII), parmi lesquels TβRI et TβRII pos sắc dent une activité kinase intrin sắc que, essentielle pour la signalisation du TGF-β. Lors de la liaison au ligand, TβRII phosphoryle les résidus sérine et thréonine de TβRI. Le TβRI activé phosphoryle ensuite la molécule de signalisation en avalSmad,conduisant à son accumulation nucléaire et à sa régulation transcriptionnelle en tant que facteur de transcription. Au stade précoce de la tumorigenèse, la famille TGF-β exerce un effet oncogène en inhibant la prolifération cellulaire. Cependant, à mesure que la tumeur continue de progresser, les cellules tumorales développent une résistance à l'inhibition de la croissance médiée par le TGF-β, qui est attribuée à des mutations dans les gènes codant pour les intermédiaires de signalisation[38],[39].
Lerécepteur des lymphocytes Tinhibe l'expression du TβRI et la signalisation du TGF-β par l'activation de la signalisation NF-κB et de lacaspase recruitment domain-containing protein 11,entraînant la quiescence descellules T[40].Smad7inhibe la signalisation dufacteur de nécrose tumoraleen formant un complexe avec TAB2 et TAB3, supprimant ainsi l'activation de NF-κB et les réponses inflammatoires[41].Lerécepteur des lymphocytes Tinhibe l'expression du TβRI et la signalisation du TGF-β par l'activation de la signalisation NF-κB et de lacaspase recruitment domain-containing protein 11,entraînant la quiescence descellules T[40].Smad7inhibe la signalisation dufacteur de nécrose tumoraleen formant un complexe avec TAB2 et TAB3, supprimant ainsi l'activation de NF-κB et les réponses inflammatoires[41]. Cependant, NF-κB dans le glioblastome active le TGF-β en induisant lemicroARN-148a ou le microARN-182, conduisant à une hyperactivation de la signalisation NF-κB et TGF-β[42],[43].TAK1 favorise la phosphorylation et l'activité transcriptionnelle de NF-κB, qui médie la réponse inflammatoire, lemicroenvironnement tumoral,lesmétastases,la chimiorésistance[44].
Voie de signalisation Wnt
[modifier|modifier le code]
Les voies de signalisation de Wnt englobent les voies Wnt/β-caténine, Wnt/planner cell polarity et Wnt/Ca2+. La voie de signalisation Wnt/β-caténine est une classe de signalisation Wnt dépendante de laβ-caténine,également connue sous le nom de voie canonique, qui contrôle principalement la prolifération cellulaire. Les voies Wnt/PCP et Wnt/Ca2+ ne dépendent pas de la β-caténine et sont connues comme voies non canoniques qui régulent la polarité, l’adhésion et la migration cellulaire. Dans la voie Wnt/β-caténine, les protéines liées auxrécepteurs des lipoprotéineset la famille des protéinesfrizzledagissent comme des récepteurs Wnt et forment un complexe avec les protéines Wnt pour activer la signalisation en aval.
Au cours du développement de l'infarctus aigu du myocarde, un Wnt2 élevé a favorisé la signalisation β-caténine/NF-κB en se liant àfrizzled-4 et au récepteurs des lipoprotéines 6, et un Wnt4 élevé a activé la même signalisation en se liant àfrizzled-2 et récepteurs des lipoprotéines 6, entraînant un effet pro-fibrotique[45].Le complexeprotéine d'inhibition(Axin)/laprotéine APC(APC)/glycogène synthase kinase 3 bêta (GSK3β)/caséine kinase 1 Alpha(CK1 Alpha ) phosphoryle et inactive la β-caténine. L'activation transcriptionnelle de NF-κB est diminuée dans lesfibroblastesembryonnaires déficients en GSK3 sans affecter la dégradation de l'IκB et la translocation nucléaire de NF-κB[46].Disheveledentrave le complexe Axin/APC/GSK3β/CK1α dans le cytoplasme, ce qui inhibe la dégradation de β -caténine et favorise sa translocation vers le noyau, et active les gènes liés à la prolifération et à la différenciation en interagissant avec la famille de facteurs de transcription du facteurT-Cell Factor(TCF) et en activant des coactivateurs[47]. Disheveled interagit avec p65 dans le noyau et inhibe l'activation transcriptionnelle médiée par NF-κB et favorise l'apoptose, indépendamment de Wnt ou de la β-caténine. La β-TrCP, une ubiquitine E3 ligase, favorise la dégradation ubiquitylée de la β-caténine en réponse à la signalisation Wnt au repos.
Voie de signalisation Notch
[modifier|modifier le code]Régulation du facteur IκB et de l'action de NF-κB
[modifier|modifier le code]Les IKK sont des IκB-kinases. La régulation du facteur IκB se fait essentiellement par des phosphorylations sur les résidus Ser32 et Ser36, grâce aux IKK. IKK est fait de l'association d'un hétérodimère NEMO (constitué de IKKa et IKKb) avec une sous-unité IKKy.
Les IKK sont activés par de nombreux couples ligand-récepteurs, variés également. Parmi eux, on peut citer:
- LeTNF-αavec le TNF-Receptor: l'activation du TNF-Receptor pourrait permettre l'activation de NF-κB qui dans ce cas stimule le facteurmTORet inhibe la production de réactifs oxygénés cellulaires, ce qui serait à la base d'un blocage des processus d'autophagie,notamment dans les cellules cancéreuses[48].
- L'IL-1β avec les lipopolysaccharides bactériens; en effet, l'IL-1β peut se fixer sur son IL-1βR dumacrophage(récepteur de cette cytokine inflammatoire) qui stimulera IKK. Cela engendre l'activation de NF-κB (dimère p50/p65) qui stimulera la transcription du gène de laNOS inductible.Celle-ci sera ensuite sécrétée par le macrophage afin d'aller bloquer le métabolisme mitochondrial des bactéries, ce qui engendre la mort de labactérie.C'est un processus très utilisé lors de l'inflammation.L'interaction du lipopolysaccharide bactérien ou du lipopolysaccharide binding protein (LBP) avec le récepteur CD14 (en surface du macrophage) peut enclencher des voies de signalisation très similaires.
- LeTLR4(CD 284), récepteur pouvant être activé par les lipopolysaccharides de bactéries Gram -, ce qui activera la voieMyD88en intracytosolique afin de stimuler une activation indirecte (pouvant êtreAkt-dépendante) du facteur NF-κB.
- L'hypoxieest capable, selon les cas, de stimuler la production de réactifs oxygénés qui peuvent stimuler l'activation de NF-κB et de facteurs HIF-1α et ensemble, stimuleront l'autophagie.
- La kinase Akt concourt indirectement à l'activation de NF-κB: Akt peut en effet activer le complexe IKK par phosphorylation, qui lui-même pourra phosphoryler IKB, ce qui activera le facteur NF-κB.
- Divers antigènes activant les B-cell Receptor (BCR) ou T-cell Receptor (TCR): par exemple, une infection bactérienne peut stimuler la production d'Interleukine 2en activant la voie incluant le complexe NFAT/AP-1/NF-κB. NFAT est activé par le Ca2+,AP-1 est activé par desMAP kinaseset la protéine kinase C (PKC) activera NF-κB. L'association des trois facteurs pourra se fixer sur le promoteur du gène de l'interleukine 2 et ainsi stimuler sa transcription. La sécrétion de l'IL-2 par les cellules T est une caractéristique majeure de la réponse immune adaptative.
- Lesignal costimulateurdes lymphocytes T permet également d'accroître le taux de NF-κB libre. En effet l'activation du CD28 (de la cellule T) par les CD80 et CD86 (aussi connus sous le nom de B7.1 ET B7.2) de laCPApermet l'augmentation de la production des facteurs AP-1 et NF-κB, triplant ainsi la transcription de l'ARNm de l'IL-2[49].
Physiopathologie
[modifier|modifier le code]- Son activation exagérée (lors de la présence de bactéries dans le sang par exemple) peut provoquer unchoc septique.
- NF-κB est connu pour être un des multiples régulateurs de plusieurs gènes codant des protéines de l'inflammation;ce facteur dispose ainsi d'une fenêtre de temps d'activation (temps passé dans le noyau) beaucoup plus long que la normale dans diverses pathologies inflammatoires comme: arthrite, maladies inflammatoires de l'intestin, asthme, athérosclérose, etc[50].
- Il a été montré dans de très nombreuses publications l'implication du facteur NF-κB dans la cancérogenèse et les processus de tumorisation de certaines cellules[51],[52].
La voie de signalisation NF-kB dans les pathologies humaines
[modifier|modifier le code]Maladies inflammatoires et auto-immunes
[modifier|modifier le code]Lors de la reconnaissance de diversmotifs moléculaires associé aux pathogènesetmotifs moléculaires associé aux dégâts,lesmacrophagesactivent et libèrent rapidement des quantités substantielles de cytokines. En fonction de conditions spécifiques, les macrophages activés peuvent se différencier endeux phénotypes distincts:lesmacrophages classiquement activésetalternativement activés.NF-κB sert de facteur de transcription clé pour les macrophages M1, régulant un ensemble de gènes impliqués dans l'inflammation, notamment lefacteur de nécrose tumorale-α,l'interleukine 1,l'interleukine 6,l'interleukine 12et lacyclooxygénase-2[53].. Lesneutrophileset lescellules dendritiquesjouent également un rôle essentiel. rôles dans l’inflammation locale, le NF-κB étant essentiel à leur survie et à leur fonctionnement dans des conditions potentiellement toxiques. Cela contribue au recrutement des neutrophiles et à la maturation des cellules dendritiques[54].
La voie de signalisation NF-κB influence de manière significative l’activation, la différenciation, la prolifération et la fonction des lymphocytes T. Lors de la liaison du complexeantigène-MHCet du CD80 ou CD86 aurécepteurs des cellules Tet au CD28, respectivement, les complexes NF-κB contenant p65 sont activés. L'activité NF-κB est cruciale pour les cellules T activées car elle protège contre l'apoptose et favorise la production de cytokines, en particulier l'interleukine 2, qui soutient la prolifération et la différenciation[55].
Traitements ciblant la voie de signalisation NF-kB
[modifier|modifier le code]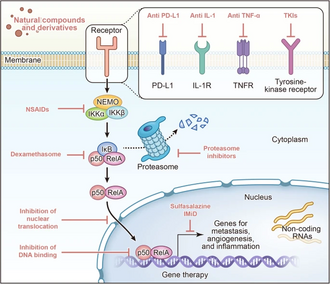
Inhibiteurs du complexe IKK
[modifier|modifier le code]Aspirine
[modifier|modifier le code]L'aspirine,unanti-inflammatoire non stéroïdien,est bien connue pour son action inhibant lacyclooxygénase.La découverte, en1994,du pouvoir inhibiteur de l'aspirine sur la transcription dépendante de NF-κB confirma le rôle important de la signalisation NF-κB dans l'inflammation et l'infection[56].La recherche suggère que les propriétés anti-inflammatoires de l'aspirine sont en partie attribuées à son inhibition spécifique de l'IKKβ[57].
Il existe des preuves substantielles indiquent que l'aspirine et les anti-inflammatoires non stéroïdien apparentés pos sắc dent une activité antitumorale potentielle et des effets préventifs du cancer, conduisant à un intérêt accru pour l'utilisation de l'aspirine pour le traitement du cancer. L'aspirine réduit la migration, l'invasion et lesmétastasesdes cellules d'ostéosarcomegrâce à la modulation de la voie NF-κB[58].L'aspirine libérant dusulfure d'hydrogène,un dérivé de l'aspirine, inhibe la croissance des cellulescancéreuses du seinen régulant négativement la voie NF-κB, induisant un arrêt du cycle cellulaire et favorisant l'apoptose.Le sulfure d'hydrogène] affecte également l’activité de lathiorédoxine réductaseet augmente les niveaux dedérivé réactif de l'oxygène[59].L’aspirine induit l’apoptose des cellules cancéreuses colorectales humaines en inhibant l’activité du NF-κB, ce qui en fait un agent thérapeutique potentiel pour le cancer du côlon[60].
Salicylate de sodium
[modifier|modifier le code]Le découverte de l'inhibition de la voie de signalisation NF-kB par lesalicylate de sodiumfut faite en1995[61].Le salicylate de sodium est connu commeinhibiteur de la COX-2et ce médicament peut empêcher la dissociation du NF-κB du complexe NF-κB/IκB, empêchant ainsi latranslocationdu NF-κB du cytoplasme vers le noyau et inhibant latranscriptionde la COX-2[62].487. De plus, le salicylate de sodium induit le passage d'un phénotype prolifératif à un phénotype apoptotique dans les cellulesleucémiqueshumaines en inhibant la réponse NF-κB et en rétablissant l'apoptoseinduite par lefacteur de nécrose tumoral[63].
Sulfasalazine
[modifier|modifier le code]Lasulfasalazineest principalement utilisée comme antibiotiquesulfamide.Lorsqu’il est partiellement absorbé, il est dégradé par lemicrobiote intestinalenacide 5-aminosalicyliqueet sulfapyridine. L'acide 5-aminosalicylique avec le tissu conjonctif de la paroiintestinaleexercent des effetsantimicrobiens,anti-inflammatoiresetimmunosuppresseurs.Elle inhibe la synthèse desprostaglandineset d'autres médiateurs inflammatoires comme lesleucotriènes[64].La sulfasalazine est un inhibiteur connu du NF-κB qui peut inhiber l'expression durécepteur de type Toll 4,deMyD88et deNF-κB p65 induite par l' acide trinitro-benzène-sulfonique[65]. La sulfasalazine peut favoriser l'apoptose dans les cellules deglioblastomeen inhibant la signalisation NF-κB[66].La voie de signalisation interleukine 1-NFkB/CREB-Wnta également été identifiée comme un nouveau mécanisme favorisant la colonisation des cellules souches du cancer du sein dans le tissu osseux. Cibler cette voie avec des médicaments comme la sulfasalazine peut prévenir lesmétastases osseusesin vivo[67].
Dexaméthasone
[modifier|modifier le code]La dexaméthasone est unglucocorticoïdedont elle a tous les effets thérapeutiques. L'inhibition de l'activation de NF-κB est l'un des mécanismes possibles par lesquels la dexaméthasone exerce ses thérapeutiques. Deux mécanismes sont proposés pour cette inhibition: Les récepteurs glucocorticoïdes activés interagissent directement avec la sous-unité RelA de NF-κB dans le noyau cellulaire conduisant à l'inhibition de sa fonction ou les récepteurs glucocorticoïdes activés améliorent la transcription de IκB empêchant la translocation nucléaire de NF-κB et sa liaison à l'ADN[68].Ces mécanismes constituent une base pour l'application thérapeutique de la dexaméthasone dans les maladies impliquant une dérégulation de NF-κB. Lapancréatite aiguëpourrait bénéficier de ce traitement en inhibant l'expression de la protéine p65. Dans lelichen plan buccal,où l'axeTLR4-NF-κB-p65 joue un rôle crucial, la dexaméthasone protège efficacement contre les dommages aux cellules épidermiques en régulant négativement l'expression durécepteur de type Toll4 et en régulant négativement la voie de signalisation NF-κB dans leskératinocytes[69].
Thalidomide
[modifier|modifier le code]Lathalidomide,initialement développée comme médicament contre lalèpre,s'est avérée avoir divers effets pharmacologiques. Son mécanisme d'action implique l'immunosuppression,la modulation immunitaire et l'inhibition de lachimiotaxie des neutrophiles.Plusieurs études ont indiqué que la thalidomide produit ces effets en inhibant l’activation de NF-κB[70],[71].
En termes de traitement inflammatoire, la thalidomide a démontré sa capacité à améliorer l’inflammation cutanée de typerosacéeen inhibant l’activation du NF-κB dans leskératinocytes[72].La thalidomide pourrait avoir un potentiel thérapeutique dans le traitement des tumeurs. Il peut inhiber l'expression d'ICAM-1induite par lefacteur de nécrose tumorale αen supprimant le promoteur ICAM-1 se liant à NF-κB, conduisant à l'inhibition de la prolifération des cellules cancéreuses du poumon[73].
Le mécanisme à l'origine de la malformation des membres induite par la thalidomide est également lié à NF-κB. La recherche a révélé que des changements dans le microenvironnement redox, déclenchés par la génération deradicaux libresà partir de la thalidomide, conduisent à la suppression de l'expression génique médiée par NF-κB, responsable de laphocomélie[74].
Lénalidomide
[modifier|modifier le code]Lelénalidomide,un analogue de la thalidomide, est un médicament antitumoral ayant une activité antitumorale, une modulation immunitaire et des propriétésanti-angiogenèse[75].Comme la thalidomide, le lénalidomide pos sắc de également la capacité d'inhiber le NF-κB. Cependant, sa puissance d’inhibition dufacteur de nécrose tumorale-αin vitro est 50 000 fois supérieures à celle de la thalidomide[76].Le lénalidomide a reçu l'approbation de la FDA en 2003 pour le traitement dumyélome multiple récidivant ou réfractaire.Il altère la voie de signalisation NF-κB dans les cellules osseuses, entraînant la suppression de l'expression génique spécifique desostéoclastes.Cela procure des effets thérapeutiques contre la résorption osseuse et fait du lénalidomide une option thérapeutique précieuse pour les maladies ostéolytiques telles que le myélome multiple[77].Le lénalidomide s'est révélé prometteur dans le traitement dulymphome diffus à grandes cellules B.Son effet antitumoral dans les cellules du lymphome diffus à grandes cellules B est associé à la régulation négative dufacteur 4 régulateur de l'interféronet à l'inhibition de l'activité NF-κB dépendante durécepteur des cellules B[78].
Notes et références
[modifier|modifier le code]- Pereira et Oakley 2008
- Perkins et Gilmore 2006
- (en)QingGuo,YiziJin,XinyuChenet XiaominYe,«NF-κB in biology and targeted therapy: new insights and translational implications»,Signal Transduction and Targeted Therapy,vol.9,no1,,p.1–37(ISSN2059-3635,PMID38433280,PMCIDPMC10910037,DOI10.1038/s41392-024-01757-9,lire en ligne,consulté le)
- (en)BartVanhaesebroeck,JulieGuillermet-Guibert,MarionaGrauperaet BenoitBilanges,«The emerging mechanisms of isoform-specific PI3K signalling»,Nature Reviews Molecular Cell Biology,vol.11,no5,,p.329–341(ISSN1471-0080,DOI10.1038/nrm2882,lire en ligne,consulté le)
- (en)Lauren M.Thorpe,HalukYuzugulluet Jean J.Zhao,«PI3K in cancer: divergent roles of isoforms, modes of activation and therapeutic targeting»,Nature Reviews Cancer,vol.15,no1,,p.7–24(ISSN1474-1768,PMID25533673,PMCIDPMC4384662,DOI10.1038/nrc3860,lire en ligne,consulté le)
- Ariella B. Hanker, Virginia Kaklamani, Carlos L. Arteaga; Challenges for the Clinical Development of PI3K Inhibitors: Strategies to Improve Their Impact in Solid Tumors.Cancer Discov1 April 2019; 9 (4): 482–491. https://doi.org/10.1158/2159-8290.CD-18-1175
- (en)R. EricDavis,Vu N.Ngo,GeorgLenzet PavelTolar,«Chronic active B-cell-receptor signalling in diffuse large B-cell lymphoma»,Nature,vol.463,no7277,,p.88–92(ISSN1476-4687,PMID20054396,PMCIDPMC2845535,DOI10.1038/nature08638,lire en ligne,consulté le)
- Wendan Xu, Philipp Berning, Georg Lenz; Targeting B-cell receptor and PI3K signaling in diffuse large B-cell lymphoma.Blood2021; 138 (13): 1110–1119. doi: https://doi.org/10.1182/blood.2020006784
- JulianePaul,MauriceSoujon,Antje M.Wengneret SabineZitzmann-Kolbe,«Simultaneous Inhibition of PI3Kδ and PI3Kα Induces ABC-DLBCL Regression by Blocking BCR-Dependent and -Independent Activation of NF-κB and AKT»,Cancer Cell,vol.31,no1,,p.64–78(ISSN1535-6108,DOI10.1016/j.ccell.2016.12.003,lire en ligne,consulté le)
- (en)WendanXu,PhilippBerning,TabeaErdmannet MichaelGrau,«mTOR inhibition amplifies the anti-lymphoma effect of PI3Kβ/δ blockage in diffuse large B-cell lymphoma»,Leukemia,vol.37,no1,,p.178–189(ISSN1476-5551,PMID36352190,PMCIDPMC9883168,DOI10.1038/s41375-022-01749-0,lire en ligne,consulté le)
- SeiichiOkabe,YukoTanakaet AkihikoGotoh,«Targeting phosphoinositide 3-kinases and histone deacetylases in multiple myeloma»,Experimental Hematology & Oncology,vol.10,no1,,p.19(ISSN2162-3619,PMID33663586,PMCIDPMC7934550,DOI10.1186/s40164-021-00213-6,lire en ligne,consulté le)
- (en)RongyingLi,AntoniPaul,Kerry W.S.Koet MichaelSheldon,«Interleukin-7 induces recruitment of monocytes/macrophages to endothelium»,European Heart Journal,vol.33,no24,,p.3114–3123(ISSN0195-668Xet1522-9645,PMID21804111,PMCIDPMC3598429,DOI10.1093/eurheartj/ehr245,lire en ligne,consulté le)
- (en)ZitongWang,ZiyuGao,YinghongZhenget JiayuanKou,«Melatonin inhibits atherosclerosis progression via galectin‐3 downregulation to enhance autophagy and inhibit inflammation»,Journal of Pineal Research,vol.74,no3,(ISSN0742-3098et1600-079X,DOI10.1111/jpi.12855,lire en ligne,consulté le)
- LingjunChen,XianyiLin,YimingLeiet XuanXu,«Aerobic glycolysis enhances HBx-initiated hepatocellular carcinogenesis via NF-κBp65/HK2 signalling»,Journal of Experimental & Clinical Cancer Research,vol.41,no1,,p.329(ISSN1756-9966,PMID36411480,PMCIDPMC9677649,DOI10.1186/s13046-022-02531-x,lire en ligne,consulté le)
- MouniraChalabi-Dchar,StéphanieCassant-Sourdy,CamilleDulucet MarjorieFanjul,«Loss of Somatostatin Receptor Subtype 2 Promotes Growth of KRAS-Induced Pancreatic Tumors in Mice by Activating PI3K Signaling and Overexpression of CXCL16»,Gastroenterology,vol.148,no7,,p.1452–1465(ISSN0016-5085,DOI10.1053/j.gastro.2015.02.009,lire en ligne,consulté le)
- Chun-YuLin,Pei-HsunTsai,Chithan C.Kandaswamiet Geen-DongChang,«Role of tissue transglutaminase 2 in the acquisition of a mesenchymal-like phenotype in highly invasive A431 tumor cells»,Molecular Cancer,vol.10,no1,,p.87(ISSN1476-4598,PMID21777419,PMCIDPMC3150327,DOI10.1186/1476-4598-10-87,lire en ligne,consulté le)
- (en)AlainIsraël,«The IKK Complex, a Central Regulator of NF-κB Activation»,Cold Spring Harbor Perspectives in Biology,,a000158(ISSN1943-0264,PMID20300203,DOI10.1101/cshperspect.a000158,lire en ligne,consulté le)
- (en)Erwin F.Wagneret Ángel R.Nebreda,«Signal integration by JNK and p38 MAPK pathways in cancer development»,Nature Reviews Cancer,vol.9,no8,,p.537–549(ISSN1474-1768,DOI10.1038/nrc2694,lire en ligne,consulté le)
- (en)H.Nakano,A.Nakajima,S.Sakon-Komazawaet J.-H.Piao,«Reactive oxygen species mediate crosstalk between NF-κB and JNK»,Cell Death & Differentiation,vol.13,no5,,p.730–737(ISSN1476-5403,DOI10.1038/sj.cdd.4401830,lire en ligne,consulté le)
- (en)HailingLiu,Chau R.Loet Mark J.Czaja,«NF-κB inhibition sensitizes hepatocytes to TNF-induced apoptosis through a sustained activation of JNK and c-Jun: NF-κB inhibition sensitizes hepatocytes to TNF-induced apoptosis through a sustained activation of JNK and c-Jun»,Hepatology,vol.35,no4,,p.772–778(DOI10.1053/jhep.2002.32534,lire en ligne,consulté le)
- NadineGehrke,NadineHövelmeyer,AriWaismanet Beate K.Straub,«Hepatocyte-specific deletion of IL1-RI attenuates liver injury by blocking IL-1 driven autoinflammation»,Journal of Hepatology,vol.68,no5,,p.986–995(ISSN0168-8278,DOI10.1016/j.jhep.2018.01.008,lire en ligne,consulté le)
- KunihiroYamaoka,PipsaSaharinen,MarkoPesuet Vance ETHolt,«The Janus kinases (Jaks)»,Genome Biology,vol.5,no12,,p.253(ISSN1474-760X,PMID15575979,PMCIDPMC545791,DOI10.1186/gb-2004-5-12-253,lire en ligne,consulté le)
- (en)MuratDigicayliogluet Stuart A.Lipton,«Erythropoietin-mediated neuroprotection involves cross-talk between Jak2 and NF-κB signalling cascades»,Nature,vol.412,no6847,,p.641–647(ISSN1476-4687,DOI10.1038/35088074,lire en ligne,consulté le)
- (en)David E.Levyet J. E.Darnell,«STATs: transcriptional control and biological impact»,Nature Reviews Molecular Cell Biology,vol.3,no9,,p.651–662(ISSN1471-0080,DOI10.1038/nrm909,lire en ligne,consulté le)
- Xue, C. et al. Evolving cognition of the JAK-STAT signaling pathway: autoimmune disorders and cancer.Signal Transduct. Target Ther.8,1–24 (2023).
- (en)HuaYu,DrewPardollet RichardJove,«STATs in cancer inflammation and immunity: a leading role for STAT3»,Nature Reviews Cancer,vol.9,no11,,p.798–809(ISSN1474-1768,PMID19851315,PMCIDPMC4856025,DOI10.1038/nrc2734,lire en ligne,consulté le)
- SergeiGrivennikov,EliadKarin,JanosTerzicet DanielMucida,«IL-6 and Stat3 Are Required for Survival of Intestinal Epithelial Cells and Development of Colitis-Associated Cancer»,Cancer Cell,vol.15,no2,,p.103–113(ISSN1535-6108,PMID19185845,PMCIDPMC2667107,DOI10.1016/j.ccr.2009.01.001,lire en ligne,consulté le)
- (en)MarenFeist,PhilippSchwarzfischer,PaulHeinrichet XueniSun,«Cooperative STAT/NF-κB signaling regulates lymphoma metabolic reprogramming and aberrant GOT2 expression»,Nature Communications,vol.9,no1,,p.1514(ISSN2041-1723,PMID29666362,PMCIDPMC5904148,DOI10.1038/s41467-018-03803-x,lire en ligne,consulté le)
- MarcinKortylewski,HongXin,MaciejKujawskiet HeehyoungLee,«Regulation of the IL-23 and IL-12 Balance by Stat3 Signaling in the Tumor Microenvironment»,Cancer Cell,vol.15,no2,,p.114–123(ISSN1535-6108,PMID19185846,PMCIDPMC2673504,DOI10.1016/j.ccr.2008.12.018,lire en ligne,consulté le)
- (en)GiorgioTrinchieri,«Interleukin-12 and the regulation of innate resistance and adaptive immunity»,Nature Reviews Immunology,vol.3,no2,,p.133–146(ISSN1474-1741,DOI10.1038/nri1001,lire en ligne,consulté le)
- HeehyoungLee,AndreasHerrmann,Jie-HuiDenget MaciejKujawski,«Persistently Activated Stat3 Maintains Constitutive NF-κB Activity in Tumors»,Cancer Cell,vol.15,no4,,p.283–293(ISSN1535-6108,PMID19345327,PMCIDPMC2777654,DOI10.1016/j.ccr.2009.02.015,lire en ligne,consulté le)
- Anna Chorzalska, John Morgan, Nagib Ahsan, Diana O. Treaba, Adam J. Olszewski, Max Petersen, Nathan Kingston, Yan Cheng, Kara Lombardo, Christoph Schorl, Xiaoqing Yu, Roberta Zini, Annalisa Pacilli, Alexander Tepper, Jillian Coburn, Anita Hryniewicz-Jankowska, Ting C. Zhao, Elena Oancea, John L. Reagan, Olin Liang, Leszek Kotula, Peter J. Quesenberry, Philip A. Gruppuso, Rossella Manfredini, Alessandro Maria Vannucchi, Patrycja M. Dubielecka; Bone marrow–specific loss ofABI1induces myeloproliferative neoplasm with features resembling human myelofibrosis.Blood2018; 132 (19): 2053–2066. doi: https://doi.org/10.1182/blood-2018-05-848408
- (en)HongboWang,WeiWei,Jing-PingZhanget ZhihuiSong,«A novel model of alternative NF-κB pathway activation in anaplastic large cell lymphoma»,Leukemia,vol.35,no7,,p.1976–1989(ISSN1476-5551,PMID33184494,PMCIDPMC9245089,DOI10.1038/s41375-020-01088-y,lire en ligne,consulté le)
- (en)Jennifer FMa,Brenda JSanchez,Derek THallet Anne‐Marie KTremblay,«STAT 3 promotes IFN γ/ TNF α‐induced muscle wasting in an NF ‐κB‐dependent and IL ‐6‐independent manner»,EMBO Molecular Medicine,vol.9,no5,,p.622–637(ISSN1757-4676et1757-4684,PMID28264935,PMCIDPMC5412921,DOI10.15252/emmm.201607052,lire en ligne,consulté le)
- LukaszHuminiecki,LeonGoldovsky,ShiriFreilichet AristidisMoustakas,«Emergence, development and diversification of the TGF-βsignalling pathway within the animal kingdom»,BMC Evolutionary Biology,vol.9,no1,,p.28(ISSN1471-2148,PMID19192293,PMCIDPMC2657120,DOI10.1186/1471-2148-9-28,lire en ligne,consulté le)
- ZhikeZi,«Molecular Engineering of the TGF-β Signaling Pathway»,Journal of Molecular Biology,vol.431,no15,,p.2644–2654(ISSN0022-2836,DOI10.1016/j.jmb.2019.05.022,lire en ligne,consulté le)
- JoanMassaguéet DeanSheppard,«TGF-β signaling in health and disease»,Cell,vol.186,no19,,p.4007–4037(ISSN0092-8674,PMID37714133,PMCIDPMC10772989,DOI10.1016/j.cell.2023.07.036,lire en ligne,consulté le)
- Sanford DMarkowitzet Anita BRoberts,«Tumor suppressor activity of the TGF-β pathway in human cancers»,Cytokine & Growth Factor Reviews,vol.7,no1,,p.93–102(ISSN1359-6101,DOI10.1016/1359-6101(96)00001-9,lire en ligne,consulté le)
- MichaelReiss,«TGF-β and cancer»,Microbes and Infection,vol.1,no15,,p.1327–1347(ISSN1286-4579,DOI10.1016/S1286-4579(99)00251-8,lire en ligne,consulté le)
- EricTu,Cheryl P.Z.Chia,WeiweiChenet DunfangZhang,«T Cell Receptor-Regulated TGF-β Type I Receptor Expression Determines T Cell Quiescence and Activation»,Immunity,vol.48,no4,,p.745–759.e6(ISSN1074-7613,PMID29669252,PMCIDPMC5911925,DOI10.1016/j.immuni.2018.03.025,lire en ligne,consulté le)
- (en)SuntaekHong,SeunghwanLim,Allen G.Liet ChanLee,«Smad7 binds to the adaptors TAB2 and TAB3 to block recruitment of the kinase TAK1 to the adaptor TRAF2»,Nature Immunology,vol.8,no5,,p.504–513(ISSN1529-2916,DOI10.1038/ni1451,lire en ligne,consulté le)
- HuiWang,Jian-QingPan,LunLuoet Xin-jieNing,«NF-κB induces miR-148a to sustain TGF-β/Smad signaling activation in glioblastoma»,Molecular Cancer,vol.14,no1,,p.2(ISSN1476-4598,PMID25971746,PMCIDPMC4429406,DOI10.1186/1476-4598-14-2,lire en ligne,consulté le)
- (en)LibingSong,LipingLiu,ZhiqiangWuet YunLi,«TGF-β induces miR-182 to sustain NF-κB activation in glioma subsets»,The Journal of Clinical Investigation,vol.122,no10,,p.3563–3578(ISSN0021-9738,PMID23006329,PMCIDPMC3589141,DOI10.1172/JCI62339,lire en ligne,consulté le)
- RaffaeleStrippoli,IgnacioBenedicto,MiguelForondaet Maria LuisaPerez-Lozano,«p38 maintains E-cadherin expression by modulating TAK1–NF-κB during epithelial-to-mesenchymal transition»,Journal of Cell Science,vol.123,no24,,p.4321–4331(ISSN1477-9137et0021-9533,DOI10.1242/jcs.071647,lire en ligne,consulté le)
- ChaoYin,ZhishuaiYe,JianWuet Chen xingHuang,«Elevated Wnt2 and Wnt4 activate NF-κB signaling to promote cardiac fibrosis by cooperation of Fzd4/2 and LRP6 following myocardial infarction»,eBioMedicine,vol.74,,p.103745(ISSN2352-3964,PMID34911029,PMCIDPMC8669316,DOI10.1016/j.ebiom.2021.103745,lire en ligne,consulté le)
- (en)Klaus P.Hoeflich,JuanLuo,Elizabeth A.Rubieet Ming-SoundTsao,«Requirement for glycogen synthase kinase-3β in cell survival and NF-κB activation»,Nature,vol.406,no6791,,p.86–90(ISSN1476-4687,DOI10.1038/35017574,lire en ligne,consulté le)
- (en)JiaqiLiu,QingXiao,JianiXiaoet ChenxiNiu,«Wnt/β-catenin signalling: function, biological mechanisms, and therapeutic opportunities»,Signal Transduction and Targeted Therapy,vol.7,no1,,p.1–23(ISSN2059-3635,PMID34980884,PMCIDPMC8724284,DOI10.1038/s41392-021-00762-6,lire en ligne,consulté le)
- Autophagy and NF-κB signalling pathways in cancer cells
- Immunobiologie, Éditions De Boeck, 2009 - page 345.
- ^ Monaco C, Andreakos E, Kiriakidis S, Mauri C, Bicknell C, Foxwell B, Cheshire N, Paleolog E, Feldmann M (April 2004). "Canonical pathway of nuclear factor kappa B activation selectively regulates proinflammatory and prothrombotic responses in human atherosclerosis". Proc. Natl. Acad. Sci. U.S.A. 101 (15): 5634–9. doi:10.1073/pnas.0401060101. PMC 397455.
- Hoesel, Bastian; Schmid, Johannes A..The complexity of NF-κB signaling in inflammation and cancer.Molecular Cancer,201312:86
- (en)N.Perkinset T.Gilmore,«Good cop, bad cop: the different faces of NF-kappaB»,Cell Death Differ.,vol.13,no5,,p.759–772(PMID16410803,DOI10.1038/sj.cdd.4401838)
- NanWang,HongweiLianget KeZen,«Molecular Mechanisms That Influence the Macrophage M1–M2 Polarization Balance»,Frontiers in Immunology,vol.5,(ISSN1664-3224,PMID25506346,PMCIDPMC4246889,DOI10.3389/fimmu.2014.00614,lire en ligne,consulté le)
- CarolWard,Edwin R.Chilvers,Mark F.Lawsonet James G.Pryde,«NF-κB Activation Is a Critical Regulator of Human Granulocyte Apoptosis in Vitro»,Journal of Biological Chemistry,vol.274,no7,,p.4309–4318(ISSN0021-9258,DOI10.1074/jbc.274.7.4309,lire en ligne,consulté le)
- (en)SteveGerondakis,Thomas S.Fulford,Nicole L.Messinaet Raelene J.Grumont,«NF-κB control of T cell development»,Nature Immunology,vol.15,no1,,p.15–25(ISSN1529-2916,DOI10.1038/ni.2785,lire en ligne,consulté le)
- (en)ElizabethKoppet SankarGhosh,«Inhibition of NF-κB by Sodium Salicylate and Aspirin»,Science,vol.265,no5174,,p.956–959(ISSN0036-8075et1095-9203,DOI10.1126/science.8052854,lire en ligne,consulté le)
- (en)Min-JeanYin,YumiYamamotoet Richard B.Gaynor,«The anti-inflammatory agents aspirin and salicylate inhibit the activity of IκB kinase-β»,Nature,vol.396,no6706,,p.77–80(ISSN1476-4687,DOI10.1038/23948,lire en ligne,consulté le)
- DanLiao,LiZhong,TingmeiDuanet Ru-HuaZhang,«Aspirin Suppresses the Growth and Metastasis of Osteosarcoma through the NF-κB Pathway»,Clinical Cancer Research,vol.21,no23,,p.5349–5359(ISSN1078-0432et1557-3265,DOI10.1158/1078-0432.ccr-15-0198,lire en ligne,consulté le)
- MitaliChattopadhyay,RavinderKodela,NiharikaNathet ArpineBarsegian,«Hydrogen sulfide-releasing aspirin suppresses NF-κB signaling in estrogen receptor negative breast cancer cells in vitro and in vivo»,Biochemical Pharmacology,vol.83,no6,,p.723–732(ISSN0006-2952,DOI10.1016/j.bcp.2011.12.019,lire en ligne,consulté le)
- (en)JianghuaShao,ToshiyoshiFujiwara,YoshihikoKadowakiet TakuyaFukazawa,«Overexpression of the wild-type p53 gene inhibits NF-κB activity and synergizes with aspirin to induce apoptosis in human colon cancer cells»,Oncogene,vol.19,no6,,p.726–736(ISSN1476-5594,DOI10.1038/sj.onc.1203383,lire en ligne,consulté le)
- (en)BetsyFrantzet Edward A.O'Neill,«The Effect of Sodium Salicylate and Aspirin on NF-κB»,Science,vol.270,no5244,,p.2017–2018(ISSN0036-8075et1095-9203,DOI10.1126/science.270.5244.2017,lire en ligne,consulté le)
- Phuong Oanh T. Tran, Catherine E. Gleason, R. Paul Robertson; Inhibition of Interleukin-1β-Induced COX-2 and EP3 Gene Expression by Sodium Salicylate Enhances Pancreatic Islet β-Cell Function.Diabetes1 June 2002; 51 (6): 1772–1778. https://doi.org/10.2337/diabetes.51.6.1772
- (en)ColinRae,SusanaLanga,Steven J.Tuckeret David J.MacEwan,«Elevated NF-κB responses and FLIP levels in leukemic but not normal lymphocytes: reduction by salicylate allows TNF-induced apoptosis»,Proceedings of the National Academy of Sciences,vol.104,no31,,p.12790–12795(ISSN0027-8424et1091-6490,PMID17646662,PMCIDPMC1937545,DOI10.1073/pnas.0701437104,lire en ligne,consulté le)
- (en)PeterGoldmanet Mark A.Peppercorn,«Sulfasalazine»,New England Journal of Medicine,vol.293,no1,,p.20–23(ISSN0028-4793et1533-4406,DOI10.1056/NEJM197507032930105,lire en ligne,consulté le)
- (en)AmirRashidian,AhadMuhammadnejad,Ahmad-RezaDehpouret Shahram EjtemaiMehr,«Atorvastatin attenuates TNBS-induced rat colitis: the involvement of the TLR4/NF-kB signaling pathway»,Inflammopharmacology,vol.24,no2,,p.109–118(ISSN1568-5608,DOI10.1007/s10787-016-0263-6,lire en ligne,consulté le)
- JingSu,FeiLiu,MeihuiXiaet YeXu,«p62 participates in the inhibition of NF-κB signaling and apoptosis induced by sulfasalazine in human glioma U251 cells»,Oncology Reports,vol.34,no1,,p.235–243(ISSN1021-335X,DOI10.3892/or.2015.3944,lire en ligne,consulté le)
- (en)RachelEyre,Denis G.Alférez,AngélicaSantiago-Gómezet KathSpence,«Microenvironmental IL1β promotes breast cancer metastatic colonisation in the bone via activation of Wnt signalling»,Nature Communications,vol.10,no1,,p.5016(ISSN2041-1723,PMID31676788,PMCIDPMC6825219,DOI10.1038/s41467-019-12807-0,lire en ligne,consulté le)
- StevenTimmermans,JolienSouffriauet ClaudeLibert,«A General Introduction to Glucocorticoid Biology»,Frontiers in Immunology,vol.10,(ISSN1664-3224,PMID31333672,PMCIDPMC6621919,DOI10.3389/fimmu.2019.01545,lire en ligne,consulté le)
- YanaGe,YeXu,WenjingSunet ZhaozhaoMan,«The molecular mechanisms of the effect of Dexamethasone and Cyclosporin A on TLR4 /NF-κB signaling pathway activation in oral lichen planus»,Gene,vol.508,no2,,p.157–164(ISSN0378-1119,DOI10.1016/j.gene.2012.07.045,lire en ligne,consulté le)
- Jayne A.Keifer,Denis C.Guttridge,Brian P.Ashburneret Albert S.Jr.Baldwin,«Inhibition of NF-κB Activity by Thalidomide through Suppression of IκB Kinase Activity»,Journal of Biological Chemistry,vol.276,no25,,p.22382–22387(ISSN0021-9258,DOI10.1074/jbc.m100938200,lire en ligne,consulté le)
- Jin, S. H., Kim, T. I., Han, D. S., Shin, S. K. & Kim, W. H. Thalidomide suppresses the interleukin 1beta-induced NFkappaB signaling pathway in colon cancer cells.Ann. N. Y Acad. Sci.973,414–418 (2002).
- MengtingChen,HongfuXie,ZhaohuiChenet SanXu,«Thalidomide ameliorates rosacea-like skin inflammation and suppresses NF-κB activation in keratinocytes»,Biomedicine & Pharmacotherapy,vol.116,,p.109011(ISSN0753-3322,DOI10.1016/j.biopha.2019.109011,lire en ligne,consulté le)
- Yi-ChuLin,Chia-TungShun,Ming-ShiangWuet Ching-ChowChen,«A Novel Anticancer Effect of Thalidomide: Inhibition of Intercellular Adhesion Molecule-1–Mediated Cell Invasion and Metastasis through Suppression of Nuclear Factor-κB»,Clinical Cancer Research,vol.12,no23,,p.7165–7173(ISSN1078-0432et1557-3265,DOI10.1158/1078-0432.ccr-06-1393,lire en ligne,consulté le)
- (en)Jason M.Hansenet CraigHarris,«A Novel Hypothesis for Thalidomide-Induced Limb Teratogenesis: Redox Misregulation of the NF-κB Pathway»,Antioxidants & Redox Signaling,vol.6,no1,,p.1–14(ISSN1523-0864et1557-7716,DOI10.1089/152308604771978291,lire en ligne,consulté le)
- (en)MaxJan,Adam S.Sperlinget Benjamin L.Ebert,«Cancer therapies based on targeted protein degradation — lessons learned with lenalidomide»,Nature Reviews Clinical Oncology,vol.18,no7,,p.401–417(ISSN1759-4782,PMID33654306,PMCIDPMC8903027,DOI10.1038/s41571-021-00479-z,lire en ligne,consulté le)
- VenumadhavKotla,SwatiGoel,SangeetaNischalet ChristophHeuck,«Mechanism of action of lenalidomide in hematological malignancies»,Journal of Hematology & Oncology,vol.2,no1,,p.36(ISSN1756-8722,PMID19674465,PMCIDPMC2736171,DOI10.1186/1756-8722-2-36,lire en ligne,consulté le)
- (en)I.Breitkreutz,M. S.Raab,S.Valletet T.Hideshima,«Lenalidomide inhibits osteoclastogenesis, survival factors and bone-remodeling markers in multiple myeloma»,Leukemia,vol.22,no10,,p.1925–1932(ISSN1476-5551,DOI10.1038/leu.2008.174,lire en ligne,consulté le)
- (en)John G.Gribben,NathanFowleret FranckMorschhauser,«Mechanisms of Action of Lenalidomide in B-Cell Non-Hodgkin Lymphoma»,Journal of Clinical Oncology,vol.33,no25,,p.2803–2811(ISSN0732-183Xet1527-7755,PMID26195701,PMCIDPMC5320950,DOI10.1200/JCO.2014.59.5363,lire en ligne,consulté le)
Voir aussi
[modifier|modifier le code]Bibliographie
[modifier|modifier le code]- (en)SilviaPereiraet FionaOakley,«Nuclear factor-kappaB1: regulation and function»,Int. J. Biochem. Cell Biol.,vol.40,no8,,p.1425–1430(PMID17693123,DOI10.1016/j.biocel.2007.05.004)
