Complexo maior de histocompatibilidade
Ocomplexo maior de histocompatibilidade(CMH), abreviado xeralmente comoMHC(do seu nome en inglés,major histocompatibility complex) e tamén chamado nalgunhas fontescomplexo principal de histocompatibilidade[1],é unha molécula proteica da superficie celular codificada por unha granfamilia de xenespresente en todos osvertebrados,que é fundamental para o funcionamento dosistema inmunitario.As proteínas MHC median as interaccións entre os distintosleucocitos,que son as células inmunitarias, e entre estes e outras células. O MHC é fundamental para apresentación de antíxenosque activa o sistema inmunitario, e determina a compatibilidade entre doante e receptor notransplante de órganos,e a susceptibilidade de sufrir unhaenfermidade autoinmuneporinmunizaciónpor reacción cruzada.
Por razóns históricas, nos humanos o MHC tamén se chama "antíxeno leucocitario humano"ouHLA(human leukocyte antigen). Nos humanos, os xenes MHC forman o denominado sistema HLA, porque estas proteínas se descubriron comoantíxenosnos leucocitos, que podían detectarse conanticorpos.
Na presentación do antíxeno primeiro as proteínas que entran no corpo e as propias da célula son procesadas dentro da célula e divididas, e un fragmento delas (epítopo) será exposto (presentado) na superficie celular unido ás moléculas do MHC, onde pode ser recoñecido poloslinfocitos.[2]O antíxeno presentado pode ser recoñecido como "propio" ou "non propio".
A familia de xenes MHC divídese en tres subgrupos ou clases: clase I, clase II, e clase III. A diversidade observada na presentación dos antíxenos, que está mediada polos MHC das clases I e II, conséguese de múltiples maneiras: (1) a codificación xenética dos MHC épolixénica,(2) os xenes MHC son moi polimórficos e teñen moitas variantes oualelos,(3) varios xenes MHC exprésanse a partir dos dous alelos que se herdaron.
O MHC na inmunidade animal
[editar|editar a fonte]Das tres clases de MHC identificadas, as máis importantes nos humanos son as das clases I e II. OMHC de clase IImedia ainmunidadea un antíxeno específica de inmunización. OMHC de clase Imedia a destrución das células hóspede que leven ese antíxeno.
Algúnsleucocitosmaduros da liñaxe doslinfocitosresidentes en tecidos linfoides periféricos, como osganglios linfáticos,levan receptores que se unen ao MHC. Co MHC interaccionan ascélulas T,que son linfocitos que interveñen nainmunidade específica,e ascélulas asasinas naturaisou NK, que son linfocitos que actúan de formainnata.Cando a expresión dos MHC de clase I é baixa en conxunto, o que suxire un funcionamento anormal, as células NK estimulan amorte celular programadada célula. (Ascélulas B,que son os outros linfocitos que median na inmunidade específica,segregananticorpos,pero non se ligan ao MHC.)
Aínda que oMHC de clase IIpode expresarse condicionalmente en todos os tipos celulares, o normal é que só apareza nascélulas presentadoras de antíxenos"profesionais", como son:macrófagos,células B,e especialmentecélulas dendríticas.Unha célula presentadora de antíxenos capta unantíxeno,realiza o procesamento do antíxeno no que este é dividido en cachos, e devolve un fragmento da molécula do antíxeno (o epitotpo) á superficie da célula presentadora unido a unha molécula do MHC de clase II. O MHC de clase II realiza así apresentación do antíxenoque está unido a el. Na presentación ten lugar un dobre contacto: os receptoresCD4que levan na súa superficie ascélulas T axudantesvirxesúnense ao MHC de clase II, mentres que o epítopo unido á molécula do MHC de clase II se une aoreceptor de células T(TCR) da célula T axudantevirxe.A célula T axudante pode ser de tipo 1 (Th1), tipo 2 (Th2), tipo 17 (Th17), ou de fenotipo regulatorio (Treg). Deste modo o MHC de clase II media a inmunización para un determinado antíxeno ou, se intervén un linfocito Treg, media ainmunotolerancia.
OsMHC de clase Iaparecen en todas as células nucleadas do corpo (basicamente todas menos osglóbulos vermellos,que perden o núcleo durante a súa maduración, e non os presentan ou só moi escasamente[3]). O MHC de clase I fai a presentación de epítopos áscélulas T citotóxicas,tamén chamadas células T asasinas, que expresan a moléculaCD8.Cando o seu CD8 se une ao MHC de clase I, se o seuTCRrecoñece o epítopo que encaixa con el, a célula T asasina induce aapoptoseda célula. Así, o MHC de clase I media nainmunidade celular.(As células B expresan o MHC de clase II para presentar o antíxeno alinfocitos Th0,pero cando o seureceptor de células Bse une ao epítopo que encaixa con el (interacción na que non media o MHC), a célula B activada segregainmunoglobulinassolubles, é dicir,anticorpos,dos que depende ainmunidade humoral.)
Xenes MHC
[editar|editar a fonte]A rexión do brazo curto do cromosoma 6 humano que contén os xenes do MHC posúe a información que codifica o seguinte:
- certasglicoproteínasda membrana plasmática implicadas nos mecanismos de presentación e procesamento de antíxenos aos linfocitos T chamadas α e β. Agrúpanse nos xenes de clase II (que codifican as proteínas MHC-II) e os xenes de clase I (que codifican as proteínas MHC-I)
- citocinas e proteínas do sistema do complemento, importantes na resposta inmunolóxica, mais que non teñen nada que ver cos xenes do MHC; estes xenes agrúpanse na clase III.
Ambos os tipos de moléculas participan na resposta inmunitaria, que permite a identificación das moléculas propias e das estrañas (invasoras), para eliminar estas últimas mediante diferentes mecanismos.
Encóntranse familias de xenes MHC en todos osvertebrados,aínda que a súa cantidade varía amplamente, e asgaliñasteñen o menor número coñecido de rexións MHC (19 xenes). Noshumanosa rexión MHC está situada nocromosoma 6,entre osmarcadores xenéticosMOG e COL11A2 (desde 6p22.1 a 6p21.3 ~29Mb a 33Mb no conxunto hg19), e contén 140 xenes que ocupan 3,6 megapares de bases(3,6 Mb ou 3 600 000 bases).[4]Arredor da metade teñen funcións inmunitarias coñecidas.
Os mesmos marcadores noopóssumMonodelphis domestica,unmarsupial,esténdense 3,95 Mb e teñen 114 xenes, 87 deles compartidos cos humanos.[5]A variación xenotípica do MHC marsupial é intermedia entre a dosmamíferos euteriose a dasaves,pero é máis próxima en organización á dos non mamíferos, e os xenes do MHC de clase I dos marsupiais sufriron unhaamplificaciónna rexión da clase II, orixinando unha rexión clase I/II única.[5]
A clase III funciona de xeito moi diferente das outras dúas clases, pero o seulocusxenético está entre os das outras dúas clases (nos humanos no cromosoma 6) e xeralmente se trata deles en conxunto.
| Clase | Codificación | Expresión |
| I | (1) proteínas de unión ao péptido, que seleccionan secuencias curtas deaminoácidospara apresentación do antíxeno,e (2) moléculas que axudan noprocesamento do antíxeno(como oTAPe atapasina). | Unha cadea, chamada α, cuxosligandosson o receptorCD8(que levan ascélulas T citotóxicas) e receptores inhibitorios que levan ascélulas NK. |
| II | (1) proteínas de unión ao péptido e (2) proteínas que axudan a cargar o antíxeno nas proteínas de unión ao péptido do MHC de clase II (comoMHC II DM,MHC II DQ,MHC II DR,eMHC II DP). | Dúas cadeas, chamadas α e β, cuxos ligandos son os receptoresCD4que levan ascélulas T axudantes. |
| III | Outras proteínas inmunitarias que non interveñen no procesamento e presentación do antíxeno, como os compoñentes dosistema do complemento(por exemplo,C2,C4,factor B), ascitocinasde sinalización inmunitaria (como oTNF-α), eproteínas de choque térmicoque protexen as células dos estreses. | Varias. |
Proteínas MHC
[editar|editar a fonte]As proteínas MHC teñen unha estrutura similar á dasinmunoglobulinas.Poden ser:

Clase I
[editar|editar a fonte]- Artigo principal:MHC de clase I.
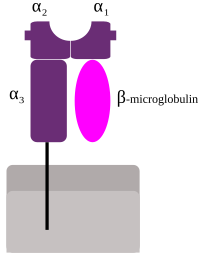
O MHC I é unhaglicoproteínachamada cadea α que está unida á pequena proteína β2 microglobulina. A cadea α está composta por tres dominios: α1, α2, α3. O α1 está situado sobre aβ2 microglobulina(que non é unha proteína de tipo MHC e está codificada nocromosoma 15 humano). A subunidade α3 é transmembrana, e mantén ancorado o MHC de clase I ámembrana plasmática.O péptido que vai ser presentado é sostido polo fondo da fenda ousuco de unión ao péptido,na rexión central doheterodímeroα1/α2. A secuencia xeneticamente codificada e expresada de aminoácidos, do fondo do suco de unión ao péptido é a que determina os péptidos específicos que se poden unir alí.[6]
Asmoléculas MHC clásicaspresentan os epítopos aosTCRsdoslinfocitos T CD8+.Asmoléculas non clásicas(MHC de clase IB) mostran limitadospolimorfismo,patróns de expresión, e de antíxenos presentados; este grupo subdivídese nun grupo codificado noslociMHC (comoHLA-E,-F,-G) e noutros que non (comoligandos de estréscomo ULBPs, Rae1, H60); o antíxeno/ligando para moitas destas moléculas non se coñece, pero poden interaccionar tanto concélulas T CD8+coma concélulas NKTecélulas NK.
Clase II
[editar|editar a fonte]- Artigo principal:MHC de clase II.
O MHC de clase II está formado por dúas cadeas, α e β, cada unha das cales ten dous dominios, chamados α1 e α2 e β1 e β2, respectivamente, e cada cadea ten un dominio transmembrana, o α2 e o β2, que mantén ancorada a molécula do MHC de clase II á membrana plasmática.[7]Ambas as dúas songlicoproteínas.O suco de unión ao péptido está formado por un heterodímero de α1 e β1.
As moléculas do MHC de clase II humanas teñen de 5 a 6 isotipos. Asmoléculas clásicasfan a presentación de péptidos alinfocitos CD4+.Asmoléculas non clásicas,accesorias e con funcións intracelulares, non están expostas nas membranas plasmáticas, senón en membranas internas noslisosomas,normalmente cargan os péptidos antixénicos nas moléculas MHC de clase II clásicas.
Clase III
[editar|editar a fonte]As moléculas de clase III teñen funcións fisiolóxicas, a diferenza das clases I e II, pero están codificadas entre elas no brazo curto docromosoma 6 humano.As moléculas de clase III inclúen varias proteínas segregadas con funcións inmunes: compoñentes dosistema do complemento(como C2, C4, e factor B),citocinas(comoTNF-α,LTA,LTB), eproteínas de choque térmico(hsp).
Presentación e procesamento do antíxeno
[editar|editar a fonte]
Os péptidos son procesados e presentados utilizando dúas rutas clásicas:
- NosfagocitosconMHC de clase IIcomo osmacrófagosecélulas dendríticasinmaturas cáptanse elementos externos porfagocitosee son introducidos enfagosomas(pero ascélulas Butilizan a forma máis xeral deendocitoseenendosomas), que se fusionan conlisosomascuxos encimas que funcionan apHácido clivan as proteínas captadas dividíndoas en moitos péptidos. Por medio dedinámica fisicoquímicana interacción molecular con determinadas variantes do MHC de clase II que ten o hóspede (codificados no xenoma do hóspede) un determinado péptido mostraráinmunodominanciae será cargado na molécula do MHC de clase II. Estes péptidos son levados e expostos no exterior na superficie celular.[8]
- No caso doMHC de clase Icalquera célula nucleada presentará normalmente péptidos citosólicos, principalmente péptidospropiosderivados do recambio das proteínas da célula e de produtos ribosómicos defectuosos. Durante as infeccións virais, as infeccións por microorganismos intracelulares, ou nas transformacións canceríxenas, estas proteínas son degradadas noproteasomae son tamén cargadas nas moléculas do MHC de clase I e expostas na superficie celular. Para que os linfocitos T poidan detectar un péptido exposto na superficie celular abonda con que só estea unido a do 0,1% ao 1% das moléculas MHC.
| Características | Ruta MHC-I | Ruta MHC-II |
|---|---|---|
| Composición do complexo péptido-MHC estable | Cadea α polimórfica e β2 microglobulina, péptido unido á cadea α | Cadeas α e β polimórficas, o péptido únese a ambas as dúas |
| Tipos decélulas presentadoras do antíxeno(APC) | Todas as células nucleadas | células dendríticas,fagocitosmononucleares,linfocitos B,algunhascélulas endoteliais,epiteliodotimo |
| Linfocitos T capaces de responder | linfocitos T citotóxicos(CD8+) | linfocitos T axudantes(CD4+) |
| Orixe das proteínas antixénicas | Proteínas citosólicas (principalmente sintetizadas pola célula); poden tamén entrar desde o medio extracelular por medio defagosomas | Proteínas presentes enendosomasoulisosomas(principalmente internalizadas desde o medio extracelular) |
| Encimasresponsables da xeración de péptidos | Proteasomacitosólico | Proteasesdos endosomas e lisosomas (por exemplo,catepsina) |
| Localización da carga do péptido na molécula MHC | Retículo endoplasmático | Compartimentos vesiculares especializados |
| Moléculas implicadas no transporte de péptidos e na súa carga nas moléculas MHC | Transportador asociado co procesamento do antíxeno(TAP) | DM, cadea invariante |
Restrición no recoñecemento dos linfocitos T
[editar|editar a fonte]No seu desenvolvemento notimo,os linfocitos T son seleccionados para recoñeceren moléculas do MHC do hóspede pero non para recoñecer outros antíxenos propios. Despois da selección, cada linfocito T mostra unha especificidade dual: o receptor de células T (TCR) recoñece os MHCpropiospero só osantíxenosnon propios.
A restrición do MHC ocorre durante o desenvolvemento do linfocito no timo por medio dun proceso chamado selección posititva. As células T poden agora recibir un sinal positivo de supervivencia mediado principalmente por células epiteliais do timo que lles presentan péptidospropiosunidos a moléculas do MHC. Os linfocitos T que non reciben este sinal no seureceptor de células T(TCR) sofrenapoptose.A selección positiva asegura que as células T maduras poden recoñecer funcionalmente moléculas do MHC na periferia (é dicir noutras partes do corpo, fóra do timo).
Os TCRs dos linfocitos T recoñecen sóepítopos secuenciais,tamén chamadosepítopos lineares,soamente de péptidos e soamente se están acoplados ás moléculas do MHC. (Por outra parte, osanticorpossegregados polascélulas B activadasúnense a diversos epítopos, comopeptidos,lípidos,carbohidratos,eácidos nucleicos,e recoñecenepítopos conformacionais,os cales teñen unha estrutura tricimensional.)
O MHC na selección da parella sexual
[editar|editar a fonte]As moléculas do MHC fan posible que osistema inmunitarioexerza unha vixilancia sobre o conxunto de moléculas proteicas da célula hóspede, e unha maior diversidade do MHC permitirá unha maior diversidade napresentación do antíxeno.En 1976 Yamazakiet aldemostraron que existía unha preferencia dosratosmacho a elixir para o apareamento a femias con distintos MHC. Obtivéronse resultados similares con especies depeixes[9]eaves.[10]Algúns datos sinalan que hai menores taxas deabortos espontáneosen parellas humanas con xenes MHC diferentes.[11]
Propúxose que o MHC está relacionado coa elección de parella nalgunhas poboacións humanas, unha teoría que está apoiada en estudos feitos por Ober e colegas en 1997,[12]e por Chaix e colegas en 2008.[13]O fenómeno podería estar mediado poloolfacto,xa que ofenotipoMHC parece estar moi implicado na forza e sensación pracenteira dos compostos olorosos percibidos presentes nasuor.Osésteresdeácidos graxos,como ometil undecanoato,metil decanoato,metil nonanoato,metil octanoatoemetil hexanoato,que forman parte dos olores corporais, mostran unha forte conexión co MHC.[14]
En 1995Claus Wedekindencontrou que nun grupo de mulleres estudantes universitarias ás que se lle fixo cheirar camisetas suadas usadas por estudantes masculinos durante dúas noites (sen desodorizante, colonias ou xabóns aromáticos), estas, con grande diferenza, elixían camisetas que foran usadas por homes con MHCs diferentes, unha preferencia que se invertía se as mulleres estaban tomandocontraceptivos orais.[15]Os resultados dun experimento de 2002 suxiren igualmente que os cheiros asociados cos alelos HLA (outra denominación do MHC) inflúen na preferencia polo olor e poden mediar sinais sociais.[16]En 2005 nun grupo de 58 suxeitos, as mulleres estaban máis indecisas cando se lles presentaba a homes con MHCs iguais aos seus,[17]aínda que se tomaban contraceptivos orais as mulleres mostraron preferencia polos MHC similares aos seus, e se non os tomaban non mostraban ningunha preferencia especial.[18]
O MHC e a diversidade evolutiva
[editar|editar a fonte]A maioría dosmamíferosteñen variantes do MHC similares ás dos humanos, os cales posúen unha gran diversidadealélicapara eses xenes, especialmente entre os nove xenes clásicos (seguramente debido en grande medida aduplicación xénica), aínda que as rexións MHC humanas teñen moitospseudoxenes.Oslocimáis diversos, principalmente HLA-A, HLA-B, e HLA-DRB1, teñen aproximadamente 1000, 1600, e 870 alelos coñecidos, respectivamente. Moitos alelos HLA son antigos, ás veces con maior homoloxía cos dochimpancéque con algúns outros alelos humanos do mesmo xene.
A explicación da gran diversidade alélica do MHC foi un reto para osbiólogos evolutivos.A maioría postulan unhaselección balanceada(verpolimorfismo (bioloxía)), que é un proceso deselección naturalna que ningún alelo único é considerado de forma absoluta como o máis vantaxoso, tal como aselección dependente da frecuenciae avantaxe do heterocigoto.Modelos recentes suxiren que non é posible manter un alto número de alelos só por vantaxe dosheterocigotos.
Unha contrahipótese é acoevoluciónpatoxénica, que postula que os alelos comúns son os que están baixo a maior presión patoxénica, orixinándose por este motivo unha selección positiva de alelos raros, que son brancos máis difíciles para os patóxenos. A medida que decrece a presión patoxénica sobre os alelos que previamente eran comúns, a súa frecuencia na poboación estabilízase, e permanecen circulando nunha ampla poboación. A pesar do gran polimorfismo do MHC a nivel de poboación, un individuo leva como moito 18 alelos MHC I ou MHC II.
Observouse unha diversidade relativamente baixa do MHC noguepardo(Acinonyx jubatus),[19]nocastor(Castor fiber),[20]e nopanda xigante(Ailuropoda melanoleuca).[21]En 2007 atribuíuselle á baixa diversidade do MHC un papel na susceptibilidade á enfermidade dodemo de Tasmania(Sarcophilus harrisii), nativo da illa deTasmania,que ten como consecuencia que un antíxeno dun tumor transmisible, implicado naenfermidade tumoral facial do demo,parece que é recoñecido como unantíxeno propio.[22]Para compensar aendogamia,suxeriuse facer esforzos para manter a diversidade xenética nas poboacións de especies en perigo e de animais en catividade.
O MHC no rexeitamento de transplantes
[editar|editar a fonte]Nostransplantes de órganos,tecidos ecélulas naié importante controlar os tipos de moléculas MHC de doante e receptor, xa que debido á variabilidade que teñen xeralmente non coinciden. As moléculas do MHC actúan comoantíxenose poden provocar respostas inmunitarias no receptor, o que orixina o rexeitamento do transplante. As moléculas MHC foron identificadas e nomeadas polo seu papel no rexeitamento dos transplantes de órganos entre ratos de distintas cepas, aínda que se tardou uns 20 anos en comprender o papel do MHC na presentación dos antíxenos peptídicos aoslinfocitos T citotóxicos.[23]
Todas as células humanasexpresanseisalelosMHC de clase I(un aleloHLA-A,-B,e-Cde cada proxenitor) e de seis a oito alelosMHC de clase II(un aleloHLA-DPe-DQ,e un ou dousHLA-DRde cada proxenitor, e combinacións deles). A variación no MHC nas poboacións humanas é alta, e hai polo menos 350 alelos para os xenes HLA-A, 620 alelos para os HLA-B, 400 alelos para DR, e 90 para DQ. Dúas persoas calquera que non sexan xemelgos idénticos expresan diferentes moléculas MHC. Todas as moléculas MHC poden mediar no rexeitamento de transplantes, pero oHLA-Ce oHLA-DPson menos importantes porque mostran un baixo polimorfismo.
Cando maduran notimo,oslinfocitos Tson seleccionados segundo a capacidade dos seus receptores de superficie característicos (receptor de células Tou TCR) de recoñecerantíxenos propios.Porén, os linfocitos T poden reaccionar contra osuco de unión ao péptidodos MHC do doante, a rexión variable do MHC onde leva oepítopodo antíxeno presentado para o recoñecemento do TCR, que é oparátopoque encaixa con el. Os linfocitos T do receptor consideran o suco de unión ao péptido incompatible como unantíxeno non propio.O recoñecemento polos linfocitos T dos MHC alleos como propios denomínasealorrecoñecemento.
O rexeitamento de transplantes pode ser de dous tipos, que están mediados polo MHC (HLA):
- Rexeitamento hiperagudo.Ocorre cando, antes do transplante, o receptor fabricouantiocorposanti-HLA, probablemente porque recibiu previamente transfusións de sangue (un tecido doante que contén linfocitos que expresan moléculas HLA), ou ben por xeración de anticorpos anti-HLA durante oembarazo(dirixidos aos HLA do pai expresados polo feto), ou por transplantes anteriores.
- Rexeitamento humoral agudo e disfunción crónica.Ocorre cando se forman anticorpos anti-HLA do receptor dirixidos contra as moléculas HLA presentes nascélulas endoteliaisdo tecido transplantado.
Nesas situacións, a resposta inmunitaria diríxese contra o órgano transplantado, orixinando lesións. Aproba de reacción cruzadaentre células doantes potenciais e o soro do receptor serve para detectar a presenza de anticorpos anti-HLA no receptor potencial que recoñecen as moléculas HLA do doante, o que prevén un rexeitamento hiperagudo. En circunstancias normais, avalíase a compatibilidade entre as moléculas HLA-A, -B, e -DR. Canto maior é o número de incompatibilidades, menor é a taxa de supervivencia a cinco anos. As bases de datos globais con información dos doantes facilitan a procura de doantes compatibles.
A terminoloxía HLA
[editar|editar a fonte]
Os MHC das clases I e II humanos denomínanse taménantíxeno leucocitario humano(HLA). Para clarificar o uso, parte da literatura biomédica utiliza o HLA para referirse especificamente ás molécula proteicas HLA e reserva o acrónimo MHC para a rexión doxenomaque codifica esta molécula, pero isto non é unha convención consistente.
OsxenesHLA máis intensamente estudados son os nove chamados xenes MHC clásicos:HLA-A,HLA-B,HLA-C,HLA-DPA1,HLA-DPB1,HLA-DQA1,HLA-DQB1,HLA-DRA,eHLA-DRB1.Nos humanos, o MHC está dividido en tres rexións: clases I, II, e III. Os xenes A, B, C, E, F, e G pertencen aoMHC de clase I,mentres que os seis xenes D pertencen á clase II.
Os xenes MHC exprésanse de modocodominante.[7]Isto significa que osalelos(variantes) herdados de ambos os proxenitores se expresan dun modo equivalente:
- Como hai 3 xenes da clase I, denominados nos humanos HLA-A, HLA-B e HLA-C, e como cada persoa herda un conxunto de xenes de cada proxenitor, todas as células dun individuo poden expresar seis tipos distintos de moléculas MHC de clase I (ver figura).
- Nolocusda clase II, cada persoa herda un par de xenes HLA-DP (DPA1 e DPA2, que codifican as cadeas α e β), un par de xenes HLA-DQ (DQA1 e DQA2, para as cadeas α e β), un xene HLA-DRα (DRA1) e un ou dous xenes HLA-DRβ (DRB1 e DRB3). Iso significa que unha persoaheterocigotapode herdar 6 ou 8 alelos da clase II, tres ou catro de cada proxenitor.
O conxunto de alelos que está presente en cadacromosomadenomínasehaplotipoMHC. Nos humanos, cada alelo HLA desígnase cun número. Por exemplo, para un individuo dado, o seu haplotipo podería ser HLA-A2, HLA-B5, HLA-DR3 etc... Cada individuo heterocigoto ten dous haplotipos MHC, un en cada cromosoma (un de orixe paterna e outro de materna).
Os xenes MHC son moi polimórficos, o que significa que hai moitos alelos distintos en cada individuo da poboación. O polimorfismo é tan alto que nunha poboación mixta (é dicir, nonendogámica) non hai dous individuos que teñan exactamente o mesmo conxunto de xenes MHC e moléculas, coa excepción dosxemelgos idénticos.
As rexións polimórficas de cada alelo están localizadas na rexión para o contacto co péptido, que será exhibida polo linfocito. Por esta razón, a rexión de contacto de cada alelo ou molécula MHC é moi variable, xa que os residuos polimórficos do MHC crean sucos ou fendas específicas nos cales só poden entrar certos tipos de péptidos. Isto impón que a unión entre a molécula do MHC e o peṕtido sexa moi específica, e isto implica que cada variante do MHC pode unirse especificamente só a aqueles péptidos que poden entrar correctamente no suco da molécula do MHC, o cal varía para cada alelo. Deste modo, as moléculas teñen unha especificidade ampla, no sentido de que poden unirse a moitos, aínda que non a todos, os tipos de péptidos posibles. Isto é unha característica esencial das moléculas MHC: Nun individuo dado, abonda con ter unhas poucas destas moléculas diferentes para poder "presentar" unha gran variedade de péptidos.
Por outra parte, dentro dunha poboación, a presenza de moitos alelos distintos asegura que haberá sempre un individuo cunha molécula do MHC específica coa capacidade de cargar o péptido correcto para recoñecer un microbio específico. Aevolucióndo polimorfismo do MHC asegura que unha poboación non sucumbirá ante a aparición dunpatóxenonovo ou mutado, porque polo menos algúns individuos poderán desenvolver unha resposta inmunitaria axeitada para derrotar ao patóxeno. As variacións nas moléculas do MHC (responsables do polimorfismo) son o resultado da herdanza de diferentes xenes para as moléculas do MHC, e non están inducidas porrecombinación,como é o caso dos receptores para os antíxenos.
Notas
[editar|editar a fonte]- ↑Bruce Alberts et al. Biología Molecular de la Célula. Omega. 1986. Páxina 1072.ISBN 84-282-0752-6.
- ↑Kimball's BiologyArquivado07 de marzo de 2018 enWayback Machine., Histocompatibility Molecules
- ↑de Villartay, JP; Rouger, P, Muller, JY, Salmon, C (1985 Jul). "HLA antigens on peripheral red blood cells: analysis by flow cytofluorometry using monoclonal antibodies.". Tissue antigens 26 (1): 12-9.PMID 3898468.
- ↑MHC Sequencing Consortium (1999). "Complete sequence and gene map of a human major histocompatibility complex".Nature401(6756): 921–923.PMID10553908.doi:10.1038/44853.
- ↑5,05,1Belov K, Deakin JE, Papenfuss AT, Baker ML, Melman SD, Siddle HV, Gouin N, Goode DL, Sargeant TJ, Robinson MD, Wakefield MJ, Mahony S, Cross JG, Benos PV, Samollow PB, Speed TP, Graves JA, Miller RD (2006)."Reconstructing an ancestral mammalian immune supercomplex from a marsupial major histocompatibility complex".PLoS Biol.4(3): e46.PMC1351924.PMID16435885.doi:10.1371/journal.pbio.0040046.
- ↑Toh H, Savoie CJ, Kamikawaji N, Muta S, Sasazuki T, Kuhara S (2000). "Changes at the floor of the peptide-binding groove induce a strong preference for proline at position 3 of the bound peptide: molecular dynamics simulations of HLA-A*0217".Biopolymers54(5): 318–27.PMID10935972.doi:10.1002/1097-0282(20001015)54:5<318::AID-BIP30>3.0.CO;2-T.
- ↑7,07,1Abbas; Lichtman A.H. (2009). "Ch.3 Antigen capture and presentation to lymphocytes".Basic Immunology. Functions and disorders of the immune system(3rd ed.). p. A.B.ISBN978-1-4160-4688-2.
- ↑Aderem A, Underhill DM (1999). "Mechanisms of phagocytosis in macrophages".Annu. Rev. Immunol.17:593–623.PMID10358769.doi:10.1146/annurev.immunol.17.1.593.
- ↑Boehm T; Zufall F (2006)."MHC peptides and the sensory evaluation of genotype".Trends Neurosci29(2): 100–107.PMID16337283.doi:10.1016/j.tins.2005.11.006.
- ↑Smith, S.B.; Webster, M.S.; Holmes, R.T. (2005)."The heterozygosity theory of extra-pair mate choice in birds: a test and a cautionary note".Journal of Avian Biology36:146–154.
- ↑Haig D (1997). "Maternal-fetal interactions and MHC polymorphism".J. Reprod. Immunol.35(2): 101–9.PMID9421795.
- ↑Ober C, Weitkamp LR, Cox N, Dytch H, Kostyu D, Elias S (1997)."HLA and mate choice in humans.".Am. J. Hum. Genet.61(3): 497–504.PMID9326314.doi:10.1086/515511.
- ↑Chaix R, Chen C, Donnelly P (2008)."Is Mate Choice in Humans MHC-Dependent?".PLoS Genetics4(9): e1000184.PMC2519788.PMID18787687.doi:10.1371/journal.pgen.1000184.
- ↑Janeš D, Klun I, Vidan-Jeras B, Jeras M, Kreft S (2010). "Influence of MHC on odour perception of 43 chemicals and body odor".Central European Journal of Biology5(3): 324–330.doi:10.2478/s11535-010-0020-6.
- ↑Wedekind C, Seebeck T, Bettens F, Paepke AJ (1995). "MHC-dependent mate preferences in humans".Proc. Biol. Sci.260(1359): 245–9.PMID7630893.doi:10.1098/rspb.1995.0087.
- ↑Jacob S, McClintock MK, Zelano B, Ober C (2002). "Paternally inherited HLA alleles are associated with women's choice of male odor".Nat. Genet.30(2): 175–9.PMID11799397.doi:10.1038/ng830.
- ↑Santos, P S; Schinemann JA, Gabardo J, Bicalho MG (2005). "New evidence that the MHC influences odor perception in humans: A study with 58 southern Brazilian students".Horm Behav.47(4): 384–388.PMID15777804.doi:10.1016/j.yhbeh.2004.11.005.
- ↑"The pill makes women pick bad mates"
- ↑Castro-Prieto A, Wachter B, Sommer S (2011)."Cheetah paradigm revisited: MHC diversity in the world's largest free-ranging population".Mol. Biol. Evol.28(4): 1455–68.PMID21183613.doi:10.1093/molbev/msq330.
- ↑Babik W, Durka W, Radwan J (2005). "Sequence diversity of the MHC DRB gene in the Eurasian beaver (Castor fiber)".Mol. Ecol.14(14): 4249–57.PMID16313590.doi:10.1111/j.1365-294X.2005.02751.x.
- ↑Zhu L, Ruan XD, Ge YF, Wan QH, Fang SG (2007)."Low major histocompatibility complex class II DQA diversity in the Giant Panda (Ailuropoda melanoleuca)".BMC Genet.8:29.PMC1904234.PMID17555583.doi:10.1186/1471-2156-8-29.
- ↑Siddle HV, Kreiss A, Eldridge MD, Noonan E, Clarke CJ, Pyecroft S, Woods GM, Belov K (2007)."Transmission of a fatal clonal tumor by biting occurs due to depleted MHC diversity in a threatened carnivorous marsupial".Proc. Natl. Acad. Sci. U.S.A.104(41): 16221–6.PMC1999395.PMID17911263.doi:10.1073/pnas.0704580104.
- ↑Abbas; Lichtman A.H. (2009). "Ch.10 Immune responses against tumors and transplant".Basic Immunology. Functions and disorders of the immune system(3rd ed.). p. A.B.ISBN978-1-4160-4688-2.
Véxase tamén
[editar|editar a fonte]Outros artigos
[editar|editar a fonte]Ligazóns externas
[editar|editar a fonte]- Molecular individualityArquivado29 de xaneiro de 2013 enWayback Machine., libro en liña.(enalemán)
- Sexual attraction is linked to MHC compatibility
- NetMHC 3.0 server— predicts binding of peptides to a number of different MHC (HLA) alleles
- T-cell Group - Cardiff University
- The story of 2YF6: A Chicken MHC[Ligazón morta]
- RCSB Protein Data Bank: Molecule of the Month - Major Histocompatibility ComplexArquivado28 de maio de 2010 enWayback Machine.
- dbMHC Home, NCBI's database of the Major Histocompatibility Complex
