Esteroide

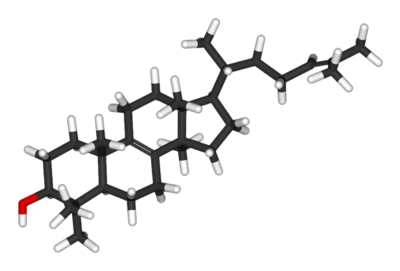
Unesteroideé uncomposto orgánicoque contén unha disposición específica de catro aneiscicloalcanosunidos, que se modifica pola unión de diversos grupos químicos (-OH, =O, -CH3,cadeas hidrocarbonadas) ou formación de dobres enlaces. Exemplos de esteroides son ocolesterol,as hormonas sexuaisestradioletestosterona,osglicocortocoides,e fármacos antiinflamatorios como adexametasona.
O esqueleto básico dos esteroides é ocilcopentanoperhidrofenantrenoouesterano,e está composto por catro aneis unidos formados en total por 17átomosdecarbono:tres son aneis deciclohexano(designados A, B, e C na figura da dereita), que en conxunto forman ofenantreno,e o outro é un anel deciclopentano(anel D). Os esteroides diferéncianse polosgrupos funcionaisunidos a este esqueleto de catro aneis e poloestado de oxidacióndos aneis. Osesteroisson un tipo especial de esteroide, que leva un grupohidroxilo(OH) en posición 3 e ten un esqueleto derivado docolestano.[1]
Existen centos de esteroides enplantas,animaisefungos.Todos os esteroides se sintetizan nas células a partir dolanosterol(en animais e fungos) ou a partir docicloartenol(en plantas). Tanto o lanosterol coma o cicloartenol derivan da ciclación dotriterpenoescualeno.[2]
Estrutura
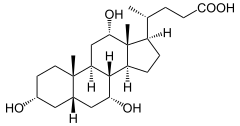
[editar|editar a fonte]Os esteroides conteñen o esqueleto doesteranoou un derivado del. Xeralmente presentan gruposmetilonos carbonos C-10 e C-13. No carbono C-17 pode haber unha cadea hidrocarbonada (alquilo)[3].Ademais pode variar a configuración dacadea laterale poden ter outros grupos metilo ou outros grupos funcionais, como o grupo hidroxilo no C-3 característico dosesteroisou gruposcarbonilo(C=O).
 |
 |
 |
 |
 |
 |
Clasificación
[editar|editar a fonte]Dentro dos lípidos os esteroides considéranse lípidosinsaponificables,xa que non conteñen ácidos graxos (coa excepción dos ésteres do colesterol). Están moi relacionados cos terpenos. Os esteroides poden clasificarse atendendo a diversos criterios.
Clasificación taxonómica/funcional
[editar|editar a fonte]Principais categorías de esteroides:
- Esteroides animais
- Esteroides deinsectos
- Ecdisteroides como aecdisteronaou aecdisona.
- Esteroides devertebrados
- Hormonas esteroides
- Os esteroides sexuais son un grupo dehormonassexuais que producen a diferenciación sexual ou axudan á función reprodutiva. Inclúen osandróxenos,estróxenos,eproxestáxenos.
- Oscorticosteroidesinclúen osglicocorticoidesemineralocorticoides.Os glicocorticoides regulan moitos aspectos dometabolismoe afunción inmunitaria,e os mineralocorticoides axudan a manter o volume sanguíneo e o controlrenalda eliminación deelectrólitos.A maioría dos esteroides de uso médico son corticosteroides.
- Osesteroides anabólicosson un tipo de esteroides que interaccionan cos receptores dos andróxenos para incrementar a formación de músculo e óso. Hai esteroides anabólicos naturais e sintéticos.
- Colesterol,que modula a fluidez dasmembranasda célula e é o principal constituínte dos depósitos nas paredes dos vasos sanguíneos implicadas naaterosclerose.
- Hormonas esteroides
- Esteroides deinsectos
- Esteroides de plantas
- Esteroides de fungos
Clasificación estrutural
[editar|editar a fonte]Tamén se poden clasificar os esteroides pola súa estrutura química. Baséanse todos no esqueleto do esterano[4].Os principais son:
| Clase | Exemplos | Número de átomos de carbono |
|---|---|---|
| Colestanos | colesterol | 27 |
| Colanos | ácido cólico | 24 |
| Pregnanos | proxesterona | 21 |
| Androstanos | testosterona | 19 |
| Estranos | estradiol | 18 |
Metabolismo
[editar|editar a fonte]Os esteroides comprenden oestróxeno,cortisol,proxesterona,etestosteronaentre outros. O estróxeno e a proxesterona prodúcense fundamentalmente noovarioe naplacentadurante o embarazo, e atestosteronanostestículos.A testosterona tamén se pode converter en estróxeno para regular a subministración de cada un deles, tanto no corpo das mulleres coma no dos homes. Certasneuronasecélulas da glíadosistema nervioso centralexpresan osencimasque se precisan para a síntese local doneuroesteroidepregnano,tanto na síntesede novocoma doutras fontes. O paso limitante da actividade de síntese de esteroides é a conversión docolesterolenpregnenolona,que ocorre dentro damitocondria.[5]

Ometabolismo de esteroidesé o conxunto de reaccións químicas no organismo que os producen, modifican, e consomen. Estasvías metabólicasinclúen:
- Biosíntese de esteroides. Fabricación de esteroides a partir de precursores máis simples.
- Esteroidoxénese. Interconversión de diferentes tipos de esteroides.
- Degradación de esteroides.
Biosíntese de esteroides
[editar|editar a fonte]Nesta vía anabólica orixínanse os esteroides a partir de precursores simples, o que se realiza de diferentes formas segundo a especie ou grupo de seres vivos, o que fai desta vía un obxectivo común no uso deantibióticose outros fármacos antiinfecciosos. Ademais, o metabolismo dos esteroides humano é a diana dos medicamentos que diminúen o nivel decolesterolcomo asestatinas.
Nos humanos a biosíntese empeza na vía domevalonato,coacetil-CoAcomo molécula básica, que formapirofosfato de dimetilaliloepirofosfato de isopentenilo.[6]Nos seguintes pasos, o pirofosfato de dimetilalilo e o pirofosfato de isopentenilo formanlanosterol,o primeiro esteroide. As seguintes modificacións pertencen xa á subseguinte esteroidoxénese.
A vía do mevalonato
[editar|editar a fonte]- Artigo principal:Vía do mevalonato.

A vía do mevalonato ou vía da hidroximetilglutaril-CoA redutase comeza e remata co pirofosfato de dimetilalilo (DMAPP) e o pirofosfato de isopentenilo (IPP).
Regulación e retroalimentación
[editar|editar a fonte]Varios encimas chave poden activarse por regulación da transcrición do ADN coa activación doSREBP(Sterol Regulatory Element-Binding Protein-1 and -2,proteínas 1 e 2 de unión ao elemento regulatorio do esterol). Este sensor intracelular detecta os niveis baixos decolesterole estimula a produción endóxena pola vía da hidroximetilglutaril-CoA redutase, e o incremento da absorción celular de lipoproteínas mediante oreceptor de membrana para as LDL(lipoproteínas de baixa densidade). A regulación desta vía tamén se consegue controlando os graos de tradución doARNm,degradación da redutase efosforilación.
Farmacoloxía
[editar|editar a fonte]Certos medicamentos alteran avía do mevalonato:
- Estatinas(usadas nahipercolesterolemia).
- Bisfosfonatos(usados no tratamento de varias doenzas dexenerativas dosósos).
Plantas e bacterias
[editar|editar a fonte]En plantas, protozoosApicomplexa(como oplasmodiodamalaria) ebacterias,utilízase unhavía alternativa á do mevalonato,que usa piruvato egliceraldehido 3-fosfatocomosubstratos.[7][8]
Do pirofosfato de dimetilalilo ao lanosterol
[editar|editar a fonte]O pirofosfato de isopentenilo e o pirofosfato de dimetilalilo doan unidades deisopreno,que se ensamblan e modifican para formarterpenoseisoprenoides,[8]que son unha gran clase de lípidos entre os que están oscarotenoides,uns dos principais produtos naturais das plantas.[9]
Agora as unidades de isopreno únense para formarescualenoe despois sofren un pregamento e forman aneis para orixinar olanosterol.[10]O lanosterol pode despois converterse noutros esteroides como ocolesteroleergosterol.[10][11]

Esteroidoxénese
[editar|editar a fonte]A esteroidoxénese é o proceso biolóxico polo cal os esteroides se xeran a partir docolesterole transfórmanse noutros esteroides. As vías metabólicas da esteroidoxénese difiren entre as especies. As vías da esteroidoxénese humana móstranse na figura. Entre os produtos orixinados na esteroidoxénese están:
Eliminación
[editar|editar a fonte]Os esteroides oxídanse principalmente por acción dos encimascitocromo P450 oxidases,como aCYP3A4.Estas reaccións encimáticas introducenosíxenonos aneis do esteroide e permiten que outros encimas rompan a estrutura dos aneis, para formarácidos biliarescomo produtos finais.[12]Estes ácidos biliares poden despois ser eliminados polabilesegregada nofígado.[13]A expresión destexeneda oxidase pode ser regulada (aumentada) polo sensor de esteroidesPXRcando hai unha concentración sanguínea alta de esteroides.[14]
Notas
[editar|editar a fonte]- ↑1,01,1G. P. Moss (1989)."Nomenclature of Steroids (Recommendations 1989)".Pure & Appl. Chem.61(10): 1783–1822.doi:10.1351/pac198961101783.Arquivado dendeo orixinalo 24 de marzo de 2012.Consultado o 16 de xullo de 2011."IUPAC-IUB Joint Commission on Biochemical Nomenclature (JCBN). The nomenclature of steroids. Recommendations 1989".Eur. J. Biochem.186(3): 429–58. 1989.PMID2606099.doi:10.1111/j.1432-1033.1989.tb15228.x.
- ↑"Lanosterol biosynthesis".Arquivado dendeo orixinalo 08 de marzo de 2011.Consultado o 16 de xullo de 2011.
- ↑PubChem;CAS Number: 203-64-5Arquivado08 de xullo de 2011 enWayback Machine.
- ↑britannica.com > Facts about gonane: steroids, as discussed in steroid (chemical compound): Steroid numbering system and nomenclatureArquivado29 de xuño de 2011 enWayback Machine.Retrieved on Feb 13, 2010
- ↑Rossier MF (2006). "T channels and steroid biosynthesis: in search of a link with mitochondria".Cell Calcium.40(2): 155–64.PMID16759697.doi:10.1016/j.ceca.2006.04.020.
- ↑Grochowski L, Xu H, White R (2006)."Methanocaldococcus jannaschii uses a modified mevalonate pathway for biosynthesis of isopentenyl diphosphate".J Bacteriol188(9): 3192–8.PMC1447442.PMID16621811.doi:10.1128/JB.188.9.3192-3198.2006.
- ↑Lichtenthaler H (1999). "The 1-Dideoxy-D-xylulose-5-phosphate pathway of isoprenoid biosynthesis in plants".Annu Rev Plant Physiol Plant Mol Biol50:47–65.PMID15012203.doi:10.1146/annurev.arplant.50.1.47.
- ↑8,08,1Kuzuyama T, Seto H (2003). "Diversity of the biosynthesis of the isoprene units".Nat Prod Rep20(2): 171–83.PMID12735695.doi:10.1039/b109860h.
- ↑Dubey V, Bhalla R, Luthra R (2003)."An overview of the non-mevalonate pathway for terpenoid biosynthesis in plants"(PDF).J Biosci28(5): 637–46.PMID14517367.doi:10.1007/BF02703339.
- ↑10,010,1Schroepfer G (1981)."Sterol biosynthesis".Annu Rev Biochem50:585–621.PMID7023367.doi:10.1146/annurev.bi.50.070181.003101.
- ↑Lees N, Skaggs B, Kirsch D, Bard M (1995)."Cloning of the late genes in the ergosterol biosynthetic pathway of Saccharomyces cerevisiae—a review".Lipids30(3): 221–6.PMID7791529.doi:10.1007/BF02537824.
- ↑Pikuleva IA (2006). "Cytochrome P450s and cholesterol homeostasis".Pharmacol. Ther.112(3): 761–73.PMID16872679.doi:10.1016/j.pharmthera.2006.05.014.
- ↑Zollner G, Marschall HU, Wagner M, Trauner M (2006). "Role of nuclear receptors in the adaptive response to bile acids and cholestasis: pathogenetic and therapeutic considerations".Mol. Pharm.3(3): 231–51.PMID16749856.doi:10.1021/mp060010s.
- ↑Kliewer S, Goodwin B, Willson T (2002). "The nuclear pregnane X receptor: a key regulator of xenobiotic metabolism".Endocr. Rev.23(5): 687–702.PMID12372848.doi:10.1210/er.2001-0038.
Véxase tamén
[editar|editar a fonte]Outros artigos
[editar|editar a fonte]Ligazóns externas
[editar|editar a fonte]- Nomenclatura dos esteroidesdo Queen Mary - Universidade de Londres.
- Esteroidoxénese.
