Etanol
| Etanol | |
|---|---|
|
|
|

|
etanol[1] | |
Outros nomes Alcohol absoluto, alcohol, alcohol etílico, monóxido de etano, EtOH, hidrato etílico, etil hidróxido, etilol, hidroxietano, metilcarbinol | |
| Identificadores | |
| Número CAS | 64-17-5 |
| PubChem | 702 |
| ChemSpider | 682 |
| Ligando IUPHAR | 2299 |
| Imaxes 3DJmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C2H6O |
| Masa molar | 46,07 g mol−1 |
| Aspecto | Líquido incoloro |
| Densidade | 0,789 g/cm3(a 20 °C) |
| Punto de fusión | −114 °C; −173 °F; 159 K |
| Punto de ebulición | 7 837 °C; 14 139 °F; 8 110 K |
| log P | -0,18 |
| Presión de vapor | 5,95 kPa (a 20 °C) |
| Acidez(pKa) | 15.9 (H2O), 29.8 (DMSO)[2][3] |
| Basicidade(pKb) | -1,9 |
| Índice de refracción(nD) | 1,361 |
| Viscosidade | 0,0012 Pa s (a 20 °C), 0.001074 Pa s (a 25 °C)[4] |
| Momento dipolar | 1.69 D[5] |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
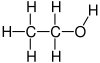
Oetanol,oualcohol etílico,é uncomposto químicoorgánico alifático cun grupo funcional hidroxilo que forma parte da familia dosalcohois.O etanol é o máis común dos alcois. Os alcois son compostos que teñen grupos hidroxilo unidos a átomos de carbono sp3 (é dicir, cadeas de carbono saturadas). A súa fórmula química éCH3-CH2-OHe o seu peso molecular é de 46.0684. En condicións normais depresiónetemperaturapreséntase como un líquido incoloro cun olor acedo parecido ao dovinagree é moi inflamable, cunpunto de ebuliciónde 78°C.Ao mesturarse conaugaen calquera proporción, dá unhamestura azeotrópica.Poden considerarse derivados orgánicos da auga nos que un dos hidróxenos foi substituído por un grupo orgánico.
O etanol é unha substancia orgánica obtida a partir da fermentación deazucres,a hidratación doetilenoou a redución doacetaldehído,[6][7]atópase enbebidascomocervexa,viñoelicores,así como naindustria do perfume.
O etanol obtívose desde a antigüidade[8]por medio de procesos fermentativos de azucres simples, podendo ser inxerido e comportándose fisioloxicamente como unha substanciapsicoactiva.Máis tarde, noséculo XIX,fenómenos como a industrialización ampliaron aínda máis este mercado, que alcanzou un protagonismo definitivo, ao mesmo ritmo que o desenvolvemento da sociedade de consumo noséculo XX.O seu uso é moi amplo: en bebidas alcohólicas, na industria farmacéutica, como disolvente químico, como combustible ou mesmo como antídoto.
O etanol é moi importante no ámbito médico, onde se utiliza, como outros alcois tamén, no exterminio da vida microbiana nociva, que podería empeorar o estado dos pacientes xa que o etanol mata os organismosdenaturalizandoas súas proteínas e disolvendolípidossendo eficaz contra a maioría debacterias,fungose varios tipos de virus, pero é ineficaz contra asesporasbacterianas.[9][10]e conservación de líquidos[11].Tamén se utiliza na produción debiodiésel,onde reacciona coaceite de rícino.
É o principal produto dasbebidas alcohólicas,como oviño(con arredor dun 13 %V/V), acervexa(entre un 5 % V/V e un 8 % V/V), oslicores(ata un 50 % V/V) o asaugardentes(ata un 70 % V/V).[12]
Etimoloxía[editar|editar a fonte]
Etanolé o nome sistemático definido pola Unión Internacional de Química Pura e Aplicada (IUPAC) para unha molécula con dous átomos de carbono (prefixo "et-" ) que ten un único vínculo entre eles (sufixo "-ano" ) e ungrupo hidroxilounido -OH (sufijo "-ol" ).[13]
O prefixo "et-" foi cuñado en 1834 polo químico alemánJustus von Liebig.[14]Etiloé unha contracción da palabra francesaéter(calquera substancia que se evapora ou sublima facilmente a temperatura ambiente) e a palabra gregaύλη(hylé,substancia).
O termo "etanol" foi cuñado como resultado dunha resolución adoptada na Conferencia Internacional sobre Nomenclatura Química que se celebrou en abril de 1892 enXenebra, Suíza.[15]
Historia[editar|editar a fonte]
- Véxase tamén:Licor.

Afermentacióndo azucre en etanol é unha das primeirasbiotecnoloxíasempregadas polo ser humano. Historicamente, o etanol identificouse de diversas formas como augardente de viño ou augardente para queimar,[16]e comoaqua vitaeou aqua vita. Os efectos embriagadores do seu consumo coñécense desde a antigüidade. O etanol foi utilizado polos humanos desde a prehistoria como ingrediente embriagador debebidas alcohólicas.Residuos secos encerámicasde hai 9.000 anos atopadas na China suxiren que os pobos doNeolíticoconsumían bebidas alcohólicas.[17]
A natureza inflamable das exhalaciones do viño xa era coñecida por antigos filósofos comoAristóteles(384-322 a.C.),Teofrasto(c. 371-287 a.C.) ePlinio o Vello(23/24-79 d.C.).[18]Con todo, isto non conduciu inmediatamente ao illamento do etanol, mesmo a pesar do desenvolvemento de técnicas de destilación máis avanzadas noExipto romanodos séculos II e III.[19]Un recoñecemento importante, atopado por primeira vez nun dos escritos atribuídos aJābir ibn Ḥayyān(século IX d. C.), foi que aoengadir salao viño fervendo, o que aumenta avolatilidade relativado viño, pódese mellorar a inflamabilidade dos vapores resultantes.[20]A destilación do viño está testemuñada en obras árabes atribuídas aal-Kindī(c. 801-873 EC) e aal-Fārābī(c. 872-950), e no libro 28 deAbulcasis's (Latín: Abulcasis, 936-1013)Kitāb al-Taṣrīf(traducido posteriormente ao latín comoLiber servatoris).[21]No século XII, empezaron a aparecer en varias obras latinas receitas para a produción deaqua ardens( "auga ardente", é dicir, etanol) mediante a destilación de viño con sal, e a finais do século XIII converteuse nunha substancia amplamente coñecida entre os químicos de Europa occidental.[22]
Os traballos deTaddeo Alderotti(1223-1296) describen un método para concentrar o etanol que consiste nadestilación fraccionadarepetida a través dunalambiquerefrixerado por auga, mediante o cal se podía obter unha pureza do etanol do 90%.[23]As propiedades medicinais do etanol foron estudadas porArnau de Vilanova(1240-1311 d.C.) eJean de Roquetaillade(c. 1310-1366), quen o consideraba unha substancia vital capaz de previr todas as enfermidades (oaqua vitaeou "auga da vida", tamén chamada por Jean oquintessencedo viño).[24]
NaChina,as probas arqueolóxicas indican que a verdadeira destilación do alcol comezou durante as dinastíasJin(1115-1234) ouSong do Sur(1127-1279).[25]Atopouse unalambiquenunxacemento arqueolóxicode Qinglong,Hebei,que data do século XII.[25]Na India, a verdadeira destilación do alcol introduciuse desde Oriente Medio e utilizábase amplamente noSultanato de Delhino século XIV.[26]
En 1796, o químico xermano-ruso Johann Tobias Lowitz obtivo etanol puro mesturando etanol parcialmente purificado (o azeótropo alcol-auga) cun exceso de álcali anhidro e destilando despois a mestura a fogo lento.[27]O químico francésAntoine Lavoisierdescribiu o etanol como un composto de carbono, hidróxeno e osíxeno, e en 1807Nicolas-Théodore de Saussuredeterminou a fórmula química do etanol.[28][29]Cincuenta anos máis tarde,Archibald Scott Couperpublicou a fórmula estrutural do etanol. Foi unha das primeiras fórmulas estruturais determinadas.[30]
O etanol foi preparado sintéticamente por primeira vez en 1825 porMichael Faraday.Descubriu que o ácido sulfúrico podía absorber grandes volumes degas de hulla.[31]Deulle a solución resultante aHenry Hennell,un químico británico, que descubriu en 1826 que contiña "ácido sulfovínico" (sulfato de hidróxeno de etilo).[32]En 1828, Hennell e o químico francésGeorges-Simon Serullasdescubriron de forma independente que o ácido sulfovínico podía descompoñerse en etanol.[33][34]Así, en 1825 Faraday descubrira sen sabelo que se podía producir etanol a partir de etileno (un compoñente do gas de hulla) mediante hidratacióncatalizadapor ácido, un proceso similar á actual síntese industrial de etanol.[35]
O etanol utilizábase como combustible para lámpadas nos Estados Unidos xa en 1840, pero un imposto aplicado ao alcol industrial durante aGuerra Civilfixo que este uso resultase antieconómico. O imposto derrogouse en 1906.[36]O seu uso como combustible de automoción remóntase a 1908, cando oFord Tpodía funcionar congasolinaou etanol.[37]Así mesmo alimenta algúnqueimador de alcohol.
O etanol destinado a usos industriais adoita producirse a partir do etileno.[38]O etanol ten un uso moi estendido como disolvente de substancias destinadas ao contacto ou consumo humano, como aromas, saborizantes, colorantes e medicamentos. En química, é tanto un disolvente como unha materia prima para a síntese doutros produtos. Ten unha longa historia como combustible para calor e luz, e máis recentemente como combustible para motores de combustión interna.
Outras constantes[editar|editar a fonte]
- Densidade óptica:nD20 = 1,361
- Concentración máxima permitida no aire polaUnión Europea:1.000 ppm[39]
- LD50:7.060 mg/kg (vía oral)
Síntese[editar|editar a fonte]
O alcohol é un líquido incoloro e volátil que está presente en diversasbebidas fermentadas.Desde a antigüidade obtíñase o etanol porfermentaciónanaeróbicadunha disolución con contido enazucree conlévedoe posteriordestilación.
Dependendo do xénero deBebida alcohólicaque o conteña, o alcohol aparece acompañado de distintos elementos químicos que o dotan de cor, sabor, cheiro, entre outras características.
Destilación[editar|editar a fonte]
Para obter etanol libre deaugaaplícase a destilación azeotrópica nunha mestura conbencenoouciclohexano.Destas mesturas destílase atemperaturasmáis baixas oazeótropo,formado polo disolvente auxiliar coa auga, mentres que o etanol quédase retido. Outro método de purificación moi utilizado actualmente é aabsorción físicamediantebarutos moleculares.[40]
A escala de laboratorio tamén se poden utilizar disecantes como omagnesio,[40]que reacciona coa auga formandohidróxenoeóxido de magnesio.
Outro xeito de sintetizalo é mesturar hidruro de osíxeno eetano.Isto é debido a que o etanol é etano en que se substituíu un átomo de hidróxeno por un de hidróxeno e osíxeno (é dicir, un ión hidróxido).
Aplicacións[editar|editar a fonte]

Xerais[editar|editar a fonte]
Ademais de usarse con fins culinarios (bebida alcohólica), o etanol utilízase amplamente en moitos sectoresindustriaise no sectorfarmacéutico,como principio activo dalgúns medicamentos ecosméticos(é o caso do alcohol antiséptico 70º GL e na elaboración de ambientadores e perfumes).
Médico[editar|editar a fonte]
Anestésico[editar|editar a fonte]
O etanol é osedantemáis antigo que se coñece, utilizado comoanestésico xeraloral durante a cirurxía na antigaMesopotamiae naépoca medieval.[41][42]A intoxicación leve comeza a partir dunhaconcentración de alcol en sanguedo 0,03-0,05% e induce ocoma anestésicoao 0,4%.[43]Con todo, este uso implicaba o alto risco dunha mortalintoxicación etílicae dunhaaspiración pulmonarno vómito, o que levou a utilizar alternativas na antigüidade, como oopioe ocánnabis,e máis tarde oéter dietílicoa partir da década de 1840.[44]
É un bodisolvente,e pode utilizarse comoanticonxelante.Tamén é un bodesinfectante.[45]O seu maior potencial bactericida obtense a unha concentración de aproximadamente o 70 %, xa que se reduce a tensión superficial da célula bacteriana, facilitando o proceso de desnaturalización proteica.[46][47]
Para o seu uso comoantisépticotópico adoita mesturarse con aditivos como oalcanforou ocloruro de benzalconiopara evitar a súa inxestión, e por ese motivo véndese como "alcohol etílico desnaturalizado". Con ese mesmo fin tamén se emprega oalcohol isopropílico,que non é potable.
Antiséptico[editar|editar a fonte]
O etanol utilízase en toalliñas médicas e, sobre todo, enxeles desinfectantes de mansantibacterianos comoantisépticopolos seus efectos bactericidas e antifúngicos.[48]O etanol matamicroorganismosdisolvendo a súa membranabicapa lipídicaedenaturalizandoas súasproteínas,e é eficaz contra a maioría debacterias,fungosevirus.Con todo, é ineficaz contra asesporasbacterianas, pero iso pode paliarse utilizandoperóxido de hidróxeno.[49]
Unha solución de etanol ao 70% é máis eficaz que o etanol puro porque o etanol depende das moléculas da auga para unha actividade antimicrobiana óptima. O etanol absoluto pode inactivar os microbios sen destruílos porque o alcol é incapaz de penetrar completamente na membrana do microbio..[50][51]O etanol tamén pode utilizarse como desinfectante e antiséptico, xa que provoca a deshidratación celular ao alterar o equilibrio osmótico a través da membrana celular, polo que a auga abandona a célula e provoca a súa morte..[52]
Antídoto[editar|editar a fonte]
O etanol pode administrarse comoantídotopara aintoxicación por etilenglicol[53]eintoxicación por metanol.[54]O etanol serve a este proceso actuando comoinhibidor competitivofronte aometanole oetilenglicolpara aalcol deshidrogenasa.[55]Aínda que ten máis efectos secundarios, o etanol é menos caro e máis fácil de conseguir que ofomepizol,que tamén se utiliza como antídoto para a intoxicación por metanol e etilenglicol.[56]
Disolvente medicinal[editar|editar a fonte]
O etanol, a miúdo en altas concentracións, utilízase para disolver moitos medicamentos insolubles en auga e compostos relacionados. As preparacións líquidas demedicamentos para a dor,medicamentos para a tose e o arrefriadoe enxaugues bucais, por exemplo, poden conter até un 25% de etanol,[57]e pode ser necesario evitalo en persoas con reaccións adversas ao etanol, comoreaccións respiratorias inducidas polo alcol.[58]O etanol está presente principalmente como conservante antimicrobiano en máis de 700 preparados líquidos de medicamentos, comoparacetamol,suplementos de ferro,ranitidina,furosemida,manitol,fenobarbital,Trimetoprim-sulfametoxazolemedicamentos de venda libre.antitusíxeno.[59]
Farmacoloxía[editar|editar a fonte]
Nos mamíferos, o etanol é principalmentemetabolizadonofígadoe noestómagopolasenzimasalcohol deshidroxenase(ADH).[60]Estas enzimas catalizan aoxidacióndo etanol enacetaldehido(etanal):[61]
- CH3CH2OH + NAD+→ CH3CHO +NADH+ H+
Industria química[editar|editar a fonte]
A industria química emprégao como composto de partida na síntese de diversos produtos, como oacetato de etilo(disolvente para pegamentos, pinturas etc.), ou oéter dietílico.Tamén se aproveitan as súas propiedades desinfectantes.
Combustible[editar|editar a fonte]
- Artigo principal:Etanol (combustible).
Emprégase comocombustibleindustrial e doméstico. No uso doméstico, emprégase oalcohol de queimar.Este ademais contén compostos como apiridinaou ometanolou outras substancias denominadas desnaturalizantes, que impiden o seu uso comoalimento,xa que o alcohol para consumo adoita levarimpostosespeciais. Nalgúns países, no canto de etanol utilízase metanol como alcohol de queimar.
NoBrasilengádese etanol ágasolinapara baixar a importación depetróleo,dando lugar áalconafta.Este país é un dos principais produtores (con 18 mil millóns de litros anuais), con isto reducen un 40 % das súas importacións decru.[62][63]Esta última aplicación esténdese tamén cada vez máis noutros países para cumprir coprotocolo de Kyoto.Estudos doDepartamento de Enerxíados USA din que o uso en automóbiles reduce a produción degases de efecto invernadoironun 85%[Cómpre referencia].En países comoMéxicoexiste a política do executivo federal de apoiar os proxectos para a produción integral de etanol e reducir a importación de gasolinas que xa alcanza o 60 %.
Toxicoloxía[editar|editar a fonte]
- Artigo principal:Efectos do alcohol no corpo.
O etanol puro irrita os ollos e a pal.[64]
O etanol actúa sobre os receptoresácido γ-aminobutíricode tipo A (GABAa) comomodulador alostérico positivoaumentando o fluxo de ións transmembrana, o que induce a un estado de inhibición neuroquímica (efecto ralentizador). Produce efectos similares ásbenzodiazepinase aosbarbitúricos,que actúan sobre o mesmo receptor aínda que en sitios distintos. Esta semellanza inclúe o potencial adictivo, que tamén é similar.
O etanol pode afectar aosistema nervioso central,provocando estados de euforia, desinhibición, mareos, somnolencia, confusión, alucinacións (como o ver dobre ou pensar que todo se move de forma espontánea). Ao mesmo tempo, baixa os reflexos. Con concentracións máis altas ralentiza os movementos, impide a coordinación correcta dos membros, perda temporal da visión etc. En certos casos prodúcese un incremento na irritabilidade do suxeito intoxicado como tamén na agresividade; noutra certa cantidade de individuos vese afectada a zona que controla os impulsos, volvéndose impulsivamente descontrolados e frenéticos. Finalmente, conduce aocomae pode provocar a morte. A toxicidade do etanol é causada en gran medida polo seu principal metabolito, oacetaldehído[65]e o seumetabolito secundario,oácido acético.[66]
Adose letal mediana(DL50) do etanol en ratas é de 10.3 g/kg.[67]Outros alcohois son significativamente máis tóxicos que o etanol, en parte porque tardan moito máis en seren metabolizados e en parte porque a súa metabolización produce substancias (metabolitos) que son aínda máis tóxicas. Ometanol(alcohol de madeira), por exemplo, oxídase nofígado,co que se forma a substancia velenosaformaldehídopolaencima alcohol deshidroxenasa;isto pode provocar cegueira ou a morte.[68]Un tratamento eficaz para evitar a intoxicación por formaldehído tras inxerir metanol é administrar etanol.[54]A encima alcohol deshidroxenasa ten unha maior afinidade polo etanol, evitando así que o metanol se una e sirva de substrato. Deste xeito, o resto de metanol terá tempo de ser excretado polos riles. O formaldehído que quede será convertido en ácido fórmico e despois excretado.[69][70]
A resistencia ao alcohol parece aumentar nas persoas adultas, de maior peso e de menor altura, mentres que os nenos son especialmente vulnerables. Comunicáronse casos de bebés que morreron por intoxicación debida á inhalación de vapores de etanol tras aplicarlles panos embebidos en alcohol. A inxesta en nenos pode conducir a un retardo mental agravado ou a un subdesenvolvemento físico e mental. Tamén se realizaron estudos que demostran que se as nais inxerían alcohol durante o embarazo, os seus fillos podían ser máis propensos a ter a síndrome de alcohólico fetal.
Analítica[editar|editar a fonte]
Un método de determinación da concentración aproximada de etanol nosangueaproveita o feito de que nospulmónsse forma un equilibrio que relaciona esta concentración coa concentración de vapor de etanol no aire expirado. Este aire faise pasar por un tubo onde se acha xel de silicio impregnado cunha mestura dedicromatoe deácido sulfúrico.O dicromato, de cor vermella alaranxado, oxida o etanol aacetaldehidoe é reducido, á súa vez, acromo(III), de cor verde. A lonxitude da zona que cambiou de cor indica a cantidade de etanol presente no aire de se pasar un determinado volume polo tubo.
Notas[editar|editar a fonte]
- ↑"Ethanol – Compound Summary".The PubChem Project.USA: National Center for Biotechnology Information.
- ↑Ballinger, P., Long, F.A.; Long (1960). "Acid Ionization Constants of Alcohols. II. Acidities of Some Substituted Methanols and Related Compounds1,2".Journal of the American Chemical Society82(4): 795–798.doi:10.1021/ja01489a008.
- ↑Arnett, E.M., Venkatasubramaniam, K.G.; Venkatasubramaniam (1983). "Thermochemical acidities in three superbase systems".J. Org. Chem.48(10): 1569–1578.doi:10.1021/jo00158a001.
- ↑Lide, David R., ed. (2012).CRC Handbook of Chemistry and Physics(92 ed.). Boca Raton, FL.: CRC Press/Taylor and Francis. pp. 6–232.
- ↑Lide, David R., ed. (2008).CRC Handbook of Chemistry and Physics(89 ed.). Boca Raton: CRC Press. pp.9–55.
- ↑Freedom Comunicações."ÁLCOOL GEL: A REVOLUÇÃO".Consultado o 27 de abril do 2023.
- ↑Ambiente Brasil."Etanol - O que é?".Arquivado dendeo orixinalo 20 de abril de 2010.Consultado o 27 de abril do 2023.
- ↑William Campbell Ottley,A Dictionary of Chemistry, and of Minerology(1826) see entry "Alcohol"
- ↑McDonnell G, Russell AD (1999)."Antiseptics and Disinfectants: Activity, Action, and Resistance".".Clin. Microbiol. Rev.12(1): 147–79. PMC 88911.PMID 9880479.
- ↑"IMPORTÂNCIA DO ÁLCOOL NO CONTROLE DE INFECÇÕES EM SERVIÇOS DE SAÚDE"(PDF).Agência Nacional de Vigilância Sanitária.pp. 1;3.Consultado o 27 de abril do 2023.
A asistencia sanitaria enfróntase constantemente a infeccións relacionadas cos procedementos asistenciais, que se traducen nun aumento da gravidade da enfermidade, da duración da hospitalización, da mortalidade e dos custos. O alcol ten propiedades microbicidas coñecidas pola súa eficacia na eliminación dos xermes máis frecuentemente implicados nestas infeccións, sendo indispensable para levar a cabo acciones sinxelas de prevención [...] A concentración recomendada para conseguir unha maior velocidade microbicida con alcol etílico é do 70% en peso e con alcol isopropílico, entre o 60 e o 95% [...].
- ↑Coffey, Donavyn (2021-09-05)."Why is alcohol used to preserve things?".livescience.com(eninglés).Consultado o 27 de abril do 2023.
- ↑"Alcohol etílico o etanol"(encastelán).Arquivado dendeo orixinalo 14 de novembro de 2014.Consultado o 10 de setembro de 2014.
- ↑""Etanol - Resumen Compuesto""(eninglés).
- ↑Liebig, Justus (1834) "Ueber die Constitution des Aethers und seiner Verbindungen" (Sobre a constitución do éter e os seus compostos), Annalen der Pharmacie, 9: 1–39. Páxina 18: "Bezeichnen wir die Kohlenwasserstoffverbindung 4C + 10H als das Radikal des Aethers mit E2 und nennen es Ethyl,…"
- ↑Armstrong, Henry (1892). [EtanolenGoogle Books."The International Conference on Chemical Nomenclature" ]
|url=incorrecto (Axuda).Nature46(1177): 56–59.Bibcode:1892Natur..46...56A.doi:10.1038/046056c0. - ↑Ottley, William Campbell (1826).A dictionary of chemistry and of mineralogy as connected with it(eninglés).Murray.
- ↑Roach J (2 de setembro de 2021)."Remains of 9,000-Year-Old Beer Found in China".Smithsonian Magazine.Consultado o 28 de abril do 2023.
- ↑Berthelot & Houdas 1893,vol. I, p. 137.
- ↑Berthelot & Houdas 1893,vol. I, pp. 138-139.
- ↑al-Hassan, Ahmad Y.(2009). "Alcohol and the Distillation of Wine in Arabic Sources from the 8th Century".Studies in al-Kimya': Critical Issues in Latin and Arabic Alchemy and Chemistry.Hildesheim: Georg Olms Verlag. pp. 283–298.(same content also available onthe author's websiteArquivado2015-12-29 enWayback Machine.).
- ↑al-Hassan 2009(same content also available onthe author's websiteArquivado2015-12-29 enWayback Machine.); cf.Berthelot & Houdas 1893,vol. I, pp. 141, 143. Sometimes, sulfur was also added to the wine (seeBerthelot & Houdas 1893,vol. I, p. 143).
- ↑Multhauf 1966,pp. 204–206.
- ↑Holmyard, Eric John(1957).Alchemy.Harmondsworth: Penguin Books.ISBN978-0-486-26298-7.pp. 51–52.
- ↑Principe, Lawrence M.(2013).The Secrets of Alchemy.Chicago: The University of Chicago Press.ISBN978-0-226-10379-2.pp. 69-71.
- ↑25,025,1Haw, Stephen G.(2006)."Wine, women and poison".Marco Polo in China.Routledge. pp. 147–148.ISBN978-1-134-27542-7.Consultado o 4 de outubro do 2023.
O período máis antigo posible parece ser o da dinastía Han oriental... o período máis probable para o comezo da verdadeira destilación de bebidas espirituosas para beber na China é durante as dinastías Jin e Song do Sur
- ↑Habib, Irfan(2011).Economic History of Medieval India, 1200–1500.Pearson Education India. pp. 55–.ISBN978-81-317-2791-1.Consultado o 4 de outubro do 2023.
- ↑Lowitz, T. (1796)."Anzeige eines, zur volkommen Entwasserung des Weingeistes nothwendig zu beobachtenden, Handgriffs" [Report of a task that must be done for the complete dehydration of wine spirits [i.e., alcohol-water azeotrope])].Chemische Annalen für die Freunde der Naturlehre, Aerznengelartheit, Haushaltungskunde und Manufakturen(enalemán)1.pp. 195–204.
Véxanse pp. 197-198: Lowitz deshidrató o azeótropo mesturándoo cun exceso de 2:1 de álcali anhidro e logo destilando a mestura a fogo lento.
- ↑Chisholm,Hugh,ed. (1911). "Alcohol".Encyclopædia Britannica1(11ª ed.).Cambridge University Press(eninglés).pp. 525–527.
- ↑de Saussure, Théodore (1807)."Mémoire sur la composition de l'alcohol et de l'éther sulfurique".Journal de Physique, de Chimie, d'Histoire Naturelle et des Arts64.pp. 316–354.No seu artigo de 1807, Saussure determinou a composición do etanol só de forma aproximada; unha análise máis precisa do etanol aparece na páxina 300 do seu artigo de 1814:de Saussure, Théodore (1814)."Nouvelles observations sur la composition de l'alcool et de l'éther sulfurique".Annales de Chimie et de Physique89.pp. 273–305.
- ↑Couper AS (1858)."On a new chemical theory"(online reprint).Philosophical Magazine16(104–116).Consultado o 4 de outubro do 2023.
- ↑Faraday M (1825)."On new compounds of carbon and hydrogen, and on certain other products obtained during the decomposition of oil by heat".Philosophical Transactions of the Royal Society of London115.pp. 440–466.doi:10.1098/rstl.1825.0022.Nunha nota ao pé de páxina na páxina 448, Faraday sinala a acción do ácido sulfúrico sobre o gas de hulla e o destilado de gas de hulla; especificamente, "O ácido [sulfúrico] combínase directamente co carbono e o hidróxeno; e encontro que cando [o composto resultante] se une con bases [forma] unha clase peculiar de sales, algo parecidas aos sulfovinatos [é dicir, sulfatos de etilo], pero aínda diferentes deles...".. "
- ↑Hennell H (1826)."On the mutual action of sulphuric acid and alcohol, with observations on the composition and properties of the resulting compound".Philosophical Transactions of the Royal Society of London116.pp. 240–249.doi:10.1098/rstl.1826.0021.Na páxina 248, Hennell menciona que Faraday deulle un pouco de ácido sulfúrico no que se disolveu gas de hulla e que el (Hennell) descubriu que contiña "ácido sulfuvínico" (sulfato ácido de etilo).
- ↑Hennell H (1828)."On the mutual action of sulfuric acid and alcohol, and on the nature of the process by which ether is formed".Philosophical Transactions of the Royal Society of London118.pp. 365–371.doi:10.1098/rstl.1828.0021.Na páxina 368, Hennell produce etanol a partir de "ácido sulfovínico" (sulfato de hidróxeno de etilo).
- ↑Sérullas, Georges-Simon (1828). Guyton de Morveau, Louis-Bernard; Gay-Lussac, Joseph Louis; Arago, François; Michel Eugène Chevreul; Marcellin Berthelot; Éleuthère Élie Nicolas Mascart; Albin Haller, eds."De l'action de l'acide sulfurique sur l'alcool, et des produits qui en résultent".Annales de Chimie et de Physique39.pp. 152–186.Na páxina 158, Sérullas menciona a produción de alcol a partir de "sulfate acid d'hydrogène carboné" (sulfato ácido de hidrocarburo).
- ↑En 1855, o químico francésMarcellin Berthelotconfirmou o descubrimento de Faraday preparando etanol a partir de etileno puro.Berthelot, Marcellin (1855). Arago, François; Gay-Lussac, Joseph Louis, eds."Sur la formation de l'alcool au moyen du bicarbure d'hydrogène (On the formation of alcohol by means of ethylene)".Annales de Chimie et de Physique43.pp. 385–405.(Nota: As fórmulas químicas do artigo de Berthelot son erróneas porque os químicos da época utilizaban masas atómicas equivocadas para os elementos; por exemplo, carbono (6 en lugar de 12), osíxeno (8 en lugar de 16) etc.)/ etc.).
- ↑Siegel, Robert (15 de febreiro de 2007)."Ethanol, Once Bypassed, Now Surging Ahead".NPR.Consultado o 4 de outubro do 2023.
- ↑DiPardo, Joseph."Outlook for Biomass Ethanol Production and Demand"(PDF).United States Department of Energy. Arquivado dendeo orixinal(PDF)o 24 de setembro de 2015.Consultado o 4 de outubro do 2023.
- ↑Myers, Richard L.; Myers, Rusty L. (2007).The 100 most important chemical compounds: a reference guide.Westport, CN: Greenwood Press. p. 122.ISBN978-0-313-33758-1.
- ↑"Safety data for ethyl alcohol".University of Oxford. 9 de maio de 2008. Arquivado dendeo orixinalo 14 de xullo de 2011.Consultado o 3 de xaneiro de 2011.
- ↑40,040,1Kosaric, Naim; Duvnjak, Zdravko; Farkas, Adalbert; Sahm, Hermann; Bringer-Meyer, Stephanie; Goebel, Otto; Mayer, Dieter (2011). "Ethanol".Ullmann's Encyclopedia of Industrial Chemistry.Weinheim: Wiley-VCH. pp. 1–72.ISBN9783527306732.doi:10.1002/14356007.a09_587.pub2.
- ↑Erro no código da cita: Etiqueta
<ref>non válida; non se forneceu texto para as referencias de nomePowell1996 - ↑Erro no código da cita: Etiqueta
<ref>non válida; non se forneceu texto para as referencias de nomeSchnelle - ↑Kaveh, Anthony."3 Natural, Ancient Anesthetics No One Talks About: Opium, Alcohol, Marijuana".Dr. Anthony Kaveh, MD.Consultado oDecember 30,2022.
- ↑Grattan, N. "Treatment of Uterine Haemorrhage".Provincial Medicine and Surgical Journal.Vol. 1, No. 6 (Nov. 7, 1840), p. 107.
- ↑Pohorecky, Larissa A.; Brick, John (xaneiro de 1988). "Pharmacology of ethanol".Pharmacology & Therapeutics36(2–3): 335–427.PMID3279433.doi:10.1016/0163-7258(88)90109-X.
- ↑"Chemical Disinfectants | Disinfection & Sterilization Guidelines | Guidelines Library | Infection Control | CDC".www.cdc.gov(eninglés).Consultado o2018-01-29.
- ↑"Why is 70% ethanol used for wiping microbiological working areas?".ResearchGate(eninglés).Consultado o2018-01-29.
- ↑Pohorecky, Larissa A.; Brick, John (xaneiro de 1988). "Pharmacology of ethanol".Pharmacology & Therapeutics36(2–3). pp. 335–427.PMID3279433.doi:10.1016/0163-7258(88)90109-X.
- ↑McDonnell G, Russell AD (xaneiro de 1999). "Antiseptics and disinfectants: activity, action, and resistance".Clinical Microbiology Reviews12(1). pp. 147–179.PMC88911.PMID9880479.doi:10.1128/CMR.12.1.147.
- ↑"Chemical Disinfectants | Disinfection & Sterilization Guidelines | Guidelines Library | Infection Control | CDC".www.cdc.gov(eninglés).Consultado o 29 de novembro do 2023.
- ↑"Why is 70% ethanol used for wiping microbiological working areas?".ResearchGate(eninglés).Consultado o 29 de novembro do 2023.
- ↑"Ethanol".www.drugbank.ca.Consultado o 29 de novembro do 2023.
- ↑Scalley, Robert (September 2002)."Treatment of Ethylene Glycol Poisoning".American Family Physician66(5). pp. 807–813.PMID12322772.Consultado o 5 de marzo do 2024.
- ↑54,054,1Beauchamp, GA; Valento, M (September 2016). "Toxic Alcohol Ingestion: Prompt Recognition And Management In The Emergency Department.".Emergency Medicine Practice18(9). pp. 1–20.PMID27538060.
- ↑Sasanami, Misa; Yamada, Taihei; Obara, Takafumi; Nakao, Atsunori; Naito, Hiromichi (2020)."Oral Ethanol Treatment for Ethylene Glycol Intoxication".Cureus12(12): e12268.ISSN2168-8184.PMC7827791.PMID33510981.doi:10.7759/cureus.12268.
- ↑Anseeuw, Kurt; Sabbe, Marc B.; Legrand, Annemie (abril de 2008)."Methanol poisoning: the duality between 'fast and cheap' and 'slow and expensive'".European Journal of Emergency Medicine15(2). pp. 107–109.ISSN0969-9546.PMID18446077.doi:10.1097/MEJ.0b013e3282f3c13b.
- ↑"Alcohol Content in Common Preparations"(PDF).Medical Society of the State of New York. Arquivado dendeo orixinal(PDF)o 29 April 2021.Consultado o 30 de marzo do 2024.
- ↑Adams KE, Rans TS (decembro de 2013)."Adverse reactions to alcohol and alcoholic beverages".Annals of Allergy, Asthma & Immunology111(6). pp. 439–445.PMID24267355.doi:10.1016/j.anai.2013.09.016.
- ↑Zuccotti GV, Fabiano V (xullo de 2011). "Safety issues with ethanol as an excipient in drugs intended for pediatric use".Expert Opinion on Drug Safety10(4). pp. 499–502.PMID21417862.doi:10.1517/14740338.2011.565328.
- ↑Farrés J, Moreno A, Crosas B, Peralba JM, Allali-Hassani A, Hjelmqvist L, et al. (September 1994). "Alcohol dehydrogenase of class IV (sigma sigma-ADH) from human stomach. cDNA sequence and structure/function relationships".European Journal of Biochemistry224(2). pp. 549–557.PMID7925371.doi:10.1111/j.1432-1033.1994.00549.x.
- ↑Edenberg HJ, McClintick JN (December 2018). "Alcohol Dehydrogenases, Aldehyde Dehydrogenases, and Alcohol Use Disorders: A Critical Review".Alcoholism: Clinical and Experimental Research42(12). pp. 2281–2297.PMC6286250.PMID30320893.doi:10.1111/acer.13904.
- ↑"Availability of Sources of E85".Clean Air Trust.Consultado o 27 de xullo de 2015.
- ↑"Fuel ethanol production worldwide".Statista.Consultado o 2 de xuño de 2021.
- ↑Minutes of MeetingArquivado16 de abril de 2021 enWayback Machine.. Technical Committee on Classification and Properties of Hazardous Chemical Data (12–13 de xaneiro de 2010).
- ↑Fowkes, Steven Wm."Living with Alcohol".CERI(eninglés).The Cognitive Enhancement Research Institute. Arquivado dendeo orixinalo 29 de febreiro de 2000.Consultado o 1 de outubro de 2016.
- ↑Maxwell, Christina R.; Spangenberg, Rebecca Jay; Hoek, Jan B.; Silberstein, Stephen D.; Oshinsky, Michael L. (2010)."Acetate causes alcohol hangover headache in rats".PloS One5(12): e15963.ISSN1932-6203.PMID21209842.doi:10.1371/journal.pone.0015963.Consultado o 1 de outubro de 2016.
- ↑Gable, Robert S. (xuño de 2004)."Comparison of acute lethal toxicity of commonly abused psychoactive substances".Addiction(eninglés)99(6): 686–696.ISSN1360-0443.doi:10.1111/j.1360-0443.2004.00744.x.
- ↑Argonne National Laboratory."Connecting Argonne science to the classroom".anl.gov(eninglés).Consultado o 1 de outubro de 2016.
- ↑Zimmerman, H. E.; Burkhart, K. K.; Donovan, J. W. (abril de 1999)."Ethylene glycol and methanol poisoning: diagnosis and treatment".Journal of emergency nursing: JEN: official publication of the Emergency Department Nurses Association25(2): 116–120.ISSN0099-1767.PMID10097201.
- ↑Lobert, S. (1 de decembro de 2000)."Ethanol, isopropanol, methanol, and ethylene glycol poisoning".Critical Care Nurse20(6): 41–47.ISSN0279-5442.PMID11878258.Consultado o 1 de outubro de 2016.
Véxase tamén[editar|editar a fonte]
| Wikimedia Commonsten máis contidos multimedia na categoría: Etanol |
| AGalicitasposúe citas sobre: Etanol |
Bibliografía[editar|editar a fonte]
- Boyce, John M; Pittet, Didier (2003)."Hand Hygiene in Healthcare Settings".Atlanta,Xeorxia:Centers for Disease Control.
- Onuki, Shinnosuke; Koziel, Jacek A.; van Leeuwen, Johannes; Jenks, William S.; Grewell, David; Cai, Lingshuang (xuño de 2008).Ethanol production, purification, and analysis techniques: a review.2008 ASABE Annual International Meeting. Providence, RI.Consultado o 16 de febreiro de 2013.
- "Explanation of US denatured alcohol designations".Sci-toys.
- Lange, Norbert Adolph (1967). John Aurie Dean, ed.Lange's Handbook of Chemistry(10th ed.). McGraw-Hill.
Outros artigos[editar|editar a fonte]
Ligazóns externas[editar|editar a fonte]
- Alcohol (Ethanol)atThe Periodic Table of Videos(University of Nottingham)
- Instituto Nacional de Seguridade e Higiene no Traballo de España:Ficha internacional de seguridade química do etanol (anhidro).
