Inmunoglobulina G

AInmunoglobulina G(IgG) é unisotipodeanticorpo.Está composta por catro cadeas polipeptídicas, douscadeas pesadasgamma (γ) idénticas entre si e dúascadeas lixeirasidénticas entre si, dispostas formando unha molécula con forma de Y, como é característico nosmonómerosdos anticorpos. Cada IgG ten dous sitios de unión aos antíxenos no extremo dos brazos do Y (rexión Fab). As IgG representan aproximadamente o 75% das inmunoglobulinas dosoro sanguíneohumano, polo que son o isotipo de anticorpo máis abundante na circulación.[1]As IgG son producidas e segregadas polascélulas plasmáticas(linfocitos Bactivados).
Funcións
[editar|editar a fonte]Os anticorpos son os principais compoñentes dosistema inmunitario.A IgG é o principalisotipoque se encontra no sangue efluídos extracelulares,o que lle permite controlar as infeccións dos tecidos corporais ao unirse aospatóxenos.Utiliza varios mecanismos inmunes, como:
- A unión das IgG aos patóxenos causa a súa inmobilización e que se unan entre eles (aglutinación).
- Ao quedaren cubertos os patóxenos con IgG (o que se chamaopsonización) estes son recoñecidos e inxeridos polosfagocitosdo sistema inmunitario.
- As IgG activan avía clásicadosistema do complemento,unha cascada de proteínas inmunes do sangue que lisa os patóxenos.
- As IgG tamén se unen eneutralizantoxinas.
- As IgG tamén xogan un importante papel nacitotoxicidade mediada por células dependente de anticorpos(ADCC) e naproteólise mediada por anticorpos intracelular,na cal se unen aoTRIM21(o receptor de grande afinidade para as IgG en humanos) para dirixir nocitosolaos virións marcados aoproteasomapara a súa destrución.[2]
- A IgG tamén está asociada coashipersensibilidadesde tipo I e III.
Os anticorpos IgG xéranse polos procesos decambio de clasee maduración da resposta a anticorpos e así participa predominantemente naresposta imunitaria secundaria.[3]A IgG segrégase como monómero de pequeno tamaño, o que lle permite perfundir facilmente nos tecidos. É o único isotipo que pode atravesar a través daplacentahumana, proporcionando protección aofetonoútero.Xunto coaIgAsegregada noleite materno,as IgG que foran absorbidas pola placenta proporcionan ao neonato unhainmunidade humoralantes de que se desenvolva o seu propiosistema inmunitario.Ocostrocontén unha grande porcentaxe de IgG, especialmente no caso do costro bovino. En individuos cunha inmunidade previa a un patóxeno, a IgG aparece arredor de 24-48 horas despois da estimulación antixénica.
Estrutura
[editar|editar a fonte]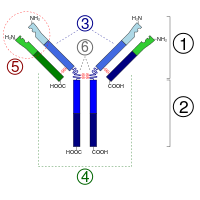
As IgG son moléculas de 150kDacompostas por catro cadeas peptídicas. Conteñen dúas cadeas idénticas pesadas gamma (γ) de arredor de 50 kDa e dúas lixeiras idénticas duns 25 kDa, polo que ten unhaestrutura cuaternariatetramérica. As dúas cadeas pesadas están enlazadas entre si e coas cadedas lixeiras por medio depontes difulfuro.Otetrámeroresultante ten dúas metades idénticas, e en conxunto ten forma de Y. Cada extremo do Y contén unsitio de uniónaoantíxenoidéntico. Asrexións Fcdas IgGs teñen un sitio moi conservado de N-glicosilación. Os N-glicanos unidos a este sitio son predominantemente estruturas cun núcleofucosiladode tipo complexo. Ademais, unha pequena proporción de N-glicanos tamén levan residuos deN-acetilglicosaminaeácido siálicocon enlace α-2,6.[4]
Movemento interno de baixa frecuencia
[editar|editar a fonte]A IgG ten un número de onda de baixa frecuencia de 28 cm−1noespectro de Raman.[5]Esta emisión foi asignada ao movemento de latexo nobaril betade nove cadeas beta no seu domiio V.[6]O mecanismo dinámico do "efecto quelato" e o "efecto disparador" das IgG foi analizado desde o ángulo da resonancia de baixa frecuencia entre os 12 barrís beta dunha molécula IgG.[7]
Subclases
[editar|editar a fonte]Hai catro subclases de IgG (IgG1, 2, 3, e 4) en humanos, denominados por orde da súa abundancia no soro (por tanto, IgG1 é a máis abundante).
| Nome | Porcentaxe | Cruza a placenta facilmente | Activador do complemento | Únese aoreceptor Fcdas células fagocíticas |
| IgG1 | 66% | si (1,47)† | o segundo maior | alta afinidade |
| IgG2 | 23% | non (0,8)† | o terceiro maior | afinidade extremadamente baixa |
| IgG3 | 7% | si (1,17)† | o máis alto | alta afinidade |
| IgG4 | 4% | si (1,15)† | non | afinidade intermedia |
| †: Cuota cordón umbilical/concentracións sanguíneas maternas. Baseado nos datos dun estudo xaponés sobre 228 madres.[8] | ||||
Nota: A afinidade da IgG polos receptores Fc nas células fagocíticas é específica de cada especie da cal proceden os anticorpos e da súa clase. A estrutura das rexións bisagra dá a cada unha das catro clases de IgG o seu perfil distintivo. Mesmo se hai arredor do 95% de semellanza nas súas rexións Fc, a estrutura das rexións bisagra é relativamente diferente.
A capacidade relativa de diferentes subclases de IgG de fixar ocomplementopode explicar por que algunhas respostas de anticorpos antidoantes non danan o enxerto despois duntransplante de órganos.[9]
Nun modelo de anemia mediada por anticorpos utilizando variantes de cambio de isotipo de IgG de autoanticorpos antieritrocitos, encontrouse que a IgG2a era superior á IgG1 na activación do complemento. Ademais, encontrábase que o isotipo IgG2a podía interaccionar moi eficientemente co receptor FcgammaR. Como resultado, requiríanse doses 20 veces maiores de IgG1, en relación aos anticorpos IgG2a, para inducir patoloxía mediada por autoanticorpos.[10]
Uso para o diagnóstico
[editar|editar a fonte]A medida da cantidade de inmunoglobulinas G pode ser unha ferramenta de diagnóstico para certas condicións se o aconsellan certos síntomas. [11]Esta medida pode indicar o estado do sistema inmunitario dunha persoa ante un determinado patóxeno. Un exemplo común desta práctica son as titulacións de anticorpos para demostrar a inmunidade serolóxica daspapeiras,sarampelo,roséola,virus da hepatite B,evaricela,entre outros.[12]
As probas de IgG non están indicadas para aalerxia.[13][14]
Notas
[editar|editar a fonte]- ↑Junqueira, Luiz C.; Jose Carneiro (2003).Basic Histology.McGraw-Hill.ISBN0-8385-0590-2.
- ↑Mallery DL, McEwan WA, Bidgood SR, Towers GJ, Johnson CM, James LC (2010)."Antibodies mediate intracellular immunity through tripartite motif-containing 21 (TRIM21)".Proc. Natl. Acad. Sci. U.S.A.107(46): 19985–19990.PMC2993423.PMID21045130.doi:10.1073/pnas.1014074107.
- ↑Meulenbroek, A.J.; Zeijlemaker, W.P. (1996).
- ↑Stadlmann J, Pabst M, Kolarich D, Kunert R, Altmann F. (2008). "Analysis of immunoglobulin glycosylation by LC-ESI-MS of glycopeptides and oligosaccharides".Proteomics8(14): 2858–2871.PMID18655055.doi:10.1002/pmic.200700968.
- ↑Painter PC, Mosher LE, Rhoads C (1982)."Low-frequency modes in the Raman spectra of proteins".Biopolymers21(7): 1469–72.PMID7115900.doi:10.1002/bip.360210715.
- ↑Chou KC (1985)."Low-frequency motions in protein molecules. Beta-sheet and beta-barrel".Biophys. J.48(2): 289–97.PMC1329320.PMID4052563.doi:10.1016/S0006-3495(85)83782-6.
- ↑Chou KC (1987)."The biological functions of low-frequency vibrations (phonons). VI. A possible dynamic mechanism of allosteric transition in antibody molecules".Biopolymers26(2): 285–95.PMID3828475.doi:10.1002/bip.360260209.
- ↑Hashira S, Okitsu-Negishi S, Yoshino K (2000). "Placental transfer of IgG subclasses in a Japanese population".Pediatr Int42(4): 337–42.PMID10986861.doi:10.1046/j.1442-200x.2000.01245.x.
- ↑ZH Gao; et al. (2004). "Immunoglobulin-G subclass antidonor reactivity in transplant recipients.".Liver Transplantation10(8): 1055–1059.PMID15390333.
- ↑Azeredo et al. J of Exp Med. 2002. 195: 665.
- ↑[|Lakos G] (2008 Mar-Apr), Anti-cyclic citrullinated peptide antibodies of IgG isotype are specific diagnostic markers of rheumatoid arthritis.,[1]
- ↑"For physicians and hospitals".Quest Diagnostics.Arquivado dendeo orixinalo 18 de febreiro de 2013.Consultado o 16 de febreiro de 2013.
- ↑American Academy of Allergy, Asthma, and Immunology, "Five Things Physicians and Patients Should Question", Choosing Wisely: an initiative of the ABIM Foundation (American Academy of Allergy, Asthma, and Immunology),[2]Arquivado03 de novembro de 2012 enWayback Machine., retrieved August 14 2012.
- ↑Cox, L.; Williams, B.; Sicherer, S.; Oppenheimer, J.; Sher, L.; Hamilton, R.; Golden, D.; American College Of Allergy, A. I. T. T. F. et al. (2008). "Pearls and pitfalls of allergy diagnostic testing: Report from the American College of Allergy, Asthma and Immunology/American Academy of Allergy, Asthma and Immunology Specific IgE Test Task Force". Annals of allergy, asthma & immunology: official publication of the American College of Allergy, Asthma, & Immunology 101 (6): 580–592. doi:10.1016/S1081-1206(10)60220-7.PMID 19119701.edit
Véxase tamén
[editar|editar a fonte]Outros anticorpos
[editar|editar a fonte]- Anticorpo
- Inmunoglobulina A(IgA)
- Inmunoglobulina E(IgE)
- Inmunoglobulina D(IgD)
- Inmunoglobulina M(IgM)
- Célula B
- Célula plasmática
- Epitopo

