Retrovirus
| Retrovirus | |||||
|---|---|---|---|---|---|
 ciclo do retrovirus VIH | |||||
| Clasificación científica | |||||
| |||||
| Xéneros | |||||
|
Subfamilia:Orthoretrovirinae Subfamilia:Spumaretrovirinae | |||||
Unretrovirusé unvirus de ARNque se replica nunha célula hóspede facendo unha copia enADNdo seuxenoma.Os máis típicos pertencen á familiaRetroviridae.Entre eles está oVIHcausante daSIDA.Ovirususa primeiramente o seuencimacaracterístico, areversotranscriptasepara producirADNa partir do seu xenoma deARN,o que é o inverso do procedemento normal (transcrición:ADN→ARN). Este novo ADN de orixe viral é despoisincorporadoao xenoma da célulahóspedepola acción dun encimaintegrase.A célula despois trata ao ADN proviral incorporado como parte do seu propio xenoma, e segue as súas instrucións fielmente, fabricando as proteínas víricas codificadas nos xenes virais necesarias para a ensamblaxe e formación de novas copias do virus. Os retrovirus sonvirus con envolturamembranosa, que toman da célula infectada.
Unha variedade especial dos retrovirus son osretrovirus endóxenos(ERV) que están integrados no xenoma do hóspede e se herdan dunha xeración a outra.
Hai algúns virus con reversotranscrición que son virus de ADN e non pertencen á familia Retroviridae ou relacionadas (ver grupo VII en "Clasificación" máis abaixo).
O retrovirus almacena o seu material xenético en forma deARNm(que ten os extremos modificados5' cape3'poliA) dentro do virión, e este serve como medio para liberar o xenoma vírico dentro da célula, e iniciar ainfección.Unha vez que está na célula hóspede, o ARN sofre areversotranscriciónnocitoplasmae despois integra o seu ADN no xenoma celular. Cando está integrado recibe o nome deprovirus.
O ADN proviral do retrovirus pode permanecer integrado moito tempo e non é detectado polo sistema inmunitario. Porén, o provirus nun determinado momento transcribe o seu ADN a ARN para expresar os xenes do virus e producir novas copias do virus. Por tanto, a información contida nun xene retroviral flúe na secuencia: ARN → ADN → ARN → proteína.
Os retrovirus son valiosas ferramentas de investigación en bioloxía molecular e foron utilizados con éxito en sistemas de transferencia de xenes.[1]
Estrutura
[editar|editar a fonte]Osviriónsdos retrovirus son partículas envoltas duns 100nmde diámetro. Os virións conteñen dúas moléculas idénticas deARNmonocatenario de 7-10quilobases(kb) de lonxitude. Aínda que os virións de diferentes retrovirus non teñen a mesma morfoloxía ou bioloxía, todos os compoñentes do virión son moi semellantes.[2]
Os principais compoñentes do virión de retrovirus son:
- Envoltura:composta delípidosobtidos damembrana plasmáticado hóspede por medio dun proceso de evaxinación, e que contén taménglicoproteínascodificadas polo xene env do virus.
- ARN:consiste nun dímero de ARN. Ten extremos modificados 5'cap e3'poliA.O xenoma de ARN presenta rexións non codificantes terminais, que son importantes para a replicación, e rexións internas que codifican as proteínas do virión.
- Oextremo 5'inclúe catro rexións, que son: R, U5, PBS, e L. Arexión Ré unha secuencia curta repetida situada en cada extremo do xenoma usada durante a reversotranscrición para asegurar o salto correcto dun extremo a outro da cadea en crecemento. Arexión U5é unha secuencia curta única situada entre as rexións R e PBS. Arexión PBS(primer binding site,sitio de unión docebador) consta de 18 bases complementarias co extremo 3' doprimerde ARNt (unARNtcelular que actúa comoprimere se hibrida coa rexión PBS). Arexión Lé unha rexión líder non traducida que é o sinal para o empaquetamento do xenoma do ARN. Asecuencia de nucleótidosno extremo 5' do xenoma do virus do sarcoma das aves foi secuenciado por J. Shine e A. P. Czernilofsky en 1977[3].
- Oextremo 3'comprende tres rexións, que son: rexión PPT (polypurine tract), U3, e R. Arexión PPTé oprimerpara a síntese da cadea + de ADN durante areversotranscrición.Arexión U3é unha secuencia situada entre as rexións PPT e R, que leva o sinal que o provirus pode usar para atranscrición xenética.Arexión Ré a secuencia repetida terminal do extremo 3'. A secuencia de nucleótidos do dominio non traducido pero conservado do extremo 3' do xenoma do virus do sarcoma das aves foi publicado por A.P. Czernilofsky en 1980[4].
- Proteínas:constan das proteínas gag,protease(PR), e as proteínas pol e env. As proteínasgagson os principais compoñentes dacápsideviral, a cal está formada por 2000-4000 copias desta proteína por virión. Aproteaseexprésase de xeito diferente nos distintos retrovirus. Funciona facendo clivaxesproteolíticasdurante a maduración do virión para producir as proteínas maduras gag e pol. As proteínaspolson responsables da síntese do ADN viral e integración no ADN da célula hóspede despois do inicio da infección. Finalmente, as proteínasenvxogan un papel na unión e entrada do virión na célula hóspede, xa que están situadas na envoltura.[5]
Multiplicación
[editar|editar a fonte]Cando os retrovirus integran os seus propios xenomas en células daliña xerminal,os seus xenomas pasan de xeración en xeración. Deste modo orixínanseretrovirus endóxenos(ERVs), que hoxe forman o 5-8% doxenoma humano,e que en xeral levan moito tempo no xenoma. Contrastan cos retrovirus exóxenos, que son dos que trata principalmente este artigo.[6]A maioría das insercións de retrovirus endóxenos non teñen función coñecida e formarían parte do que se denominou "ADN lixo".Porén, moitos retrovirus endóxenos xogan importantes papeis na bioloxía do hóspede, como o control da transcrición de xenes, fusión celular durante o desenvolvemento daplacentano curso da xerminación dunembrión,e resistencia a infeccións por retrovirus exóxenos. Os retrovirus endóxenos recibiron tamén a atención dos investigadores da área dainmunoloxía.[7]
A transcrición ten lugar do ADN ao ARN, pero areversotranscricióntranscribe ARN a ADN. O prefixo "retro" en retrovirus refírese a esta inversión dofluxo xenéticododogma central da bioloxía molecular.A actividade de reversotrinscritase, ademais de nos retrovirus, foi atopada tamén nas célulaseucariotas,nas que permite a xeración e inserción de novas copias deretrotransposónsno xenoma dohóspede.
Cando o retrovirus inserta o seu xenoma no da célula hóspede, este transcríbese e orixina ARNms que saen aocitosol,onde son traducidos ás proteínas necesarias para formar os novos virus. É importante notar que un retrovirus debe traer con el a súa propiareversotranscriptasedentro da súa cápside, xa que non pode utilizar os encimas das células infectadas.
As drogas terapéuticas denominadas inhibidores da protease e da reversotranscriptase teñen como dianas sitios e secuencias específicos nos seus respectivos encimas. Porén, estas drogas poden perder rapidamente a súa efectividade debido a que as secuencias xénicas que codifican para a protease e a reversoptranscriptase mutan rapidamente. Estes cambios de bases orixinancodónse sitios específicos nos encimas, que cambian, e, por tanto, evitan ser as dianas das drogas ao perderen os sitios que as drogas utilizan para unirse a eles.
Como a reversotranscrición carece da habitual actividade decorrección de probasdareplicación do ADN.Os retrovirus mutan con gran frecuencia. Isto permite que o virus aumente a súa resistencia aos fármacos antivirais rapidamente, e impide o desenvolvemento devacinasefectivas e inhibidores para os retrovirus.[8]
Un inconveniente de moitos retrovirus, como o retrovirus da leucemia murina Moloney, implica o requirimento de que as células estean dividíndose activamente para que se produza a transdución, o que dificulta o seu uso na terapia xénica. Como resultado, as células como asneuronasson moi resistentes á infección e á transdución por retrovirus, xa que non se dividen. Sempre existe a preocupación de que amutaxénese insercionaldebida á integración no xenoma do hóspede poida orixinar uncancroouleucemia.Isto é diferente ao que fan osLentiviridae,un subgrupo dentro dos Retroviridae que pode integrar o seu ARN no xenoma de células hóspede que non se están a dividir.
Transmisión
[editar|editar a fonte]Hai tres modos de transmisión entre os retrovirus:
- De célula a célula[9]
- Por medio de fluídos
- Polo aire, como no caso doretrovirus do Jaagsiekte da ovella(oJaagsiekteé unha enfermidade pulmonar).
Xenes
[editar|editar a fonte]Os xenomas de retrovirus xeralmente conteñen tresmarcos de lectura abertosque codifican as proteínas que poden encontrarse no virus maduro. Son:
- antíxeno específico de grupo(gag). Codifica as proteínas estruturais e internas do virus;
- polimerase(pol). Codifica areversotranscriptase,proteaseeintegrase;e,
- envoltura(env). Codifica as proteínas da envoltura retroviral.
A posesión dunha copia funcional do xene env é o que fai que os retrovirus sexan distintos dos retroelementos.[10]O xene env realiza tres funcións distintas: permite que o retrovirus entre e saia das células hóspede por medio do tráfico de membranasendosómicasna célula, protección do ambiente extracelular por medio dabicapa lipídica,e a capacidade de entrar nas células. A capacidade do retrovirus de unirse á súa célula hóspede utilizando receptores específicos da superficie celular dálla o compoñente de superficie (SU) do env, e a capacidade do retrovirus de entrar na célula por medio da fusión de membranas débese ao compoñente transmembrana ancorado na membrana (TM). Deste xeito, a proteína env é a que permite que o retrovirus sexa infeccioso.
Provirus
[editar|editar a fonte]É o ADN vírico incorporado ao xenoma da célula hóspede en forma de provirus, que pode pasar á proxenie da célula. Cando a célula se divide ten que replicar previamente o seu xenoma e ao facelo replica tamén o provirus integrado, polo que as células fillas levan tamén o provirus. O ADN dalgúns retrovirus insírese aleatoriamente no xenoma da célula hóspede, polo que pode ser inserido nunoncoxene.Deste modo algúns retrovirus poden converter as células normais en células cancerosas. Algúns provirus permanecen latentes na célula durante longos períodos antes de que son activados por algún cambio no seu ambiente.
Primeiras fases da evolución
[editar|editar a fonte]O estudo dos retrovirus levou á primeira demostración da síntese de ADN a partir de moldes de ARN, un modo fundamental de transferir o material xenético entre especies. Especulouse que nas fases máis iniciais daevolución das célulasos procesos de reversotranscrición do ARN ao ADN utilizados polos retrovirus son os que puideron orixinar a aparición do ADN como material xenético. Neste modelo que se enmarca nahipótese do mundo de ARN,os organismos celulares adoptaron o ADN (molécula quimicamente máis estable) cando os retrovirus evolucionaron para crearADNa partir de moldes deARN.
Terapia xénica
[editar|editar a fonte]Osvectoresgammarretroviraiselentiviraisutilizados naterapia xénicamedian a modificación xenética estable de células tratadas por medio da súa integración no xenoma celular. Esta trecnoloxía é útil non só na investigación, senón tamén para a terapia xénica clínica que trata de corrixir os defectos xenéticos das células de forma permanente; por exemplo, encélulas naiproxenitoras. Desenvolvéronse partículas vector retrovirais que infectan determinados tipos de células. Os vectores gammarretrovirais e lentivirais foron xa usados ata o momento en máis de 300 ensaios clínicos, para tratar diversas doenzas.[1][11]
Cancro
[editar|editar a fonte]Os retrovirus que causan o crecemento de tumores inclúen ovirus do sarcoma de Rouse ovirus do tumor mamario de rato.O cancro pode ser desencadeado porprotooncoxenesque foron incorporados por erro no ADN proviral ou pola disrupción de protooncoxenes celulares. O virus do sarcoma de Rous contén oxene srcque desencadea a formación de tumores. Máis tarde atopouse que un xene similar das células estaba implicado nasinalización celular,o cal era moi probablemente extraído co ADN proviral. Os virus non transformantes poden inserir o seu ADN aleatoriamente en protooncoxenes, interrompendo aexpresiónde proteínas que regulan ociclo celular.Opromotordo ADN do provirus pode tamén causar a sobreexpresión de xenes regulatorios.
Clasificación
[editar|editar a fonte]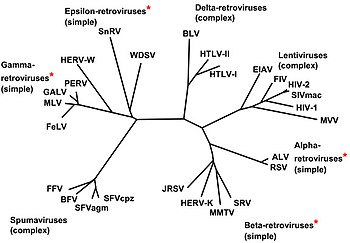
Os virus que presentan reversotranscrición poden clasificarse da seguinte maneira:
Exóxenos
[editar|editar a fonte]Non se transmiten á proxenie directamente polo xenoma, xa que non están definitivamente integrados nel (só o fan durante as infeccións), polo que chegan ao corpo desde o exterior causando a infección. O grupo inclúe os seguintesxéneros:
- Alpharetrovirus;especie tipo:virus da leucose aviaria;outro é ovirus do sarcoma de Rous
- Betaretrovirus;especie tipo:virus do tumor mamario de rato
- Gammaretrovirus;especie tipo:virus da leucemia murina;outro é ovirus da leucemia felina
- Deltaretrovirus;especie tipo:virus da leucemia bovina;outro é ovirus T linfotrópico humanocausante de cancro
- Epsilonretrovirus;especie tipo:virus do sarcoma dermal Walleye
- Lentivirus;especie tipo:virus da inmunodeficiencia humana 1;outros son ovirus da inmunodeficiencia simiae ovirus da inmunodeficiencia felina
- Spumavirus;especie tipo:virus escumoso simio.
Estes xéneros estaban antes clasificados en tres subfamilias (Oncovirinae,Lentivirinae,eSpumavirinae), pero co coñecemento que se ten actualmente dos retrovirus esta división xa non parece apropiada. (Porén, o termooncovirusaínda se usa correntemente).
Os retrovirus clasificáronse en dous grupos naclasificación de Baltimore,que son os grupos VI e VII de virus. Os detalles da reversotranscrición non son iguais en todos eles.
Virus do grupo VI
[editar|editar a fonte]Son virus de ARN. Todos os membros dogrupo VIusan unhareversotranscriptasecodificada polo virus, que é unha ADN polimerase ARN dependente, para producir ADN a partir do xenoma inicial viral de ARN. O ADN é a miúdo integrado no xenoma do hóspede, como no caso dos retrovirus epseudovirus,nos que o xenoma é replicado e transcrito polo hóspede.
O grupo VI inclúe as seguintesfamilias:
- Metaviridae
- Pseudoviridae
- Retroviridae- Retrovirus, por exemplo,VIH.
Virus do grupo VII
[editar|editar a fonte]Ambas as familias dogrupo VIIteñen xenomas de ADN nas partículas que infectan as células. O xenoma de ADN é transcrito tanto a un ARNm (usado na síntese proteica) coma a un ARN prexenómico (usado como molde durante a replicación do xenoma vírico por reversotranscrición). Unha reversotranscriptase codificada polo virus utiliza o ARN prexenómico como molde para a creación do ADN viral xenómico para as novas copias do virus.
O grupo VII inclúe as seguintes familias:
- Hepadnaviridae- por exemplo,virus dahepatite B
- Caulimoviridae- por exemplo,virus do mosaico da coliflor.
Endóxenos
[editar|editar a fonte]- Artigo principal:retrovirus endóxenos.
Osretrovirus endóxenos(ERV)s non están formalmente incluídos neste sistema de clasificación, xa que están integrados no xenoma e pasan directamente de xeración en xeración formando parte do xenoma e nunca están no exterior. Deberon orixinarse por infeccións retrovirais nos antepasados das especies hai moito tempo. Clasifícanse en tres clases baseándose na proximidade aos xéneros de retrovirus exóxenos:
- Clase I. Son similares aos gammarretrovirus.
- Clase II. Son máis similares aos betarretrovirus e alfarretrovirus.
- Clase III. Son similares aos espumavirus.
Tratamento
[editar|editar a fonte]Asdrogas antirretroviraisson medicacións usadas para o tratamento de infeccións por retrovirus, principalmente oVIH.Hai distintas clases de drogas antirretrovirais que actúan en diferentes estadios do ciclo de replicación do VIH. A combinación de varias drogas antirretrovirais (xeralmente tres ou catro) é unha activa terapia antirretroviral.[12]
Tratamento de retrovirus veterinarios
[editar|editar a fonte]As infeccións polovirus da leucemia felinae ovirus da inmunodeficiencia felinapoden tratarse con produtos como oinmunomoduladorchamadoinmunomodulador célula T-linfocito(LTCI).[13]
Notas
[editar|editar a fonte]- ↑1,01,1Kurth, R; Bannert, N (editors) (2010).Retroviruses: Molecular Biology, Genomics and Pathogenesis.Caister Academic Press.ISBN978-1-904455-55-4.
- ↑John M. Coffin (1992). "Structure and Classification of Retroviruses". En Jay A. Levy.The Retroviridae(1st ed.). New York: Plenum Press. p. 20.ISBN0-306-44074-1.
- ↑J. Shine e Czernilofsky et al. Proc. Natl. Acad. Sci. USA, Vol 75, pp 1473–1477, 1977
- ↑A.P. Czernilofsky et al. Nucleic Acuds Research, Vol. 8, pp 2967–2984, 1980
- ↑John M. Coffin (1992). "Structure and Classification of Retroviruses". En Jay A. Levy.The Retroviridae(1st ed.). New York: Plenum Press. pp. 26–34.ISBN0-306-44074-1.
- ↑Robert Belshaw; Pereira V; Katzourakis A; Talbot G; Paces J; Burt A; Tristem M. (2004)."Long-term reinfection of the human genome by endogenous retroviruses".Proc Natl Acad Sci USA101(14): 4894–9.PMC387345.PMID15044706.doi:10.1073/pnas.0307800101.
- ↑Medstrand P, van de Lagemaat L, Dunn C, Landry J, Svenback D, Mager D (2005). "Impact of transposable elements on the evolution of mammalian gene regulation".Cytogenet Genome Res110(1-4): 342–52.PMID16093686.doi:10.1159/000084966.
- ↑Svarovskaia ES; Cheslock SR; Zhang WH; Hu WS; Pathak VK. (2003). "Retroviral mutation rates and reverse transcriptase fidelity.".Front Biosci.8(1-3): d117–34.PMID12456349.doi:10.2741/957.
- ↑Clare Jolly (2011)."Cell-to-cell transmission of retroviruses: Innate immunity and interferon-induced restriction factors.".PubMed Central411(251–259): 251–9.PMC3053447.PMID21247613.doi:10.1016/j.virol.2010.12.031.
- ↑Felix J. Kim; Jean-Luc Battini, Nicolas Manel, Marc Sitbon (2004). "Emergence of vertebrate retroviruses and envelope capture".Virology(318): 183–191.
- ↑Desport, M (editors) (2010).Lentiviruses and Macrophages: Molecular and Cellular Interactions.Caister Academic Press.ISBN978-1-904455-60-8.
- ↑Haddad M, Inch C, Glazier RH; et al. (2000). "Patient support and education for promoting adherence to highly active antiretroviral therapy for HIV/AIDS".Cochrane Database of Systematic Reviews (Online)(3): CD001442.PMID10908497.doi:10.1002/14651858.CD001442.
- ↑Gingerich DA (2008)."Lymphocyte T-cell immunomodulator (LTCI): Review of the immunopharmacology of a new biologic"(PDF).Intern J Appl Res Vet Med6(2): 61–8.
Véxase tamén
[editar|editar a fonte]Ligazóns externas
[editar|editar a fonte]| Commonsten máis contidos multimedia sobre: Retrovirus |
- ViralZoneUn portal pertencente aoInstituto Suízo de Bioinformáticacon recursos para todas as familias virais, que dá información molecular xeral e epidemiolóxica (ligazóns para"Retro-transcribing viruses")
- Animación Flash sobre retrovirus
- Retrovirologyrevista científica
- Retrovirus life cycle chaptercapítulo do texto en liña de "Bioloxía" de Kimball
- "Retroviruses"ISBN 0-87969-571-4
- Annals of Science: Darwin's Surprise.Michael Specter.The New Yorker.Decembro 3, 2007.
