John Dalton
| John Dalton | |
 | |
| Rođenje | 6.rujna1766. Eaglesfield,Cumbria,Ujedinjeno Kraljevstvo |
|---|---|
| Smrt | 27. srpnja1844. Manchester,Greater Manchester,Ujedinjeno Kraljevstvo |
| Narodnost | Englez |
| Polje | Kemija,fizika |
| Istaknuti studenti | James Prescott Joule |
| Poznat po | Daltonova atomska teorija, Daltonov zakon, Daltonizam Relativna atomska masa |
| Istaknute nagrade | ČlanKraljevskog društva(1826.) |
| Portal o životopisima | |




John Dalton(Eaglesfield,6. rujna1766.-Manchester,27. srpnja1844.),engleskiprirodoslovac,kemičarifizičar.Zbog doprinosa razvojuatomske teorijesmatra se jednim od utemeljitelja suvremenogaprirodoslovlja.U knjiziNovi sustav kemijske filozofije(eng.New System of Chemical Philosophy,I, 1808., II, 1810.) pretpostavio je da sekemijski elementisastoje od malih neuništivihčestica,atoma.Time je utemeljio atomsku teoriju građe tvari, ustvrdivši da se svaki kemijski element sastoji od atoma iste vrste, dok sekemijski spojevisastoje od različitih atoma. Uveo je posebne simbole za kemijske elemente i spojeve i dao pregledrelativnih atomskih masa.Proučavajući zakonitosti kemijskog spajanja, 1802. otkrio zakon umnoženih masenih omjera, a 1807. i zakonparcijalnih tlakova(Daltonov zakon).
Osim kemijom, bavio se sustavnimmeteorološkimistraživanjima. Kako je bio slijep za boje, proučavao je tuanomaliju,koja je po njemu nazvanadaltonizam.Premda su se neki Daltonovi zaključci pokazali pogrešnima (na primjer predodžba o nedjeljivosti atoma, koja je pobijena otkrićemradioaktivnoga raspada), njegova atomska teorija i predodžba o atomskim masama elemenata imaju ogromno značenje za razvoj fizike i kemije.[1]
Dalton je u školi bio marljiv i uporan učenik, vješt u računanju. Kad je smrću učitelja škola zatvorena, Dalton je s 18 godina otvorio svoju školu u napuštenu sjeniku, a zatim u Domukvekera.Prvo se baviometeorologijom,a zatimkemijom.Učio je i podučavao, osim matematike i fizike, englesku gramatiku, grčki, latinski i francuski jezik. S 22 godine razmišljao je o studiranju prava ili medicine, no zbog nepodržavanja obitelji te zbog činjenice da je neistomišljenicima studiranje ili predavanje na engleskim fakultetima bili zabranjeno ipak nije, te je 1793. otišao u Manchester.
Godine1803.predložio je svoje principe atomske teorije (uveo je pojamatomske težine,točnije,relativne atomske mase,uzevši kao standard atomvodika(H), jer je najlakši i pripisao mu je atomsku masu 1,[2]sugerirajući da su svi elementi sastavljeni od sitnih, neuništivih čestica, zvanih atomi, koji su svi jednaki i imaju istu masu. Atomi nekog elementa mogu pri kemijskoj reakciji ući u sastav kemijskog spoja ili iz njih izaći, ali njihova ukupna masa u sustavu ostaje nepromijenjena. Dalton je pretpostavio da jevodiknajlakši element pa je uveo pojamrelativne atomske mase (Ar)kao omjer mase atoma elementa i mase atoma vodika. Također je proučavao sljepoću na boje (daltonizam).[3]
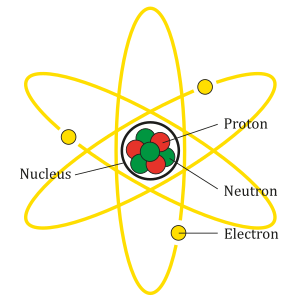
U atomskoj teorijimaterije,atomse sastoji odatomske jezgreoko koje kružeelektroni.Danas je općenito priznato mišljenje da se atomska jezgra svihkemijskih elemenatasastoji od pozitivno nabijenihprotonaineutronakoji nemajuelektrični naboj.Čestice koje se nalaze u atomskoj jezgri, to jest protoni i neutroni, zovu se zajedničkim imenomnukleoni(lat.nucleus:jezgra). Neutron imamasugotovo jednaku masi protona. Proton je jezgravodikovogatoma, pa mu je masa jednaka masi atoma vodika. Broj protona u atomskoj jezgri koji se zoveatomski broj,jednak je njezinomelektričnom nabojui uvijek odgovara rednom broju kemijskog elementa uperiodnom sustavu.Dakle atomskim brojem određena je vrsta kemijskog elementa.
U neutralnom atomu broj elektrona što kruže oko jezgre jednak je broju protona u jezgri. Pozitivan naboj jednog protona jednako je velik kao negativan naboj elektrona. 1869. ruski kemičarD. I. Mendeljejevotkrio je zakonitost ponavljanja kemijskih svojstva elemenata kod povećanja njihove atomske mase. On je tada sve poznate elemente poredao po rastućim atomskim masama jedan iznad drugoga i sastavio periodičku tablicu. Mendeljejev je dokazao da svaki kemijski element ima određen sastav atoma koji označuje atomska masa i mjesto u periodnom sustavu elemenata.
Broj protonaPi neutronaNu jezgri određuje atomsku masuAodređenog elementa, to jest:
i zove semaseni brojatoma. Na primjer jezgrahelijasastoji se od dva protona i dva neutrona. Prema tome jeelektrični nabojjezgre iredni brojhelija 2, arelativna atomska masa4. Oko atomske jezgre kruže negativno nabijeni elektroni, a broj elektrona jednak je broju protona u jezgri.
No kod istog broja protona u jezgri mogu postojati različite količine neutrona. Dva atoma koji imaju isti broj protona, a različiti broj neutrona, imaju skoro ista kemijska svojstva i isti redni broj, ali različite atomske mase. Takvi se elementi koji imaju isti redni broj, a različitu atomsku masu, zovuizotopi.Tako na primjer postojiklorkoji ima redni broj 17, to jest njegova jezgra sadrži 17 protona, dok mu je atomska masa 35, što znači da jezgra njegova atoma sadrži 18 neutrona (17 + 18 = 35). Međutim, postoji i klor s atomskom masom 37, to jest jezgra njegova atoma sadrži 20 neutrona (17 + 20 = 37). Običan klor koji se nalazi u spojevima u prirodi ima atomsku masu 35,46, što znači da je on smjesa tih dvaju izotopa koji su u njemu zastupani u omjeru 3: 1, to jest:
Prvi izotop klora pišemo simbolički17Cl35,a drugi17Cl37.Gornji broj uz kemijski simbol elementa znači relativnu atomsku masu tog elementa, a donji - broj protona u jezgri tog elementa, odnosno njegov redni broj. Ivodikima svoje izotope:1H1obični vodik,1H2teški vodik ilideuteriji1H3tricij.
Ovakvi izotopi nađeni su gotovo kod svih kemijskih elemenata. Takouranij,koji je najvažniji u dobivanjunuklearne energije,ima 5 izotopa. Uranij ima redni broj 92, a njegovi izotopi imaju atomske mase 234, 235, 237, 238 i 239. U prirodnom uraniju najjače je zastupljen izotop s atomskom masom 238. Ima ga 137 puta više nego izotopa s atomskom masom 235. Ostalih njegovih izotopa ima još i manje. Izotopi se danas vrlo mnogo primjenjuju u medicini, tehnici i privredi, a naročito su veoma važni u proizvodnji nuklearne energije. Odjeljivanje izotopa vrši se centrifugiranjem, destilacijom, difuzijom i tako dalje.
Da se jezgra atoma koja se sastoji od pozitivno nabijenih protona ne razleti, jer se istoimeni električni naboji međusobno odbijaju, uzrok su privlačne sile koje vladaju, između protona i neutrona. To su takozvane sile jezgre iliosnovne silekoje, iako su vrlo velike, djeluju samo na vrlo male daljine, to jest u dimenzijama atomske jezgre. Tumačenje tih sila spada danas u glavne probleme atomske fizike.[4]
Relativna atomska masa(oznakaAr) je svojstvena veličina svakogkemijskog elementa(stariji naziv:atomska težina). To je broj koji pokazuje koliko je puta prosječna masa atoma nekog elementa veća od 1/12 mase atomaugljikovaizotopa12C, to jest to je omjer između prosječne mase atoma nekog kemijskog elementa iunificirane atomske jedinice mase.Izražavanje atomskih masa relativnim jedinicama uveo je 1803. John Dalton, koji je zamjernu jedinicuuzeo vodikov atom kao najlakši od svih atoma i pridijelio mu vrijednost 1 (poslije je kao jedinica služila i 1/16 mase atomakisikovaizotopa16O). Takvo je izražavanje uvedeno iz praktičnih razloga, jer su mase atoma izvanredno malene (na primjer masa je vodikova atoma 1,673 · 10−27kg). Kako se većina kemijskih elemenata u prirodi pojavljuje u obliku smjese svojih izotopa, relativne atomske mase odgovaraju srednjoj vrijednosti relativnih masa atoma prisutnih izotopa, pa zato redovito nisu cijeli brojevi. Mjerna jedinica relativne atomske mase je broj jedan (1).[5]
Daltonov zakongovori otlakovimapojedinih vrstaplinovau smjesi plinova, a glasi:
Parcijalni tlakodređenog plina u smjesi, je onaj tlak koji bi taj plin imao kada bi sam zauzimaoobujam,koji zauzima smjesa. Daltonov zakon nam omogućava odredivanje parcijalnih tlakova plinova prisutnih uatmosferi,poznavanjem njihovih udjela u atmosferskomzraku.Tako, ako jekisikprisutan u zraku udjelom od 21%, tada će i njegov parcijalni tlak biti 21% od ukupnog tlaka zraka.
Matematički, Daltonov zakon se može pisati:
- ili
Gdjep1,p2,....,pn– predstavlja parcijalne tlakove pojedinih sastojaka smjese plinova. Pretpostavlja se da plinovi ne reagiraju kemijski međusobno:
gdje jepi– parcijalni tlak pojedinog plina,yi– udio pojedinog plina u smjesi.
Daltonov zakon ne opisuje u potpunosti realneplinove.Razlike su pogotovo velike kod visokihtlakova,kada sumolekulevrlo blizu jedne drugima, pa dolaze do izražajameđumolekularne sile,i mijenjaju vrijednost tlaka.
Daltonizamjesljepoćazaboje,potpuna ili djelomična nemogućnost raspoznavanja boja. Umrežnicipostoje tri vrste receptora (osjetne stanice) za boje (za crvenu, zelenu i plavu boju, a ostale boje nastaju miješanjem tih osnovnih), od kojih svaki sadržipigmentosjetljiv na određenuvalnu duljinusvjetlosti.Osoba s normalnim raspoznavanjem boje (trikromat) ima sva tri pigmenta u pravilnim omjerima, dikromati razlikuju samo dvije temeljne boje (obično zamjenjuju crvenu boju zelenom), a monokromati uopće ne razlikuju boje. Daltonizam je najčešće urođen (8% muškaraca i 1% žena) i nedostupan je liječenju.
- ↑Dalton, John,[1]"Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2018.
- ↑Filipović, Lipanović: "Opća i anorganska kemija", 9. izd., Školska knjiga, Zagreb, 1995.,ISBN953-0-30907-4,str.36.
- ↑Claus Bernet:John Dalton (1766. – 1844.),Biographisches-bibliographisches Kirchenlexikon, 31, 2010., 309.-332.
- ↑Velimir Kruz: "Tehnička fizika za tehničke škole", "Školska knjiga" Zagreb, 1969.
- ↑relativna atomska masa,[2]"Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2018.





